RESURS EDUCAIONAL DESCHIS DENUMIRE PHUL N ORGANISMUL UMAN
































- Slides: 38

RESURSĂ EDUCAŢIONALĂ DESCHISĂ DENUMIRE: PH-UL ÎN ORGANISMUL UMAN AUTOR: DUMITRA MIRELA UNITATEA DE ÎNVĂŢĂM NT: COLEGIUL ECONOMIC „P. S. AURELIAN“ SLATINA DISCIPLINA: CHIMIE DOMENIUL: CLASA: SCOPUL MATERIALULUI PROPUS: DOCUMENTARE PENTRU CADRELE DIDACTICE

COLEGIUL ECONOMIC “ PETRE S. AURELIAN” SLATINA PH-UL ÎN ORGANISMUL UMAN DUMITRA MIRELA

Noțiuni generale În discuţiile cotidiene auzim despre modificarea valorilor p. H-ului în cazul ploilor acide sau despre balanţa p. H-ului produselor cosmetice. Pentru experţi, valoarea p. H-ului reprezintă un parametru important ce caracterizează calitatea unei soluţii apoase. De ce? Deoarece comportarea chimică a unei soluţii este determinată de natura sa acidă, neutră sau alcalină.

p. H este prescurtarea de la "pondus hydrogenii". Noţiunea a fost introdusă de către omul de ştiinţă danez S. P. L. Sorensen, în anul 1909, pentru a măsura concentraţia ionilor de hidrogen dintr-o soluţie apoasă şi a fost definit ca: “logaritmul zecimal cu semn schimbat al concentraţiei ionilor de hidrogen. În soluţie, p. Hul reprezintă de fapt logaritmul negativ al concentraţiei ionului de H 3 O+ “ p. H = - log [H 3 O+] p. H-ul măsoară aciditatea sau alcalinitatea unei soluţii apoase

Metode de măsurare a p. H-ului p. H-ul se măsoară prin adăugarea unui indicator de p. H în soluţia de analizat. Culoarea variază în funcţie de p. H-ul soluţiei. Utilizarea indicatorilor pentru determinări calitative trebuie să ţină cont de variaţia de culoare a acestuia (de preferat sunt indicatorii care virează pe un interval de p. H cât mai mic); determinarea exactă a p. H-ului se face prin metode combinate: utilizarea de indicatori împreună cu metode spectrofotometrice; utilizarea unui p. H metru cu electrozi p. H selectivi: electrodul de sticlă, electrodul de hidrogen, electrodul de chinhidronă.

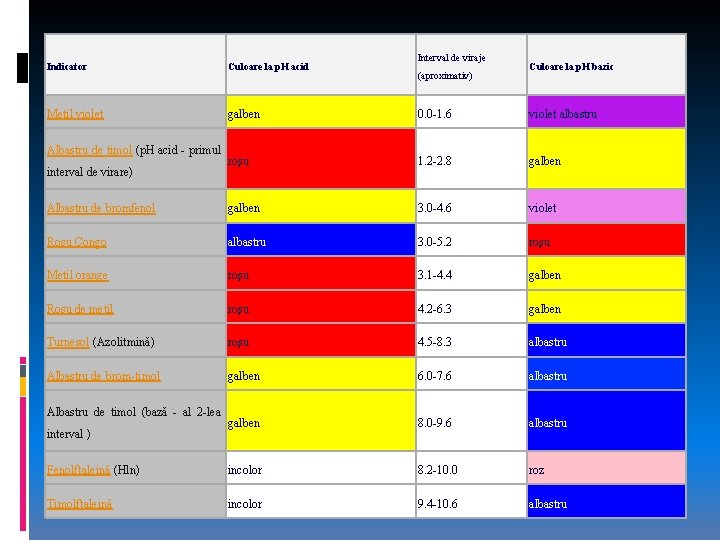
Indicatorii de p. H (acido-bazici) Indicatorii sunt substanţe organice a căror formă acidă sau bazică (moleculară) are o altă culoare decât baza sau acidul conjugat. Dacă aciditatea soluţiei se modifică (de exemplu prin neutralizare cu o bază) indicatorul îşi schimbă culoarea. Schimbarea culorii indicatorului este legată de o modificare de structură şi are loc într-un interval numit interval de viraj, specific fiecărui indicator.

Interval de viraje Indicator Culoare la p. H acid Metil violet galben 0. 0 -1. 6 violet albastru roşu 1. 2 -2. 8 galben Albastru de bromfenol galben 3. 0 -4. 6 violet Roşu Congo albastru 3. 0 -5. 2 roşu Metil orange roşu 3. 1 -4. 4 galben Roşu de metil roşu 4. 2 -6. 3 galben Turnesol (Azolitmină) roşu 4. 5 -8. 3 albastru Albastru de brom-timol galben 6. 0 -7. 6 albastru galben 8. 0 -9. 6 albastru Fenolftaleină (Hln) incolor 8. 2 -10. 0 roz Timolftaleină incolor 9. 4 -10. 6 albastru Albastru de timol (p. H acid - primul interval de virare) Albastru de timol (bază - al 2 -lea interval ) (aproximativ) Culoare la p. H bazic

Pentru a determina caracterul acid sau bazic al unei soluţii, în practică se folosesc hârtii indicatoare, impregnate cu un singur indicator. Hârtia indicator universal se obţine prin impregnarea cu amestecuri de indicatori astfel aleşi încât ea să capete anumite coloraţii pentru un p. H dat. Coloraţia dobândită de aceasta hârtie introdusă într-o solutie, se compară cu o scara de culori, fiecare nuanţa indicând o valoare a p. H-ului.

p. H-ul în organism Toate procesele vitale din organism se desfăşoară la valori exacte ale p. H-ului. În organismul animal precum şi în organismul omului, multe dintre reacţiile chimice sunt extrem de sensibile la p. H-ul mediului de reacţie. Pentru menţinerea constantă a p. H-ului în mediul intern, organismul uman foloseşte ca mecanisme funcţionale: 1. Neutralizarea acizilor şi a bazelor de către soluţii tampon 2. Eliminarea renală a excesului de acizi 3. Eliminarea functională a dioxidului de carbon.

1. Neutralizarea acizilor şi a bazelor de către soluţii tampon Sistemele tampon care contribuie la menținerea constantă a p. Hului în organism sunt orientate împotriva efectului acizilor, întrucât produșii de metabolism pot determina scăderea p. H-ului sanguin. Organismul nu dispune de sisteme tampon care să acționeze împotriva bazelor , deoarece în cursul evoluției nu a existat pericolul alcalinizării excesive a sângelui. Cele mai importante sisteme tampon din organism sunt: • hemoglobină acidă / oxihemoglobină acidă • H 2 CO 3/KHCO 3 • hemoglobinat de potasiu oxihemoglobinat • K 2 HPO 4/KH 2 PO 4

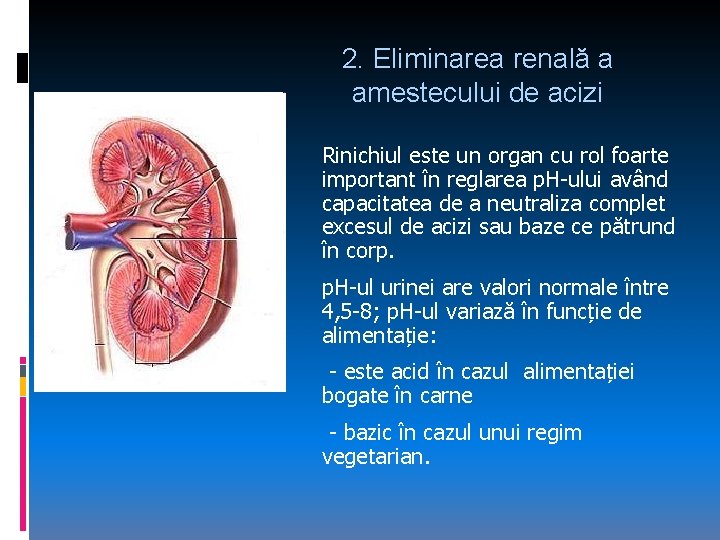
2. Eliminarea renală a amestecului de acizi Rinichiul este un organ cu rol foarte important în reglarea p. H-ului având capacitatea de a neutraliza complet excesul de acizi sau baze ce pătrund în corp. p. H-ul urinei are valori normale între 4, 5 -8; p. H-ul variază în funcție de alimentație: - este acid în cazul alimentației bogate în carne - bazic în cazul unui regim vegetarian.

3. Eliminarea functională a dioxidului de carbon Creșterea concentrației ionilor H 3 O+ stimulează centrul respirator, care prin modificarea ventilației pulmonare, va reduce în 1 -3 minute concentrația ionilor hidroniu la normal. Plămânii sunt organe care elimină excesul de CO 2 , format continuu în organism prin procese metabolice. Puterea de tamponare a aparatului respirator este de două ori mare decât a unui sistem chimic.

p. H-ul sângelui Sângele uman are p. H-ul cuprins între 7, 38 -7, 52. Prin urmare el este uşor bazic şi numai în aceste condiţii celulele sângelui îşi pot îndeplini funcţiile lor. p. H-ul sanguin arterial variază între 7, 39 -7, 44; în sângele venos (în repaus) este cu 0, 02 mai scăzut decât cel arterial, considerându-se p. H-ul normal pentru sânge venos pana la 7, 35; p. H-ul e scăzut dimineața, pentru că excitabilitatea centrilor respiratori scade în cursul nopții și se acumulează dioxid de carbon. El scade deasemenea în efortul fizic, prin formarea unui exces de acid lactic, precum și în cursul digestiei intestinale. Crește în timpul digestiei gastrice datorita pierderii de H 3 O+ prin sucul gastric.

Acidoza se caracterizează prin coborîrea p. H-ului sanguin sub 7, 35 (valoarea normală: 7, 35 -7, 45). Provine din alimentație (proteine, glucide, lipide). Până în prezent a fost descrisă o triplă sursă de H 3 O+: • arderea incompletă a unei părți de lipide și glucide (în mod normal ele sunt arse până la H 2 O și CO 2, ambele eliminânduse); • oxidarea aminoacizilor sulfurați proveniți din catabolizarea proteinelor, care dă naștere la acid sulfuric transformat imediat în sulfați. Această sursă de H 3 O+ stă la originea a 60 -80% din acizii formați în organism; • oxidarea și hidroliza fosfoproteinelor care produc acid fosforic transformat apoi în fosfat.

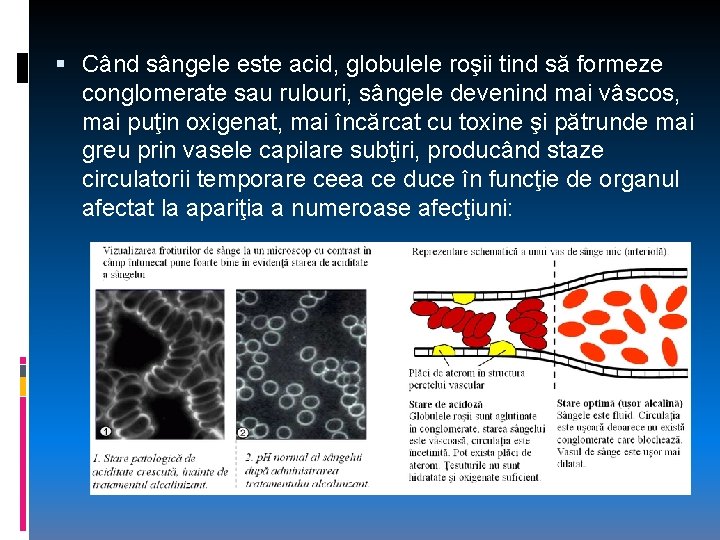
Când sângele este acid, globulele roşii tind să formeze conglomerate sau rulouri, sângele devenind mai vâscos, mai puţin oxigenat, mai încărcat cu toxine şi pătrunde mai greu prin vasele capilare subţiri, producând staze circulatorii temporare ceea ce duce în funcţie de organul afectat la apariţia a numeroase afecţiuni:

Alcaloză Creşterea p. H-ului peste valoarea de 7, 45 (alcaloză ) creează de asemenea probleme serioase, dar este mai rar întâlnită deoarece în mod obişnuit, metabolismul generează mai mulţi acizi decît baze

p. H-ul tubului digestiv În tubul digestiv, p. H-ul ia valorile : Saliva sucul gastric sucul pancreatic, bila urina p. H = 6, 7 -7, 5 1, 5 -2, 5 8 7 -8 4, 5 -8 Stomacul este un organ care prezintă secreţii foarte acide (p. H~1) valoarea aceasta scazută a p. H-ului fiind legată de funcţiile sale digestive. Stomacul unei persoane adulte produce 2 -3 litri suc gastric. Principala componentă a sucului gastric este acidul clorhidric. p. H-ul sucului gastric este de cca 1, 5, ceea ce corespunde unei concentraţii de cca. 0, 03 M. Creşterea acidității stomacului duce la apariția unor afecţiuni: gastrite, ulcer etc. Saliva acționează ca un tampon neutralizând p. H-ul acid al cavității bucale și astfel împiedicând demineralizarea smalțului.

Digestia duodenală Acțiunea chimică a intestinului subțire se realizează prin sucul pancreatic, intestinal și bila. Sucul pancreatic conține bicarbonat de sodiu, de potasiu si clorura de sodiu care îi conferă o reacție ușor alcalină: p. H 7. 5 -8. 2. Sucul intestinal are în compoziție substanțe anorganice (Na+, Cl-, HCO 3 -, ) care-i conferă un p. H ușor alcalin : 7 -8. 5. Sărurile anorganice din compoziția bilei (Na. Cl, Na. HCO 3) îi asigura un p. H alcalin 7. 7.

• Consumarea de alune sau branzeturi la sfarsitul mesei dar nu și a merelor compenseaza scaderea p. H-ului indus de dulciuri. • Consumul multor fructe și legume ajuta la pastrarea optimă a nivelului p. H-ului.

Determinarea p. H-ului organismului Analiza sangelui este considerata cea mai buna metoda de determinare a p. H-ului. O alta metoda de determinare este si testarea urinei. Stresul, infectiile genereaza stari acide si scad valoarea p. H -ului. p. H-ul indică, capacitatea tubilor renali de a menține echilibrul acido-bazic al plasmei și lichidului extracelular, care se realizează prin reabsorbția sodiului si secreția tubulara de hidrogen și ioni amoniu. Testul de detectare a p. H-ului urinar se bazează pe o combinație de 3 indicatori: rosu-metil, albastru bromtimol și fenolftaleina. La un nivel al p. Hului de 5 -9 se obține o gradare a culorii de la potocaliu la galben-verzui si albastru.

p. H-ul părului şi pielii Părul şi pielea sunt şi ele parţi ale organismului - produsele cosmetice folosite trebuie să aibă un p. H de aproximativ 5, 5 deci slab acid pentru a neutraliza alcalinitatea introdusă de apă sau detergenţi. Pielea sănătoasă protejează organismul de factorii externi de natură mecanică, fizică sau chimică şi previne invazia de microorganisme. Bariera protectoare acidă (mantaua acidă) este formată din lipide ale pielii (90%), sudoare şi celule keratinizate moarte. p. H-ul pielii este intre 5. 4 – 5. 9. Chiar şi după contactul cu acizi slabi sau alcalini (după spălarea cu săpunuri alcaline) pielea îşi redobândeşte p. H-ul original. Acest p. H slab acid inhibă creşterea bacteriană protejând astfel organismul de microorganisme

• Daca șamponul folosit este foarte acid (p. H=1 -2) punțile de hidrogen și cele saline nu se mai formează , părul devine fragil şi făra strălucire • daca p. H-ul este unul bazic daunează deasemenea părului. • Sapunul cu un p. H necorespunzător usucă tenul și irită astfel glandele sebacee.

Analizatorul vizual În ochiul ținut la întuneric, reacția retinei este neutră, iar în ochiul luminat ea devine acidă. Aceasta modificare de p. H se explică prin prezenta fosforului anorganic, care rezultă din descompunerea substanțelor fotosensibile aflate în elementele senzoriale

Activitatea enzimelor Enzimele sunt substanţe de natură proteică. Acestea reprezintă macromolecule, compuse din lanţuri polipeptidice, având o masă moleculară între 10. 000 1. 000. Activitatea enzimatică este în strânsă legătură cu p. H-ul mediului în care se află. Pepsina este activă numai în soluţii puternic acide (p. H optim 1, 5 – 2). În duoden şi în intestin, unde p. H=8, pepsina este inactivă. α –glucozidaza determină hidroliza enzimatica a zaharozei la p. H = 6 -7, iar invertaza îsi manifestă activitatea maxima în medii acide (p. H= 4 -5), unde activitatea α – glucozidazei este aproape nulă.


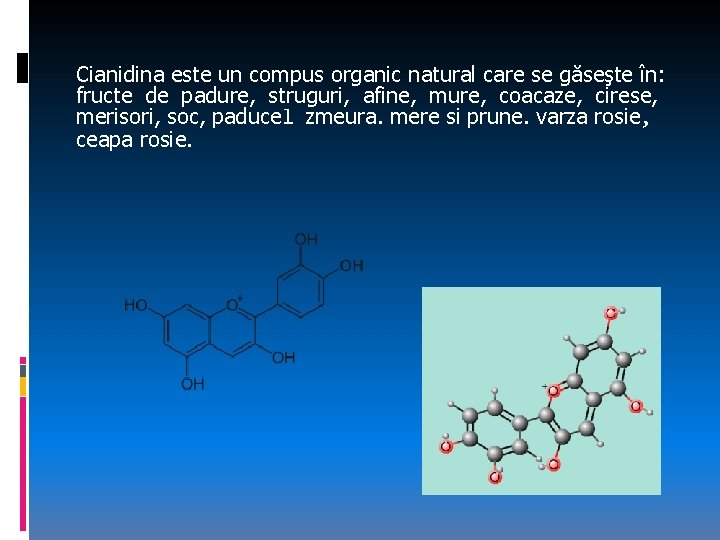
Aplicaţie practică Prepararea unui indicator din extract de varză roşie: Prepararea unui indicator universal. Determinarea p. H-ului pentru diferite soluţii cu indicatorii preparați şi p. H-metru. Sucul de varza rosie conține un pigment numit “cianidină” care poate fi utilizat la monitorizarea p. H-ului în solutii. Este de culoare roz în solutii acide (ph < 7), mov în soluții neutre (ph ~ 7), albastru în soluții alcaline (ph > 7), și incolor în soluții foarte alcaline unde pigmentul este redus complet, dar culoarea depinde şi de tipul de acid folosit (anorganic, organic).

Cianidina este un compus organic natural care se găseşte în: fructe de padure, struguri, afine, mure, coacaze, cirese, merisori, soc, paducel zmeura. mere si prune. varza rosie, ceapa rosie.

Prepararea sucului de varză roşie: Se Se Se taie varza; fierbe în apă aprox. 15 minute; lasă apoi să se răcească şi se filtrează; obţine un lichid bleu-violet. adauga 2 -3 ml alcool etilic.

Obţinerea scării cromatice a extractului de varză roşie Se lucrează cu probe de diferite p. H – uri, între 1 şi 13; Pentru prepararea acestora se folosesc următoarele substanţe: HCl de concentraţie 0, 01 m, sodă caustică Na. OH, apă distilată. Se folosesc următoarele vase, ustensile şi aparate: eprubete, pipete, pahare Berzelius, spatule, baloane cotate, sticle de ceas, foarfecă, balanţă de laborator

Se întocmeşte scara cromatică a extractului de varză roşie


Determinarea p. H-ului pentru diferite soluţii cu extract de varză roşie.

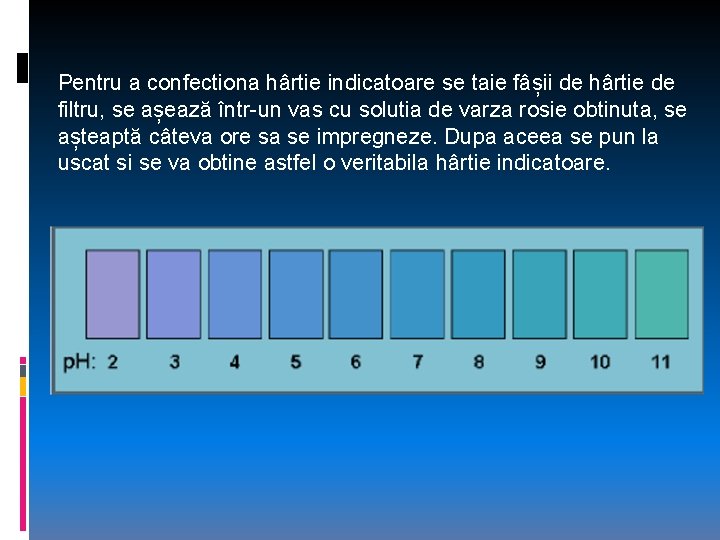
Pentru a confectiona hârtie indicatoare se taie fâșii de hârtie de filtru, se așează într-un vas cu solutia de varza rosie obtinuta, se așteaptă câteva ore sa se impregneze. Dupa aceea se pun la uscat si se va obtine astfel o veritabila hârtie indicatoare.


Obţinerea scării cromatice a indicatorului universal Pentru a obţine sacra cromatică a indicatorului universal s-au folosit probe cu p. H cuprins între 2 şi 12 preparate în acelaşi mod ca la extractul de varză roşie.

Determinarea p. H-ului pentru diverse solutii cu indicator universal.


• Cu ajutorul indicatorului universal se poate stabili direct caracterul acid sau bazic al soluţiei; nu este necesară o verificare cu mai multe tipuri de indicatori • Rezultatele cele mai exacte se obţin cu ajutorul p. H-metrului. Indicatorii preparaţi de noi dau o valoare aproximativă a p. H-ul soluţiei respective. Bibliografie Marius Andruh, Ion Baciu, Daniela Bogdan “Chimie – manual clasa a XII a” , Ed. Mistral www. chemweb. com C. D. Neniţescu, „Chimie generală” Ed. Didactică şi Pedagogică, Bucureşti 1985 http: //education. inflpr. ro
 Parameci structura
Parameci structura Internet explorer haqida malumot
Internet explorer haqida malumot Mzmun
Mzmun Crosetul stahl
Crosetul stahl O poarta-n ceruri s-a deschis
O poarta-n ceruri s-a deschis Ce este un semiplan
Ce este un semiplan Appium pronunciation
Appium pronunciation Hidroxizi alcalini exemple
Hidroxizi alcalini exemple Formula chimica hidroxid de calciu
Formula chimica hidroxid de calciu Completati ecuatiile
Completati ecuatiile Compusi binari ai oxigenului
Compusi binari ai oxigenului N in chimie
N in chimie Grosismentul microscopului formula
Grosismentul microscopului formula Sistemul reproducator femeiesc
Sistemul reproducator femeiesc Mutatii autozomale
Mutatii autozomale Imgine
Imgine Programul operational capital uman
Programul operational capital uman Cariotipul uman
Cariotipul uman Sindromul fatco
Sindromul fatco Anatomie cai biliare
Anatomie cai biliare Electrocutarea primul ajutor
Electrocutarea primul ajutor Sngele
Sngele Actiunea etanolului asupra organismului uman
Actiunea etanolului asupra organismului uman Proiectul „genomul uman”
Proiectul „genomul uman” Vasa occipitalia
Vasa occipitalia Faringele anatomie
Faringele anatomie Suntem ceea ce mancam
Suntem ceea ce mancam Ipostazele psihicului uman
Ipostazele psihicului uman Au corpul alcatuit din cap torace si abdomen
Au corpul alcatuit din cap torace si abdomen Ochii sunt fereastra sufletului
Ochii sunt fereastra sufletului Efectele drogurilor
Efectele drogurilor