Renouvellement des matrices extracellulaires Composition des matrices Maladies


































- Slides: 69

Renouvellement des matrices extra-cellulaires

• Composition des matrices • Maladies humaines dues à des modifications des composants des matrices et leurs modèles expérimentaux • Le rôle des protéases impliquées dans le renouvellement des matrices

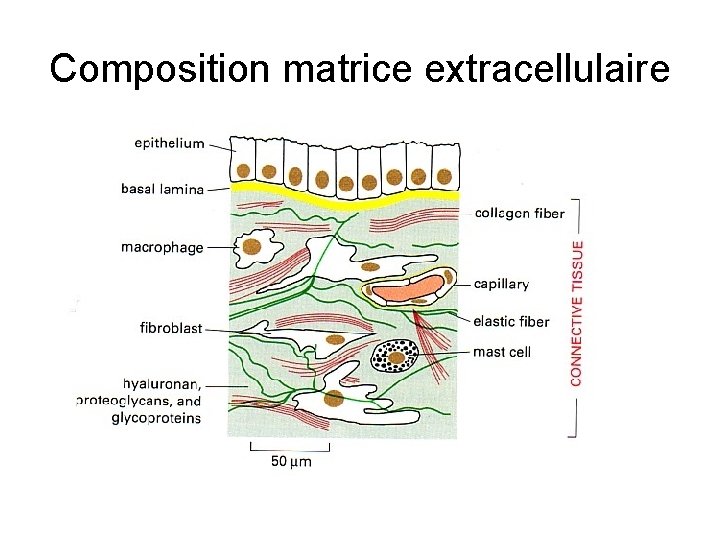
matrice extracellulaire : généralités Présentes dans tous les tissus Tissus riches en MEC : os cartilage Synthétisée par c. mésenchymateuses : Cellules stromales = précurseur fibroblastes spécialisés : ostéoblastes chondrocytes Composée de : protéoglycannes protéines fibreuses : structurales = collagène et élastine adhésive = fibronectine et cie

Composition matrice extracellulaire

Remodelage des matrices • MEC constamment renouvelée : • Équilibre synthèse ↔ dégradation • Dégradation : due à des protéases synthétisées par c. mésenchymateuses ++ ou macrophages ou leucocytes

Rôle des matrices en physiologie • Cohésion des tissus • Rôle dans la mobilité cellulaire • Rôle de stockage de facteurs de croissance

Physiopathologie des matrices • MEC de mauvaise qualité : maladies génétique affectant un des composants de la MEC) • Excès de matrice extracellulaire = fibrose • Pas assez de matrice extracellulaire (synthése↓ ou dégradation ↑) – Arthrose, ostéoporose – Arthrites

Composition des matrices (Pathologies résultant de l’altération (mutation génétique) d’un des composants de la matrice)

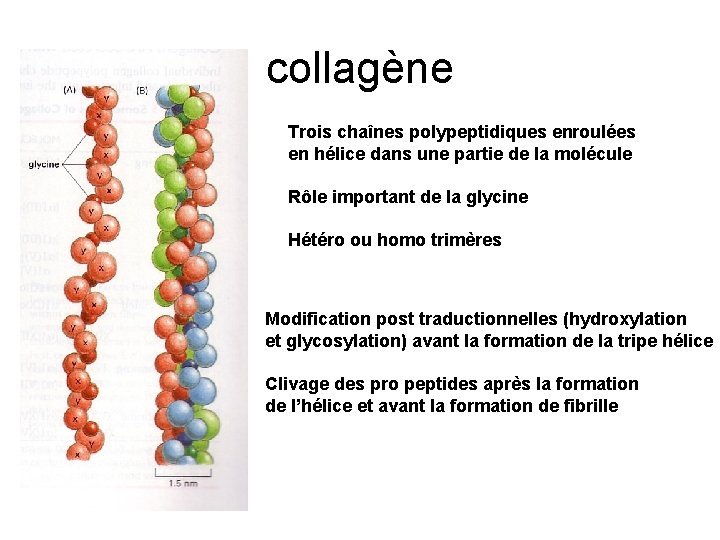
collagène Trois chaînes polypeptidiques enroulées en hélice dans une partie de la molécule Rôle important de la glycine Hétéro ou homo trimères Modification post traductionnelles (hydroxylation et glycosylation) avant la formation de la tripe hélice Clivage des pro peptides après la formation de l’hélice et avant la formation de fibrille

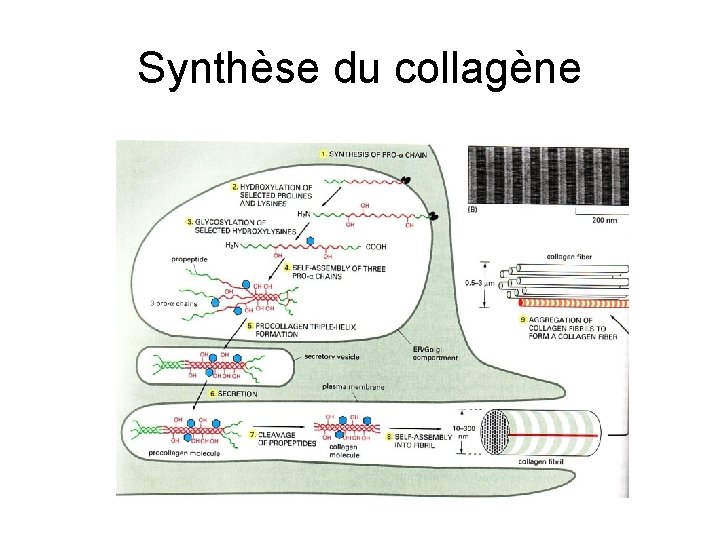
Synthèse du collagène

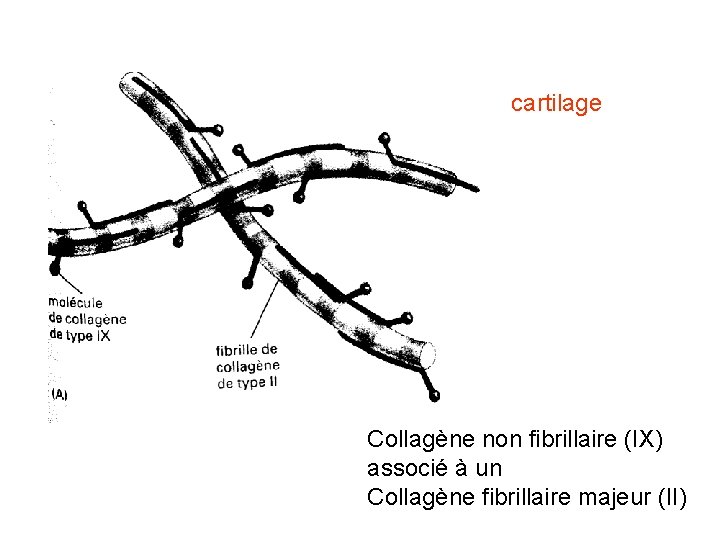
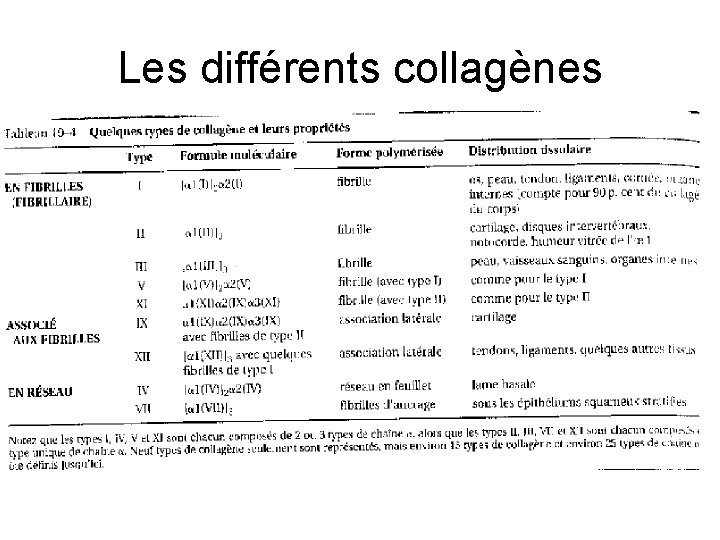
STRUCTURE DES COLLAGENES • Les molécules peuvent se grouper en fibres = collagènes fibrillaires – majeurs (I, III) – mineurs (V, XI) • Les collagènes non fibrillaires s'associent aux fibrillaires (IX, X XII) forment des réseaux (IV, VII)

cartilage Collagène non fibrillaire (IX) associé à un Collagène fibrillaire majeur (II)

Les différents collagènes

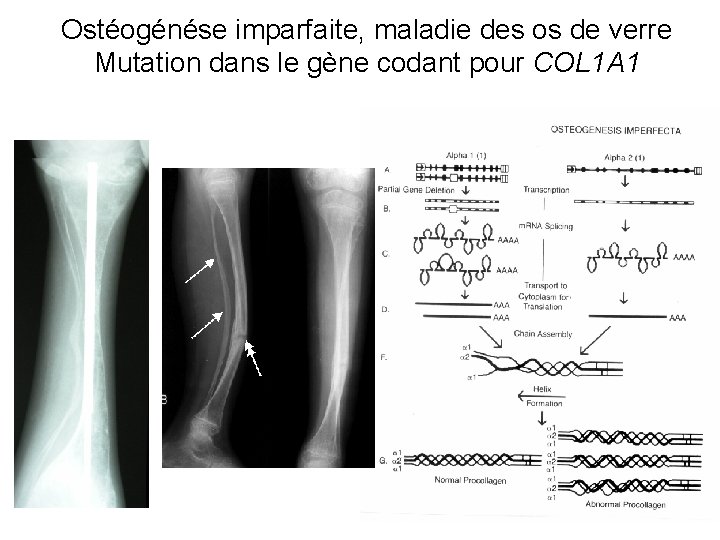
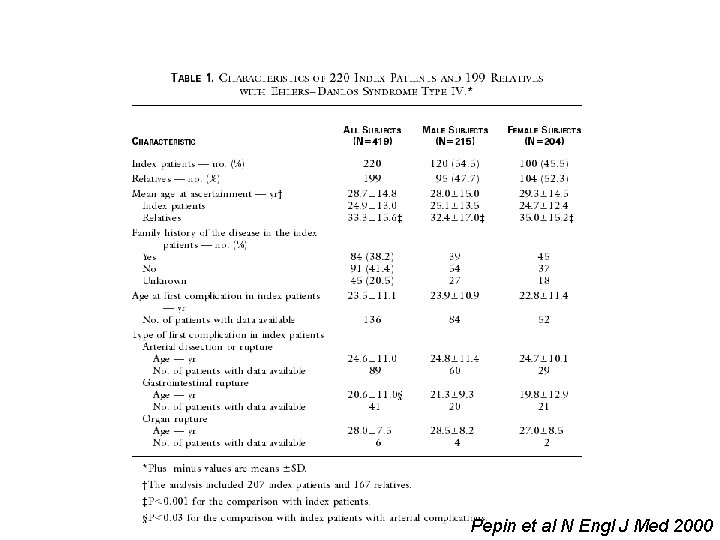
PATHOLOGIES DES COLLAGENES • Mutation dans la séquence codante d’un collagène maladies génétiques rares. Génotypage difficile • Mutation dans la séquence codante du collagène I = maladie de Lobstein. Phénotype uniquement osseux. • Mutation dans la séquence codante du collagène II = arthroses à début précoce + dysplasies + myopie • Mutation du collagène III = Ehlers-Danlos : • Peau fragile (fine, ecchymoses ) Rupture des organes (colon, uterus) Anévrysmes vasculaires

Ostéogénése imparfaite, maladie des os de verre Mutation dans le gène codant pour COL 1 A 1

Syndrome d’Ehlers Danlos : mutation dans le gène codant pour le collagène III Pepin et al N Engl J Med 2000

Pepin et al N Engl J Med 2000

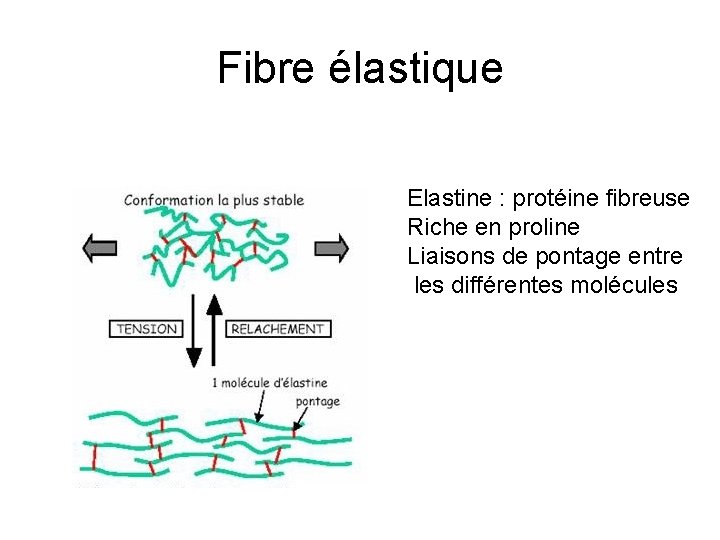
Fibre élastique Elastine : protéine fibreuse Riche en proline Liaisons de pontage entre les différentes molécules

Fibre élastique • La fibre élastique = noyau d'élastine entourée d'un manchon de microfibrilles de 10 nm de diam. • Les microfibrilles sont formées de glycoprotéines (fibrilline) et peuvent exister dans les MEC indépendamment de l'élastine

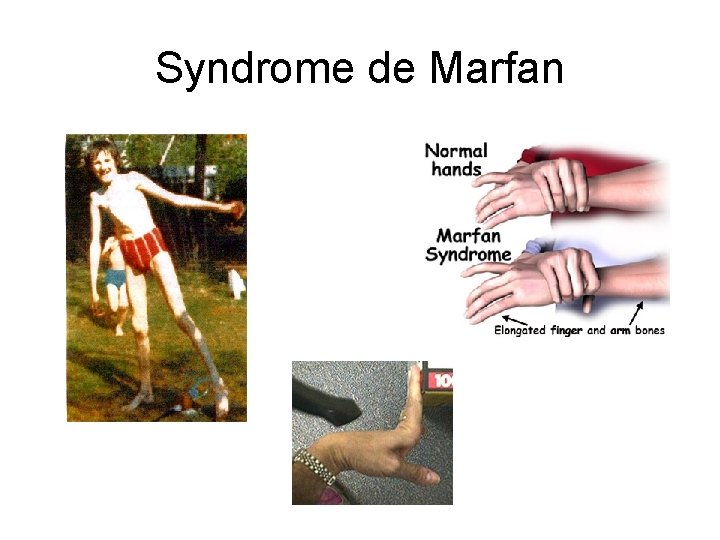
SYNDROME DE MARFAN Amenophis 4 Lincoln

Syndrome de Marfan

SYNDROME DE MARFAN Due à des mutations dans le gène de la fibrilline Incidence 1/10 000 - Allongement excessif et gracilité des membres et des doigts - Hyperextensibilité cutanée - Ectopie du cristallin - Altération de la paroi des artères (média), anévrysmes vasculaires - Fréquemment formes incomplètes

PROTEINES ADHESIVES Médient l'adhésion entre la MEC et les cellules Contiennent la séquence d'acides aminés R = Arginine G= Glycine D= Acide aspartique Elles ne sont pas spécifiques d'un tissu Fibronectine Vitronectine Thrombospondine Ténascine Laminine : membranes basales

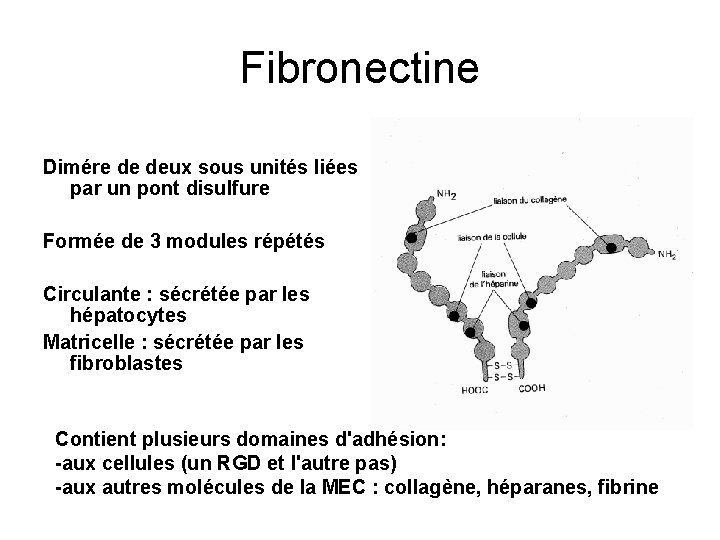
Fibronectine Dimére de deux sous unités liées par un pont disulfure Formée de 3 modules répétés Circulante : sécrétée par les hépatocytes Matricelle : sécrétée par les fibroblastes Contient plusieurs domaines d'adhésion: -aux cellules (un RGD et l'autre pas) -aux autres molécules de la MEC : collagène, héparanes, fibrine

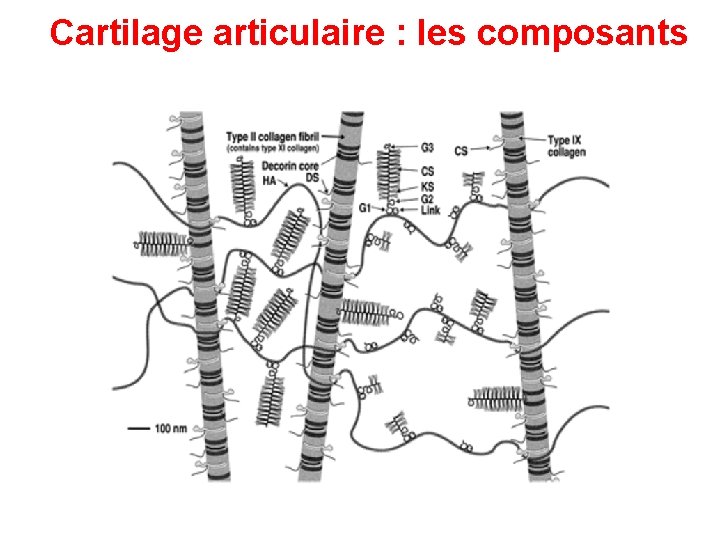
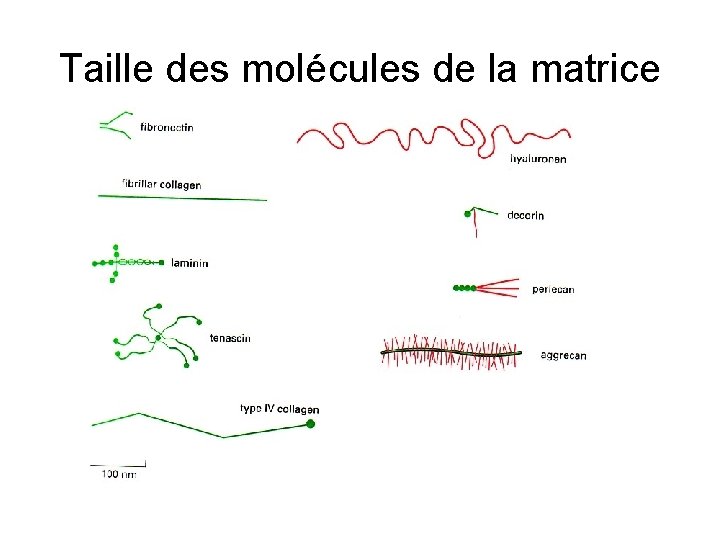
Glycosaminoglycannes = chaîne polysaccharidique faite d’unités disaccharidiques répétitives Forte charge négative (groupement sulfaté et carboxyle) donc elles attirent des ions Na+ et absorption de grandes quantités d'eau Particularité : structure très étirée volume considérable résistance Présents en grande abondance dans le cartilage

Acide hyaluronique : particularité : ubiquitaire, très long non sulfaté, non lié aux protéines très long (25 000 disaccharides) disaccharides identiques Présent dans tous les tissus Remplissage des espaces permettant la migration des cellules

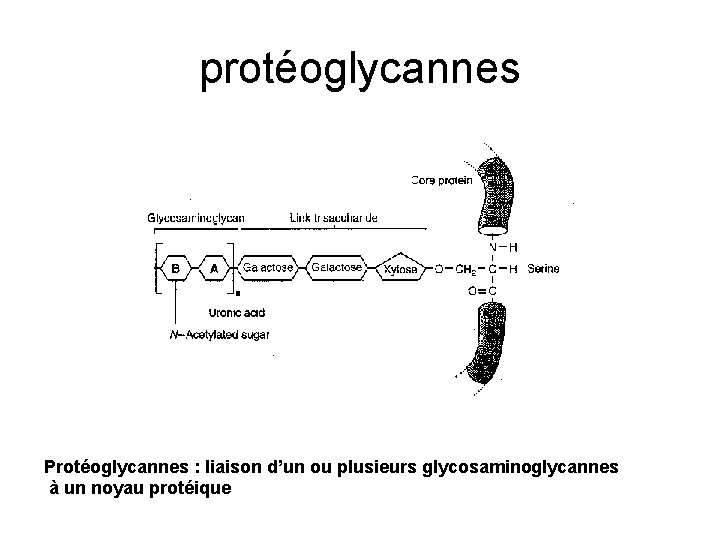
protéoglycannes Protéoglycannes : liaison d’un ou plusieurs glycosaminoglycannes à un noyau protéique

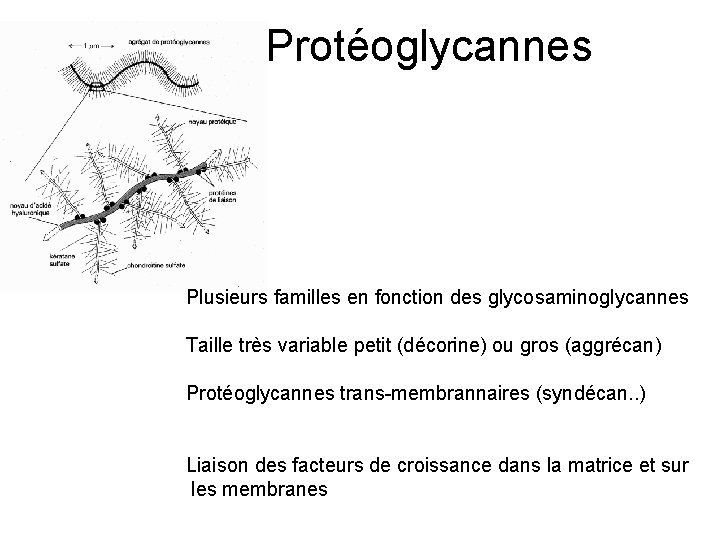
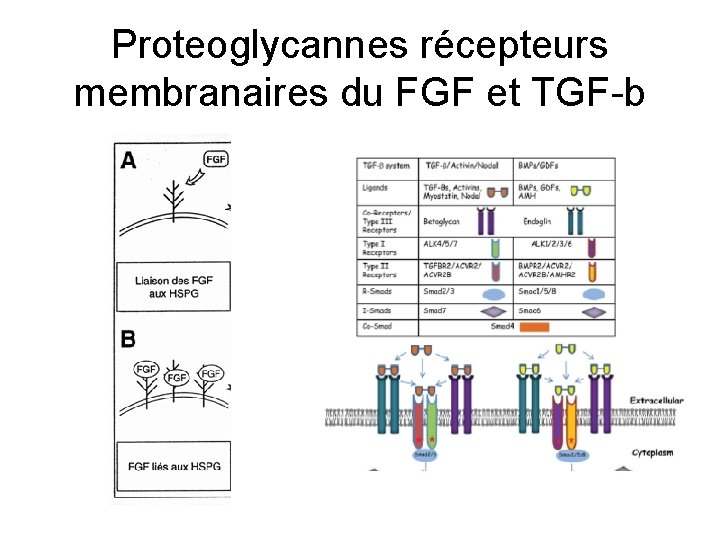
Protéoglycannes Plusieurs familles en fonction des glycosaminoglycannes Taille très variable petit (décorine) ou gros (aggrécan) Protéoglycannes trans-membrannaires (syndécan. . ) Liaison des facteurs de croissance dans la matrice et sur les membranes

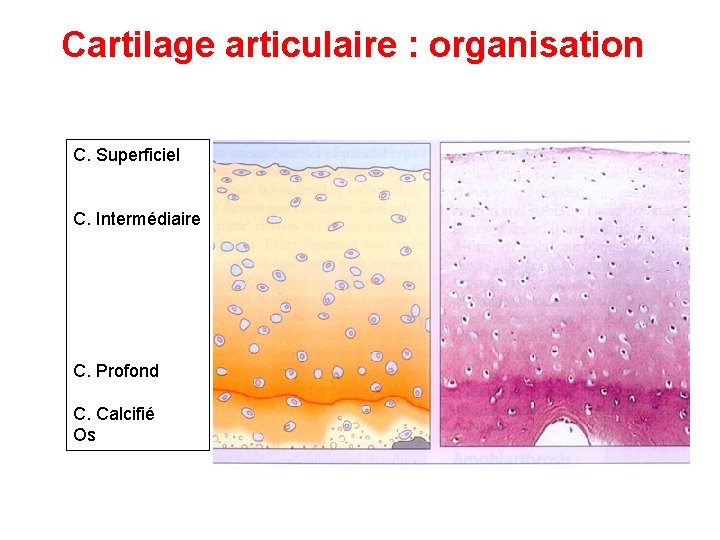
Cartilage articulaire : organisation C. Superficiel C. Intermédiaire C. Profond C. Calcifié Os

Cartilage articulaire : les composants

Proteoglycannes récepteurs membranaires du FGF et TGF-b

Taille des molécules de la matrice

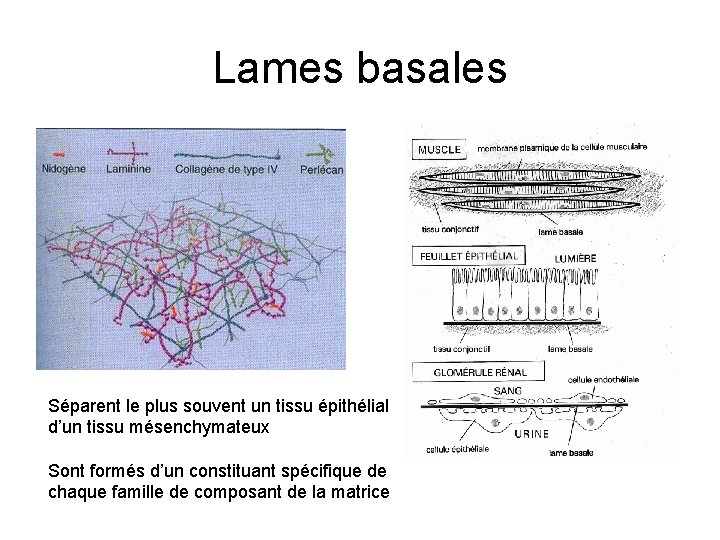
Lames basales Séparent le plus souvent un tissu épithélial d’un tissu mésenchymateux Sont formés d’un constituant spécifique de chaque famille de composant de la matrice

Lames basales : Pathologies Affection acquises (développement d’auto anticorps) ou héréditaires entrainant des manifestations essentiellement cutanées ou rénales

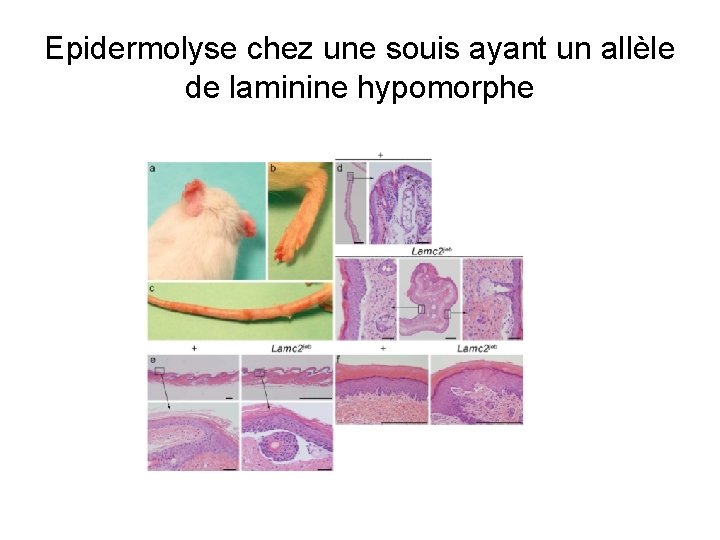
Epidermolyse chez une souis ayant un allèle de laminine hypomorphe

Dégradation de la matrice : les protéases

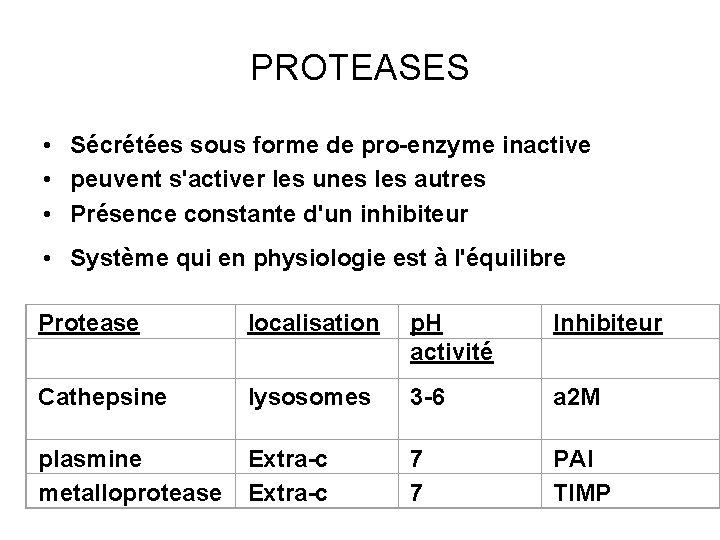
PROTEASES • Sécrétées sous forme de pro-enzyme inactive • peuvent s'activer les unes les autres • Présence constante d'un inhibiteur • Système qui en physiologie est à l'équilibre Protease localisation p. H activité Inhibiteur Cathepsine lysosomes 3 -6 a 2 M plasmine metalloprotease Extra-c 7 7 PAI TIMP

Protéases: rôle en physiologie Renouvellement normal des matrices Réparation des plaies : - «shedding» des molécules transmembranaires -clive les facteurs de croissance associés des protéines matricielles -clive directement les facteurs de croissance sécrétés sous forme de pro-peptides

Protéases: rôle en physiologie et pathologie Migration des leucocytes clivage des composants de la matrice extracellulaire : clivage des molécules de la matrice, des intégrines, des cadhérines Destruction du inflammatoires cartilage dans Angiogenèse : relargage du VEGF Métastases les maladies

Cathepsines le p. H acide des endosomes clive le prodomaine et la protéase est activée dans le lysosome où règne un p. H acide A l'état physiologique elles sont pas ou peu sécrétées : enzymes de dégradation intracellulaires Maladie lysosomiales = "maladies de surcharges" dues à une absence de dégradation des protéines intracellulaires dans le lysosome et certaines par un mauvais routage des cathepsines

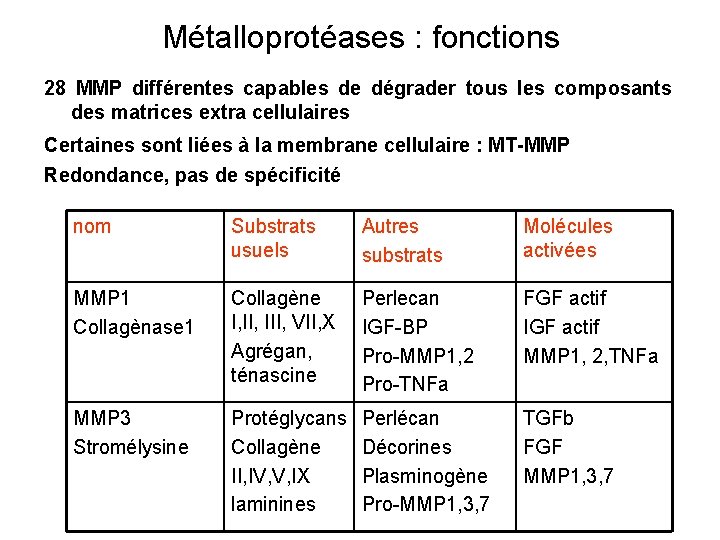
Métalloprotéases : fonctions 28 MMP différentes capables de dégrader tous les composants des matrices extra cellulaires Certaines sont liées à la membrane cellulaire : MT-MMP Redondance, pas de spécificité nom Substrats usuels Autres substrats Molécules activées MMP 1 Collagènase 1 Collagène I, III, VII, X Agrégan, ténascine Perlecan IGF-BP Pro-MMP 1, 2 Pro-TNFa FGF actif IGF actif MMP 1, 2, TNFa MMP 3 Stromélysine Protéglycans Collagène II, IV, V, IX laminines Perlécan Décorines Plasminogène Pro-MMP 1, 3, 7 TGFb FGF MMP 1, 3, 7

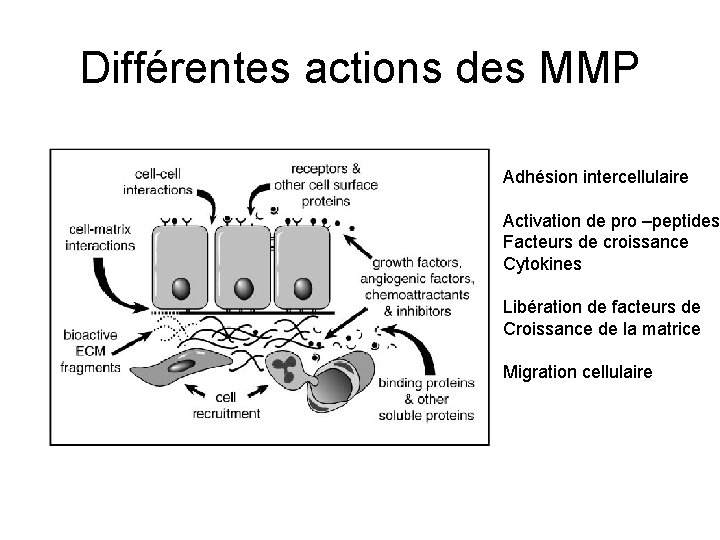
Différentes actions des MMP Adhésion intercellulaire Activation de pro –peptides Facteurs de croissance Cytokines Libération de facteurs de Croissance de la matrice Migration cellulaire

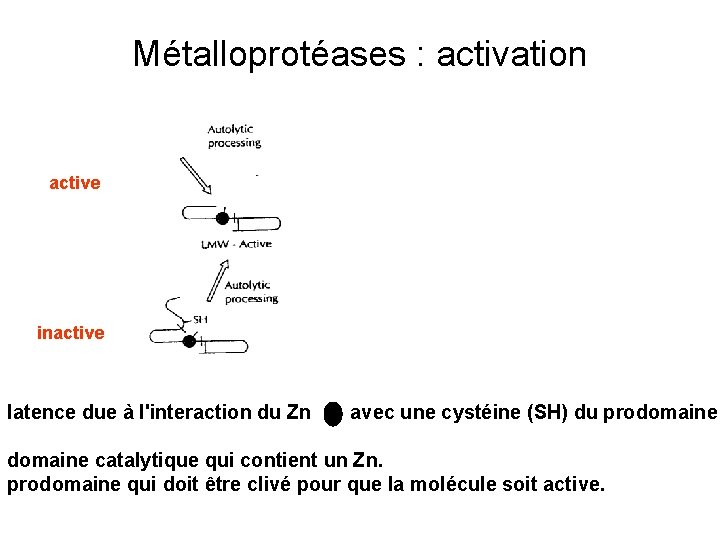
Métalloprotéases : activation active inactive latence due à l'interaction du Zn avec une cystéine (SH) du prodomaine catalytique qui contient un Zn. prodomaine qui doit être clivé pour que la molécule soit active.

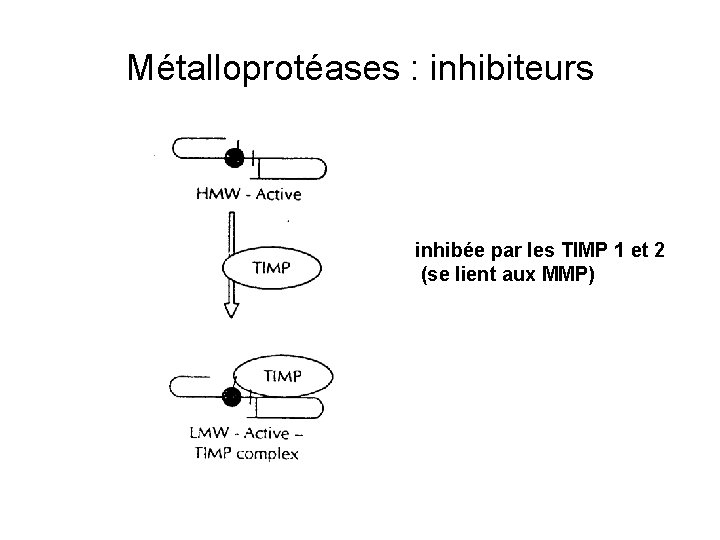
Métalloprotéases : inhibiteurs inhibée par les TIMP 1 et 2 (se lient aux MMP)

Métalloprotéases : activation en cascade -Activation par d’autres protéases (cascade) dans les matrices Ex : dégradation des protéoglycannes du disque inter vertebral par macrophages activés : MMP 7 produite par le macrophage permet le » shedding » du TNFa membranaires augmente la production et activation de MMP 3 des chondrocytes dégradation protéoglycannes ou par les MT-MMP à la surface des cellules active les autres MMP Contrôlée (induites ou réprimées) par les facteurs de croissance (inhibent) et cytokines (activent)

Complexité des métalloprotéases • Système redondant : beaucoup de protéases ont le même substrat • Dans une voie la MMP peut avoir plusieurs substrats • Les MMP s’activent les unes les autres et aussi autres protéases → difficulté d’interpréter modèles souris KO

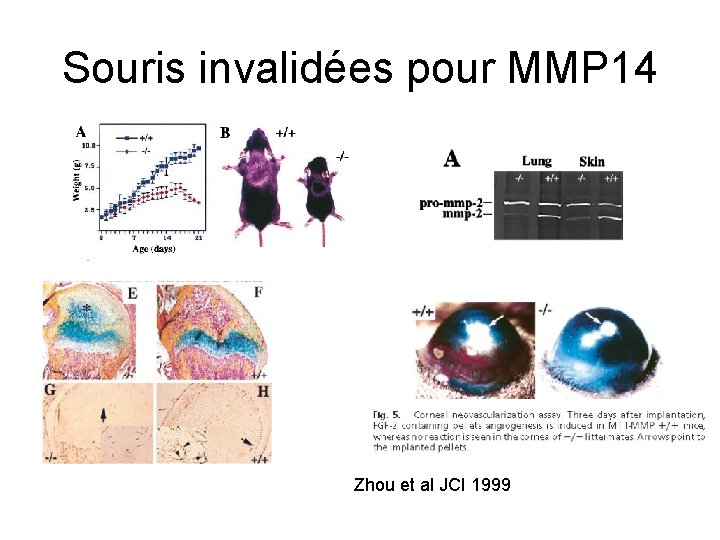
Souris invalidées pour MMP 14 Zhou et al JCI 1999

Famille des Furines • Protéase trans-membranaires • Présentes dans le trans Gogli • Clive et induit la maturation de récepteurs, hormones, facteurs de croissance, MMP au niveau d’une séquence consensus d’aa • Protéine pro-convertase

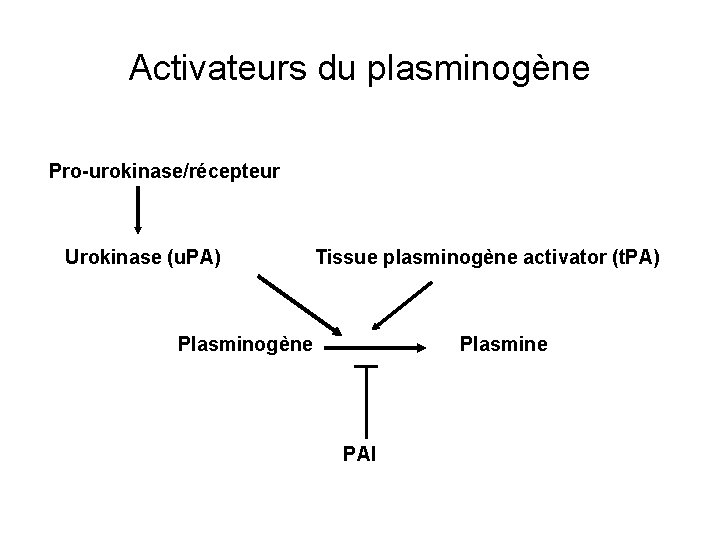
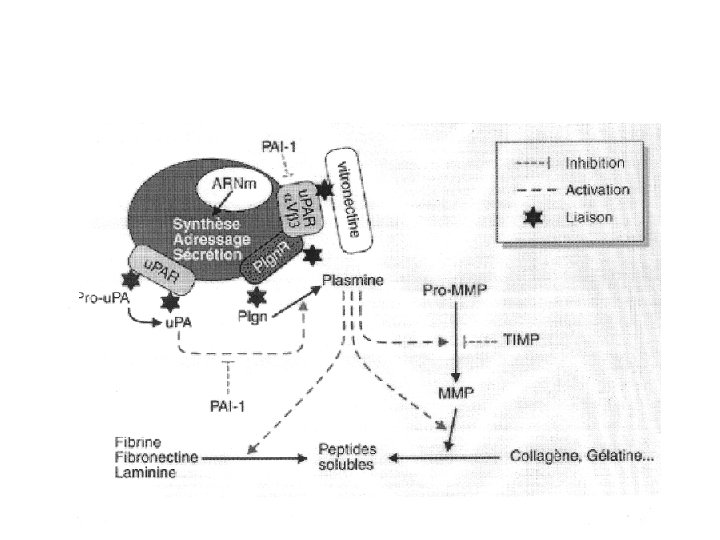
Sérines protéases : les activateurs du plasminogène convertissent le zymogène (plasminogène) en plasmine -plasmine dégrade tous les composants de la matrice excepté le collagène natif et l’élastine -Inhibiteur de l’activateur du plasminogène (PAI) prévient la conversion du plasminogène en plasmine. Stabilisé dans les matrices par la vitronectine

Activateurs du plasminogène Pro-urokinase/récepteur Urokinase (u. PA) Tissue plasminogène activator (t. PA) Plasminogène Plasmine PAI

Tissue plasminogène activateur a) type tissulaire (t. PA) Circulant Produit uniquement par les CEndothéliales Activité déclenchée par la fibrine Impliqué dans la dégradation du caillot

urokinase b) urokinase (u. PA) sécrétée sous forme inactive (pro-u. PA) par de nombreuses cellules -u. PA a un récepteur cellulaire spécifique u. PAR -La liaison au récepteur entraîne l'activation de pro-u. PA en u. PA. -u. PA est régulé par les facteurs de croissance et des oncogènes -u. PAR intéragit avec les intégrines et peut lier la vitronectine rôle dans l’adhésion cellulaire

Sérine protéase

Protéases et métastases Rationnel

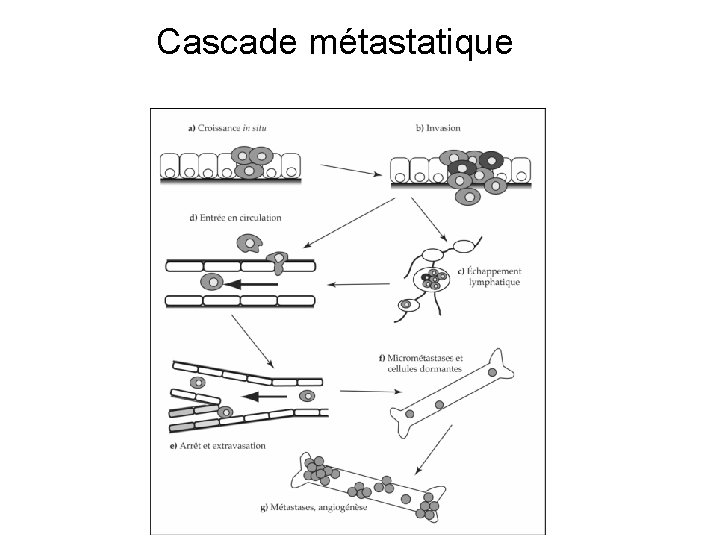
Cascade métastatique

Cascade métastatique • Dans la tumeur primitive : perte de la connexion des cellules tumorales entre elles et dégradation du stroma de la tumeur, angiogénése, puis rupture de la membrane basale • Migration vers les ganglions puis vers les vaisseaux sanguins (rupture de la basale des vaisseaux et passage entre les cellules endothéliales) • Extravasation du vaisseau, dégradation du stroma du tissu hôte de la métastase, angiogénése, adhésion et prolifération dans le tissu métastatique

Matrice et métastases : rationnel sécrétion de protéases par les cellules tumorales ↑ +++ ü dégradation de la MEC autour de la tumeur (stroma tumoral) ü dégradation de la basale des Vx ü dégradation de la MEC de la tumeur primitive et de l'organe dans lequel va se développer la métastase ü Libération de la MEC des facteurs de croissance (VEGF, FGF) stimulant l’angiogénése

Modèles utilisés - Test in vitro : invasion des cellules à travers une matrice synthétique - Modèles in vivo chez le rongeur - Application humaine : les mêmes facteurs prédisposant sont ils retrouvés chez l’homme?

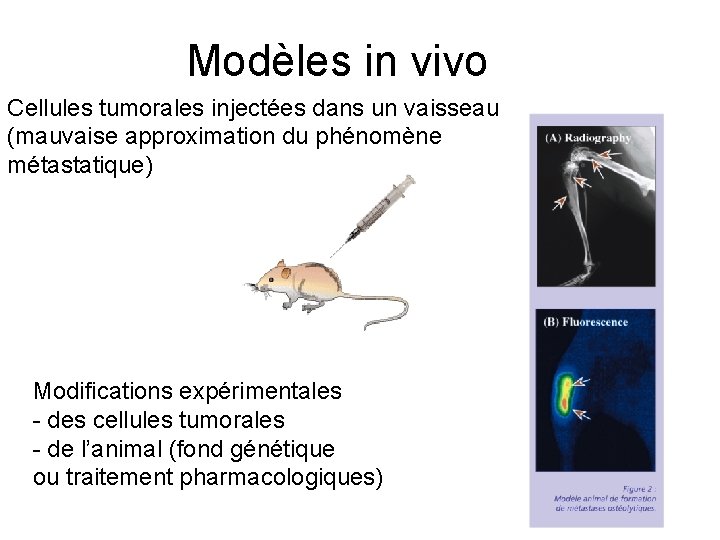
Modèles in vivo Cellules tumorales injectées dans un vaisseau (mauvaise approximation du phénomène métastatique) Modifications expérimentales - des cellules tumorales - de l’animal (fond génétique ou traitement pharmacologiques)

PROTEASES ET METASTASES résultats expérimentaux (1) Arguments expérimentaux in vivo - On injecte dans la circulation à des souris nude des lignées de cellules tumorales humaines transfectées ü avec protéases (métalloprotéase ou urokinase) caractère invasif ü avec des inhibiteur des métalloprotéases (TIMP) ou d’urokinase (PAI) ↓ leurs capacités invasives.

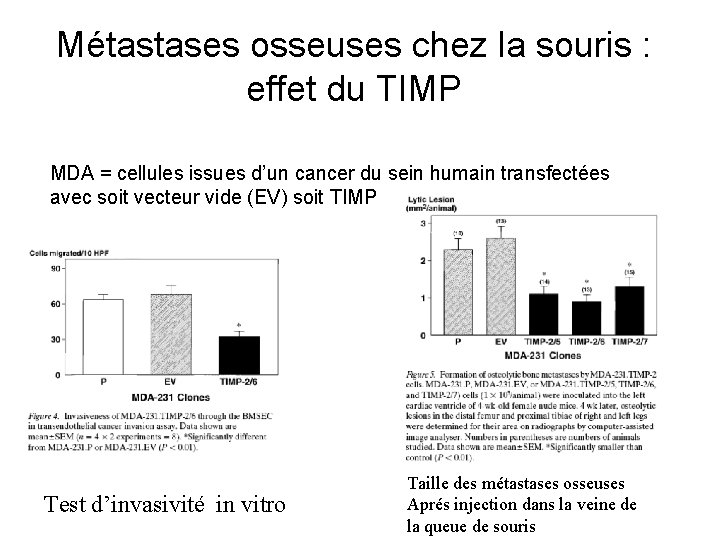
Métastases osseuses chez la souris : effet du TIMP MDA = cellules issues d’un cancer du sein humain transfectées avec soit vecteur vide (EV) soit TIMP Test d’invasivité in vitro Taille des métastases osseuses Aprés injection dans la veine de la queue de souris

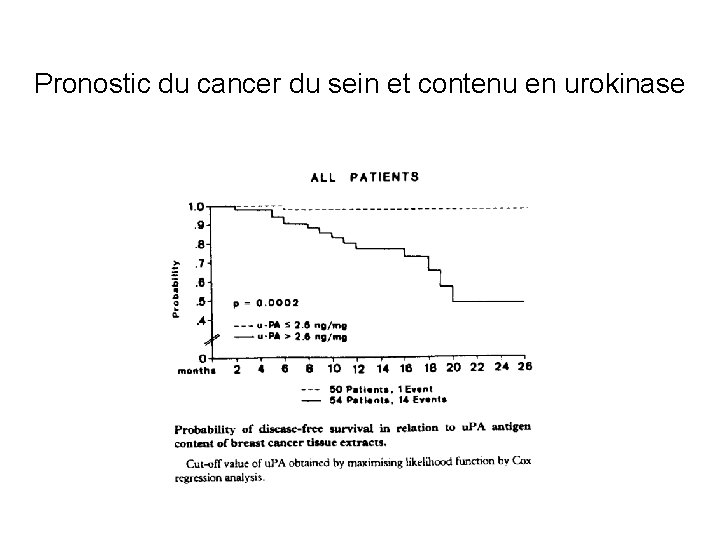
PROTEASES ET METASTASES (2) Etudes prospectives chez les patients : Evaluation du niveau d’expression d’un gène ou de la protéine dans la tumeur primitive (tumorothéques). puis suivi prospectif des patients. Analyse de leur survie sans récidives Preuve du concept et intérêt pronostique -Activateur du plasminogène (urokinase) et cancer du sein et de la prostate -Cathépsine D et cancer du sein -Collagénases de type IV (lames basales) et cancers du poumon

Pronostic du cancer du sein et contenu en urokinase

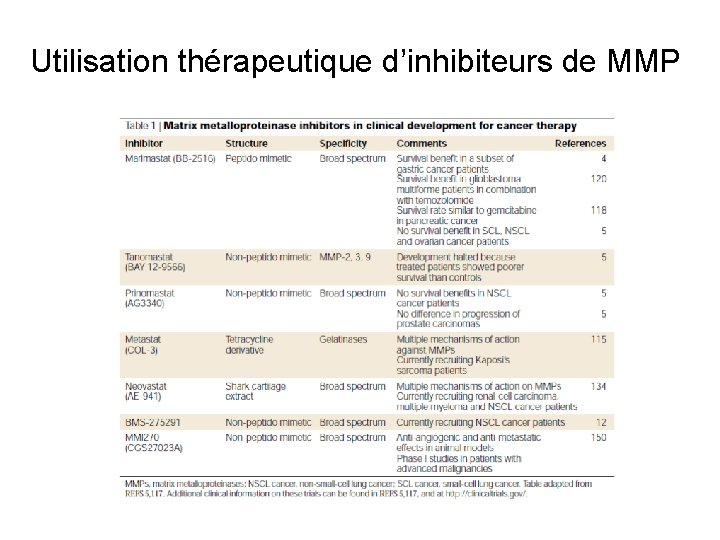
Utilisation thérapeutique d’inhibiteurs de MMP

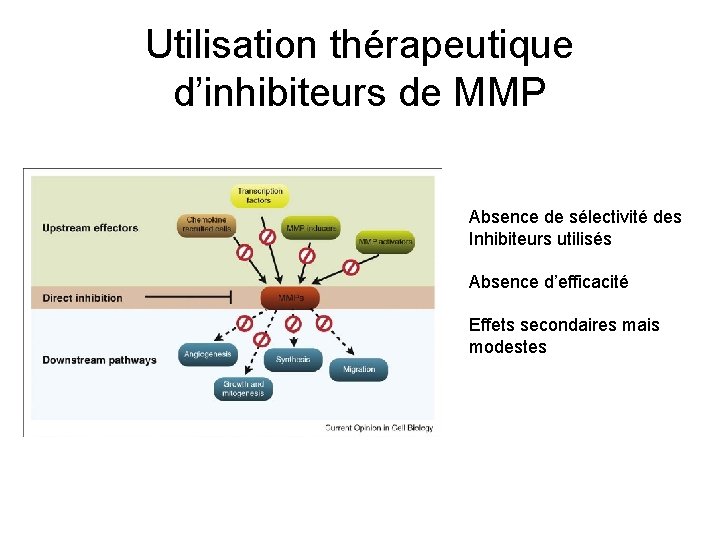
Utilisation thérapeutique d’inhibiteurs de MMP Absence de sélectivité des Inhibiteurs utilisés Absence d’efficacité Effets secondaires mais modestes

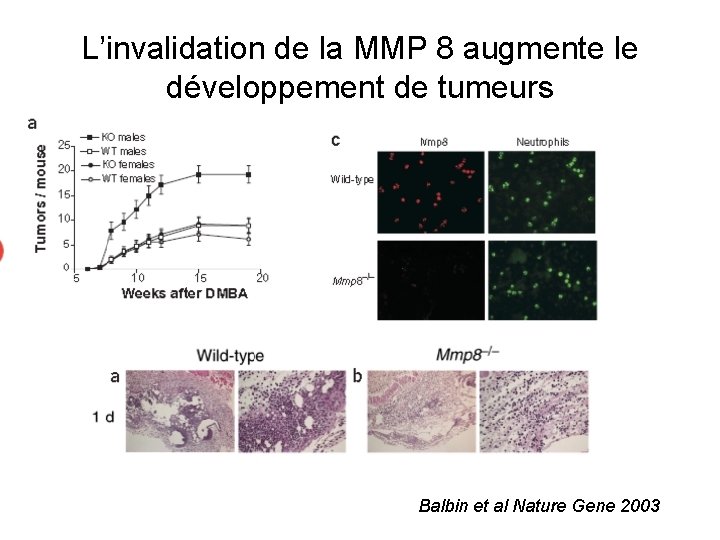
L’invalidation de la MMP 8 augmente le développement de tumeurs Balbin et al Nature Gene 2003

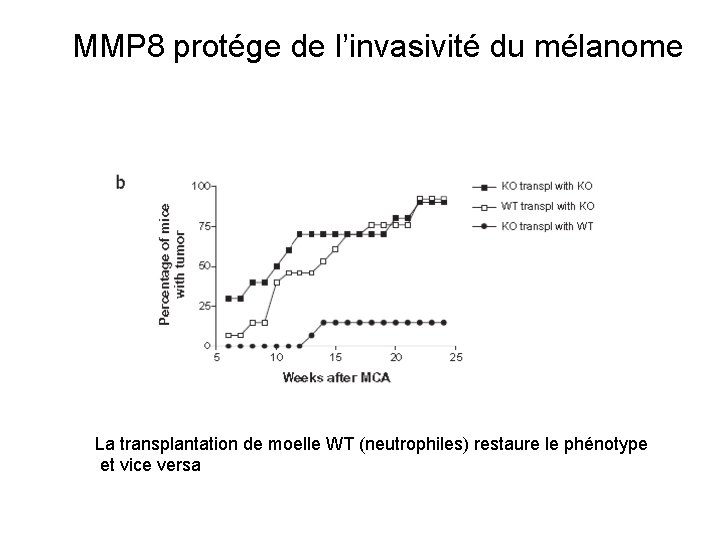
MMP 8 protége de l’invasivité du mélanome La transplantation de moelle WT (neutrophiles) restaure le phénotype et vice versa

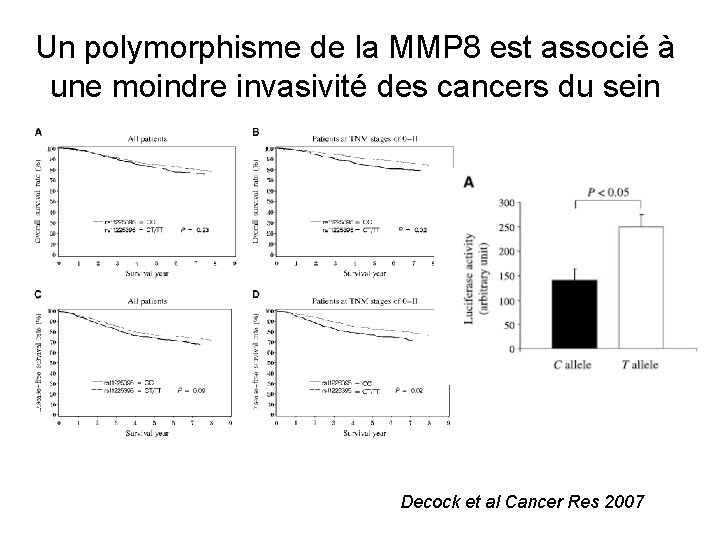
Un polymorphisme de la MMP 8 est associé à une moindre invasivité des cancers du sein Decock et al Cancer Res 2007

Résultats décevants des inhibiteurs de MMP • Les MMP peuvent avoir des effets positifs ou négatifs sur l’invasivité des cancers en fonction – de leur cibles cellulaires différentes (cellules de l’immunité, cellules du stroma tumoral) – des produits de dégradation qu’ils génèrent • Dégradomique : évaluer in vivo tous les produits de dégradations d’une MMP • Les métalloprotéases sont elles encore des cibles thérapeutiques?