REGULACION DE LA RESPUESTA INMUNE TOLERANCIA Y AUTOINMUNIDAD











































- Slides: 59

REGULACION DE LA RESPUESTA INMUNE. TOLERANCIA Y AUTOINMUNIDAD Bioqca. Esp. Sandra Grenón Especialización Bioquímica Clínica Área Endocrinología Inmunoquímica Clínica 2014







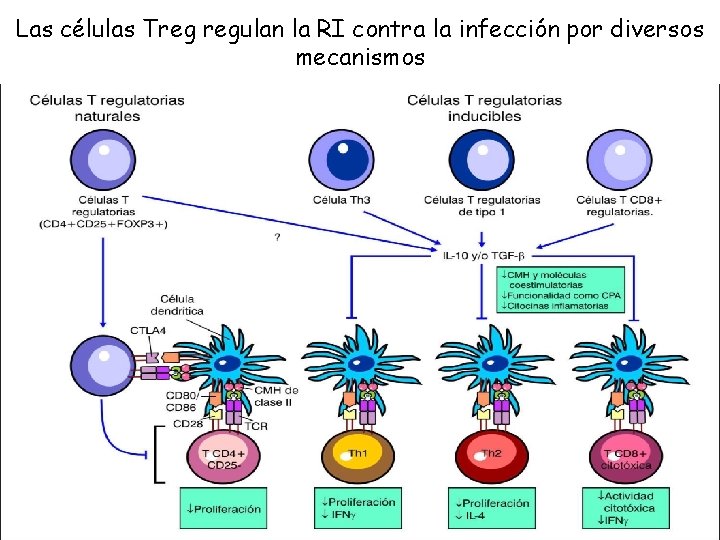
Las células Treg regulan la RI contra la infección por diversos mecanismos

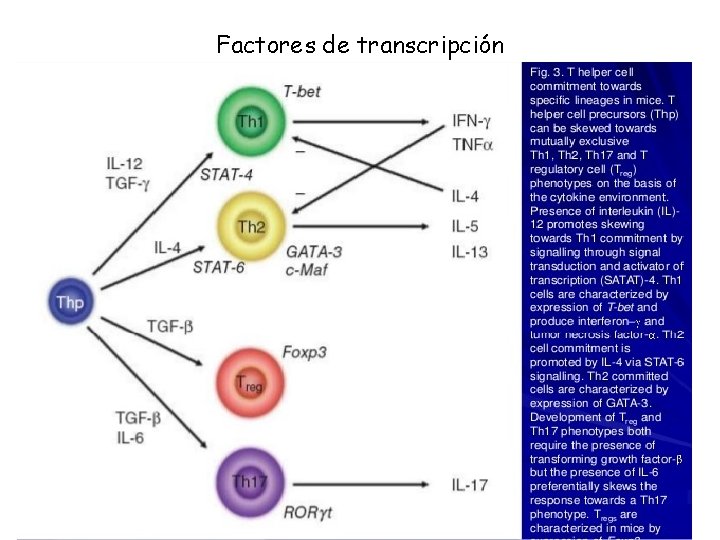
La diferenciación de estas subpoblaciones esta dada por el microambiente de citocinas, así como las interacciones entre el TCR y el antígeno, las moléculas coestimuladoras y la expresión de factores de transcripción Esta clasificación se ha hecho en base al perfil de citocinas sintetizadas, las funciones biológicas desarrolladas , así como la expresión de diversos marcadores


Factores de transcripción


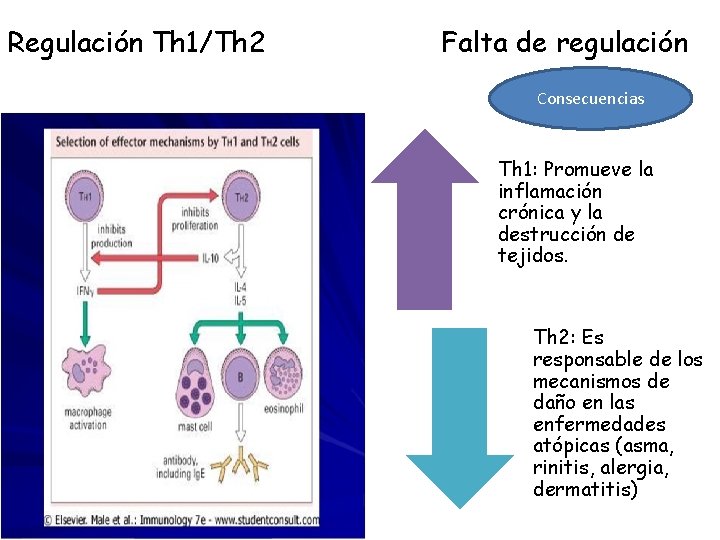
Linfocitos Th 1 y Th 2 Estas poblaciones una vez diferencias (polarizadas), son estables, después de cierto numero de divisiones. El establecimiento del programa de transcripción es estable aun cuando sean transferidas a un nuevo microambiente polarizante. Th 2 Th 1 Inducen síntesis de Ig. E, eliminación de parásitos (nematodos), reclutamiento de eosinófilos, activación de células, daño y expulsión de parásitos del intestino (hipermotilidad intestinal, producción de moco) Incrementa los mecanismos para la erradicación de patógenos intracelulares, es un potente activador de la inmunidad mediada por células



Regulación Th 1/Th 2 Falta de regulación Consecuencias Th 1: Promueve la inflamación crónica y la destrucción de tejidos. Th 2: Es responsable de los mecanismos de daño en las enfermedades atópicas (asma, rinitis, alergia, dermatitis)

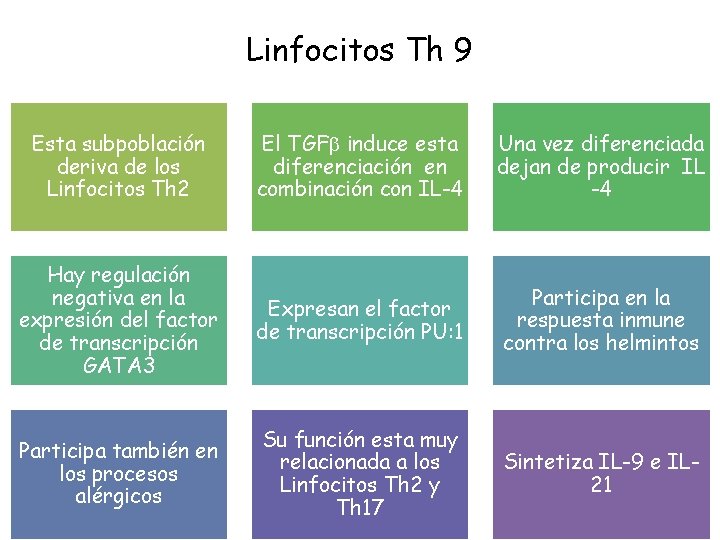
Linfocitos Th 9 Esta subpoblación deriva de los Linfocitos Th 2 El TGFb induce esta diferenciación en combinación con IL-4 Una vez diferenciada dejan de producir IL -4 Hay regulación negativa en la expresión del factor de transcripción GATA 3 Expresan el factor de transcripción PU: 1 Participa en la respuesta inmune contra los helmintos Participa también en los procesos alérgicos Su función esta muy relacionada a los Linfocitos Th 2 y Th 17 Sintetiza IL-9 e IL 21


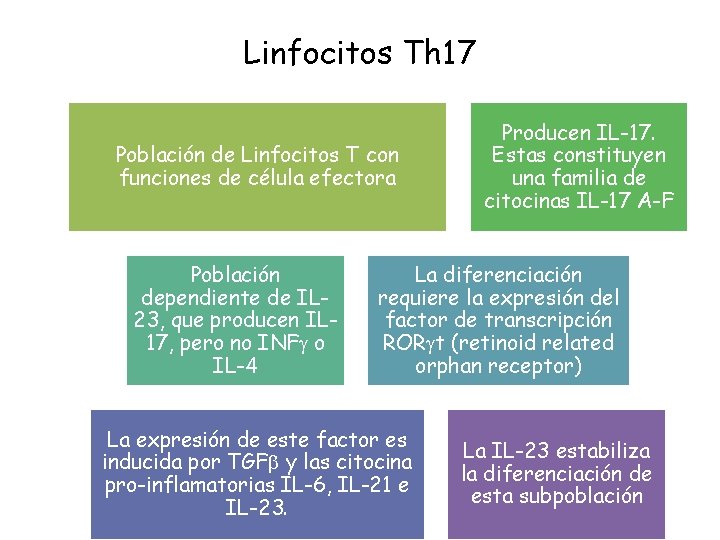
Linfocitos Th 17 Población de Linfocitos T con funciones de célula efectora Población dependiente de IL 23, que producen IL 17, pero no INFg o IL-4 Producen IL-17. Estas constituyen una familia de citocinas IL-17 A-F La diferenciación requiere la expresión del factor de transcripción RORgt (retinoid related orphan receptor) La expresión de este factor es inducida por TGFb y las citocina pro-inflamatorias IL-6, IL-21 e IL-23. La IL-23 estabiliza la diferenciación de esta subpoblación



Linfocitos Th 17 La plasticidad de los Linfocitos Th 17, tiene importantes implicancias biológicas Son muy importantes en la lámina propia de la pared intestinal. Promueven el estrechamiento de las uniones celulares en las mucosas. La inestabilidad de esta población, se ve compensada por la presión selectiva para mantener el perfil Th 17 en el ambiente intestinal. Las bacterias comensales en el intestino, son esenciales para la inducción de las células Th 17. Tratamientos con antibióticos orales, pueden inhibir la diferenciación de las células Th 17 en la lámina propia del intestino Th 17 es muy importante en el inicio y desarrollo de la respuesta inflamatoria aguda Estimula la generación de neutrófilos y su movilización Juega un papel central en los mecanismos de protección tempranos contra daño por trauma severo, el cual puede derivar en necrosis y sepsis. De manera relevante forma parte de una red de interacciones entre la inmunidad innata y la RI adaptativa para PROMOVER LA INFLACION



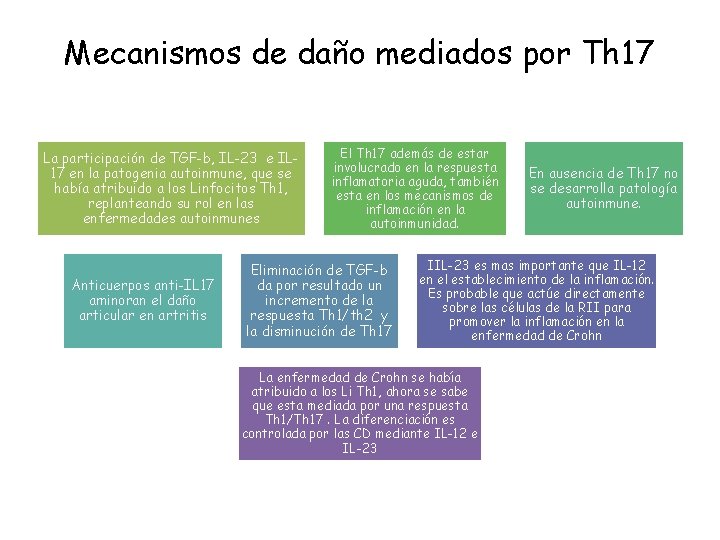
Mecanismos de daño mediados por Th 17 La participación de TGF-b, IL-23 e IL 17 en la patogenia autoinmune, que se había atribuido a los Linfocitos Th 1, replanteando su rol en las enfermedades autoinmunes Anticuerpos anti-IL 17 aminoran el daño articular en artritis El Th 17 además de estar involucrado en la respuesta inflamatoria aguda, también esta en los mecanismos de inflamación en la autoinmunidad. Eliminación de TGF-b da por resultado un incremento de la respuesta Th 1/th 2 y la disminución de Th 17 En ausencia de Th 17 no se desarrolla patología autoinmune. IIL-23 es mas importante que IL-12 en el establecimiento de la inflamación. Es probable que actúe directamente sobre las células de la RII para promover la inflamación en la enfermedad de Crohn La enfermedad de Crohn se había atribuido a los Li Th 1, ahora se sabe que esta mediada por una respuesta Th 1/Th 17. La diferenciación es controlada por las CD mediante IL-12 e IL-23

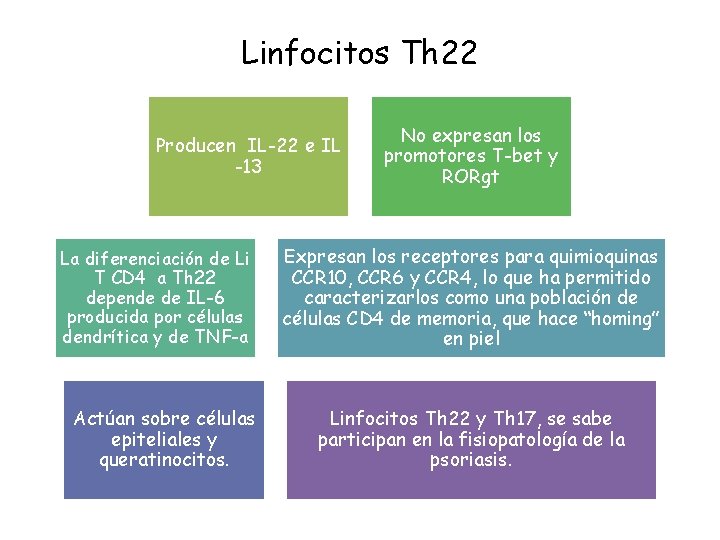
Linfocitos Th 22 Producen IL-22 e IL -13 La diferenciación de Li T CD 4 a Th 22 depende de IL-6 producida por células dendrítica y de TNF-a Actúan sobre células epiteliales y queratinocitos. No expresan los promotores T-bet y RORgt Expresan los receptores para quimioquinas CCR 10, CCR 6 y CCR 4, lo que ha permitido caracterizarlos como una población de células CD 4 de memoria, que hace “homing” en piel Linfocitos Th 22 y Th 17, se sabe participan en la fisiopatología de la psoriasis.


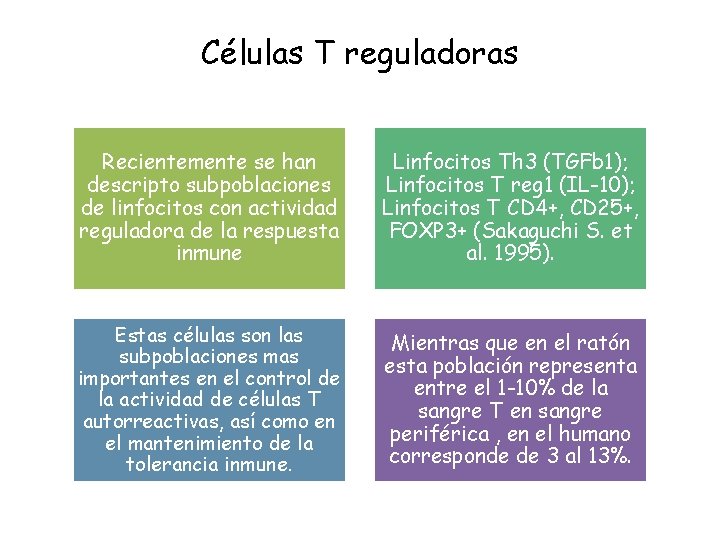
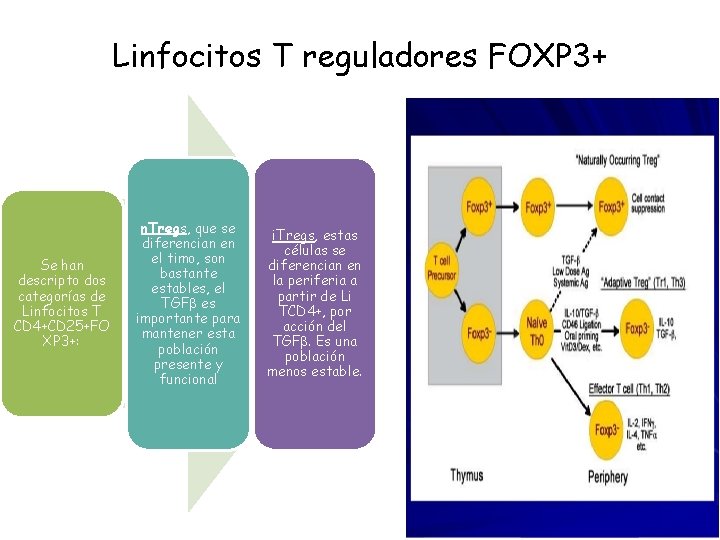
Células T reguladoras Recientemente se han descripto subpoblaciones de linfocitos con actividad reguladora de la respuesta inmune Linfocitos Th 3 (TGFb 1); Linfocitos T reg 1 (IL-10); Linfocitos T CD 4+, CD 25+, FOXP 3+ (Sakaguchi S. et al. 1995). Estas células son las subpoblaciones mas importantes en el control de la actividad de células T autorreactivas, así como en el mantenimiento de la tolerancia inmune. Mientras que en el ratón esta población representa entre el 1 -10% de la sangre T en sangre periférica , en el humano corresponde de 3 al 13%.

Linfocitos T reguladores FOXP 3+ Se han descripto dos categorías de Linfocitos T CD 4+CD 25+FO XP 3+: n. Tregs, que se diferencian en el timo, son bastante estables, el TGFb es importante para mantener esta población presente y funcional i. Tregs, estas células se diferencian en la periferia a partir de Li TCD 4+, por acción del TGFb. Es una población menos estable.

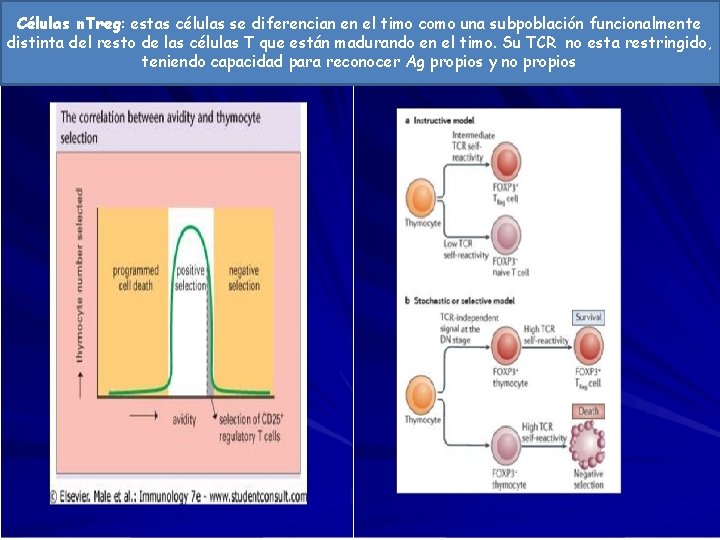
Células n. Treg: estas células se diferencian en el timo como una subpoblación funcionalmente distinta del resto de las células T que están madurando en el timo. Su TCR no esta restringido, teniendo capacidad para reconocer Ag propios y no propios

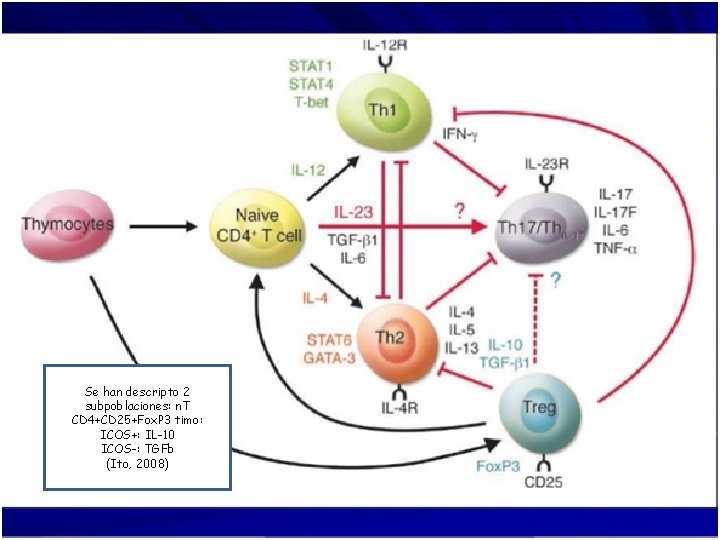
Se han descripto 2 subpoblaciones: n. T CD 4+CD 25+Fox. P 3 timo: ICOS+: IL-10 ICOS-: TGFb (Ito, 2008)



di Aunque la actividad supresora de las células Treg requieran la activación vía TCR, una vez activada puede suprimir a otros Li T “espectadores”. El fenómeno de tolerancia infecciosa se ha propuesto bajo las siguientes bases: Una subpoblación de células n. Treg, pueden promover la expansión de nuevas poblaciones de células Treg, con especificidades antigénicas distinta a la población Treg original.





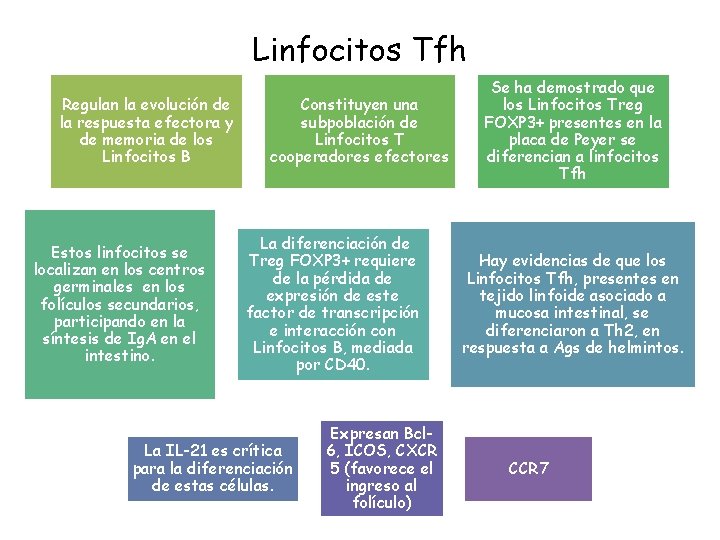
Linfocitos Tfh Regulan la evolución de la respuesta efectora y de memoria de los Linfocitos B Estos linfocitos se localizan en los centros germinales en los folículos secundarios, participando en la síntesis de Ig. A en el intestino. Constituyen una subpoblación de Linfocitos T cooperadores efectores La diferenciación de Treg FOXP 3+ requiere de la pérdida de expresión de este factor de transcripción e interacción con Linfocitos B, mediada por CD 40. La IL-21 es crítica para la diferenciación de estas células. Expresan Bcl 6, ICOS, CXCR 5 (favorece el ingreso al folículo) Se ha demostrado que los Linfocitos Treg FOXP 3+ presentes en la placa de Peyer se diferencian a linfocitos Tfh Hay evidencias de que los Linfocitos Tfh, presentes en tejido linfoide asociado a mucosa intestinal, se diferenciaron a Th 2, en respuesta a Ags de helmintos. CCR 7



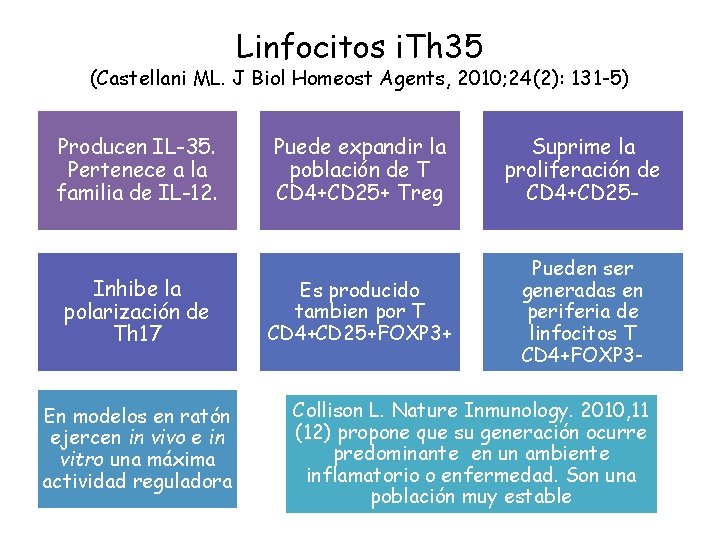
Linfocitos i. Th 35 (Castellani ML. J Biol Homeost Agents, 2010; 24(2): 131 -5) Producen IL-35. Pertenece a la familia de IL-12. Inhibe la polarización de Th 17 En modelos en ratón ejercen in vivo e in vitro una máxima actividad reguladora Puede expandir la población de T CD 4+CD 25+ Treg Suprime la proliferación de CD 4+CD 25 - Es producido tambien por T CD 4+CD 25+FOXP 3+ Pueden ser generadas en periferia de linfocitos T CD 4+FOXP 3 - Collison L. Nature Inmunology. 2010, 11 (12) propone que su generación ocurre predominante en un ambiente inflamatorio o enfermedad. Son una población muy estable

Células NKT

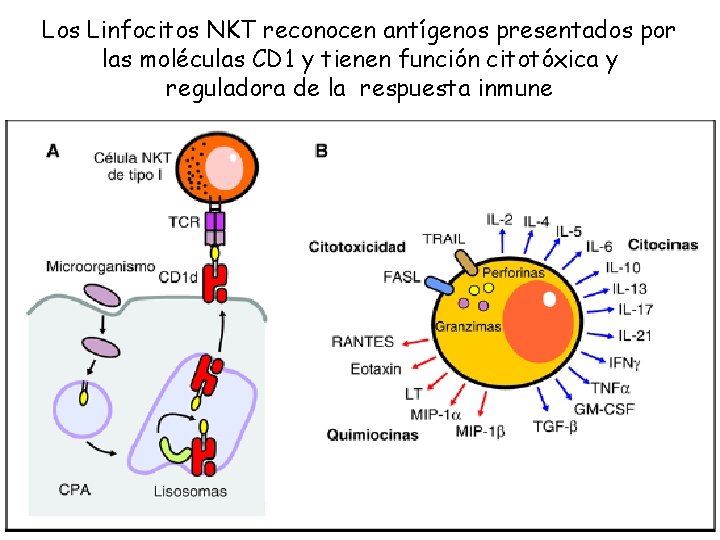
Los Linfocitos NKT reconocen antígenos presentados por las moléculas CD 1 y tienen función citotóxica y reguladora de la respuesta inmune





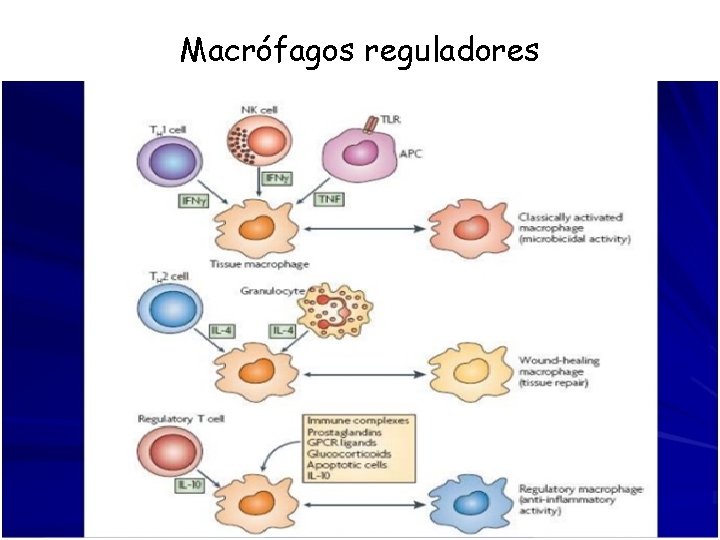
Macrófagos reguladores




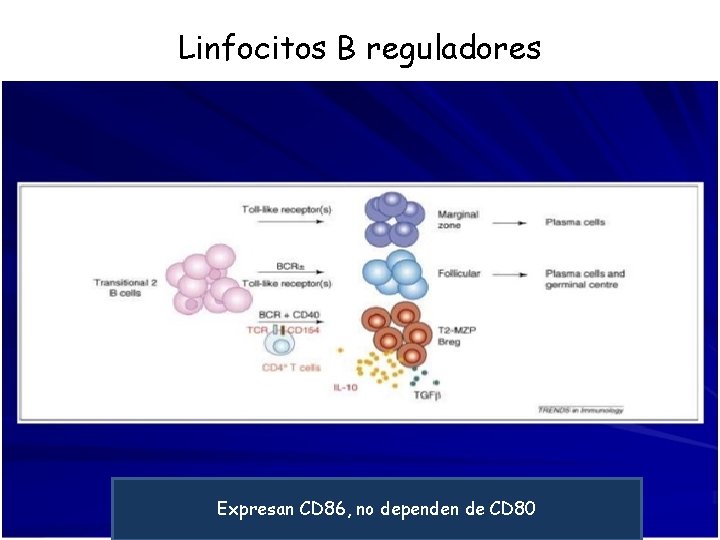
Linfocitos B reguladores Expresan CD 86, no dependen de CD 80






 Poliespecificidad
Poliespecificidad Mapa
Mapa Respuesta
Respuesta Linfocito b
Linfocito b Sistema inmune
Sistema inmune Sistema inmune en reptiles
Sistema inmune en reptiles Inmune pelicula
Inmune pelicula Linfoides
Linfoides Inmunidad activa y pasiva
Inmunidad activa y pasiva Inmunidad celular
Inmunidad celular Organizador grafico del sistema inmune
Organizador grafico del sistema inmune Tiroiditis de hashimoto
Tiroiditis de hashimoto Gluconeogenesis regulacion
Gluconeogenesis regulacion Pancreas
Pancreas Heparinas de bajo peso molecular
Heparinas de bajo peso molecular Regulacion profesion ingeniero industrial
Regulacion profesion ingeniero industrial Uso especifico del espacio y el tiempo pineau
Uso especifico del espacio y el tiempo pineau Regulacion del gasto cardiaco
Regulacion del gasto cardiaco Conclusiones del aparato reproductor masculino
Conclusiones del aparato reproductor masculino Enzimas
Enzimas Agencia de regulación y control hidrocarburífero
Agencia de regulación y control hidrocarburífero Metabolismo
Metabolismo Regulacion calcio
Regulacion calcio Sistema nervioso cordal
Sistema nervioso cordal Tormenta tiroidea tratamiento
Tormenta tiroidea tratamiento Gluconeognesis
Gluconeognesis 2º bachillerato
2º bachillerato Ecuacion de hill
Ecuacion de hill Normas nacionales sobre regulación de la fertilidad
Normas nacionales sobre regulación de la fertilidad Tolerancia en piezas mecanicas
Tolerancia en piezas mecanicas Tolerancia farmacologica
Tolerancia farmacologica Sistema de ajustes y tolerancias
Sistema de ajustes y tolerancias Cotas teoricamente exactas
Cotas teoricamente exactas Tolerancia corregida
Tolerancia corregida La tolerancia permite ganar la paz
La tolerancia permite ganar la paz Desenho tecnico mecanico
Desenho tecnico mecanico Tolerancia a fallos sistemas distribuidos
Tolerancia a fallos sistemas distribuidos Simbolo cilindricidad
Simbolo cilindricidad Tolerancias
Tolerancias Valores en el amor
Valores en el amor Construye un acróstico con la palabra conflicto
Construye un acróstico con la palabra conflicto Lugares de tolerancia
Lugares de tolerancia Insulina ultrarapida
Insulina ultrarapida Discrepancia en topografia
Discrepancia en topografia Tolerancia de inclinacion
Tolerancia de inclinacion Que es tolerancia
Que es tolerancia Objetivos de la tolerancia
Objetivos de la tolerancia 60h5
60h5 Lactacida
Lactacida Limites de tolerância ecologia
Limites de tolerância ecologia Respuesta
Respuesta Estructura de una inmunoglobulina
Estructura de una inmunoglobulina Como redactar una buena respuesta
Como redactar una buena respuesta Tablas de multiplicar con respuesta
Tablas de multiplicar con respuesta Sabes que es un pronombre
Sabes que es un pronombre Costo de respuesta
Costo de respuesta Respuesta
Respuesta Dot respuesta
Dot respuesta Respuesta
Respuesta Matrilocalidad
Matrilocalidad