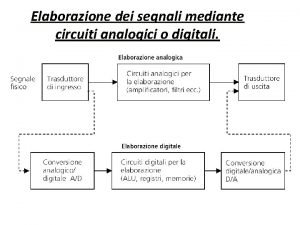
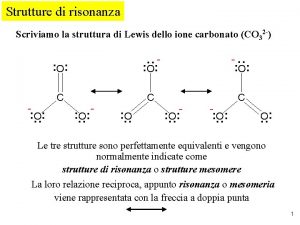
REGOLE DELLA RISONANZA Tutte le strutture canoniche di








- Slides: 24

REGOLE DELLA RISONANZA Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di C con cinque valenze La posizione dei nuclei DEVE essere la stessa in TUTTE LE STRUTTURE ciò significa che quello che cambia quando si scrivono le varie strutture di risonanza è la distribuzione degli elettroni mobili (p e doppietti elettronici) Tutti gli atomi che prendono parte alla risonanza devono essere COPLANARI (o quasi) questo perché solo orbitali coplanari si sovrappongono lateralmente, permettendo la delocalizzazione degli elettroni Tutti le strutture canoniche di risonanza devono avere lo stesso numero di elettroni spaiati.

L'energia della molecola vera è INFERIORE a quella di una qualsiasi delle sue strutture di risonanza. Le strutture canoniche non contribuiscono allo stesso modo alla descrizione della molecola vera. Ciascuna forma contribuisce in modo proporzionale alla sua stabilità: quella che sarebbe più stabile contribuisce di più. FORME CANONICHE UGUALI CONTRIBUISCONO ALLO STESSO MODO Quante più strutture di risonanza uguali si possono scrivere, tanto maggiore è la stabilizzazione di risonanza POSSONO ESSERE DELOCALIZZATI SOLO ELETTRONI IMPEGNATI IN LEGAMI p COPPIE DI ELETTRONI NON CONDIVISI (n)

Le strutture di risonanza possono contribuire in modo diverso alla descrizione della molecola vera. Strutture più "stabili" contribuiscono di più. a) Strutture con più legami covalenti sono in genere più stabili di quelle con meno legami covalenti b) La stabilità di una struttura diminuisce aumentando la separazione di carica (allontanamento di cariche diverse). Strutture con più cariche formali sono meno stabili di strutture non cariche. Strutture con più di due cariche in genere contribuiscono poco all'ibrido. Un tipo di struttura particolarmente sfavorevole è quella che porta due cariche uguali su due atomi adiacenti. c) Strutture in cui tutti gli atomi della prima riga del sistema periodico (C, N, O) hanno l'ottetto completo sono più importanti delle strutture con ottetti non completi. d) A parità di ottetti elettronici, strutture con carica negativa sull'atomo più elettronegativo sono più stabili di altre, in cui la carica negativa sia su un atomo meno elettronegativo. e) Strutture con angoli distorti o lunghezze di legame distorte sono instabili.

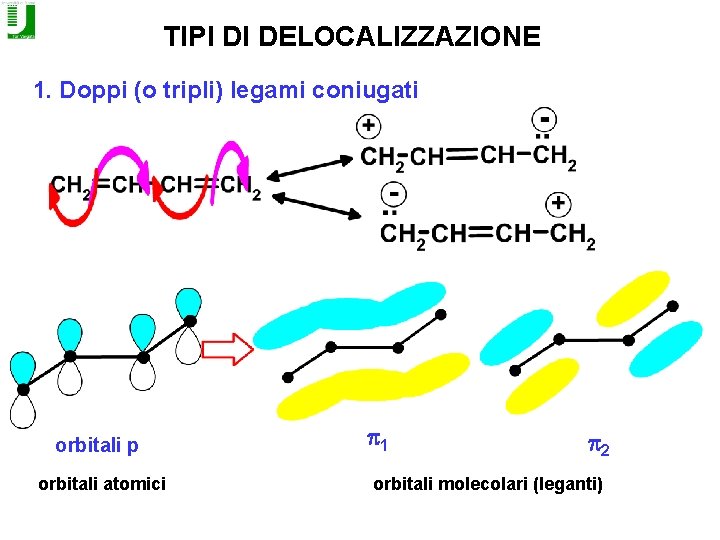
TIPI DI DELOCALIZZAZIONE 1. Doppi (o tripli) legami coniugati orbitali p orbitali atomici p 1 p 2 orbitali molecolari (leganti)

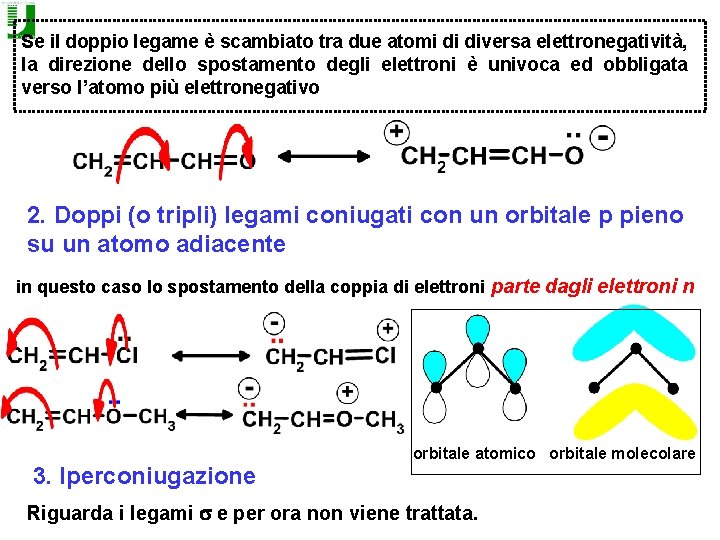
Se il doppio legame è scambiato tra due atomi di diversa elettronegatività, la direzione dello spostamento degli elettroni è univoca ed obbligata verso l’atomo più elettronegativo 2. Doppi (o tripli) legami coniugati con un orbitale p pieno su un atomo adiacente in questo caso lo spostamento della coppia di elettroni parte dagli elettroni n 3. Iperconiugazione orbitale atomico orbitale molecolare Riguarda i legami s e per ora non viene trattata.

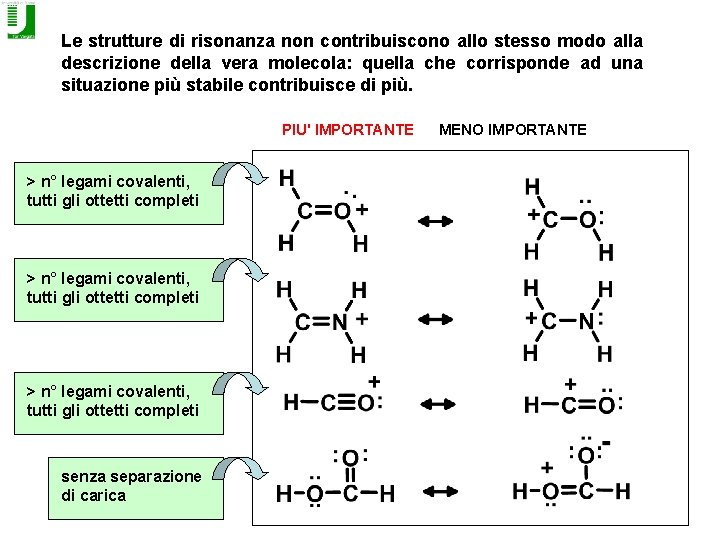
Le strutture di risonanza non contribuiscono allo stesso modo alla descrizione della vera molecola: quella che corrisponde ad una situazione più stabile contribuisce di più. PIU' IMPORTANTE > n° legami covalenti, tutti gli ottetti completi senza separazione di carica MENO IMPORTANTE

PIU' IMPORTANTE MENO IMPORTANTE senza separazione di carica negativa sull’atomo più elettronegativo Si passa da una struttura di risonanza all'altra spostando COPPIE di elettroni. Questi spostamenti si possono fare solo su un atomo o un legame adiacente e sono UN ARTIFICIO necessario per la rappresentazione.

NELLA REALTA' GLI ELETTRONI NON SI SPOSTANO, MA SONO DELOCALIZZATI. Lo spostamento degli elettroni dipende soprattutto dal loro tipo (p o n) e non dall'atomo coinvolto.

1. ELETTRONI p Gli elettroni p (orbitale molecolare) si spostano mettendoli entrambi su un orbitale atomico Se fra A e B non c'è differenza di elettronegatività: entrambi gli spostamenti sono ugualmente possibili Se fra A e B c'è differenza di elettronegatività: lo spostamento avviene solo nella direzione che portala coppia di elettroni sull'atomo più elettronegativo.

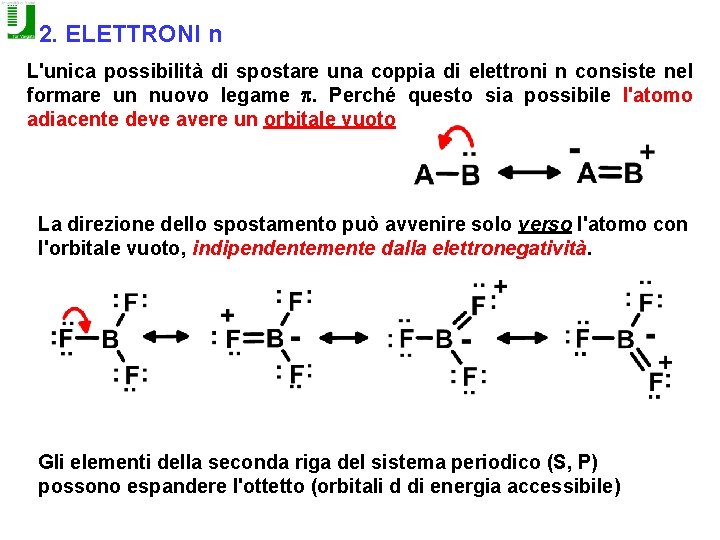
2. ELETTRONI n L'unica possibilità di spostare una coppia di elettroni n consiste nel formare un nuovo legame p. Perché questo sia possibile l'atomo adiacente deve avere un orbitale vuoto La direzione dello spostamento può avvenire solo verso l'atomo con l'orbitale vuoto, indipendentemente dalla elettronegatività. Gli elementi della seconda riga del sistema periodico (S, P) possono espandere l'ottetto (orbitali d di energia accessibile)

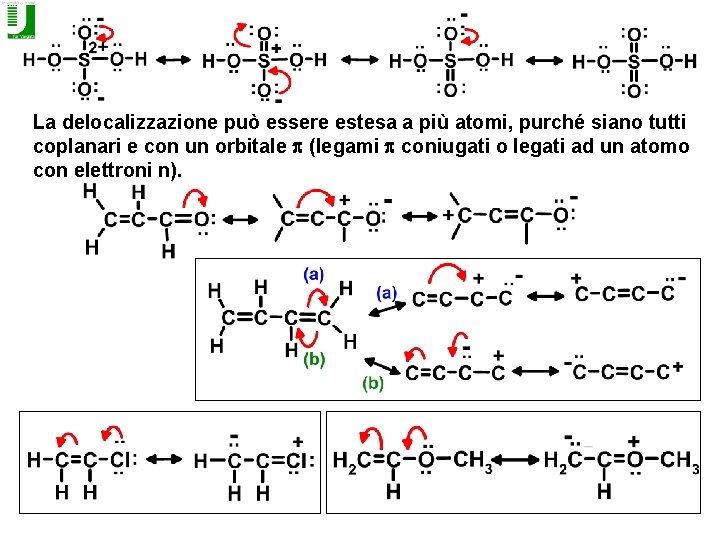
La delocalizzazione può essere estesa a più atomi, purché siano tutti coplanari e con un orbitale p (legami p coniugati o legati ad un atomo con elettroni n).

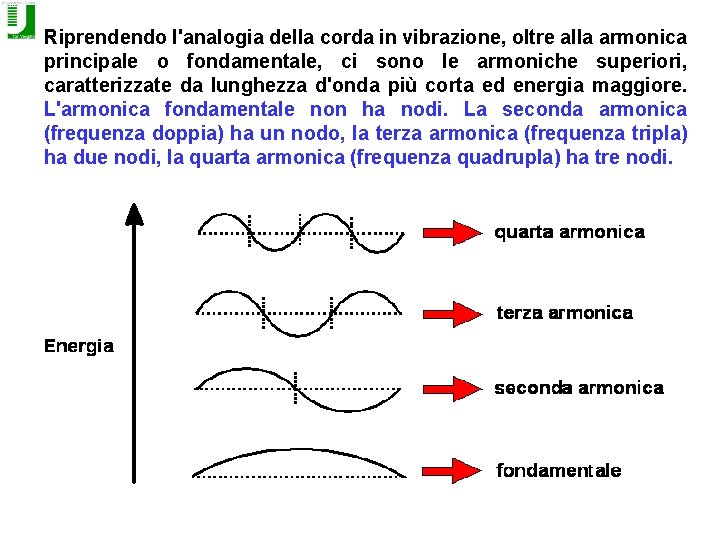
Riprendendo l'analogia della corda in vibrazione, oltre alla armonica principale o fondamentale, ci sono le armoniche superiori, caratterizzate da lunghezza d'onda più corta ed energia maggiore. L'armonica fondamentale non ha nodi. La seconda armonica (frequenza doppia) ha un nodo, la terza armonica (frequenza tripla) ha due nodi, la quarta armonica (frequenza quadrupla) ha tre nodi.

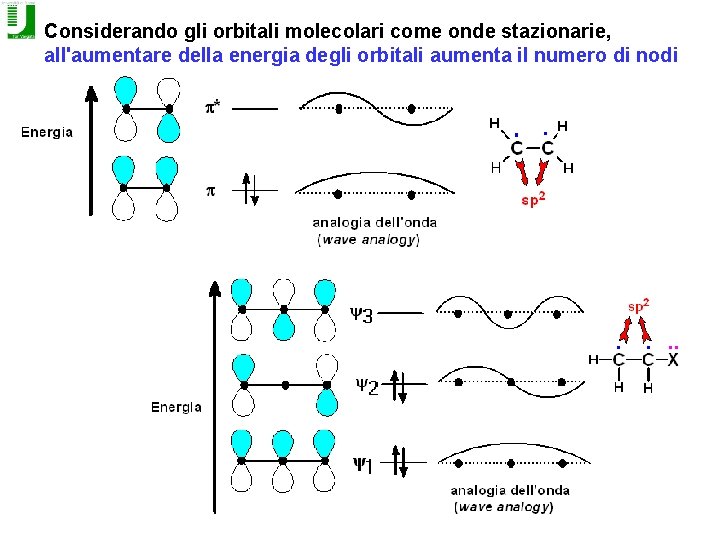
Considerando gli orbitali molecolari come onde stazionarie, all'aumentare della energia degli orbitali aumenta il numero di nodi

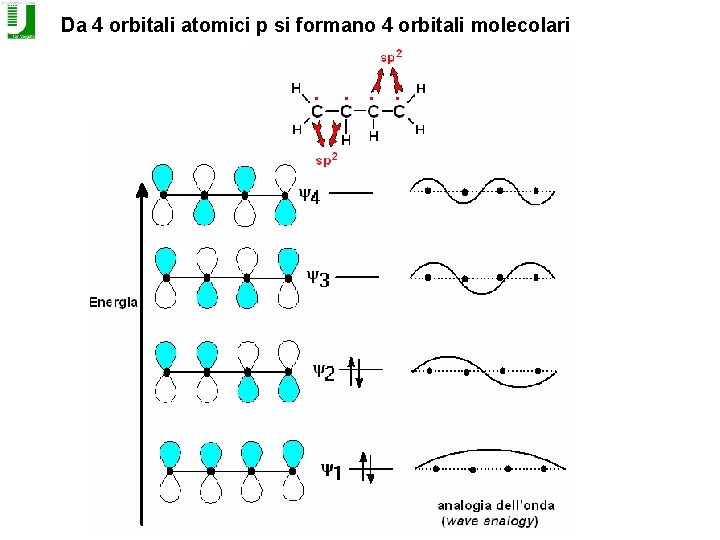
Da 4 orbitali atomici p si formano 4 orbitali molecolari

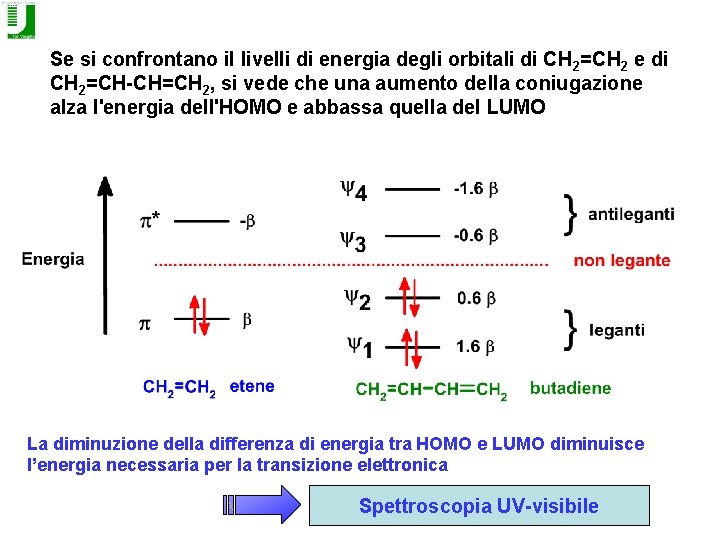
Se si confrontano il livelli di energia degli orbitali di CH 2=CH 2 e di CH 2=CH-CH=CH 2, si vede che una aumento della coniugazione alza l'energia dell'HOMO e abbassa quella del LUMO La diminuzione della differenza di energia tra HOMO e LUMO diminuisce l’energia necessaria per la transizione elettronica Spettroscopia UV-visibile

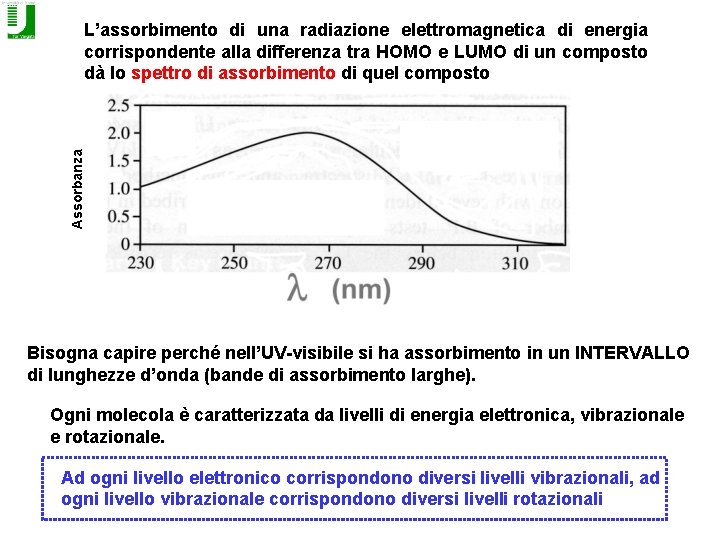
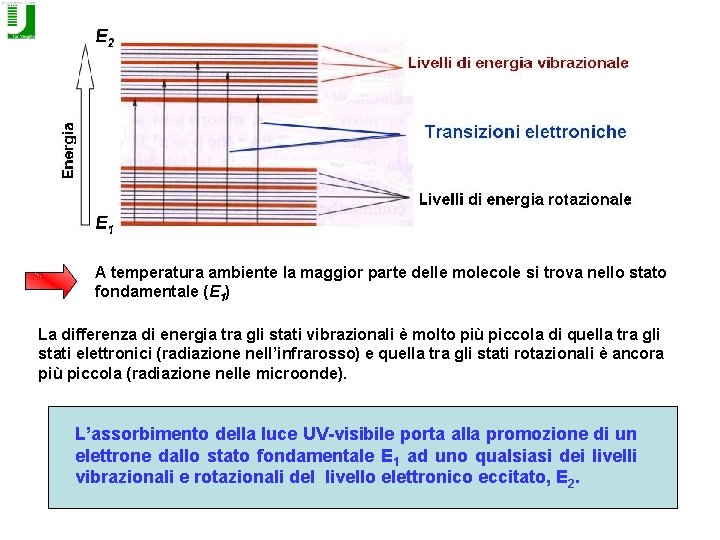
Assorbanza L’assorbimento di una radiazione elettromagnetica di energia corrispondente alla differenza tra HOMO e LUMO di un composto dà lo spettro di assorbimento di quel composto Bisogna capire perché nell’UV-visibile si ha assorbimento in un INTERVALLO di lunghezze d’onda (bande di assorbimento larghe). Ogni molecola è caratterizzata da livelli di energia elettronica, vibrazionale e rotazionale. Ad ogni livello elettronico corrispondono diversi livelli vibrazionali, ad ogni livello vibrazionale corrispondono diversi livelli rotazionali

A temperatura ambiente la maggior parte delle molecole si trova nello stato fondamentale (E 1) La differenza di energia tra gli stati vibrazionali è molto più piccola di quella tra gli stati elettronici (radiazione nell’infrarosso) e quella tra gli stati rotazionali è ancora più piccola (radiazione nelle microonde). L’assorbimento della luce UV-visibile porta alla promozione di un elettrone dallo stato fondamentale E 1 ad uno qualsiasi dei livelli vibrazionali e rotazionali del livello elettronico eccitato, E 2.

Le transizioni elettroniche si dividono in “permesse dalla simmetria” e “proibite dalla simmetria” Le transizioni proibite dalla simmetria possono ugualmente avvenire, ma sono deboli (minore probabilità) Legge di Lambert-Beer A=ec Transizioni permesse dalla simmetria Transizioni proibite dalla simmetria e 10 000 (log e 4) e < 10 000: tra 10 e 1000 (log e tra 1 e 3)) La parte della molecola che contiene gli elettroni coinvolti nella transizione elettronica si chiama CROMOFORO. La lunghezza d’onda del massimo della banda di assorbimento si indica con lmax ed il coefficiente di estinzione molare corrispondente si indica con emax.

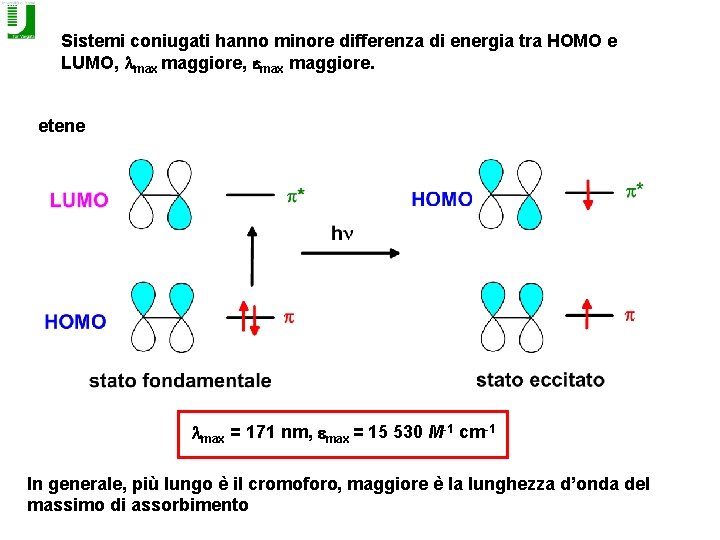
Sistemi coniugati hanno minore differenza di energia tra HOMO e LUMO, lmax maggiore, emax maggiore. etene lmax = 171 nm, emax = 15 530 M-1 cm-1 In generale, più lungo è il cromoforo, maggiore è la lunghezza d’onda del massimo di assorbimento

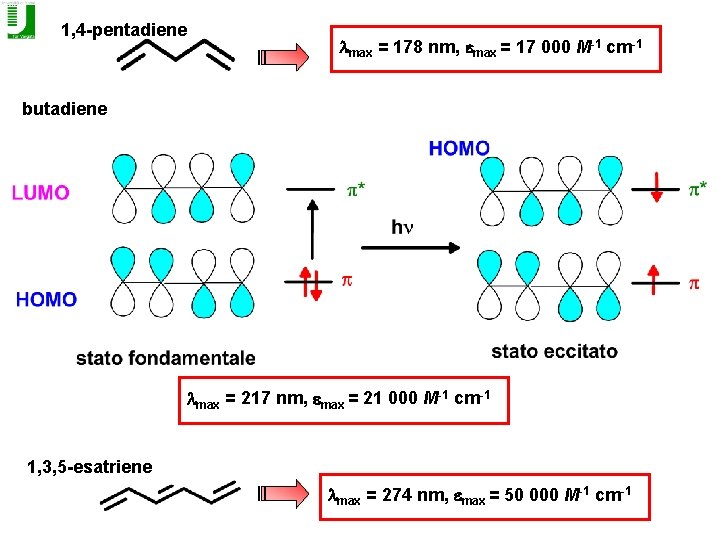
1, 4 -pentadiene lmax = 178 nm, emax = 17 000 M-1 cm-1 butadiene lmax = 217 nm, emax = 21 000 M-1 cm-1 1, 3, 5 -esatriene lmax = 274 nm, emax = 50 000 M-1 cm-1

b-carotene lmax = 426 nm, 451 nm, 483 nm 11 doppi legami coniugati

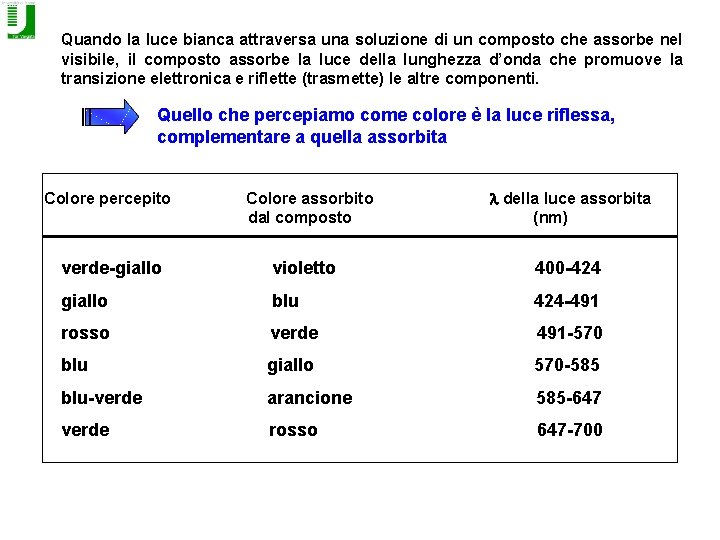
Quando la luce bianca attraversa una soluzione di un composto che assorbe nel visibile, il composto assorbe la luce della lunghezza d’onda che promuove la transizione elettronica e riflette (trasmette) le altre componenti. Quello che percepiamo come colore è la luce riflessa, complementare a quella assorbita Colore percepito Colore assorbito dal composto l della luce assorbita (nm) verde-giallo violetto 400 -424 giallo blu 424 -491 rosso verde 491 -570 blu giallo 570 -585 blu-verde arancione 585 -647 verde rosso 647 -700

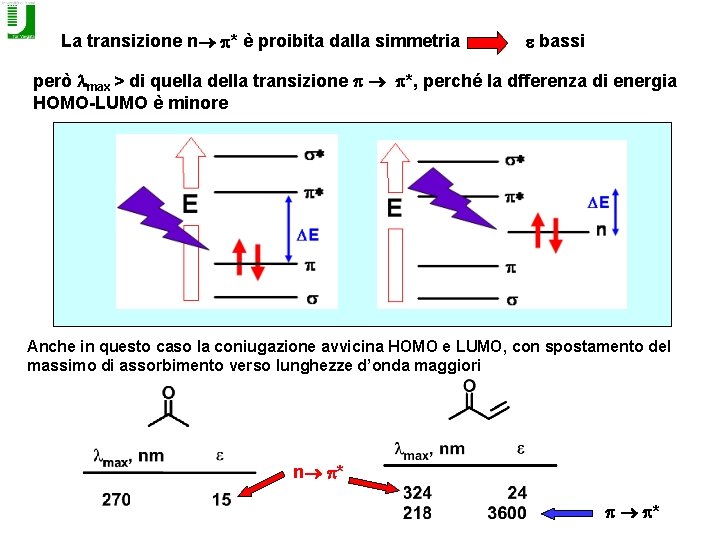
La transizione n p* è proibita dalla simmetria e bassi però lmax > di quella della transizione p p*, perché la dfferenza di energia HOMO-LUMO è minore Anche in questo caso la coniugazione avvicina HOMO e LUMO, con spostamento del massimo di assorbimento verso lunghezze d’onda maggiori n p* p p*

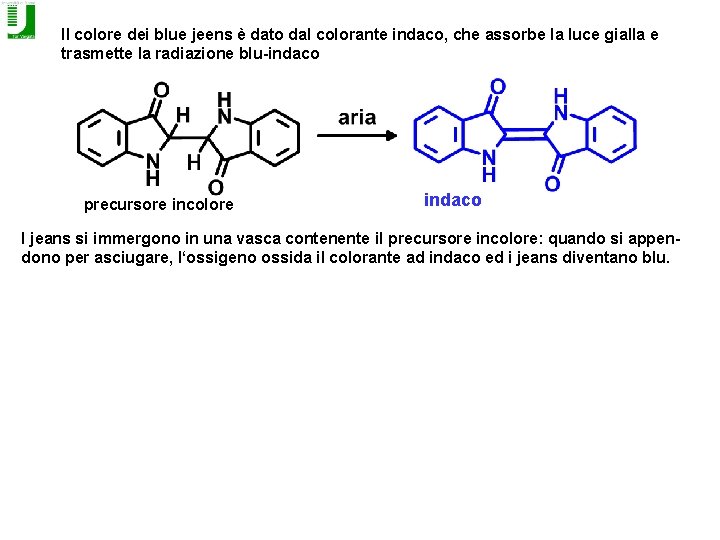
Il colore dei blue jeens è dato dal colorante indaco, che assorbe la luce gialla e trasmette la radiazione blu-indaco precursore incolore indaco I jeans si immergono in una vasca contenente il precursore incolore: quando si appendono per asciugare, l‘ossigeno ossida il colorante ad indaco ed i jeans diventano blu.
 Fonti storiche cristiane su gesù
Fonti storiche cristiane su gesù Figure retoriche i poeti lavorano di notte
Figure retoriche i poeti lavorano di notte Risonanza simpatica
Risonanza simpatica Legame peptidico risonanza
Legame peptidico risonanza Fonti cristiane canoniche
Fonti cristiane canoniche Regole della pallamano
Regole della pallamano Regole della comunicazione
Regole della comunicazione Cosa hanno in comune tutte le religioni
Cosa hanno in comune tutte le religioni Ascolta il tuo cuore esso conosce tutte le cose
Ascolta il tuo cuore esso conosce tutte le cose Nuvolette tutte d'oro
Nuvolette tutte d'oro Schema sintetico stato patrimoniale
Schema sintetico stato patrimoniale Lodiamo il signore
Lodiamo il signore Nonsense esempio scuola primaria
Nonsense esempio scuola primaria Figure fonetiche
Figure fonetiche Tutte embedding
Tutte embedding Voi tutte opere del signore
Voi tutte opere del signore Tutte le porte logiche
Tutte le porte logiche Strutture elementari tecnologia
Strutture elementari tecnologia Esempio di struttura funzionale
Esempio di struttura funzionale Reazioni vincolari manicotto
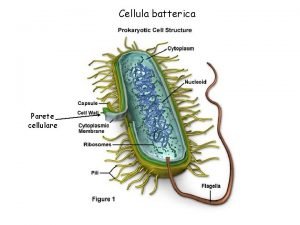
Reazioni vincolari manicotto Cellula
Cellula Serie armonica generalizzata
Serie armonica generalizzata Strutture logiche preformate
Strutture logiche preformate Nova angeletta sovra l'ale accorta figure retoriche
Nova angeletta sovra l'ale accorta figure retoriche Esempio calcolo vento tettoia ntc 2018
Esempio calcolo vento tettoia ntc 2018