Regolazione del bilancio salino Il bilancio salino dipende

Regolazione del bilancio salino Il bilancio salino dipende soprattutto dal bilancio dell’Na. Cl. Il bilancio dell’Na. Cl è mantenuto grazie all’azione integrata di due ordini di meccanismi: 1) i meccanismi di controllo dell’osmolarità plasmatica; 2) i meccanismi di controllo del volume circolante effettivo.

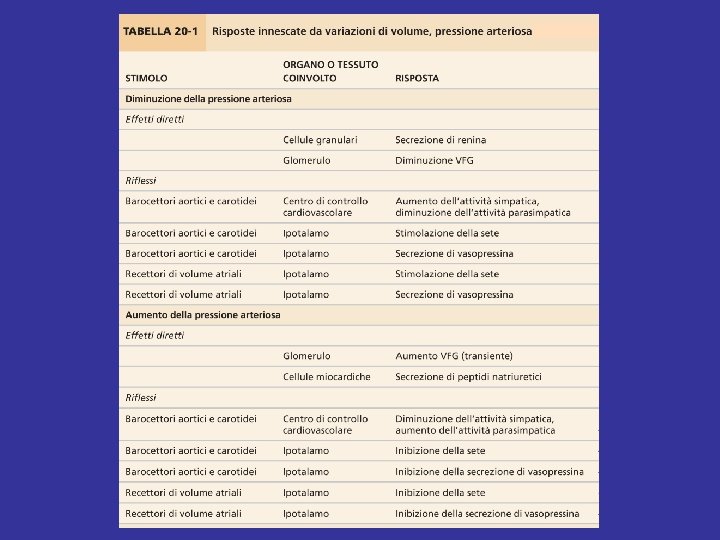
Il concetto di volume circolante effettivo (1) Il volume circolante effettivo (VCE) è definito come quella quota del volume vascolare che risulta efficace ai fini della “produzione” di pressione arteriosa e della perfusione dei tessuti. Il VCE è influenzato da: Volume del liquido extracellulare (LEC) ↓ Volume del letto vascolare ↓ Riempimento telediastolico delle camere cardiache ↓ Performance ventricolare ↓ Gittata cardiaca; pressione arteriosa

Il concetto di volume circolante effettivo (2) Quale variabile risulta determinante ai fini del controllo del VCE da parte dell’organismo? In ultima analisi la “pressione del sistema vascolare”, sia sul versante venoso che su quello arterioso. Infatti: • una riduzione della pressione venosa riduce il riempimento telediastolico dei ventricoli e quindi la performance miocardica; • una riduzione della pressione arteriosa riduce la perfusione dei tessuti periferici.

Il concetto di volume circolante effettivo (3) ↑ volume del liquido extracellulare (LEC) ↓ ↑ volume del letto vascolare ↓ ↑ riempimento telediastolico delle camere cardiache ↓ ↑ performance ventricolare Scompenso cardiaco ↓ ↑ gittata cardiaca; ↑ pressione arteriosa VCE ridotto → ulteriore aumento del LEC!

Il concetto di volume circolante effettivo (4) ↑ volume del liquido extracellulare (LEC) ↑ volume del letto vascolare Riempimento telediastolico delle camere cardiache Performance ventricolare Cirrosi epatica ↑ gittata cardiaca; pressione arteriosa non aumentata VCE non aumentato → il volume del LEC non viene corretto!
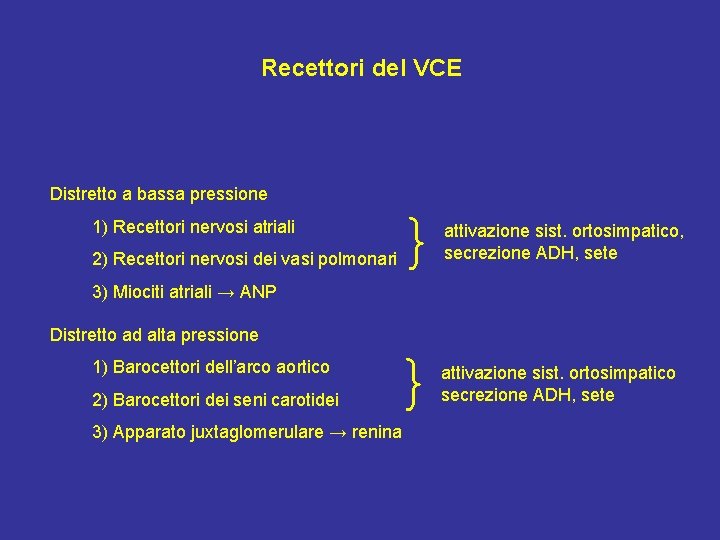
Recettori del VCE Distretto a bassa pressione 1) Recettori nervosi atriali } attivazione sist. ortosimpatico, secrezione ADH, sete } attivazione sist. ortosimpatico secrezione ADH, sete 2) Recettori nervosi dei vasi polmonari 3) Miociti atriali → ANP Distretto ad alta pressione 1) Barocettori dell’arco aortico 2) Barocettori dei seni carotidei 3) Apparato juxtaglomerulare → renina

Aumentata stimolazione dei recettori nervosi (↑ VCE): • Riduzione della sensibilità alle variazioni di osmolarità nella secrezione di ADH • Riduzione della sete • Riduzione dell’attività simpatica Ridotta stimolazione dei recettori nervosi (↓ VCE): • Stimolazione della secrezione di ADH (per riduzioni del VCE di almeno il 5 -10%) • Aumento della sensibilità alle variazioni di osmolarità nella secrezione di ADH • Aumento della sete • Aumento dell’attività simpatica

Azioni delle terminazioni ortosimpatiche renali Un aumento dell’attività delle fibre ortosimpatiche renali ha i seguenti effetti: 1) vasocostrizione dell’arteriola afferente (recettori α) → ↓ VFG → ↓ carico filtrato di Na. Cl; 2) aumento della secrezione di renina dalle cellule granulari (recettori β) → ↑ AT II; 3) aumento riassorbimento tubulare di Na. Cl (soprattutto TCP; recettori α). Una riduzione dell’attività delle fibre ortosimpatiche renali ha effetti opposti.
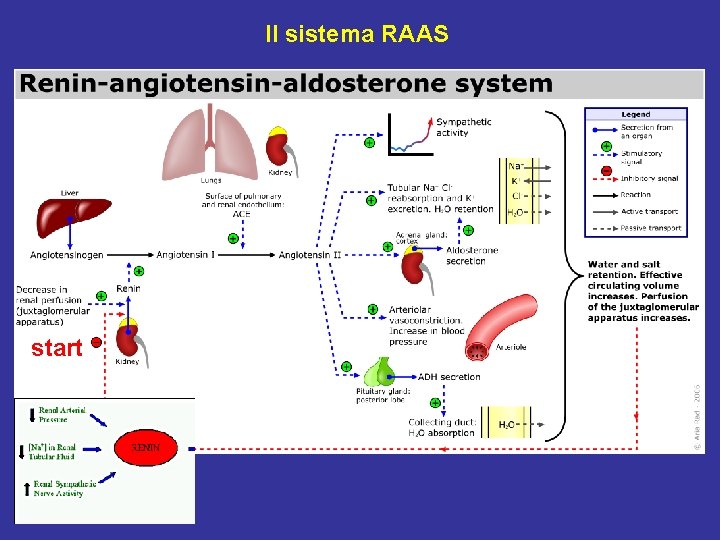
Il sistema RAAS start

Effetti dell’attivazione del sistema RAAS • Effetti locali (attivazione del feed-back tubulo-glomerulare): tendono a ristabilire una normale pressione di filtrazione e quindi una normale VFG. Consistono in: produzione di AT II ad opera dell’ACE dell’endotelio dei capillari locali → vasocostrizione dell’arteriola efferente → ↑ della pressione di filtrazione → ↑ VFG. • Effetti sistemici: tendono a ristabilire una normale pressione arteriosa sistemica. Sono secondari alla produzione di AT II soprattutto ad opera dell’ACE dell’endotelio dei capillari polmonari. 1) AT II → vasocostrizione arteriolare sistemica 2) AT II ad alte concentrazioni → vasocostrizione dell’arteriola afferente → ↓ VFG 3) AT II → ↑ riassorbimento di Na. Cl dal TCP → ↑ riassorbimento H 2 O 4) AT II → ↑ produzione di aldosterone → ↑ riassorbimento Na. Cl dal TCD e DC 5) AT II → ↑ secrezione ADH → ↑ riassorbimento H 2 O dal TCD e DC 6) AT II → stimolazione centro ipotalamico della sete → ↑ assunzione di H 2 O
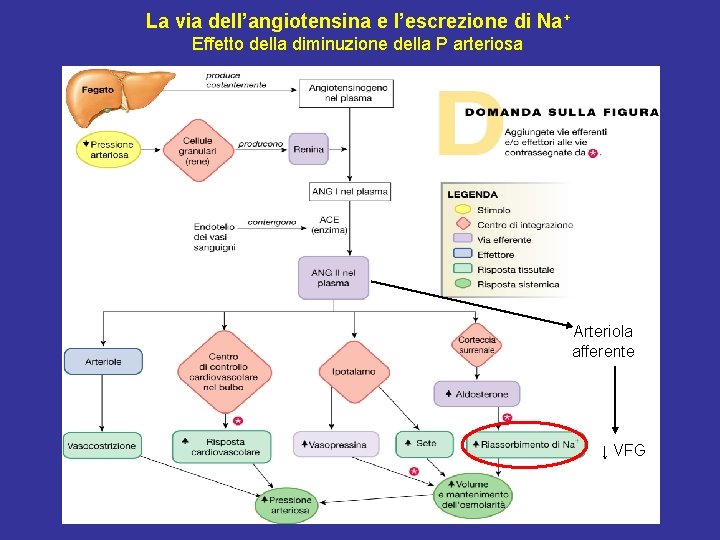
La via dell’angiotensina e l’escrezione di Na+ Effetto della diminuzione della P arteriosa Arteriola afferente ↓ VFG
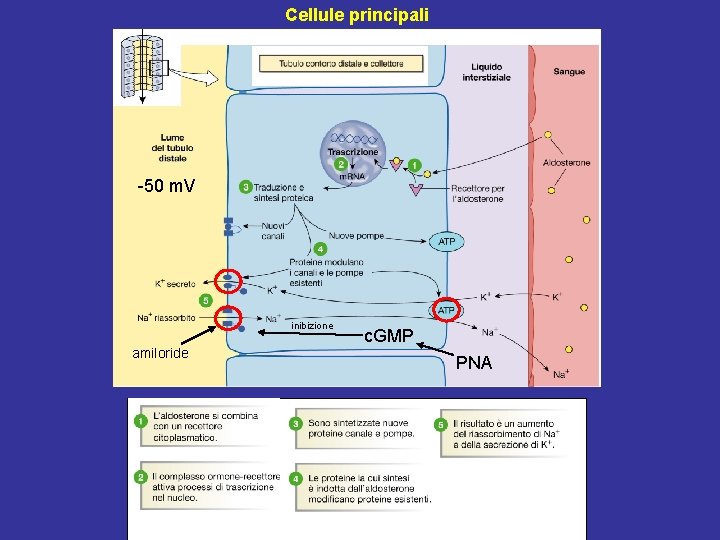
Cellule principali -50 m. V inibizione amiloride c. GMP PNA

Effetti dell’ANP • Rene: 1) Vasodilatazione dell’arteriola afferente e vasocostrizione dell’arteriola efferente → aumento VFG con FPR circa stabile, aumento FF 2) Inibizione della secrezione di renina dalle cellule granulari dall’apparato juxtaglomerulare 3) Inibizione del riassorbimento del Na+ nel dotto collettore (inibizione canali ENa. C; meccanismo c. GMP-dipendente) • Ipotalamo: Inibizione della secrezione di ADH • Corticale del surrene: Inibizione diretta della secrezione di aldosterone

Riassorbimento renale del Na+ Carico filtrato di Na+: 180 l/die × 140 mmol/l = 25200 mmol/die Riassorbimento renale: 1) 67% dal TCP; 2) 25% dal TAS dell’ansa di Henle; 3) 4% dal TCD; 4) > 3% dal dotto collettore. Quota escreta: < 1% del carico filtrato (normalmente 140 m. Eq/die in media)

Controllo dell’escrezione di Na. Cl in condizioni di euvolemia (piccole variazioni del VCE) 1) Il riassorbimento del Na+ dal TCP, dal TAS dell’ansa di Henle e dal TCD viene regolato in modo da mantenere costante il carico di Na+ che perviene al DC; 2) il riassorbimento del Na+ dal DC viene aggiustato in modo che l’escrezione di Na+ ne bilanci l’assunzione.

1) Controllo del carico di Na+ che perviene 2) al dotto collettore a) Autoregolazione della VFG a) a 1) Meccanismo miogeno b) a 2) Feed-back tubulo-glomerulare b) Compensazione delle piccole variazioni della VFG: c) equilibrio glomerulo-tubulare d) b 1) Dipendenza del riassorbimento di Na+ nel TCP dal carico filtrato di glucosio e AA e) b 2) Dipendenza dalla FF del riassorbimento di soluti e acqua dall’interstizio (meccanismo osmotico)

2) Regolazione del riassorbimento di Na+ dal dotto collettore a) Aldosterone → ↑ riassorbimento b) ANP → ↓ riassorbimento

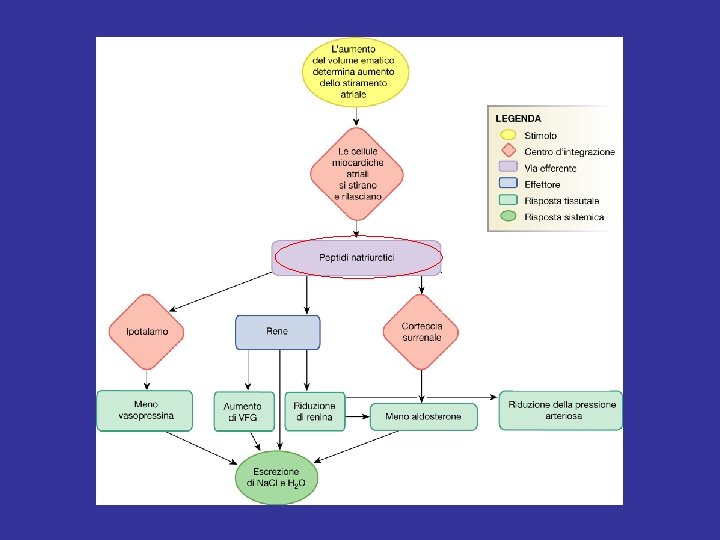
Controllo dell’escrezione di Na. Cl e H 2 O in condizioni di espansione del VCE (1) Segnali convergenti al rene: 1) attivaz. recettori di volume e pressione → riduzione dell’attivazione delle fibre ortosimpatiche; 2) attivaz. recettori di volume e pressione → riduzione della secrezione di ADH; 3) aumento del rilascio di ANP dai miociti atriali; 4) riduzione della secrezione di renina e della produzione di AT II; 5) ↓ AT II e ↑ ANP → riduzione della secrezione di aldosterone.

Controllo dell’escrezione di Na. Cl e H 2 O in condizioni di espansione del VCE (2 a) Meccanismi attivati: 1) Aumento della VFG. Dovuto a: a) ↓ attività ortosimpatica → vasodilatazione arteriola afferente b) ↑ ANP → vasodilatazione arteriola afferente e vasocostrizione arteriola efferente 2) Riduzione del riassorbimento di Na+ nel TCP. Dovuta a: a) ↓ attività ortosimpatica b) ↓ AT II c) ↑ pressione idrostatica nei capillari peritubulari

Controllo dell’escrezione di Na. Cl e H 2 O in condizioni di espansione del VCE (2 b) Meccanismi attivati: 3) Riduzione del riassorbimento di Na+ nel DC. Dovuta a: a) ↓ aldosterone b) ↑ ANP 4) Riduzione della secrezione di ADH. Dovuta a: a) ↓ attivazione recettori di volume e pressione b) ↓ AT II c) ↑ ANP d) ↑ escrezione Na. Cl → ↓ osmolarità

Relazioni fra pressione arteriosa, VFG e riassorbimento in condizioni di espansione del VCE ↑ pressione arteriosa ma VFG aumentata: autoregolazione non attiva 1) Meccanismo miogenico non attivo } 2) Feed-back tubulo-glomerulare non attivo sovrastati da alti livelli di ANP ↑ VFG ma riassorbimento del Na+ dal TCP diminuito: equilibrio glomerulo-tubulare non attivo 1) ↑ del carico di glucosio e AA non efficace } } 2) Riassorbimento di soluti e acqua dall’interstizio non aumentato inibizione del trasporto (↓ att. ortosimp. , ↓ AT II) FF non aumentata

Controllo dell’escrezione di Na. Cl e H 2 O in condizioni di riduzione del VCE (1) Segnali convergenti al rene: 1) ↓ attivaz. recettori di volume e pressione → aumento dell’attivazione delle fibre ortosimpatiche; 2) ↓ attivaz. recettori di volume e pressione → aumento della secrezione di ADH; 3) riduzione del rilascio di ANP dai miociti atriali; 4) aumento della secrezione di renina e della produzione di AT II; 5) ↑ AT II e ↓ ANP → aumento della secrezione di aldosterone.

Controllo dell’escrezione di Na. Cl e H 2 O in condizioni di riduzione del VCE (2 a) Meccanismi attivati: 1) Riduzione della VFG. Dovuta a: a) ↑ attività ortosimpatica → vasocostrizione arteriola afferente b) ↓ ANP → vasocostrizione arteriola afferente e vasodilatazione arteriola efferente 2) Aumento del riassorbimento di Na+ nel TCP. Dovuto a: a) ↑ attività ortosimpatica b) ↑ AT II c) ↓ pressione idrostatica nei capillari peritubulari

Controllo dell’escrezione di Na. Cl e H 2 O in condizioni di riduzione del VCE (2 b) Meccanismi attivati: 3) Aumento del riassorbimento di Na+ nel DC. Dovuto a: a) ↑ aldosterone b) ↓ ANP 4) Aumento della secrezione di ADH. Dovuto a: a) ↑ attivazione recettori di volume e pressione b) ↑ AT II c) ↓ ANP d) ↓ escrezione Na. Cl → ↑ osmolarità

Relazioni fra pressione arteriosa, VFG e riassorbimento in condizioni di riduzione del VCE ↓ pressione arteriosa ma VFG diminuita: autoregolazione non attiva 1) Meccanismo miogenico non attivo } 2) Feed-back tubulo-glomerulare non attivo sovrastati da alti livelli di AT II e attività ortosimp. ↓ VFG ma riassorbimento del Na+ dal TCP aumentato: equilibrio glomerulo-tubulare non attivo 1) ↓ del carico di glucosio e AA non efficace } } 2) Riassorbimento di soluti e acqua dall’interstizio non diminuito potenziamento del trasporto (↑ att. ortosimp. , ↑ AT II) FF non diminuita
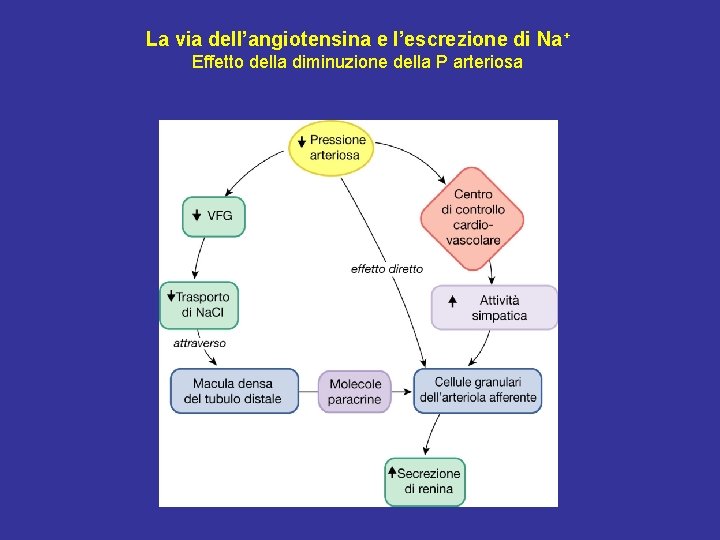
La via dell’angiotensina e l’escrezione di Na+ Effetto della diminuzione della P arteriosa
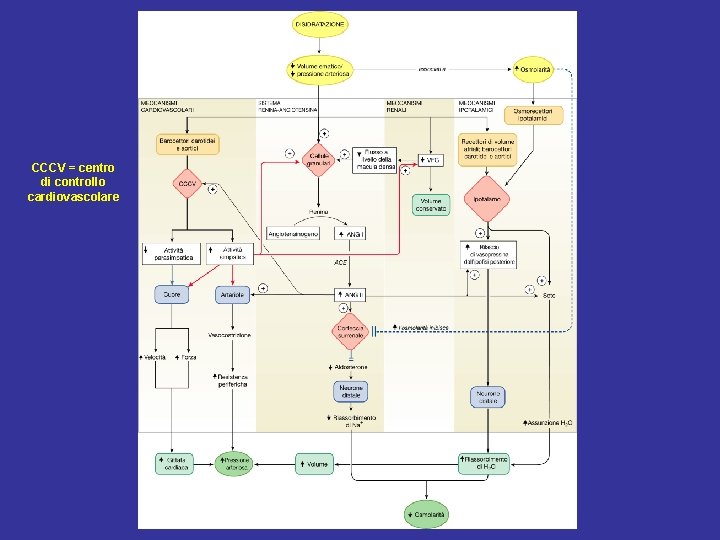
CCCV = centro di controllo cardiovascolare
![Bilancio del potassio [K+] extracellulare: 4. 2 m. Eq/l [K+] intracellulare: 140 m. Eq/l Bilancio del potassio [K+] extracellulare: 4. 2 m. Eq/l [K+] intracellulare: 140 m. Eq/l](http://slidetodoc.com/presentation_image_h/cf4002b1c1cf3d2f2bec8997f42eb87c/image-30.jpg)
Bilancio del potassio [K+] extracellulare: 4. 2 m. Eq/l [K+] intracellulare: 140 m. Eq/l Aumenti di 3 -4 m. Eq causano aritmie o anche arresto cardiaco, ipereccitabilità neuronale etc. In un uomo di 70 kg: 3920 m. Eq intracellulari 59 m. Eq extracellulari 50 -200 m. Eq vengono introdotti giornalmente (50 m. Eq per pasto) È quindi necessario: 1) mantenere il bilancio del K+; 2) controllare la distribuzione del K+ nei compartimenti corporei.

Omeostasi del K+ L’omeostasi del K+ è mantenuta grazie a due ordini di meccanismi: 1) meccanismi di regolazione della distribuzione del K+ fra LEC e LIC 2) meccanismi di regolazione dell’escrezione del K+

Fattori che modificano la distribuzione intra-extra del K+ Fattori che muovono il K+ all’interno della cellula (↓ [K+]extra) Fattori che muovono il K+ fuori dalla cellula (↑ [K+]extra) • Insulina • Stimolazione β-adrenergica • Aldosterone • Alcalosi • Deficit di insulina • Blocco β-adrenergico • Deficit di aldosterone • Acidosi • Lisi cellulare • Strenuo esercizio fisico • ↑ osmolarità del liquido extracellulare ↑ [H+] inibisce ATPasi Na/K
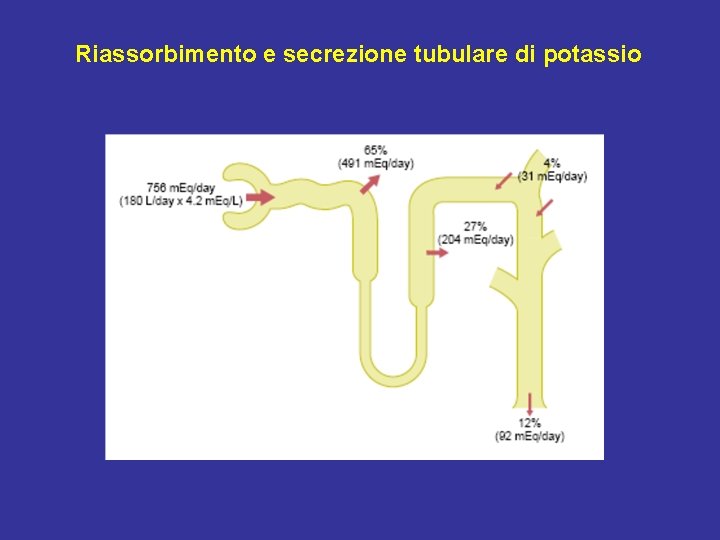
Riassorbimento e secrezione tubulare di potassio
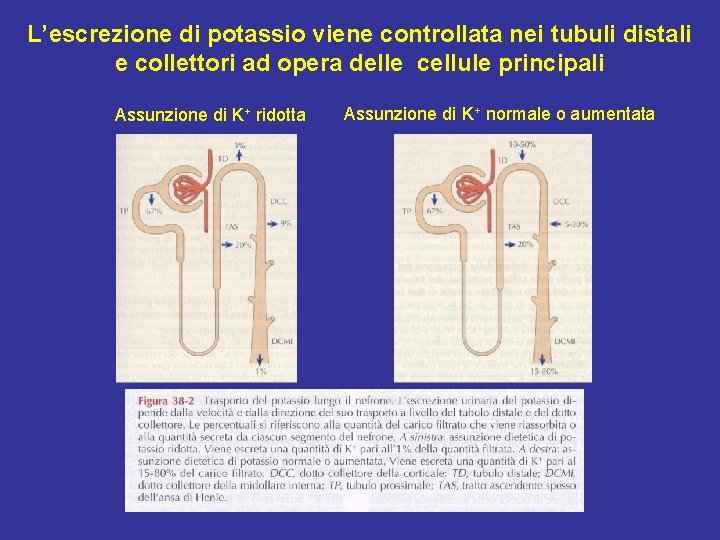
L’escrezione di potassio viene controllata nei tubuli distali e collettori ad opera delle cellule principali Assunzione di K+ ridotta Assunzione di K+ normale o aumentata
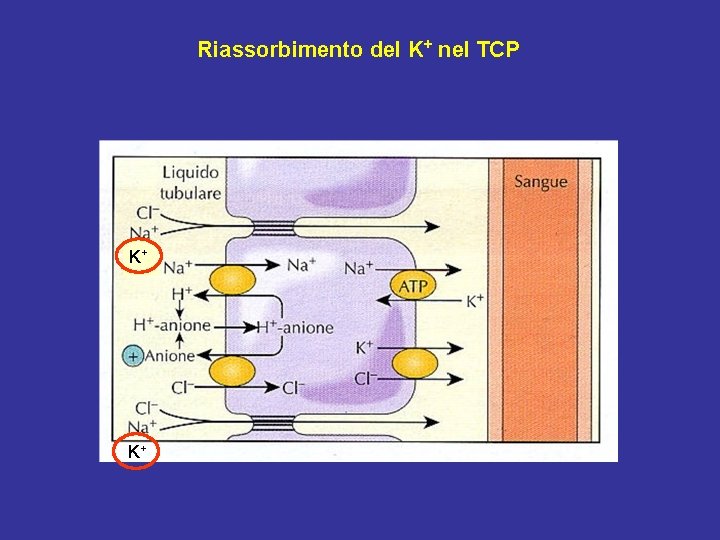
Riassorbimento del K+ nel TCP K+ K+
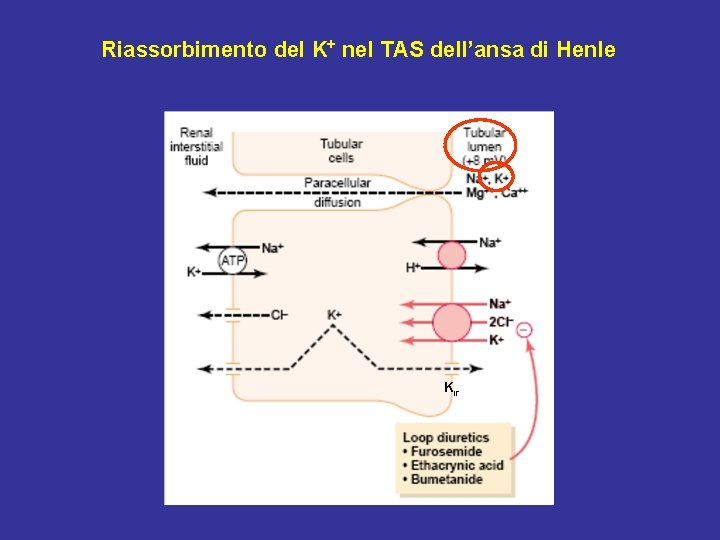
Riassorbimento del K+ nel TAS dell’ansa di Henle Kir
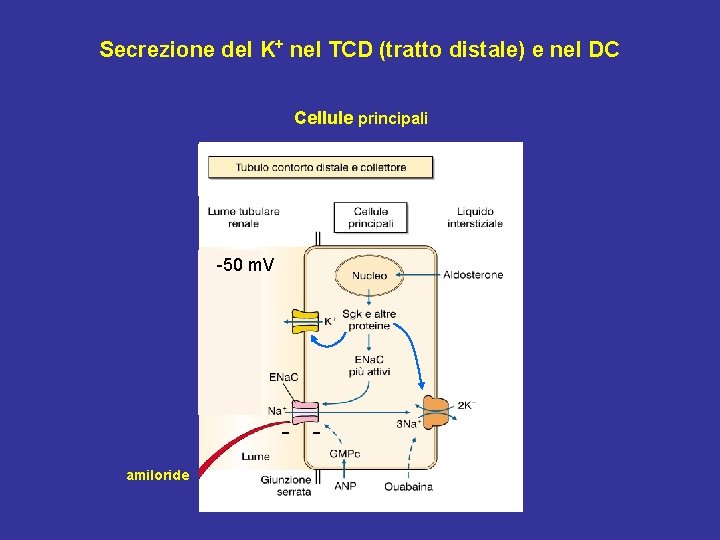
Secrezione del K+ nel TCD (tratto distale) e nel DC Cellule principali -50 m. V - amiloride
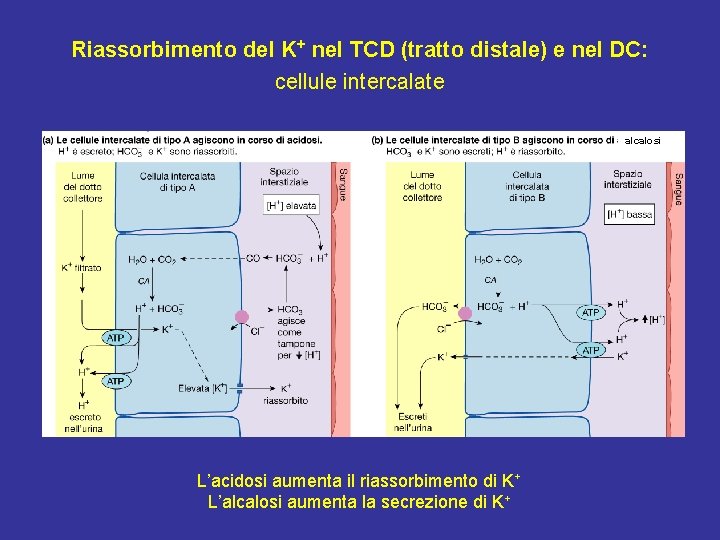
Riassorbimento del K+ nel TCD (tratto distale) e nel DC: cellule intercalate alcalosi L’acidosi aumenta il riassorbimento di K+ L’alcalosi aumenta la secrezione di K+

Fattori determinanti nella secrezione del K+ nelle cellule principali del TCD e del DC 1) Attività della Na+/K+ ATPasi • Densità della Na+/K+ ATPasi sulla membrana basolaterale • Velocità del trasporto: concentrazione del K+ nell’interstizio 2) Gradiente elettrochimico del K+ sulla membrana apicale • Potenziale elettrico transepiteliale: canali ENa. C; concentrazione del Na+ nel liquido tubulare • Concentrazione del K+ nel liquido tubulare 3) Permeabilità al K+ sulla membrana apicale

Regolazione della secrezione del K+ nelle cellule principali del TCD e del DC Fattori omeostatici 1) Concentrazione extracellulare del K+ 2) Aldosterone
![Un ↑ [K+]extra stimola la secrezione di aldosterone Effect of extracellular fluid potassium ion Un ↑ [K+]extra stimola la secrezione di aldosterone Effect of extracellular fluid potassium ion](http://slidetodoc.com/presentation_image_h/cf4002b1c1cf3d2f2bec8997f42eb87c/image-41.jpg)
Un ↑ [K+]extra stimola la secrezione di aldosterone Effect of extracellular fluid potassium ion concentration on plasma aldosterone concentration. Note that small changes in potassium concentration cause large changes in aldosterone concentration. Un ↑ [K+]extra o aldosterone stimola la escrezione urinaria di potassio Effect of plasma aldosterone concentration (red line) and extracellular potassium ion concentration (black line) on the rate of urinary potassium excretion. These factors stimulate potassium secretion by the principal cells of the cortical collecting tubules.
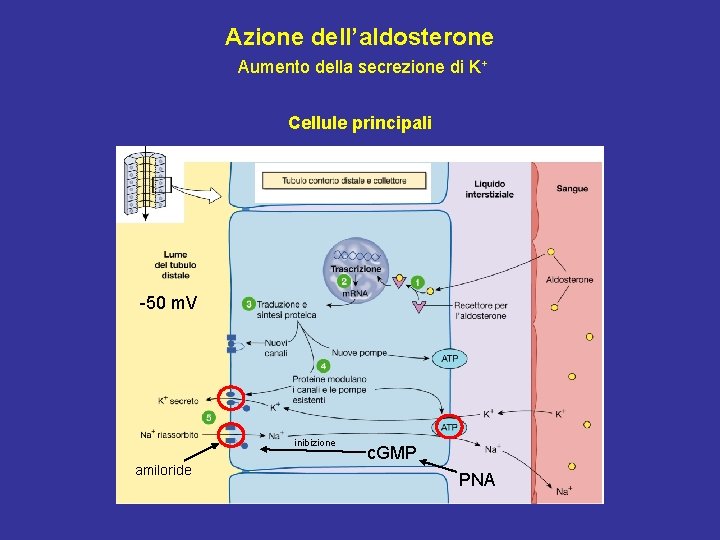
Azione dell’aldosterone Aumento della secrezione di K+ Cellule principali -50 m. V inibizione amiloride c. GMP PNA
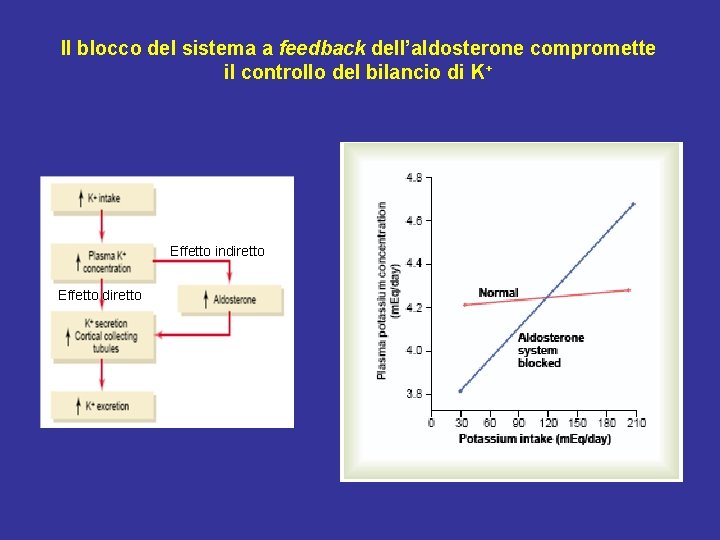
Il blocco del sistema a feedback dell’aldosterone compromette il controllo del bilancio di K+ Effetto indiretto Effetto diretto
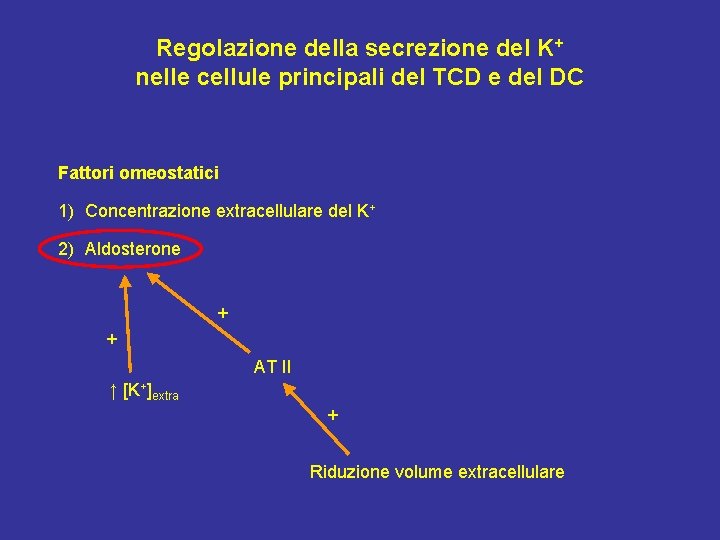
Regolazione della secrezione del K+ nelle cellule principali del TCD e del DC Fattori omeostatici 1) Concentrazione extracellulare del K+ 2) Aldosterone + + AT II ↑ [K+]extra + Riduzione volume extracellulare
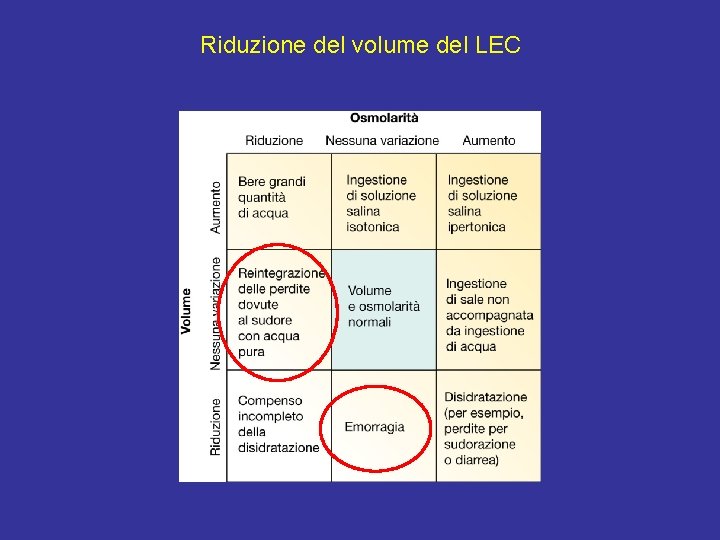
Riduzione del volume del LEC

Riduzione del volume del LEC, ipovolemia Efflusso di K+ dalle cellule Tendenza all’aumento della [K+]extra – ↑ aldosterone
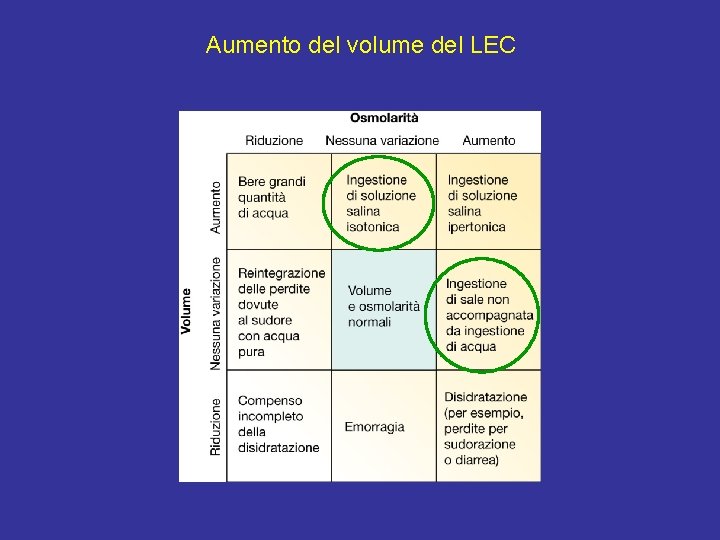
Aumento del volume del LEC
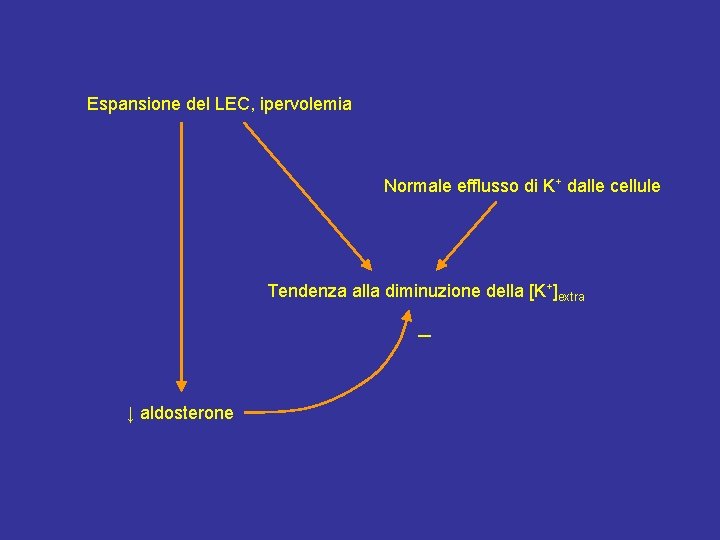
Espansione del LEC, ipervolemia Normale efflusso di K+ dalle cellule Tendenza alla diminuzione della [K+]extra – ↓ aldosterone

Regolazione della secrezione del K+ nelle cellule principali del TCD e del DC Fattori omeostatici 1) Concentrazione extracellulare del K+ 2) Aldosterone 3) ADH: ↑ [Na+] nel liquido tubulare → ↑ potenziale elettrochimico del Na+ sulla membrana apicale → ↑ potenziale transepiteliale 4) Fattori non omeostatici 5) Velocità del flusso del liquido tubulare

Effetto della velocità di flusso del liquido tubulare sulla secrezione del K+: meccanismi 1) ↑ velocità di ricambio del K+ nel liquido tubulare → il potenziale elettrochimico del K+ sulla membrana apicale viene preservato. 2) ↑ quantità di Na+ che perviene al TCD e al DC nell’unità di tempo → il potenziale elettrochimico del Na+ sulla membrana apicale viene preservato.

Effetto della velocità di flusso del liquido tubulare sulla secrezione del K+: conseguenze fisiologiche 1) L’effetto dell’aldosterone sull’escrezione netta di K+ richiede tempo! 2) L’effetto dell’ADH sul potenziale elettrochimico del Na+ permette di disaccoppiare l’escrezione di K+ dalle variazioni nell’escrezione di acqua.

Diuretici Aumentano la velocità d. I produzione delle urine. Molti diuretici aumentano anche l’escrezione urinaria di soluti (soprattutto Na+). In clinica sono usati per ridurre edema e ipertensione. Caffeina, teofillina e teobromina sono diuretici vasodilatazione arteriole renali ↑ VFG. I diuretici dell’ansa sono tra i più potenti.

Regolazione della secrezione del K+ nelle cellule principali del TCD e del DC Fattori omeostatici 1) Concentrazione extracellulare del K+ 2) Aldosterone 3) ADH: ↑ [Na+] nel liquido tubulare → ↑ potenziale elettrochimico del Na+ sulla membrana apicale → ↑ potenziale transepiteliale 4) Fattori non omeostatici 5) Velocità del flusso del liquido tubulare 6) Equilibrio acido-base

Alcalosi 1) Aumenta la secrezione del K+ nelle cellule principali del TCD/DC • Potenzia l’attività della Na+/K+ ATPasi sulla membrana basolaterale • Aumenta la permeabilità al K+ sulla membrana apicale 2) Aumenta la secrezione del K+ nelle cellule intercalate di tipo B e ne diminuisce il riassorbimento nelle cellule intercalate di tipo A

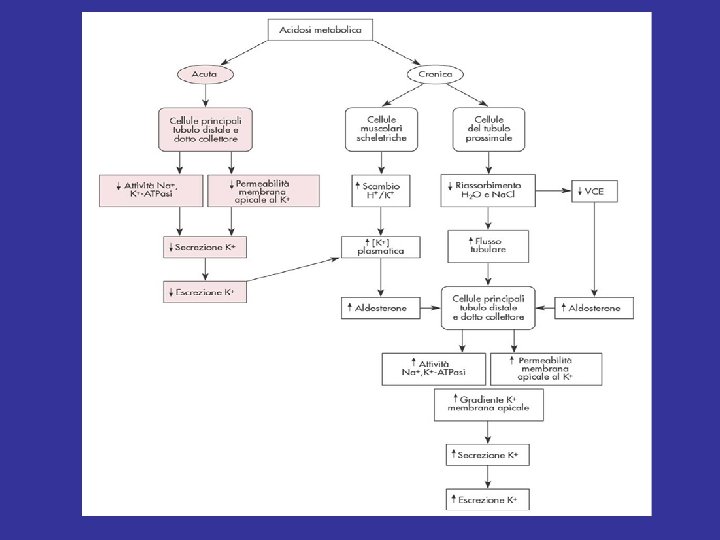
Acidosi 1) Diminuisce la secrezione del K+ nelle cellule principali del TCD/DC • Deprime l’attività della Na+/K+ ATPasi sulla membrana basolaterale • Riduce la permeabilità al K+ sulla membrana apicale 2) Diminuisce la secrezione del K+ nelle cellule intercalate di tipo B e ne aumenta il riassorbimento nelle cellule intercalate di tipo A Acidosi acuta → ↓ escrezione K+ → iperkaliemia

Acidosi 1) Diminuisce la secrezione del K+ nelle cellule principali del TCD/DC • Deprime l’attività della Na+/K+ ATPasi sulla membrana basolaterale • Riduce la permeabilità al K+ sulla membrana apicale 2) Diminuisce la secrezione del K+ nelle cellule intercalate di tipo B e ne aumenta il riassorbimento nelle cellule intercalate di tipo A 3) Riduce il riassorbimento di Na. Cl e H 2 O dal TCP deprimendo l’attività della Na+/K+ ATPasi 4) • → ↑ flusso tubulare → ↑ escrezione K+ • → riduzione LEC → ↑ secrezione aldosterone → ↑ secrezione K+ 4) Aumenta la [K+]extra deprimendo l’attività della Na+/K+ ATPasi cellulare → ↑ secrezione aldosterone → ↑ secrezione K+

Acidosi cronica → ↑ escrezione K+ → ipokaliemia 3) Riduce il riassorbimento di Na. Cl e H 2 O dal TCP deprimendo l’attività della Na+/K+ ATPasi • → ↑ flusso tubulare → ↑ escrezione K+ • → riduzione LEC → ↑ secrezione aldosterone → ↑ secrezione K+ 4) Aumenta la [K+]extra deprimendo l’attività della Na+/K+ ATPasi cellulare → ↑ secrezione aldosterone → ↑ secrezione K+
- Slides: 58