Recherche en imagerie Quelle mthodologie pour quelle s
































































- Slides: 79

Recherche en imagerie: Quelle méthodologie, pour quelle (s) question (s) et avec quels outils ? Gilles Chatellier AP-HP, HEGP CIE 4 INSERM Faculté de Médecine René Descartes GC, 2010 1

Le contexte: Médecine fondée sur le niveau de preuve § Evidence based medicine is “The conscientious, explicit and judicious use of current best evidence in making decisions about the care of individual patients”. § The best evidence is clinically relevant research “especially patient-centered clinical research into the accuracy and precision of diagnostic tests, the power of prognostic markers, and the efficacy and safety of therapeutic, rehabilitative, and preventive regimens”. DL Sackett, 1996 GC, 2010 2

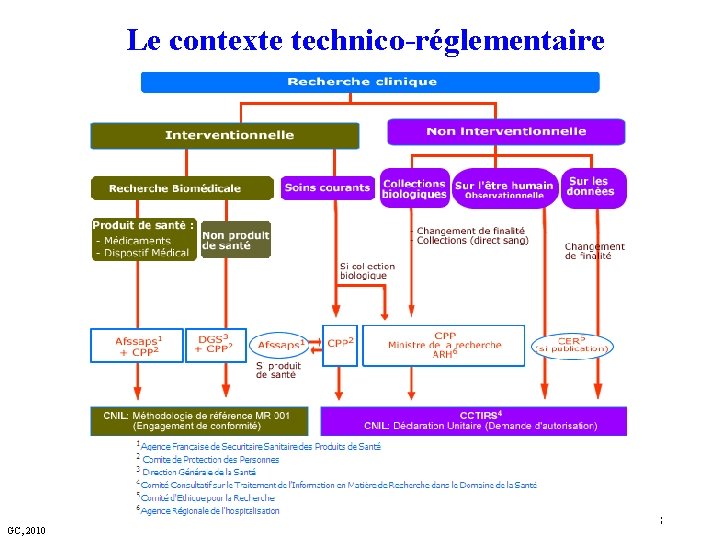
Le contexte technico-réglementaire GC, 2010 3

Le contexte technico-réglementaire (2) Attention ! Le contexte réglementaire va changer (Loi Jardé votée, décrets d’application d’ici < 1 an Conséquences: § Positives : notion de risque introduite dans la loi § Négatives: soumission au CPP de toute recherche, sans réflexion sur l’organisation et la charge de travail de ces derniers GC, 2010 4

Le financement La recherche non financée devient de plus en difficile. Le financement est possible via de multiples appels d’offre (PHRC, STIC, Sociétés Savantes, Associations de malades, Fondations…. Remarques: § Imaginer monter un projet seul est source de déconvenues § Dans tous les CHU l’aide à la Recherche Clinique est une réalité (certes imparfaite…): CIC, URCs… § La surveillance du bon emploi de l’argent est de plus en plus précise. GC, 2010 5

Recherche: Le minimum requis • Une bonne question • Une revue exhaustive de la littérature • Des malades en nombre suffisant (échapper au piège du nombre de sujets nécessaire) • Un méthodologiste (il n’y a pas que des questions statistiques) et un clinicien qui dialoguent • Des soins de base de qualité • Du temps clinique (médecins, manipulateurs) et des professionnels (Unité de Recherche Clinique) dédiés à la recherche GC, 2010 6

La précision de la question de recherche est l’élément le plus important de tout protocole de recherche « Ceux qui ne savent pas où ils vont surpris d'arriver ailleurs » Pierre DAC GC, 2010 7

Une question, beaucoup de méthodes ! § Il y a souvent de nombreuses manières de répondre à la même question. § Choisir la bonne méthode nécessite la réponse à de nombreux pré-requis: . • Connaître les forces et les faiblesses de chaque type de méthodologie. • Identifier la problématique: Traitement? Pronostic? Diagnostic ? Synthèse ? • Connaissances spécifiques: connaissance exhaustive de la littérature, la connaissance des biais… • Connaissances statistiques, mais ce n’est pas l’essentiel … GC, 2010 8

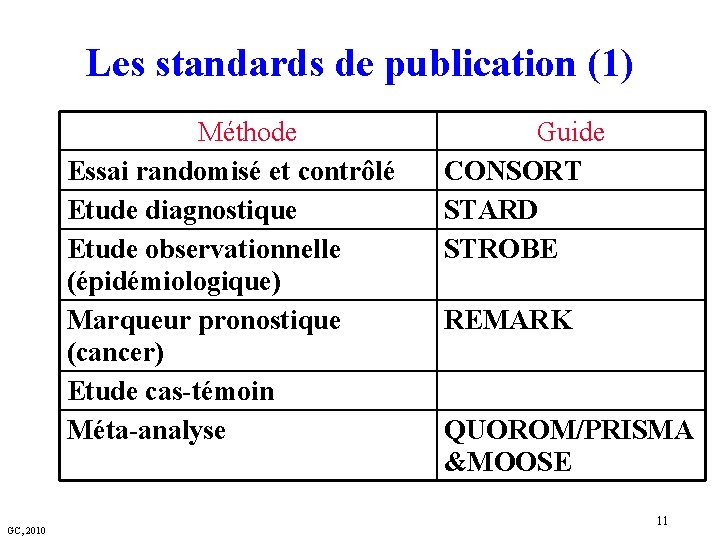
Une aide importante: Les standards de publication § Les standards de publication sont une liste des éléments qu’il est nécessaire de trouver dans une publication § Ces standards doivent obligatoirement être respectés pour que la publication soit acceptée, dans de très nombreuses revues § Ces standards sont une aide précieuse pour écrire un projet de recherche (ce qui doit être publié doit être planifié…) GC, 2010 9

Les questions Question Efficacité d’une thérapeutique, d’une méthode diagnostique, de dépistage Etiologie Pronostic Diagnostic Méta-analyse GC, 2010 Méthode Essai contrôlé randomisé Etude cas témoin Devenir d’un malade, évaluation d’un risque Identification d’une maladie Synthèse 10

Les standards de publication (1) Méthode Essai randomisé et contrôlé Etude diagnostique Etude observationnelle (épidémiologique) Marqueur pronostique (cancer) Etude cas-témoin Méta-analyse GC, 2010 Guide CONSORT STARD STROBE REMARK QUOROM/PRISMA &MOOSE 11

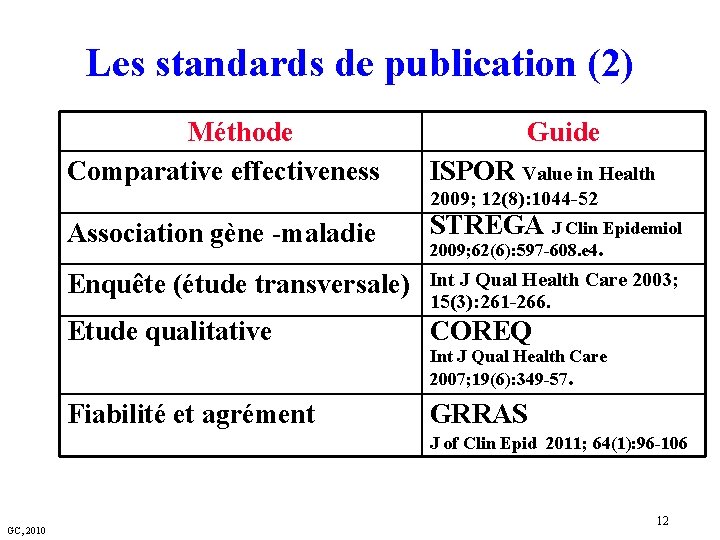
Les standards de publication (2) Méthode Comparative effectiveness Guide ISPOR Value in Health 2009; 12(8): 1044 -52 Association gène -maladie STREGA J Clin Epidemiol 2009; 62(6): 597 -608. e 4. Enquête (étude transversale) Int J Qual Health Care 2003; 15(3): 261 -266. Etude qualitative COREQ Fiabilité et agrément GRRAS Int J Qual Health Care 2007; 19(6): 349 -57. J of Clin Epid 2011; 64(1): 96 -106 GC, 2010 12

http: //www. equator-network. org GC, 2010 13

Quelles méthodologies de la recherche pour les radiologues § Toutes! § Dans les études en cours à l’HEGP, menées par des radiologues en 2012 sont concernées: • La radiologie diagnostique et interventionnelle • Le diagnostic, le pronostic, le traitement, la reproductibilité • Le cancer, les maladies cardio-vasculaires § Un radiologue doit donc connaitre … toute l’épidémiologie clinique! GC, 2010 14

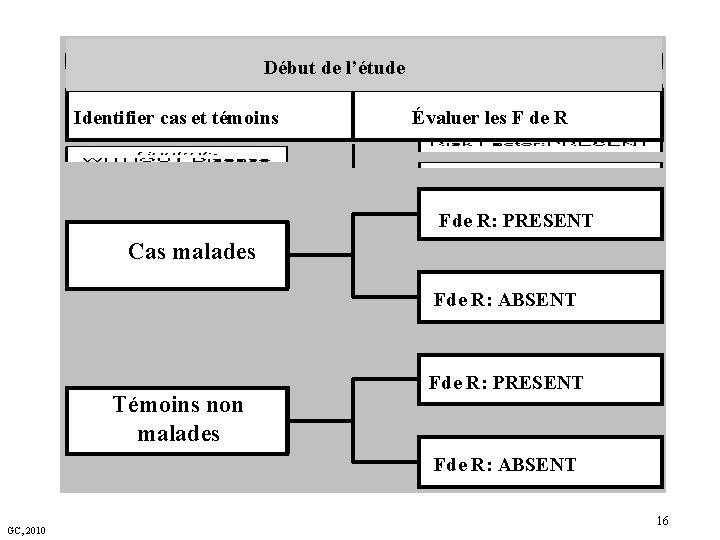
Plan expérimental 1. Cas - Témoin § Dans une étude cas/témoin on a le « résultat de santé » (par exemple, une maladie) et on en recherche les causes (par exemple, facteurs de risque) chez les personnes qui partagent ces résultats. § Le plus souvent, toute l'étude est réalisée avec une information déjà enregistrée, et plus ou moins disponible (dossiers des patients) ou des bases de données (Pour les radiologues, PACS). GC, 2010 15

Début de l’étude Identifier cas et témoins Évaluer les F de R Fde R: PRESENT Cas malades Fde R: ABSENT Témoins non malades Fde R: PRESENT Fde R: ABSENT GC, 2010 16

Données présentées dans une table de contingence 2 x 2 Sujets AVC+ Facteur de Présent risque (Hypertension Absent ) AVC: Accident vasculaire cérébral GC, 2010 AVC- 2 1 Quels Fd. R? 2 groupes de sujets 17

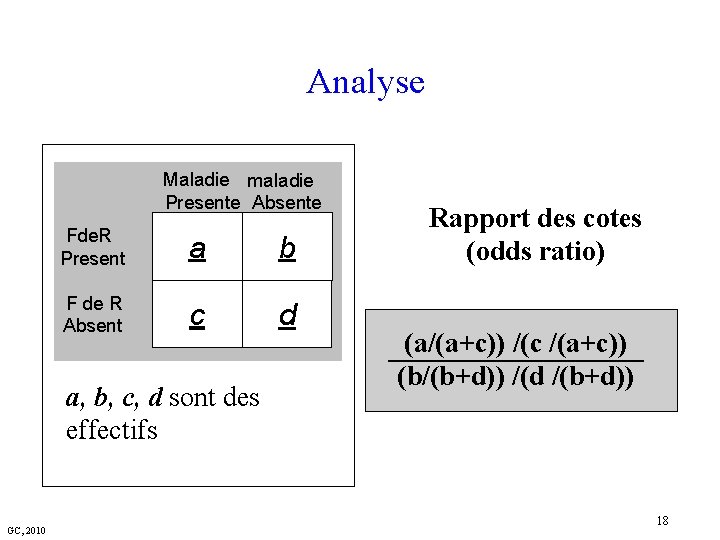
Analyse Maladie maladie Presente Absente Fde. R Present a b F de R Absent c d a, b, c, d sont des effectifs GC, 2010 Rapport des cotes (odds ratio) (a/(a+c)) /(c /(a+c)) (b/(b+d)) /(d /(b+d)) 18

Plan expérimental 1 Cas – Témoin : Avantages § Efficace et simple § Utile pour étudier les maladies rares § Considérations éthiques: souvent pas un problème important, quoique… • Les dossiers patients doivent être examinés (CNIL? ) • Comité d’éthique: y penser • Selon la nature de l'étude (génétique) le consentement des patients peut ou non être exigé GC, 2010 19

Plan expérimental 1 Cas – Témoin: Faiblesses § L'information disponible peut être insatisfaisante: • Qualité de la mesure • Variabilité dans le temps • Données manquantes § Biais de mémorisation § Quelle définition du groupe contrôle ? GC, 2010 20

Plan expérimental 2: Cohorte § Cette conception d'étude adopte une approche longitudinale. § Cette conception n'est pas appropriée aux projets à court terme ! ! § Des sujets avec ou sans un facteur de risque identifiable (hypertension, traitement) sont suivis et présentent ou non un certain état (accident vasculaire cérébral (AVC)). § Les sujets avec et sans le facteur de risque sont comparés. GC, 2010 21

Présent Identifier les sujets Futur Mesurer Les F de R Mesurer les Résultats Maladie PRESENTE F de R PRESENT Maladie ABSENTE Population d étude Temps Maladie PRESENTE F de R ABSENT Maladie Présente non inclus GC, 2010 Maladie ABSENTE 22

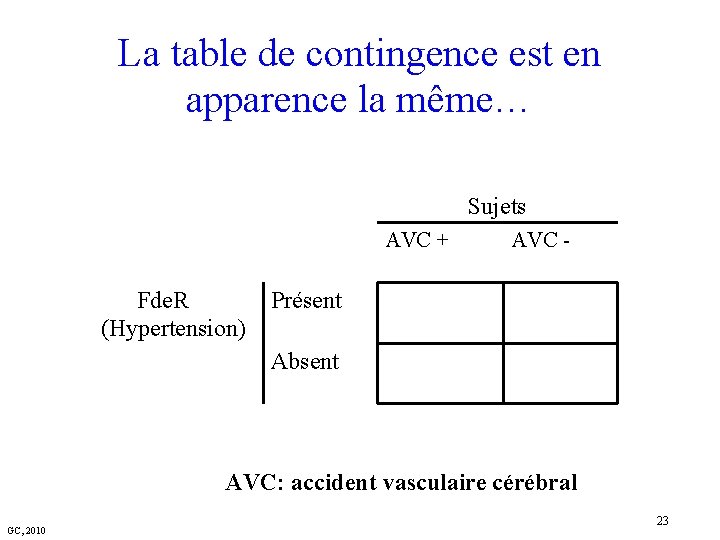
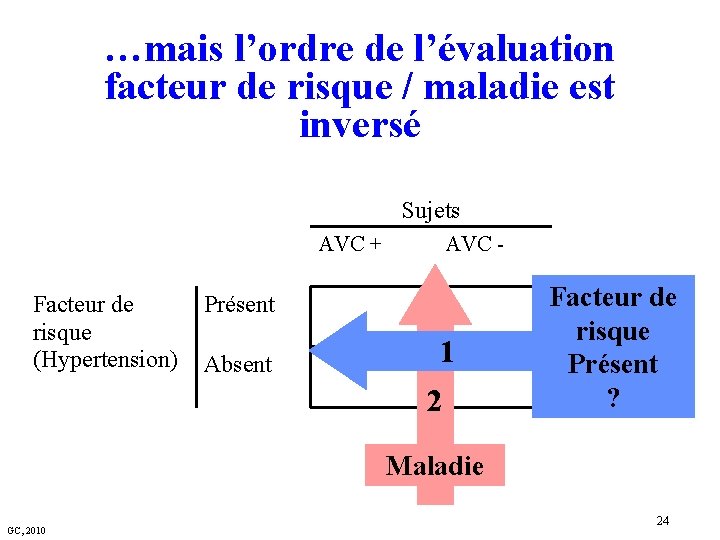
La table de contingence est en apparence la même… Sujets AVC + Fde. R (Hypertension) AVC - Présent Absent AVC: accident vasculaire cérébral GC, 2010 23

…mais l’ordre de l’évaluation facteur de risque / maladie est inversé Sujets AVC + Facteur de risque (Hypertension) AVC - Présent Absent 1 2 Facteur de risque Présent ? Maladie GC, 2010 24

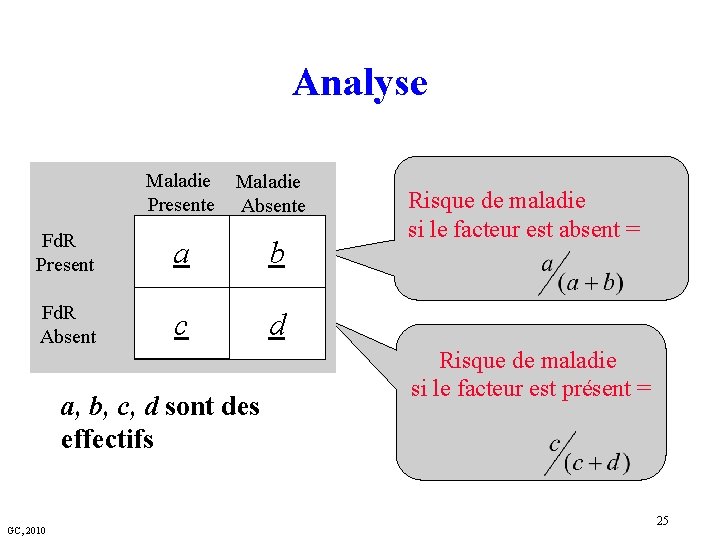
Analyse Maladie Presente Maladie Absente Fd. R Present a b Fd. R Absent c d a, b, c, d sont des effectifs GC, 2010 Risque de maladie si le facteur est absent = Risque de maladie si le facteur est présent = 25

Risque relatif Maladie Presente Maladie Absente Fd. R Present a b Fd. R Absent c d RR= a, b, c, d sont des effectifs GC, 2010 26

Plan expérimental 2 Cohorte: les avantages. § Les données peuvent être recueillies d'une façon complète et uniforme § Le biais de mémorisation n’est pas un problème § La définition du résultat ( « outcome » ) est homogène chez tous les sujets § Pas de sélection des groupes, volontaire ou non GC, 2010 27

Plan expérimental 2 Cohorte: les désavantages. § « Design » coûteux en temps et en argent § Le choix de la population d'étude peut influencer la généralisation des résultats § Effet du temps: • Perdus de vue • Changement des critères de jugement • …de méthodologie de mesure (évolution des techniques très rapide en imagerie et en biologie) § Biais de surveillance GC, 2010 28

Exemple: Suppléments hormonaux après la ménopause 1990 -2002 § Question thérapeutique importante § S'applique à des millions de femmes § Le Prempro (oestrogène/progestine) était le médicament le +prescrit aux USA à la fin des années 90 § Impact potentiellement énorme en terme de santé publique § Effet complexe: les hormones ont un rôle potentiel sur des maladies multiples (cancer, ostéoporose, maladies cardio-vasculaire) GC, 2010 29

Nurses Health Study (NEJM, 1991) § Prospective cohort study, n = 48, 470 § 337, 000 person years of follow-up Risk of Major Estrogen Use Coronary Disease* Relative Risk** Never Used 1. 4 1. 0 Former user 1. 3 0. 83 (0. 65 -1. 05) Current user 0. 6 0. 56 (0. 40 -0. 80) * Events per 1000 women-years of follow-up ** Relative Risk (95% CI) compared to never users GC, 2010 30

Supplémentation hormonale après la ménopause Maladie Cardiopathie ischémique Ostéoporose (Fr. de hanche) Cancer du sein Cancer de l’endomètre Alzheimer’s Embolie Pulmonaire & thrombose veineuse Effet sur le risque* Diminution: 40 - 80% Diminution: 30 - 60% Augmentation: 10 - 20% Augmentation: 700% Diminution: ? Augmentation: 200 - 300% * Réduction relative de risque; Études observationnelles (cas - témoins et cohortes) GC, 2010 31

Mais… § Les utilisatrices sont-elles différentes des non- utilisatrices (se traiter ou non est un choix de la patiente) ? • • ge État de santé Plus d'exercice Comportements de santé …. § Solutions • Ajustements (mais pas toujours possible) • Essais randomisés GC, 2010 32

Plan expérimental 3 Essai randomisé et contrôlé Randomized Controlled Trial Gold standard pour l’évaluation de l’effet des procédures ou stratégies médicales Le plus souvent utilisé dans le cadre des essais dit de « phase 3 » dans le monde des essais médicamenteux GC, 2010 33

Essai randomisé et contrôlé Présent Début Suivi Randomisation Traitement A Population d’étude Maladie présente Maladie absente Temps Traitement B GC, 2010 Résultat Maladie présente Maladie absente 34

La table de contingence est encore la même… … mais les sujets sont assignés par tirage au sort au traitement Tirage au sort pour créer les groupes 1 Sujets + AVC- Trt Groupe Controle 2 Evaluation de la maladie GC, 2010 35

Essai randomisé et contrôlé: ce qu’il fait, ce qu’il ne fait pas § § GC, 2010 L’ERT peut réduire les problèmes liés à: Biais de jugement des médecins Attentes des patients Prise en charge Observance… Mais attention § Une bonne question est + que jamais cruciale § Ne pas oublier l’importance de la méthode expérimentale à tous les niveaux de l’essai (mesure du critère de jugement, nb de sujets nécessaire, statistiques…) § financement approprié et mise en œuvre sont les 2 clés du succès (essais multicentriques) 36

Essai randomisé et contrôlé: Éthique § Placebo et autre outils de « contrôle » • De manière générale, le “contrôle” est un élément essentiel (aveugle, standardisation des traitements associés, double lecture des documents radiologiques…) mais il est difficile à mettre en œuvre. § Randomisation : charge émotionnelle GC, 2010 • Médecins: obtention du consentement informé, non connaissance du traitement, traitement de type « fausse intervention (sham) » … • Patients : information appropriée 37

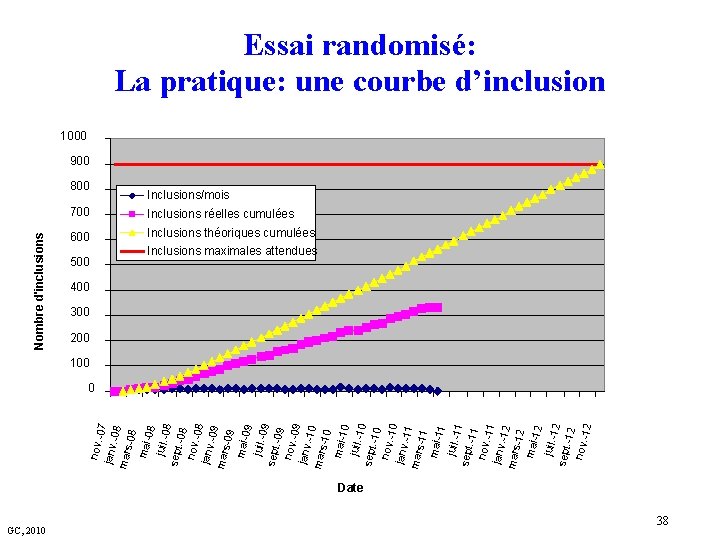
nov. 07 janv. -08 mars -08 mai 08 juil. -0 8 sept. -08 nov. 08 janv. -09 mars -09 mai 09 juil. -0 9 sept. -09 nov. 09 janv. -10 mars -10 mai 10 juil. -1 0 sept. -10 nov. 10 janv. -11 mars -11 mai 11 juil. -1 1 sept. -11 nov. 11 janv. -12 mars -12 mai 12 juil. -1 2 sept. -12 nov. 12 Nombre d'inclusions Essai randomisé: La pratique: une courbe d’inclusion 1000 900 800 GC, 2010 500 Inclusions/mois 700 Inclusions réelles cumulées 600 Inclusions théoriques cumulées Inclusions maximales attendues 400 300 200 100 0 Date 38

Essai randomisé et contrôlé: Eléments - clés § Question TRES précise § Validité interne • Qualité des CRITERES DE JUGEMENT et des méthodes et instruments de mesure • Choix du comparateur • Qualité du contrôle : co-intervention, aveugle difficile, violation de la randomisation, perdus de vue…. • Qualité de la randomisation (masquage) • Qualité du suivi § Patients • Calcul réaliste du nombre de sujets • Disponibilité des patients (problème pour les radiologues) § Résultats • Quantité d’effet • Analyse en intention de traiter GC, 2010 39

Essai randomisé et contrôlé: Encadrement L’essai randomisé et contrôlé, plus que tout autre design, est une affaire de professionnels: § AVANT • Protocole, investigateurs et promoteur • Déclarations (CPP, CNIL, Autorités compétentes…) § Pendant • ARC/TEC • BPC § APRES (mais mieux vaut s’en occuper avant!!!) • CONSORT Statement • Règles de lecture de l’EBM Working group GC, 2010 40

Women’s Health Initiative Hormone Replacement Therapy (2002) § Randomized trial • 16, 608 women with uterus (ERT + progestin vs. placebo) • ~11, 000 women without uterus (ERT alone vs. placebo) § § GC, 2010 Ages 50 -79, mean age 64 Represent broad range of U. S. women 40 clinical centers Follow-up planned for 8. 5 years, to end in 2005 41

Women’s Health Initiative Hormone Replacement Therapy (2002) § Combination therapy arm stopped early (3 years) • Mean 5. 2 years of follow-up • Overall, health risks outweigh benefits • Significant increased risk for invasive breast cancer HRT users GC, 2010 42

WHI: Invasive Breast Cancer 3% 2 % 1% years 7 GC, 2010 1 2 3 4 5 6 43

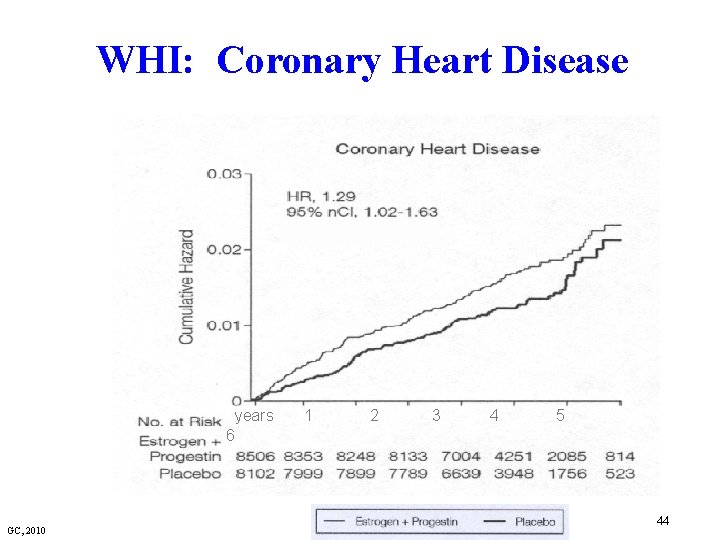
WHI: Coronary Heart Disease years 6 GC, 2010 1 2 3 4 5 44

GC, 2010 45

Le diagnostic: De nombreuses questions … § Quels objectifs ? • Reproductibilité • Performances • Efficacité § Quelles métriques ? • Sensibilité, spécificité § Quelle méthodes • test index & test de référence § Méthodologie • Design • Méthodologie (cohorte, cas contrôle… ) • Nb de sujets nécessaire (aide d’un statisticien) GC, 2010 46

Tests diagnostiques Architecture de leur évaluation § Phase 1: Do test results in affected patients differ from those in normal individuals? § Phase 2: Are patients with certain test results more likely to have the target disorder? § Phase 3: Do test results distinguish patients with and without the target disorder among those in whom it is clinically sensible to suspect the disorder? § Phase 4: Do patients undergoing the diagnostic test fare better than similar untested patients? Sackett, BMJ, 2002 GC, 2010 47

Test diagnostique: quelle place dans le processus diagnostique? P Bossuyt, BMJ, 2006 GC, 2010 48

Evaluation d’un test diagnostique: schéma idéal Cohorte Test évalué Test de référence Classification des résultats en aveugle GC, 2010 49

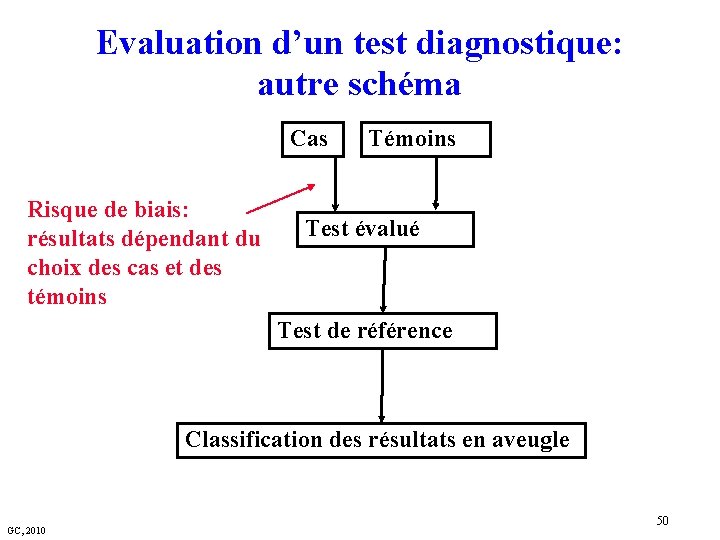
Evaluation d’un test diagnostique: autre schéma Cas Risque de biais: résultats dépendant du choix des cas et des témoins Test évalué Test de référence Classification des résultats en aveugle GC, 2010 50

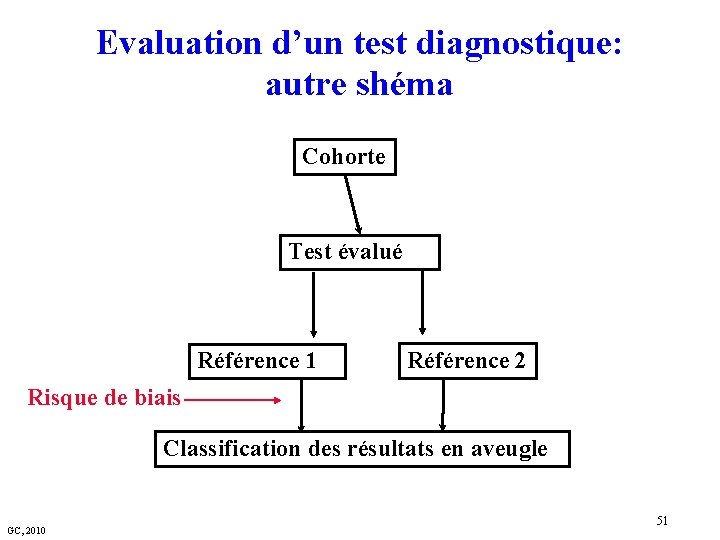
Evaluation d’un test diagnostique: autre shéma Cohorte Test évalué Référence 1 Référence 2 Risque de biais Classification des résultats en aveugle GC, 2010 51

Etude diagnostique: validité 1. Réunir un ensemble de patients représentatifs de la maladie (“ appropriate spectrum”) 2. Soumettre tous les patients au test de référence ( « gold standard » ) 3. S’assurer que la comparaison au test de référence est réellement: • • GC, 2010 Indépendante En aveugle’? 52

Réunir un ensemble de patients représentatifs de la maladie Biais de représentativité (Spectrum bias) § Sujet: valeur de la radiologie standard pour le diagnostic de pneumonie § Echantillon biaisé: pratiquer la radio seulement chez les patients ayant une forte suspicion de pneumonie § Echantillon correct: tous les patients ayant un trouble respiratoire et chez qui une radio pulmonaire est pratiquée GC, 2010 53

Soumettre tous les patients au gold standard Biais de vérification § Sujet: valeur de l’ECG d’effort dans le diagnostic de l’insuffisance coronaire § Gold standard : angiographie § Biais de vérification: seuls les patients positifs à l’ECG ont une angiographie. § Méthode correcte: tous les patients ont une angiographie GC, 2010 54

S’assurer que la comparaison au test de référence est réellement indépendante Biais d’observation (observer bias) § Sujet: valeur de l’ECG d’effort dans le diagnostic de l’insuffisance coronaire § Gold standard : angiographie § Biais d’observation: le radiologue qui pratique l’angiographie connait le résultat du test d’effort § Méthode correcte: séparer la réalisation de l’angiographie de son interprétation GC, 2010 55

Test diagnostiques: les métriques Situation de recherche M+ T+ T- GC, 2010 VP FN MFP VN Sensibilité Se= VP ÷ (VP+FN) Spécificité Se= VN ÷ (FP+VN) 56

Test diagnostiques: les métriques Situation clinique M+ T+ T- GC, 2010 VP FN MFP VN Probabilité post test: M+ si Test + : VPP VP ÷ (VP+FP) Probabilité post test: M- si Test - : VPN VN ÷ (FN+VN) 57

Test diagnostiques: les métriques Situation clinique: les rapports de vraisemblance (RV) – 1 M+ T+ T- GC, 2010 MFP VP ÷ Total(M+) RV+ = FP ÷ Total(M-) FN VN FN ÷ Total(M+) RV- = VN ÷ Total(M-) Total M+ Total M- VP • Un RV compris entre 1 et l’ augmente la probabilité de la maladie • Un RV compris entre 0 et 1 diminue la probabilité de la 58 maladie

Test diagnostiques: les métriques Situation clinique: les rapports de vraisemblance (RV) -2 M+ T+ GC, 2010 a Mb a ÷ Total(M+) RV+ = b ÷ Total(M-) Test douteux e f e ÷ Total(M+) RV d = f ÷ Total(M-) T- c d c ÷ Total(M+) RV- = d ÷ Total(M-) Total M+ Total M- 59

Test diagnostiques: les métriques Rapport des cotes diagnostique (RCd) M+ MT+ a b T- c d §RCd = a ÷ c / b ÷ d §La cote d’un résultat positif du test chez les personnes malades divisé par la cote d’un résultat positif du test chez les personnes non malades. §Le RCd est un résumé simple des résultats d’une table 2× 2, incorporant la sensibilité et la spécificité. §Exprimé en termes de sensibilité et de spécificité il s’écrit: Se÷ (1 -Se) RCd = (1 -Sp) ÷ (Sp) GC, 2010 60

Analyse de la reproductibilité Coefficient kappa Kappa: concordance inter- ou intra-observateur corrigée de la concordance liée au hasard GC, 2010 61

Nombre de sujets nécessaire § La vraie difficulté pour les radiologues chercheurs qui ne recrutent pas directement les patients: connaitre la population disponible pour l’étude. § Comme TOUTE étude, une étude diagnostique doit comprendre le calcul du nb de sujets nécessaire § Particularité: la multiplicité des métriques utilisables (Se, Sp, les 2, LR, courbe ROC…) et des questions (comparaison, précision…) GC, 2010 62

GC, 2010 63

Preuve empirique de biais liés au design Lijmer JG et al. JAMA; 1999: 282: 1061 -1066. GC, 2010 64

Les standards de publication Des guides méthodologiques très utiles : exemple du STARD Statement GC, 2010 65

GC, 2010 66

Les standards de publication (1) STARD Statement N° 3 4 5 6 GC, 2010 Guide Describe the study population: The inclusion and exclusion criteria, setting and locations where the data were collected. Describe participant recruitment: Was recruitment based on presenting symptoms, results from previous tests, or the fact that the participants had received the (evaluated) index tests or the (golden) reference standard? Describe participant sampling: Was the study population a consecutive series of participants defined by the selection criteria in items 3 and 4? If not, specify how participants were further selected. Describe data collection: Was data collection planned before the index test and reference standard were performed (prospective study) or after (retrospective study)? 67

Les standards de publication(2) STARD Statement N° Guide 7 8 Describe the reference standard and its rationale. Describe technical specifications of material and methods involved including how and when measurements were taken, and/or cite references for index tests and reference standard. 10 Describe the number, training and expertise of the persons executing and reading the index tests and the reference standard. Describe whether or not the readers of the index tests and reference standard were blind (masked) to the results of the other test and describe any other clinical information available to the readers. 11 12 Describe methods for calculating or comparing measures of diagnostic accuracy, and the statistical methods used to quantify uncertainty (e. g. 95% confidence intervals). 13 Describe methods for calculating test reproducibility, if done. GC, 2010 68

Les standards de publication(3) STARD Statement N° GC, 2010 Guide 17 Report time interval from the index tests to the reference standard, and any treatment administered between. 18 Report distribution of severity of disease (define criteria) in those with the target condition; other diagnoses in participants without the target condition. 19 Report a cross tabulation of the results of the index tests (including indeterminate and missing results) by the results of the reference standard; for continuous results, the distribution of the test results by the results of the reference standard. 20 Report any adverse events from performing the index tests or the reference standard. 21 Report estimates of diagnostic accuracy and measures of statistical uncertainty (e. g. 95% confidence intervals). 22 Report how indeterminate results, missing responses and outliers of the index tests were handled. 23 Report estimates of variability of diagnostic accuracy between subgroups of participants, readers or centers, if done. 69

Standards sur les données Characteristics of Image Acquisition § Identify the model and manufacturer of the hardware and software used to acquire the image. § Describe any settings, optical or band-pass filters, sampling algorithms, amplification, or other technical information necessary to understand how the image was acquired and that could affect the interpretation of the image. § Describe or reference any procedures undertaken to prepare the patient for imaging. If applicable, specify any contrast media used, including the dose, route, and timing of its administration relative to the acquisition of the image or any fasting, voiding, or dietary preparations. § Describe or reference any standard procedures or protocols used to acquire the image. If applicable, state the conditions under which the image was taken (in the emergency department, operating room, ambulatory care center, during a stress test, and so on) and any “evocative” techniques used to increase the diagnostic value of the image. § Describe the condition of the patient during imaging. If applicable, specify the patient's position or posture (seated; supine), state of consciousness (asleep; anesthetized), and any medications in the patient’s system during imaging. Lang, T. How to Document Biomedical Images for Publication Cité sur http: //www. equator-network. org/ GC, 2010 70

GC, 2010 71

La méta-analyse § De plus en plus utilisée § S’applique à TOUTES les études: thérapeutiques, diagnostiques, pronostiques § Utilisations: • Préparation à un travail original • Résumé de plusieurs études • Recherche d’explications à des discordances inter-études GC, 2010 72

Etapes d’une méta analyse 1. 2. 3. GC, 2010 Définir la question posée • Critères d’inclusion et d’exclusion (Population , Intervention, Résultat) • Hypothèses a priori concernant une hétérogénéité Définir la méthode de recherche de la littérature : • Sources d’information (bases de données, recherche manuelle, …) • Restrictions éventuelles (temps, langue…) • Identifier les titres et résumés correspondant Identification des critères d’inclusion ou de non inclusion • Obtenir les articles complets des titres et abstracts sélectionnés • Appliquer des critères d’inclusion ou de non inclusion sur les articles • Sélectionner une liste finale d’articles • Evaluer l’agrément dans cette sélection (2 personnes) et conserver la trace des choix effectué 73

Etapes d’une méta analyse (2) 4. 5. 6. GC, 2010 Extraire les données (créer la base de données) • Participants, interventions comparatives, schémas d’étude • Résultats • Critères de qualité • Agrément (2 personnes) Conduire l’analyse • Choix de la méthode destinée à pooler les données • Explorer l’hétérogénéité (analyse de sensibilité, analyse en sous groupes) Explorer la possibilité de biais de publication 74

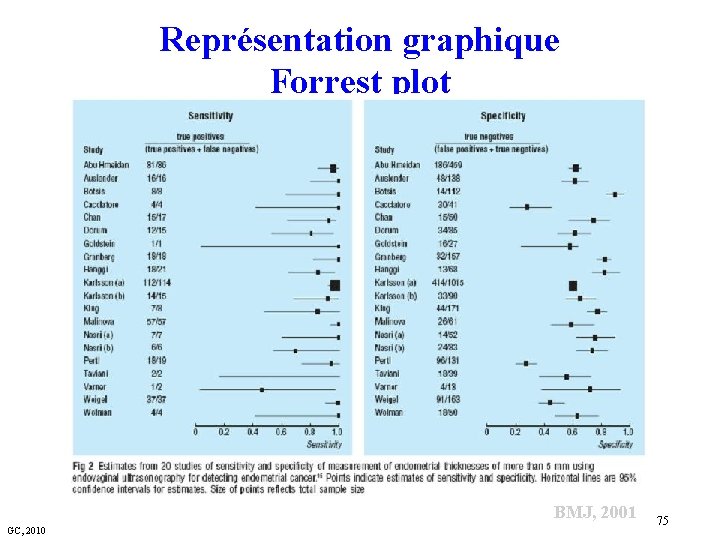
Représentation graphique Forrest plot BMJ, 2001 GC, 2010 75

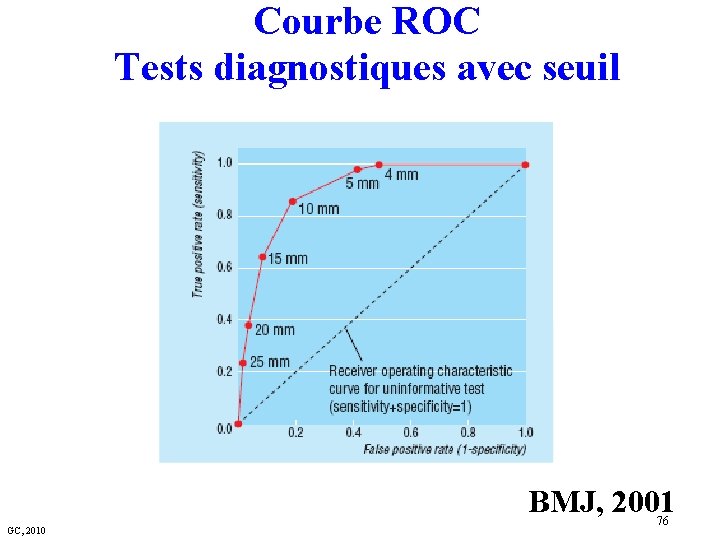
Courbe ROC Tests diagnostiques avec seuil BMJ, 2001 GC, 2010 76

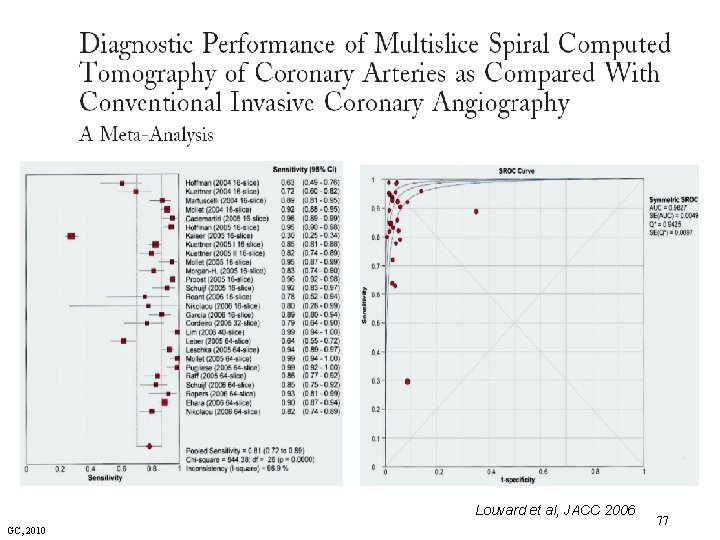
Meta-analysis of diagnostic studies Louvard et al, JACC 2006 GC, 2010 77

Fig 1: Positive likelihood ratios (squares) and 95% CI for strategies used to confirm a diagnosis of pulmonary embolism. Size of square is related to variance of study. Broken line represents pooled positive likelihood ratio, and limits of diamond represents 95% CI of pooled ratios Roy PM. et al. BMJ 2005; 331: 259 GC, 2010 78

M-A pronostique Facteurs de risque de l’embolie pulmonaire Sanchez et al, 2008 GC, 2010 79
 Fibrine pansement
Fibrine pansement Dut informatique option imagerie numérique
Dut informatique option imagerie numérique Polype de killian tdm
Polype de killian tdm Syndrome de rokitansky imagerie
Syndrome de rokitansky imagerie Quelle methode pour arrêter les fuites urinaires la nuit
Quelle methode pour arrêter les fuites urinaires la nuit Cod
Cod Mthodologie
Mthodologie Mthodologie
Mthodologie Mthodologie
Mthodologie Mthodologie
Mthodologie Introduction tfe exemple
Introduction tfe exemple Mthodologie
Mthodologie Mthodologie
Mthodologie Toi et moi basel
Toi et moi basel Eureka recherche documentaire
Eureka recherche documentaire Recherche photos
Recherche photos Recherche par image
Recherche par image La recherche des besoins
La recherche des besoins Recherche inversée par image
Recherche inversée par image Stratégie de recherche documentaire
Stratégie de recherche documentaire Définition de la recherche qualitative
Définition de la recherche qualitative Recherche par image
Recherche par image Prosper lucas domaine de recherche
Prosper lucas domaine de recherche Algorithme de la recherche dichotomique
Algorithme de la recherche dichotomique Recherche image
Recherche image Amf recherche avancée
Amf recherche avancée La musique tunisienne moderne
La musique tunisienne moderne Recherche 4life
Recherche 4life Frais de recherche et de développement syscohada
Frais de recherche et de développement syscohada Cidreq recherche simple
Cidreq recherche simple Recherche par image
Recherche par image Masterliste psychologie
Masterliste psychologie Recherche heuristique intelligence artificielle
Recherche heuristique intelligence artificielle Recherche séquentielle
Recherche séquentielle Recherche par image
Recherche par image Cross-docking définition
Cross-docking définition Recherche locale
Recherche locale Recherche documentaire
Recherche documentaire Cervicocystoptose
Cervicocystoptose Suz uzh
Suz uzh Recherche d image
Recherche d image Recherche opérationnelle
Recherche opérationnelle Recherche par image google
Recherche par image google Initiation à la recherche en soins infirmiers
Initiation à la recherche en soins infirmiers Saan galing ang salitang recherche
Saan galing ang salitang recherche Moteur de recherche exemple
Moteur de recherche exemple V
V Recherche séquentielle
Recherche séquentielle Polynomes
Polynomes Quelle est l'image de 2
Quelle est l'image de 2 De quelle couleur sont tes yeux
De quelle couleur sont tes yeux Buch als quelle angeben
Buch als quelle angeben Que quoi qui
Que quoi qui Magnificat en lingala
Magnificat en lingala Quelle est la capitale de moldavie
Quelle est la capitale de moldavie Plus grosse pelle hydraulique du monde
Plus grosse pelle hydraulique du monde Forbidden city, hall of supreme harmony
Forbidden city, hall of supreme harmony Backuparten
Backuparten O quelle joie quand on m'a dit
O quelle joie quand on m'a dit Welche flüsse entspringen am gotthard
Welche flüsse entspringen am gotthard Quelle
Quelle Completez avec quel quelle quels quelles
Completez avec quel quelle quels quelles Il est neuf heures
Il est neuf heures Quel est le rôle de la domotique
Quel est le rôle de la domotique Quelle est la nature de ce document
Quelle est la nature de ce document Quelle est l'image de 2
Quelle est l'image de 2 Quelle est sa nationalité
Quelle est sa nationalité Quelle foutaise
Quelle foutaise Itanje
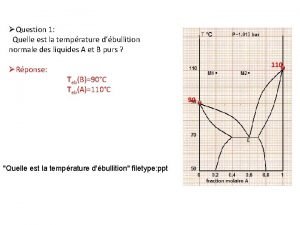
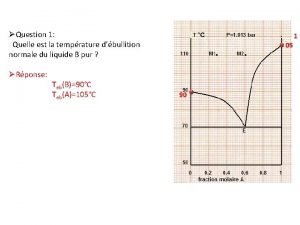
Itanje Dampfdruckdiagramm
Dampfdruckdiagramm Variance statistique
Variance statistique Royaume uni parle quel langue
Royaume uni parle quel langue Gott ist die quelle des lebens
Gott ist die quelle des lebens Quelle chance tu as
Quelle chance tu as Quelle heure est-il
Quelle heure est-il Quel est le colorant spécifique de l'amidon
Quel est le colorant spécifique de l'amidon Donau quelle
Donau quelle Ordonner des fractions
Ordonner des fractions Quelle
Quelle 5000002010
5000002010