RECHERCHE CLINIQUE Cadre lgislatif de la recherche clinique























































































- Slides: 100

RECHERCHE CLINIQUE Cadre législatif de la recherche clinique 1 7 novembre 2014 Béatrice Barbier - Valérie Jolaine URC/CIC Paris Necker Cochin

2 1. 2. 3. 4. 5. Introduction Les textes La recherche clinique en pratique Les nouveaux textes Quizz

Introduction 3 Pourquoi fait-on de la Recherche Clinique? 1. 2. Faire évoluer la prise en charge des patients Apporter de nouvelles connaissances et permettre le progrès médical

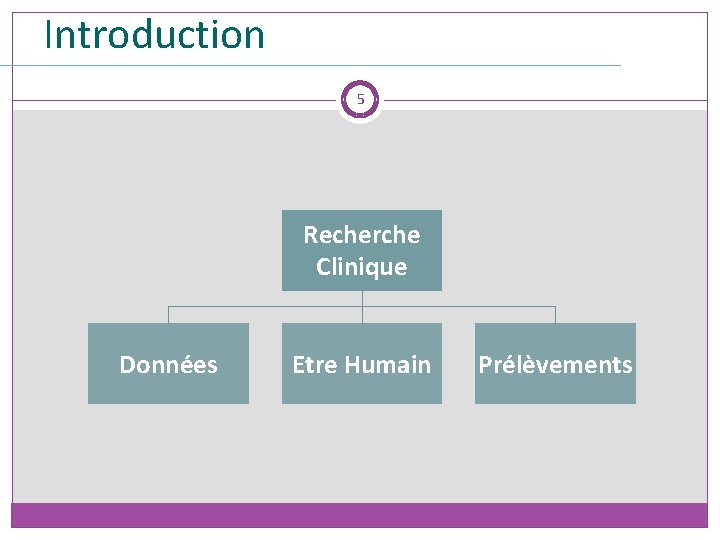
Introduction 4 Qu’est-ce que la Recherche Clinique?

Introduction 5 Recherche Clinique Données Etre Humain Prélèvements

Introduction 6 Date de naissance de la recherche Clinique ? 1. 2. 3. 4. La préhistoire L’antiquité XVIIIème siècle XXème Siècle

Introduction 7 Date de naissance de la recherche Clinique 1. 2. 3. 4. La préhistoire L’antiquité XVIIIème siècle XXème Siècle

Introduction 8 Hippocrate (400 AJC) Refus de l’expérimentation humaine Vivisection sur les esclaves à des fins scientifiques

9 1. 2. 3. 4. 5. Introduction Les textes La recherche clinique en pratique Les nouveaux textes Quizz DU INF TEC 16/11/2012

Les textes 10 Pourquoi des lois en recherche clinique? Protéger les personnes qui se prêtent à la recherche Information / Consentement de participation Modalités de recueil du consentement Droit de retirer son consentement à tout moment Pharmacovigilance Assurance Définir les acteurs de la recherche et leurs responsabilités …

Introduction – Définitions de droit 11 DU INF TEC Loi Règle de droit écrite. Elle s’applique à tous sans exception et nul n’est censé l’ignorer. Elle est délibérée, amendée et votée par le parlement (Assemblée nationale et Sénat) en termes identiques. Elle est promulguée (signée) par le Président de la République et publiée au JO. 16/11/2012

Introduction – Définitions de droit 12 Règlement en droit public Disposition prise par certaines autorités administratives, auxquelles la Constitution donne compétence pour émettre des règles normatives. Règlement en droit communautaire Texte directement applicable en l’état, dans tous ces éléments , dès sa publication DU INF TEC 16/11/2012

Introduction – Définitions de droit 13 Décret : pris par le Président de la République ou le Premier Ministre Arrêté : pris par les ministres du Gouvernement, les préfets, les sous-préfets et les maires des communes, dans la limites de leurs attributions Directive : décision de droit communautaire visant à favoriser l'harmonisation des législations nationales des États membres de l'Union Européenne. Elle impose aux États membres un objectif à atteindre, tout en leur laissant le choix quant aux moyens d'y parvenir (lois, décrets, principes généraux). 16/11/2012

14 1. 2. 3. 4. 5. Introduction Les textes La recherche clinique en pratique Les nouveaux textes Quizz

Les textes Procès de Nuremberg Procès intenté contre certains médecins ayant dirigé les expériences sur des détenus des camps de concentration nazis. 15

Les textes 16 Code de Nuremberg (1947) - 10 Principes dont : “ Nécessité de soumettre les recherches entreprises sur l'homme à des contrôles préalables ” “ Le consentement volontaire du sujet humain est absolument essentiel. Le sujet doit préalablement être renseigné exactement sur la nature, la durée et le but de l'expérience, ainsi que sur les méthodes et les moyens employés, les dangers et les risques encourus. ” “ Le sujet humain doit être libre, pendant l'expérience, de faire interrompre l'expérience, s'il estime avoir atteint le seuil de résistance, mentale ou physique, au delà duquel il ne peut aller. ”

Les textes 17 DÉCLARATIONS INTERNATIONALES Code de Nuremberg La première déclaration internationale sur la recherche impliquant la participation de sujets humains est le Code de Nuremberg de 1947, issu du procès des médecins accusés de s'être livrés à des expérimentations cruelles sur des prisonniers et des détenus au cours de la seconde guerre mondiale. Le Code met tout particulièrement l'accent sur le "consentement volontaire" ("consentement éclairé" est maintenant l'expression habituelle) du sujet, considéré comme absolument essentiel ".

18 DÉCLARATIONS INTERNATIONALES Déclaration d’Helsinki en 1964 L’Association Médicale Mondiale (AMM) a élaboré la Déclaration d’Helsinki comme un énoncé de principes éthiques applicables à la recherche médicale impliquant des êtres humains, y compris la recherche sur du matériel biologique humain et sur des données identifiables. Déclaration de Manille en 1981 La Déclaration de Manille est un projet commun de l'Organisation mondiale de la santé et du Conseil des organisations internationales des sciences médicales. Il s'agit de directives internationales proposées pour la recherche biomédicale impliquant des sujets humains, créée en 1981 à Manille

Les textes 19 1932 – 1972 - Étude menée sur la syphilis lorsqu’elle n’est pas traitée à Tuskegee (Alabama) Pas d’information sur le diagnostic Pas de consentement (concept alors inexistant en droit américain) Pas le traitement pourtant disponible dès 1943 (pénicilline) Fuite dans la presse en 1972 arrêt l’étude Mai 1997 excuses de Bill Clinton

Les textes 20 Les principaux textes aujourd’hui en France Déclaration d’Helsinki 2008 (9 amendements)

Les textes 21 Loi de Bioéthique - la loi n° 2011 -814 du 7 juillet 2011 S’intéresse aux activités médicales et de recherches qui utilisent des éléments du corps humain. Par exemple: Les greffes d’organes, de tissus; de moelle osseuse Assistance médicale à la procréation Les recherches ayant comme objet l’embryon et les cellules embryonnaires Le dépistage des maladies faisant appel aux gènes • Loi informatique et liberté : Loi 78 -17 du 6 janvier 1978 modifiée

Les textes 22 Loi de Santé publique 2004 - Loi n° 2004 -806 du 9 août 2004 relative à la politique de santé publique fixant les conditions des recherches biomédicales pratiquées et organisées en vue du développement des connaissances biologiques ou médicales Loi Huriet-Sérusclat = loi n° 88 -138 du 20 décembre 1988 relative à la protection des personnes se prêtant à des recherches biomédicales Directive 2001/20/CE du Parlement européen et du Conseil de l’Union européenne du 4 avril 2001 relative aux essais cliniques de médicaments concernant le rapprochement des dispositions législatives, réglementaires et administratives des États membres relatives à l'application de bonnes pratiques cliniques dans la conduite d'essais cliniques de médicaments à usage humain

Les textes 23 Loi de Santé publique 2004 - Loi n° 2004 -806 du 9 août 2004 Titre II: recherches biomédicales • Principes Généraux: 1 e chapitre – Définitions des recherches biomédicales – Conditions de réalisation des RBM (Protection des personnes fragiles, bénéfice / risque…) – Responsabilité du promoteur (financement, assurance, indemnisation, dépôts aux autorités…) – Conditions lieux de recherche

Les textes 24 Loi de Santé publique 2004 - Loi n° 2004 -806 du 9 août 2004 Chapitre II • Information de la personne qui se prête à une recherche biomédicale et recueil de son consentement – Importance du consentement – Contenu de la note d’information – Modalité de recueil du consentement (mineurs, situation d’urgence, majeur protégé, personnes privées de liberté par une décision judiciaire)

Les textes 25 Loi de Santé publique 2004 - Loi n° 2004 -806 du 9 août 2009 • Chapitre III : Comité de protection des personnes et autorité compétente • Chapitre V : Dispositions particulières à certaines recherches • chapitre VI : Dispositions pénales :

Les textes 26 Moyens d’application de ces lois Décret n° 2006 -477 du 26 avril 2006 relatif aux recherches biomédicales, pris en application de la loi de santé publique Arrêtés 2006 : ~ 27 avril 2006 : liste des informations transmises par l’ANSM à l’organisme gestionnaire de la base de données européenne ~ 19 mai 2006 : brochure investigateur ; rapport de sécurité ; modifications substantielles ; fin de recherche ; rapport final ~ 24 mai 2006 : dossier de demande d’autorisation de recherche biomédicale et d’avis du CPP ; protocole ; déclarations d’effets indésirables et de faits nouveaux à La loi de santé publique est entrée en vigueur le 27 août 2006

Les textes 27 Loi de Bioéthique - la loi n° 2011 -814 du 7 juillet 2011 (1994 - 2004 - 2011) TITRE Ier : EXAMEN DES CARACTÉRISTIQUES GÉNÉTIQUES À DES FINS MÉDICALES TITRE II : ORGANES ET CELLULES TITRE III : DIAGNOSTIC PRÉNATAL, DIAGNOSTIC PRÉIMPLANTATOIRE ET ÉCHOGRAPHIE OBSTÉTRICALE ET FŒTALE TITRE IV : INTERRUPTION DE GROSSESSE PRATIQUÉE POUR MOTIF MÉDICAL TITRE V : ANONYMAT DU DON DE GAMÈTES TITRE VI : ASSISTANCE MÉDICALE À LA PROCRÉATION TITRE VII : RECHERCHE SUR L'EMBRYON ET LES CELLULES SOUCHES EMBRYONNAIRES TITRE VIII : NEUROSCIENCES ET IMAGERIE CÉRÉBRALE TITRE IX : APPLICATION ET ÉVALUATION DE LA LOI RELATIVE À LA BIOÉTHIQUE formation ARC

Les textes 28 Article 39 du Titre VI « Lorsque la recherche biomédicale concerne le domaine de la maïeutique et répond aux conditions fixées au dernier alinéa de l'article L. 1121 -5, l'investigateur peut confier à une sage-femme ou à un médecin le soin de communiquer à la personne qui se prête à cette recherche les informations susvisées et de recueillir son consentement. « Lorsque la recherche biomédicale concerne le domaine de l'odontologie, l'investigateur peut confier à un chirurgien-dentiste ou à un médecin le soin de communiquer à la personne qui se prête à cette recherche les informations susvisées et de recueillir son consentement. » formation ARC

Les nouveaux textes 29 Article L 1121 -5 du CSP Les femmes enceintes, les parturientes et les mères qui allaitent ne peuvent être sollicitées pour se prêter à des recherches biomédicales que dans les conditions suivantes : - soit l'importance du bénéfice escompté pour elles-mêmes ou pour l'enfant est de nature à justifier le risque prévisible encouru ; - soit ces recherches se justifient au regard du bénéfice escompté pour d'autres femmes se trouvant dans la même situation ou pour leur enfant et à la condition que des recherches d'une efficacité comparable ne puissent être effectuées sur une autre catégorie de la population. Dans ce cas, les risques prévisibles et les contraintes que comporte la recherche doivent présenter un caractère minimal.

Les textes 30 Loi informatique et liberté : Loi 78 -17 du 6 janvier 1978 modifiée Chapitre IX - TRAITEMENTS DE DONNÉES À CARACTÈRE PERSONNEL AYANT POUR FIN LA RECHERCHE DANS LE DOMAINE DE LA SANTÉ Article 54 Pour chaque demande de mise en œuvre d'un traitement de données à caractère personnel, un comité consultatif sur le traitement de l'information en matière de recherche dans le domaine de la santé (CCTIRS), institué auprès du ministre chargé de la recherche et composé de personnes compétentes en matière de recherche dans le domaine de la santé, d'épidémiologie, de génétique et de biostatistique, émet un avis sur la méthodologie de la recherche au regard des dispositions de la présente loi, la nécessité du recours à des données à caractère personnel et la pertinence de celles-ci par rapport à l'objectif de la recherche, préalablement à la saisine de la Commission nationale de l'informatique et des libertés.

Article 54 (suite) • Le comité consultatif dispose d'un mois pour transmettre son avis au demandeur. A défaut, l'avis est réputé favorable. En cas d'urgence, ce délai peut être ramené à quinze jours. • La mise en œuvre du traitement de données est ensuite soumise à l'autorisation de la Commission nationale de l'informatique et des libertés, qui se prononce dans les conditions prévues à l'article 25.

Les textes 32 Pour les catégories les plus usuelles de traitements automatisés ayant pour finalité la recherche dans le domaine de la santé et portant sur des données ne permettant pas une identification directe des personnes concernées, la commission peut homologuer et publier des méthodologies de référence, établies en concertation avec le comité consultatif ainsi qu'avec les organismes publics et privés représentatifs, et destinées à simplifier la procédure prévue aux quatre premiers alinéas du présent article. Décision du 5 janvier 2006 portant homologation d'une méthodologie de référence pour les traitements de données personnelles opérés dans le cadre des recherches biomédicales (méthodologie de référence MR-001)

Les textes 33 Décision du 24 novembre 2006 fixant les règles de bonnes pratiques cliniques pour les recherches biomédicales portant sur le médicament Issue de la Directive 2005/28/CE du 8 avril 2005 Les BPC sont mentionnées à l’article L. 1121 -3 du CSP

En pratique - Typologie La Recherche Clinique 34 Recherche Clinique Données Loi Informatique et liberté 1978 révisée Etre Humain Loi de Santé Publique 2004 Produits biologiques issus du corps humain Loi de bioéthique 2011

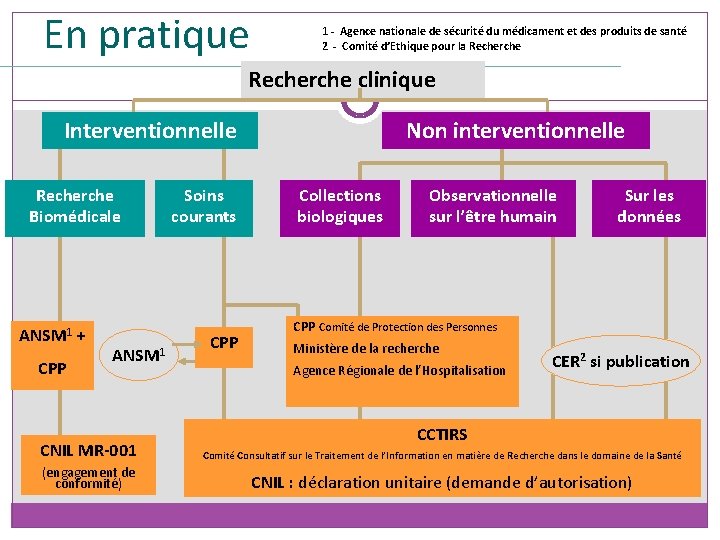
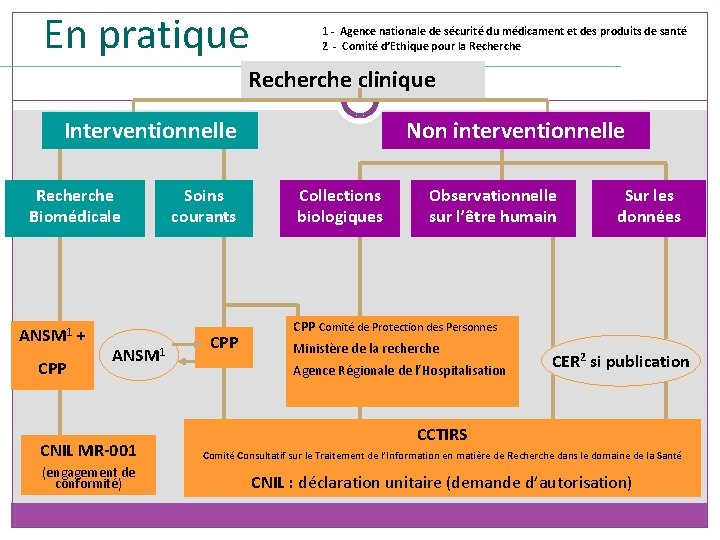
En pratique - Typologie 35 Recherche clinique Interventionnelle Non interventionnelle Essai non interventionnel : Etude dans le cadre duquel le ou les médicaments sont prescrits de manière habituelle conformément aux conditions fixées dans l’autorisation de mise sur le marché. L’affectation du patient à une stratégie thérapeutique donnée n’est pas fixée à l’avance par un protocole d’essai, elle relève de la pratique courante et la décision de prescrire le médicament est clairement dissociée de celle d’inclure le patient dans l’étude. Aucune procédure supplémentaire de diagnostic ou de surveillance ne doit être appliquée aux patients et des méthodes épidémiologiques sont utilisées pour analyser les données recueillies » (directive 2001/20/CE - Art. 2. c. )

En pratique - Typologie 36 Collections biologiques Recherche clinique Non interventionnelle Observationnelle sur l’être humain Sur les données Collections biologiques : réunion, à des fins scientifiques, de prélèvements biologiques effectués sur un groupe de personnes identifiées et sélectionnées en fonction des caractéristiques cliniques ou biologiques d’un ou plusieurs membres du groupe ainsi que des dérivés de ces prélèvements (loi n° 2004 -800 du 6 août 2004 relative à la bioéthique) Observationnelle : suivi de cohorte - traitements, investigations, consultations de suivi de la pratique courante Sur les données : aucune interférence avec le soin du malade

En pratique - Typologie Recherche clinique 37 Recherches Biomédicales (RBM) Recherches organisées et pratiquées sur l’être humain en vue du développement des connaissances Recherche Soins Biomédicale courants biologiques ou médicales (Art L. 1121 -1) Recherches visant à évaluer les soins courants : - Recherches autres que celles portant sur les médicaments, lorsque les actes sont pratiqués et les produits utilisés de manière habituelle mais que des modalités particulières de surveillance sont prévues par un protocole (Art L. 1121 -1 2°) - Recherche dont l’objectif est d’évaluer des actes, combinaisons d’actes ou stratégies médicales de prévention, de diagnostic ou de traitement qui sont dans la pratique courante (Art R 1121 -3) Interventionnelle

En pratique 1 - Agence nationale de sécurité du médicament et des produits de santé 2 - Comité d’Ethique pour la Recherche clinique Interventionnelle Recherche Biomédicale Non interventionnelle Soins courants Collections biologiques Si collection biologique ANSM 1 + CPP ANSM 1 CPP Observationnelle sur l’être humain Sur les données Changement de finalité Collections (direct sang) CPP Comité de Protection des Personnes Ministère de la recherche Agence Régionale de l’Hospitalisation CER 2 si publication CCTIRS CNIL MR-001 Comité Consultatif sur le Traitement de l’Information en matière de Recherche dans le domaine de la Santé (engagement de conformité) CNIL : déclaration unitaire (demande d’autorisation)

En pratique – Instances 39 Comité de Protection des Personnes (CPP) Rôle (art. L 1123 -7 du CSP) : aspect scientifique : il doit s'assurer de la pertinence générale des projets, de l'adéquation entre les objectifs poursuivis et les moyens mis en œuvre, ainsi que de la qualification du ou des investigateurs. Protocole Cahier d’observation CV investigateurs aspect protection des personnes et dimension éthique : il doit veiller à ce que le participant à la recherche reçoive une information adaptée sur les risques et bénéfices de la recherche, et doit veiller aux modalités de recueil du consentement. Notice d’information Formulaire de recueil du consentement

En pratique – Instances 40 Composition du CPP (art R 1123 -4 du CSP) : 14 membres - 4 personnes qualifiées en recherche clinique (médecins, compétence en biostatistique ou épidémologie) - 1 médecin généraliste - 1 pharmacien hospitalier - 1 infirmier - 1 personne qualifiée en raison de sa compétence en éthique - 1 psychologue - 1 travailleur social - 2 personnes qualifiées en raison de leur compétence juridique - 2 représentants des associations agréées de malades et d’usagers du système de santé

En pratique – Instances 41 Champ de compétences des CPP (art. R 1123 -21 du CSP) Le CPP rend un avis sur les : Projets initiaux de recherches biomédicales Projets de modifications substantielles Evaluations de soins courants Déclarations de collection d'échantillons biologiques Utilisations d'éléments et produits du corps humain à des fins scientifiques avec changement de finalité par rapport au consentement initial.

En pratique – Instances 42 Comité d’Ethique pour la Recherche - Comité d’Ethique d’établissement : CENEM - SRLF

En pratique – Instances 43 Autorité compétente (Art L 1123 -12 du CSP) ANSM: Agence Nationale de Sécurité du Médicament et des produits de sante Rôle : Qualité et sécurité des produits et techniques utilisées Sécurité des personnes au regard des actes pratiqués Modalités prévues pour le suivi des personnes L’AC émet une autorisation

En pratique – Instances 44 Comité Consultatif sur le Traitement de l’Information en matière de Recherche dans le domaine de la Santé (CCTIRS) CCTIRS émet un avis sur : la méthodologie la nécessité du recours à des données à caractère personnel La pertinence de ces données par rapport à l’objectif de l’étude Éclairer la CNIL

En pratique – Instances 45 Commission Nationale de l’Informatique et des Libertés (CNIL) Encadre la mise en œuvre des traitements de données à caractère personnel qu’ils soient automatisés ou manuels données à caractère personnel lorsqu’elles permettent d’identifier directement ou indirectement des personnes ( ex : nom, n°SS, n°tél…. . ) Notifie une autorisation

En pratique – Instances 46 CNIL Engagement de conformité à la méthodologie de référence MR- 001 : - Champ d’application : Traitement des données à caractères personnel contenues ou appelées à figurer dans des fichiers réalisés dans le cadre de RBM soumises aux dispositions des art L 1121 -1 et suivants du CSP. - Simplification des formalités dans le domaine de la recherche en adoptant une méthodologie de référence Déclaration normale Demande d’autorisation

En pratique 1 - Agence nationale de sécurité du médicament et des produits de santé 2 - Comité d’Ethique pour la Recherche clinique Interventionnelle Recherche Biomédicale Non interventionnelle Soins courants Collections biologiques Si collection biologique ANSM 1 + CPP ANSM 1 CPP Observationnelle sur l’être humain Sur les données Changement de finalité Collections (direct sang) CPP Comité de Protection des Personnes Ministère de la recherche Agence Régionale de l’Hospitalisation CER 2 si publication CCTIRS CNIL MR-001 Comité Consultatif sur le Traitement de l’Information en matière de Recherche dans le domaine de la Santé (engagement de conformité) CNIL : déclaration unitaire (demande d’autorisation)

En pratique – Acteurs 48 Les acteurs de la Recherche clinique Promoteur (RBM) Gestionnaire (Soins courants) Investigateur Personnes participantes

En pratique – Acteurs 49 Promoteur article L 1121 -1 CSP : « La personne physique ou la personne morale qui prend l’initiative d‘une recherche biomédicale sur l’être humain, qui assure la gestion et qui vérifie que son financement est prévu, est dénommée le promoteur »

En pratique – Acteurs 50 Promoteur Responsabilité légale (RBM) article L 1121 -10 CSP : Assure l’indemnisation des conséquences dommageables de la recherche biomédicale Doit souscrire une assurance garantissant sa responsabilité civile et celle de tout intervenant Promoteur = interlocuteur unique de la victime ou de ses ayants droit

En pratique – Acteurs 51 Promoteur Dispositions financières (RBM) article R 1121 -4 CSP : Prend en charge les frais supplémentaires liés à la recherche Fournit gratuitement les médicaments expérimentaux

En pratique – Acteurs 52 Gestionnaire article L 1121 -1 2° CSP • La personne physique ou la personne morale qui prend l’initiative de ces recherches en assure la gestion et vérifie que son financement est prévu.

En pratique – Acteurs 53 Gestionnaire • Le financement des soins est assuré par l’assurance maladie • Le financement de la recherche est à la charge de celui qui l’entreprend • la recherche ne devant comporter aucun risque supplémentaire l’assurance sera donc celle de l’établissement responsable des soins

En pratique – Acteurs 54 Investigateur article L 1121 -1 CSP : «La ou les personnes physiques qui dirigent et surveillent la réalisation de la recherche sur un lieu sont dénommées investigateurs » article L 1121 -3 CSP : Les recherches biomédicales ne peuvent être effectuées que si elles sont réalisées sous la direction et sous la surveillance d’un médecin justifiant d’une expérience appropriée

En pratique – Acteurs 55 Personnes participantes Consentement libre et éclairé Examen médical préalable (Art L. 1121 -11 du CSP) Toute recherche biomédicale sur une personne qui n’est pas affiliée à un régime de sécurité sociale ou bénéficiaire d’un tel régime est interdite (Art L. 1121 -11 du CSP)

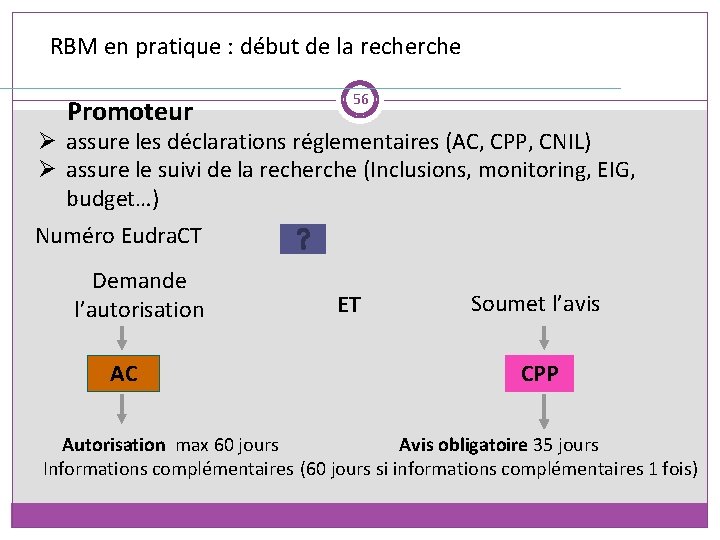
RBM en pratique : début de la recherche Promoteur 56 Ø assure les déclarations réglementaires (AC, CPP, CNIL) Ø assure le suivi de la recherche (Inclusions, monitoring, EIG, budget…) Numéro Eudra. CT Demande l’autorisation AC ET Soumet l’avis CPP Autorisation max 60 jours Avis obligatoire 35 jours Informations complémentaires (60 jours si informations complémentaires 1 fois)

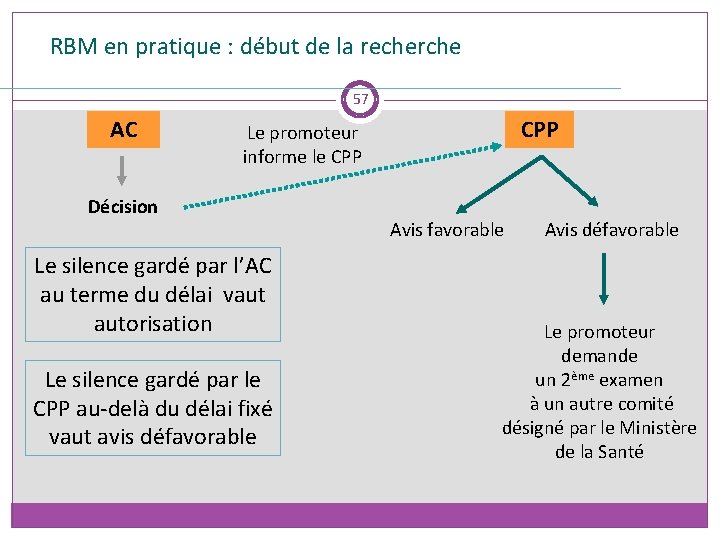
RBM en pratique : début de la recherche 57 AC CPP Le promoteur informe le CPP Décision Le silence gardé par l’AC au terme du délai vaut autorisation Le silence gardé par le CPP au-delà du délai fixé vaut avis défavorable Avis défavorable Le promoteur demande un 2ème examen à un autre comité désigné par le Ministère de la Santé

SC en pratique : début de la recherche 58 Gestionnaire Ø assure les déclarations réglementaires ( CPP, CNIL) Ø assure le suivi de la recherche (Inclusions, monitoring, EIG, budget…) Numéro ID-RCB Soumet l’avis CPP Le silence gardé par le CPP au-delà du délai fixé par art R 1123 -24 vaut avis défavorable (Art 5) Avis obligatoire 35 jours (60 jours si informations complémentaires)

En pratique : les délais 59 ANSM (art R 1123 -32) AC notifie au promoteur la date de réception du dossier ainsi que la date à laquelle, a défaut d’autorisation expresse, la recherche est réputée autorisée Délai instruction ne peut excéder 60 J L ’AC peut demander au promoteur des informations complémentaires et fixe un délai pour lui adresser le projet modifié ou les informations complémentaires. Ce délai ne suspens pas le délai dont dispose l’AC pour se prononcer sur sa demande La décision de l’AC est transmise pour information par le promoteur au CPP

En pratique : les délais 60 CPP (art R 1123 -24) Le CPP se prononce dans un délai de 30 J à compter de la date de réception notifiée au promoteur Le CPP peut formuler une seule demande d’informations complémentaires Le délai de réponse du CPP est alors porté à 60 J Ce délai est suspendu par la demande d’informations complémentaires jusqu’à réception des éléments demandés

En pratique : les délais 61 CCTIRS Le comité consultatif dispose d'un mois pour transmettre son avis au demandeur. A défaut, l'avis est réputé favorable. CNIL (art 25 de la loi informatique et liberté) La CNIL se prononce dans un délai de 2 mois à compter de la réception de la demande. Ce délai peut être renouvelé une fois. Lorsque la commission de s’est pas prononcée dans ces délais, la demande d’autorisation est réputée rejetée

62 1. 2. 3. 4. 5. Introduction Les textes La recherche clinique en pratique Les nouveaux textes Quizz

Les nouveaux textes 63 Loi n° 2012 -300 du 5 mars 2012 : Loi « Jardé » On ne parle plus de recherche biomédicale mais de recherche impliquant la personne humaine Un cadre unique plus harmonisé à toutes ces recherches impliquant la personne humaine Création de 3 catégories de recherches en fonction du risque et de la contrainte ajoutés par la recherche 1) Recherches interventionnelles (qui comportent des risques et des contraintes supérieurs aux risques et aux contraintes minimes) 2) Recherches interventionnelles qui comportent des risques et des contraintes minimes et ne portent pas sur des médicaments ( liste) 3) Recherches non interventionnelles

Les nouveaux textes 64 Un socle réglementaire commun pour toutes les catégories de recherche : o Promoteur (les 3 catégories) o Avis CPP ( les 3 catégories de recherche) o ANSM autorisation ( 1 e catégorie) ; copie avis CPP et résumé recherche (2 e et 3 e catégories) o CNIL (plus de CCTIRS pour 3 e catégorie)

Les nouvelles règles du consentement: Les nouveaux textes la gradation en fonction du risque 65 Catégorie 1 : Catégorie 2 : Recherches interventionnelles (à risques et contraintes qui comportent des risques et des contraintes minimes supérieurs aux risques et contraintes minimes) Catégorie 3 : Recherches non interventionnelles § Obligation d’information individuelle de la personne § Consentement Libre ; Eclairé ; Recueilli par écrit § Consentement Libre ; Eclairé ; Exprès (oral ou écrit) § Droit d’opposition

Les nouveaux textes 66 Le Règlement (UE) n° 536/2014 du Parlement Européen et du Conseil du 16 avril 2014 relatif aux essais cliniques de médicaments à usage humain et abrogeant la directive 2001/20/CE a été adopté par le Conseil de l’UE le 16 avril 2014. Il a été publié au journal officiel de l’Union Européenne le 27 mai 2014 Entrée en vigueur du règlement européen attendue pour l’année 2016.

Les nouveaux textes 67 Pour tout essai clinique devant être conduit dans au moins un Etat membre de l’Union européenne, un dossier de demande d’autorisation sera déposé par le promoteur sur un portail de l’Union européenne. Pour les essais menés dans plusieurs Etats membres, un dossier unique sera déposé et un Etat-membre rapporteur sera désigné

Les nouveaux textes 68 Les aspects éthiques du protocole seront évalués concomitamment au niveau de chaque Etat-membre concerné. Au final, une décision nationale unique d’autorisation sera prononcée par chaque Etat membre concerné.

Les nouveaux textes 69 Définitions : 1) «étude clinique» , toute investigation en rapport avec l'homme destinée: a) à mettre en évidence ou à vérifier les effets cliniques, pharmacologiques ou les autres effets pharmacodynamiques d'un ou de plusieurs médicaments; ou b) à identifier tout effet indésirable d'un ou de plusieurs médicaments; c) à étudier l'absorption, la distribution, le métabolisme et l'excrétion d'un ou de plusieurs médicaments; dans le but de s'assurer de la sécurité et/ou de l'efficacité de ces médicaments;

Les nouveaux textes 70 2) «essai clinique» , une étude clinique remplissant l'une des conditions suivantes: a) l'affectation du participant à une stratégie thérapeutique en particulier est fixée à l'avance et ne relève pas de la pratique clinique normale de l'État membre concerné; b) la décision de prescrire les médicaments expérimentaux est prise en même temps que la décision d'intégrer le participant à l'essai clinique; ou c) outre la pratique clinique normale, des procédures de diagnostic ou de surveillance s'appliquent aux participants;

Les nouveaux textes 71 3) «essai clinique à faible niveau d'intervention» : un essai clinique obéissant à l'ensemble des conditions suivantes: a) les médicaments expérimentaux, à l'exclusion des placebos, sont autorisés; b) selon le protocole de l'étude clinique: i) les médicaments expérimentaux sont utilisés conformément aux conditions de l'autorisation de mise sur le marché; ou ii) l'utilisation des médicaments expérimentaux est fondée sur des données probantes et étayée par des publications scientifiques concernant la sécurité et l'efficacité de ces médicaments expérimentaux dans l'un des États membres concernés; et c) les procédures supplémentaires de diagnostic ou de surveillance impliquent au plus un risque ou une contrainte supplémentaire minimale pour la sécurité des participants par rapport à la pratique clinique normale dans tout État membre concerné;

Les nouveaux textes 72 4) «étude non interventionnelle» , une étude clinique autre qu'un essai clinique; (Le règlement ne s'applique pas aux études non interventionnelles).

Plan 1. 2. 3. 4. Introduction Les Textes La recherche clinique en pratique Quizz

74 Plan 1. 2. 3. 4. Introduction Les Textes La recherche clinique en pratique Quizz

Tester vos connaissances - Réglementaire 75 1. Parmi les textes suivants, lesquels sont en vigueur en France actuellement ? 1. 2. 3. 4. 5. Loi de bioéthique (2004) Loi Huriet Sérusclat (1988) Déclaration d’Helsinki (2008) Loi de Santé Publique (2004) Code de Nuremberg (1947)

Tester vos connaissances - Réglementaire 76 1. Parmi les textes suivants, lesquels sont en vigueur en France actuellement ? 1. 2. 3. 4. 5. Loi de bioéthique (2004) Loi Huriet Sérusclat (1988) Déclaration d’Helsinki (2008) Loi de Santé Publique (2004) Code de Nuremberg (1947)

Tester vos connaissances - Réglementaire 77 2. Quel texte définit les BPC en France? 1. Directive Européenne (2001) 2. Loi de Santé Publique (2004) 3. Décision du 24 novembre 2006

Tester vos connaissances - Réglementaire 78 2. Quel texte définit les BPC en France? 1. Directive Européenne (2001) 2. Loi de Santé Publique (2004) 3. Décision du 24 novembre 2006

Tester vos connaissances - Réglementaire 79 3. Quel est l’objectif principal des lois en matière de recherche clinique ?

Tester vos connaissances - Réglementaire 80 3. Quel est l’objectif principal des lois en matière de recherche clinique ? Protection des personnes

Tester vos connaissances - Réglementaire 81 4. La date de début d’une recherche biomédicale correspond à la date mentionnée dans les dossiers soumis au CPP et à l’autorité compétente 1. Vrai 2. Faux

Tester vos connaissances - Réglementaire 82 4. La date de début d’une recherche biomédicale correspond à la date mentionnée dans les dossiers soumis au CPP et à l’autorité compétente 1. Vrai 2. Faux « Date effective de commencement de la recherche correspond à la date de la signature du consentement par la première personne qui se prête à la recherche en France » (article R 1123 -34 CSP)

Tester vos connaissances - Réglementaire 83 5. Quel est le délai de validité des autorisations CPP et ANSM avant la première inclusion ? 1. 1 an 2. 5 ans 3. 10 ans

Tester vos connaissances - Réglementaire 84 5. Quel est le délai de validité des autorisations CPP et ANSM avant la première inclusion ? 1. 1 an 2. 5 ans 3. 10 ans Si, dans le délai d’un an suivant l’avis du comité de protection des personnes / l’autorisation de la recherche, la recherche biomédicale n’a pas débutée, cet avis / cette autorisation devient caduc/que (article R 1123 -28 et R 1123 -33 CSP)

Tester vos connaissances - Typologie 85 1. Un essai comparant deux techniques courantes de diagnostic avec randomisation peut-il relever du soin courant ? 1. Oui 2. Non

Tester vos connaissances - Typologie 86 1. Un essai comparant deux techniques courantes de diagnostic avec randomisation peut-il relever du soin courant ? 1. Oui 2. Non

Tester vos connaissances - Typologie 87 2. Quelle est la définition d’une recherche biomédicale ? 1. Recherche organisées et pratiquées sur l’être humain en vue de développer des connaissances biologiques ou médicales 2. Recherches dans lesquelles tous les actes sont pratiqués et les produits utilisés de manière habituelle, sans aucune procédure supplémentaires ou inhabituelles de diagnostic ou de surveillance 3. La recherche portant sur l’ensemble des êtres vivants afin d’améliorer les connaissances médicales et biologiques

Tester vos connaissances - Typologie 88 2. Quelle est la définition d’une recherche biomédicale ? 1. Recherche organisées et pratiquées sur l’être humain en vue de développer des connaissances biologiques ou médicales 2. Recherches dans lesquelles tous les actes sont pratiqués et les produits utilisés de manière habituelle, sans aucune procédure supplémentaires ou inhabituelles de diagnostic ou de surveillance 3. La recherche portant sur l’ensemble des êtres vivants afin d’améliorer les connaissances médicales et biologiques

Tester vos connaissances - Typologie 89 3. Parmi les 5 types de recherche clinique, pourriez-vous en citer 3 ?

Tester vos connaissances - Typologie 90 3. Parmi les 5 types de recherche clinique, pourriez-vous en citer 3 ? 1. 2. 3. 4. 5. Recherche biomédicale (RBM) Soin courant Recherche sur données Recherche observationnelle (cohorte) Collections biologiques

Tester vos connaissances - Acteurs 91 1. Quelles responsabilités incombent au promoteur d’une RBM ? 1. Souscrire une assurance 2. Informer le patient 3. Prendre en charge le financement supplémentaire 4. Recueillir le Consentement

Tester vos connaissances - Acteurs 92 1. Quelles responsabilités incombent au promoteur d’une RBM ? 1. Souscrire une assurance 2. Informer le patient 3. Prendre en charge le financement supplémentaire 4. Recueillir le consentement

Tester vos connaissances - Acteurs 93 2. Qui déclare une RBM aux autorités ? 1. L’investigateur 2. Le promoteur

Tester vos connaissances - Acteurs 94 2. Qui déclare une RBM aux autorités ? 1. L’investigateur 2. Le promoteur

Tester vos connaissances - Acteurs 95 3. Qui est responsable du bon déroulement d’une recherche sur un lieu donné ? 1. L’investigateur 2. Le promoteur

Tester vos connaissances - Acteurs 96 3. Qui est responsable du bon déroulement d’une recherche sur un lieu donné ? 1. L’investigateur 2. Le promoteur

97 Liens utiles

• DIRC Ile de France : http: //www. drrc. ap-hop-paris. fr 98 • Agence Nationale de Sécurité et du Médicament et des produits de santé : www. afssaps. sante. fr • Dispositions législatives et réglementaires françaises : www. legifrance. gouv. fr • Site du ministère de la santé : www. sante. gouv. fr • Site sur la recherche biomédicale : www. recherche-biomedicale. sante. gouv. fr • European Medicine Agency (EMEA): www. emea. eu. int • Règles gouvernant les produits pharmaceutiques dans l’union européenne : http: //ec. europa. eu/enterprise/pharmaceuticals/eudralex/index. htm • Unité de Recherche Clinique Paris Centre Descartes : http: //www. recherchecliniquepariscentre. fr DU INF TEC 16/11/2012

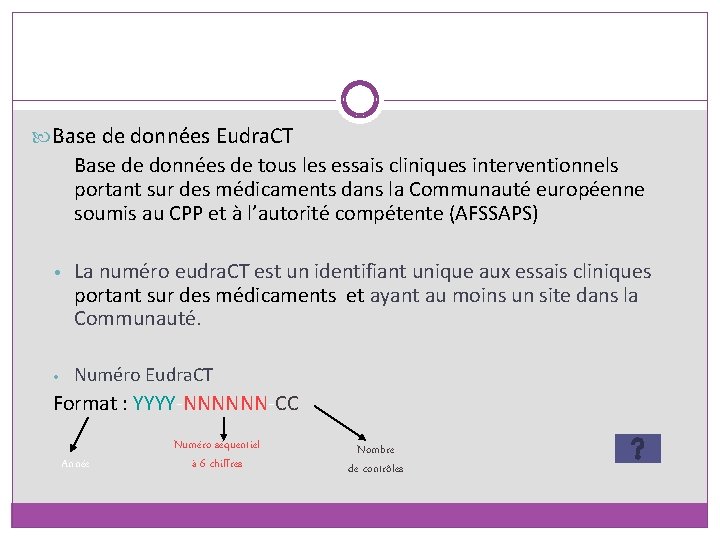
Base de données Eudra. CT Base de données de tous les essais cliniques interventionnels portant sur des médicaments dans la Communauté européenne soumis au CPP et à l’autorité compétente (AFSSAPS) • La numéro eudra. CT est un identifiant unique aux essais cliniques portant sur des médicaments et ayant au moins un site dans la Communauté. • Numéro Eudra. CT Format : YYYY-NNNNNN-CC Année Numéro séquentiel à 6 chiffres Nombre de contrôles

Numéro ID-RCB ou encore numéro d’enregistrement national est numéro d’identification unique. Il est attribué à tout protocole de recherche en soins courants et à tout projet d’utilisation des éléments et produits du corps humain (collections). Le numéro ID-RCB est ainsi obtenu automatiquement, en suivant la procédure indiquée sur le site Internet de l'ANSM à la rubrique « Essais cliniques ne portant pas sur des produits de santé