Reaktioners hastighet Kemister frgar sig ofta hur kemiska









![© v = k x [H 2] x [I 2] © Eftersom reaktionshastigheten också © v = k x [H 2] x [I 2] © Eftersom reaktionshastigheten också](https://slidetodoc.com/presentation_image_h/e4f512919bbaf8c0c6fd8a0af4c18cbd/image-12.jpg)

![©Ökar vi också koncentrationen av [I 2] till det bubbla, kommer reaktionshastigheten bli fyra ©Ökar vi också koncentrationen av [I 2] till det bubbla, kommer reaktionshastigheten bli fyra](https://slidetodoc.com/presentation_image_h/e4f512919bbaf8c0c6fd8a0af4c18cbd/image-14.jpg)




- Slides: 19

Reaktioners hastighet Kemister frågar sig ofta hur kemiska reaktioner kan påskyndas. Detta är betydelsefullt t. ex. för att göra en kemisk tillverkningsprocess lönsam

© I en kompost försöker vi skapa så goda förutsättningar som möjligt för att mikroorganismer ska trivas. Genom kemiska reaktioner i deras celler återanvänds avfallet och blir näringsrik jord som kan ge liv åt nya växtgenerationer. Avfall som bara innehåller organiska föreningar som blad, gräs och potatisskal bryts ner fort medan t. ex. benbitar med mycket oorganiskt innehåll kräver längre tid eftersom mikroorganismerna inte har så stort behov av dessa ämnen.

Fundera på. . . ©Varför går nedbrytningen trögt på vintern och snabbt på sommaren? Och varför går komposteringen snabbare om materialet är finfördelat?

©För att en reaktion ska kunna ske mellan två ämnen, krävs framför allt en sak… Vad?

Reaktionshastigheten beror av flera faktorer ©De i reaktionen ingående ämnenas natur ©Temperaturen ©Ämnenas koncentration ©Ämnenas kontaktytor mot varandra, alltså partikelstorleken ©Närvaro/frånvaro av katalysator ©Närvaro/frånvaro av inhibitor

Kollisioner krävs ©För att ämnen skall kunna reagera med varandra måste de träffas. ©Men det räcker inte med att ”bara ”träffas”, de måste träffas på rätt sätt och med tillräckligt hög energi

Rätt sätt att träffas ©http: //www 4. liber. se/gymnasiekemib/02. h tml

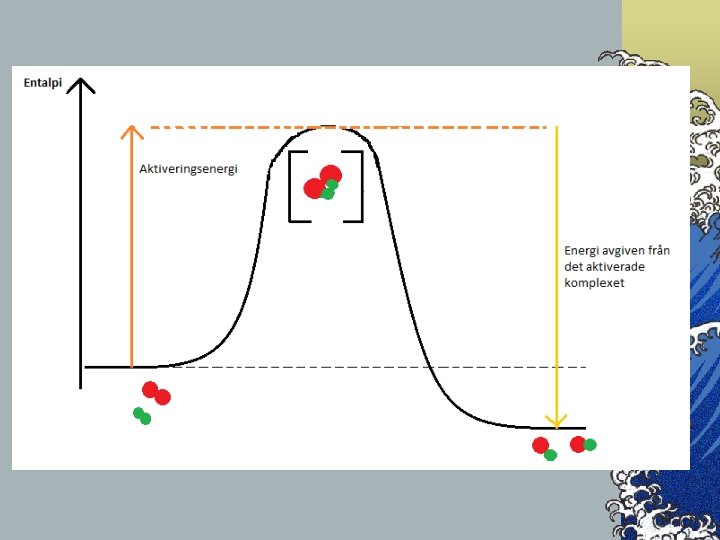
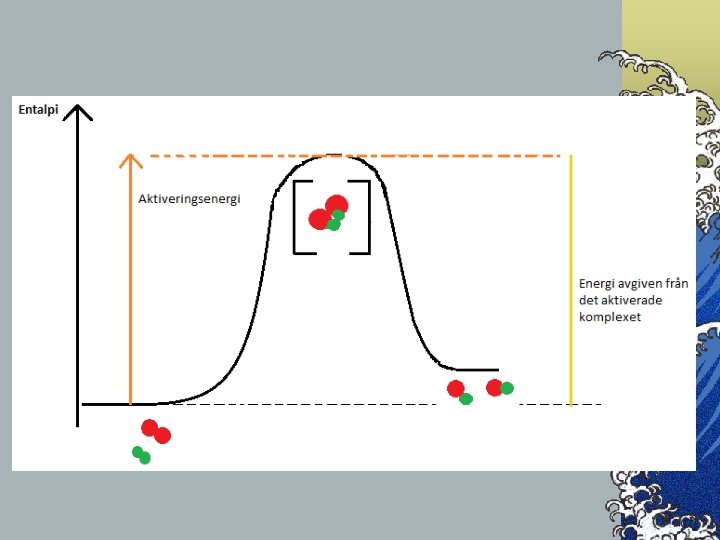
Med tillräckligt mycket energi © Vid en viss temperatur känner vi partiklarna i en gas medelhastighet. Vi känner inte hastigheten hos varje partikel, men då vi kan mäta medelhastigheten inser vi att vissa partiklar rör sig långsammare och andra snabbare. © När nya ämnen ska bildas måste bindningar omstruktureras. Gamla bindningar måste brytas, vilka kosta energi, innan nya kan skapas och avge energi. © För att bindningar ska brytas krävs en minsta energi, alltså även en minsta hastighet. © När partiklarna krockar omvandlas den kinetiska energin till elektronenergi och ett aktiverat komplex bildas. Aktiverade komplex brukar visas med en klammer [ ] © Den energi som krävs för att skapa det aktiva komplexet, utöver medelenergin, kallas aktiveringsenergi. © I det aktiverade komplexet bryts bindningar, då åtgår energi, och när nya skapas avges energi. Detta gör att det aktiverade komplexets energi alltid är högre än reaktanternas och produkternas.



Vi såg att reaktionshastigheten är beroende av flera faktorer © Reaktionshastigheten är proportionell mot koncentrationen av reaktanterna. I fallet nedan både [H 2] och [I 2] H 2(g) + I 2(g) 2 HI(g) Reaktionshastigheten, v, är alltså…
![v k x H 2 x I 2 Eftersom reaktionshastigheten också © v = k x [H 2] x [I 2] © Eftersom reaktionshastigheten också](https://slidetodoc.com/presentation_image_h/e4f512919bbaf8c0c6fd8a0af4c18cbd/image-12.jpg)
© v = k x [H 2] x [I 2] © Eftersom reaktionshastigheten också är beroende av ämnenas karaktär, temperatur osv, gäller konstanten bara för de här ämnena vid den aktuella temperaturen © Konstanten innehåller bland annat faktorer som anger hur många partiklar som har tillräckligt hög energi, som krockar på lämpligt sätt osv.

Generalisera… © För att ange en formel som gäller för alla ämnen, betecknar vi [H 2]med a och [I 2] med b. ©V=kxaxb © Om vi sedan ändrar koncentrationen för a till 2 a, blir den nya reaktionshastigheten © v 2 = k x 2 a x b, eller © v 2 = 2 x k x a x b © Eftersom k x a x b = hastigheten innan koncentrationsökningen, kan vi sätta v 2 = 2 x v © Alltså, dubblar vi koncentrationen för en av reaktanterna, ökar reaktionshastigheten till det dubbla.
![Ökar vi också koncentrationen av I 2 till det bubbla kommer reaktionshastigheten bli fyra ©Ökar vi också koncentrationen av [I 2] till det bubbla, kommer reaktionshastigheten bli fyra](https://slidetodoc.com/presentation_image_h/e4f512919bbaf8c0c6fd8a0af4c18cbd/image-14.jpg)
©Ökar vi också koncentrationen av [I 2] till det bubbla, kommer reaktionshastigheten bli fyra gånger så hög som reaktionshastigheten från början osv. ©Reaktionshastigheten ökar med koncentrationen för att antalet krockar mellan partiklarna ökar.

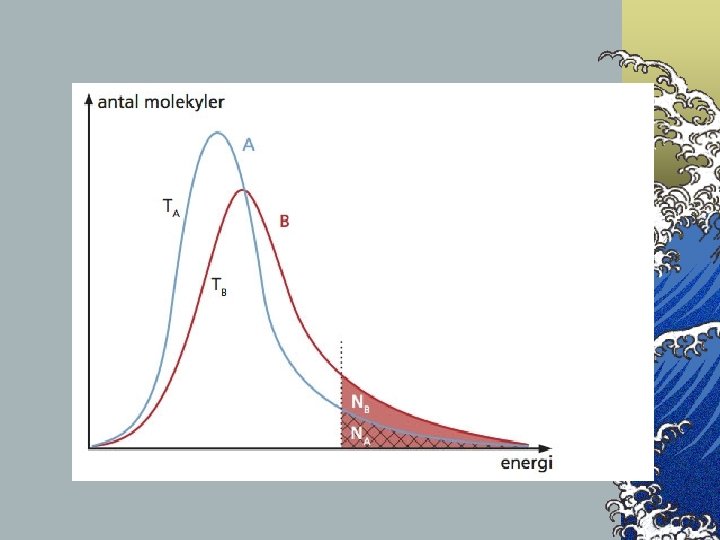
Om temperaturen ökar… ©Ökar inte reaktionshastigheten proportionellt mot temperaturökningen. ©Reaktionshastigheten ökar mycket kraftigt med stigande temperatur. Detta beror på att fler partiklar får så hög rörelseenergi att de vid krock kan bilda det aktiverade komplexet.


Reaktionsmekanismer ©En reaktionsformel talar om vilka start och slutprodukter som deltar i en reaktion, men inte reaktionsvägen. ©Ibland är reaktionsvägen just så enkel som formeln visar, som i reaktionen mellan vätgas och jodgas, men långt ifrån alltid!

© När vätgas reagerar med klorgas är reaktionsvägen mer komplicerad. © I klorgas finns ett bindande elektronpar. När en klorgasmolekyl tagit upp mycket energi (från ex en ljusvärmekälla) spjälkas molekylen i atomer, med varsin oparad elektron. © Partiklar, atomer och molekyler med oparade elektroner är mycket reaktiva och kallas för radikaler. (Hos radikaler visas bara de oparade elektronerna) © Kloratomen (radikalen) reagerar vidare med en vätgasmolekyl, H 2 + Cl· HCl + H· © Detta upprepas i en kedja och kallas därför kedjereaktion. Den fortgår tills två radikaler reagerar med varandra.

Katalysatorer ©Reagerar inte själv men öppnar en ny och snabbar reaktionsväg, som ofta kräver en lägre aktiveringsenergi (se utblick 2. 1)