Reakcje zwizkw organicznych wielofunkcyjnych Hydroksykwasy Ketonokwasy Aminokwasy Peptydy

- Slides: 7

Reakcje związków organicznych wielofunkcyjnych Hydroksykwasy Ketonokwasy Aminokwasy Peptydy i białka

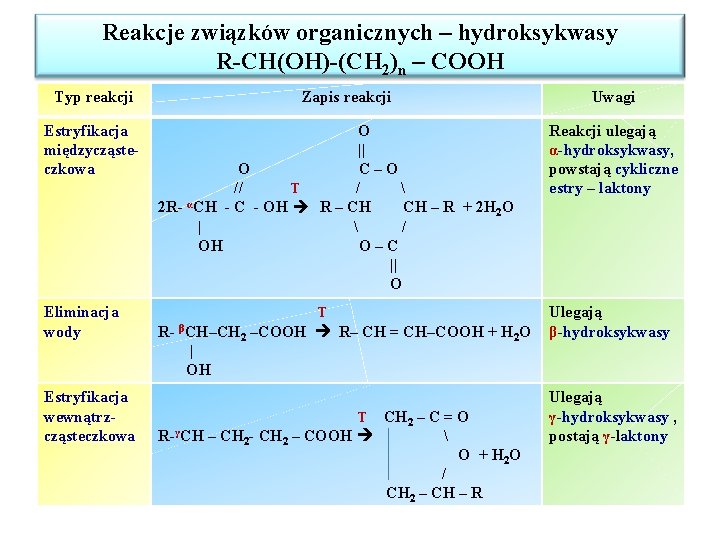
Reakcje związków organicznych – hydroksykwasy R-CH(OH)-(CH 2)n – COOH Typ reakcji Estryfikacja międzycząsteczkowa Eliminacja wody Zapis reakcji O || O C–O // T / α 2 R- CH - C - OH R – CH CH – R + 2 H 2 O | / OH O–C || O T R- βCH–CH | OH Estryfikacja wewnątrzcząsteczkowa 2 –COOH R– CH = CH–COOH + H 2 O CH 2 – C = O R-γCH – CH 2 - CH 2 – COOH O + H 2 O / CH 2 – CH – R T Uwagi Reakcji ulegają α-hydroksykwasy, powstają cykliczne estry – laktony Ulegają β-hydroksykwasy Ulegają γ-hydroksykwasy , postają γ-laktony

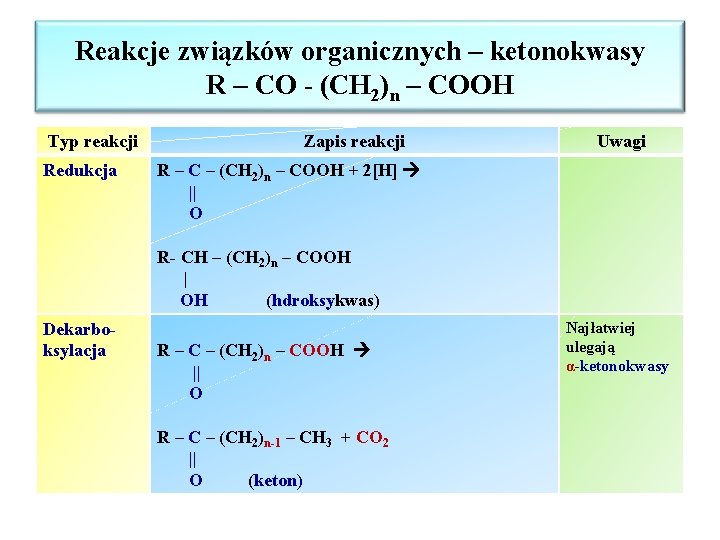
Reakcje związków organicznych – ketonokwasy R – CO - (CH 2)n – COOH Typ reakcji Redukcja Zapis reakcji Uwagi R – C – (CH 2)n – COOH + 2[H] || O R- CH – (CH 2)n – COOH | OH (hdroksykwas) Dekarboksylacja R – C – (CH 2)n – COOH || O R – C – (CH 2)n-1 – CH 3 + CO 2 || O (keton) Najłatwiej ulegają α-ketonokwasy

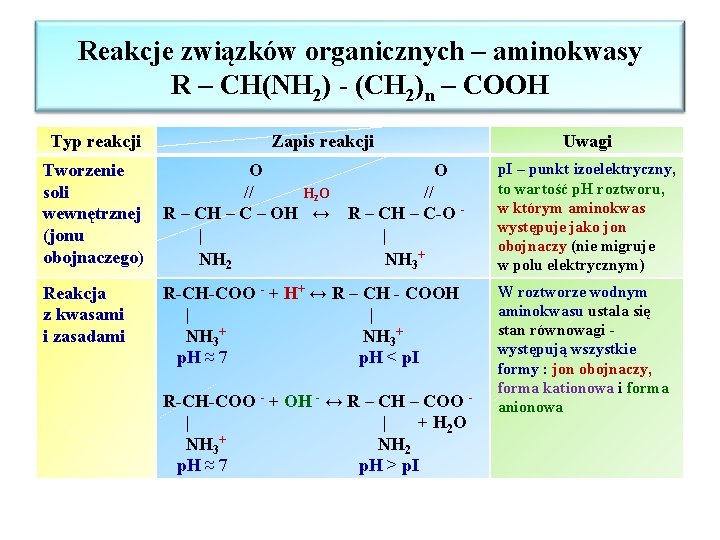
Reakcje związków organicznych – aminokwasy R – CH(NH 2) - (CH 2)n – COOH Typ reakcji Zapis reakcji Uwagi Tworzenie soli wewnętrznej (jonu obojnaczego) O O // H 2 O // R – CH – C – OH ↔ R – CH – C-O | | NH 2 NH 3+ p. I – punkt izoelektryczny, to wartość p. H roztworu, w którym aminokwas występuje jako jon obojnaczy (nie migruje w polu elektrycznym) Reakcja z kwasami i zasadami R-CH-COO - + H+ ↔ R – CH - COOH | | NH 3+ p. H ≈ 7 p. H < p. I W roztworze wodnym aminokwasu ustala się stan równowagi występują wszystkie formy : jon obojnaczy, forma kationowa i forma anionowa R-CH-COO - + OH - ↔ R – CH – COO | | + H 2 O NH 3+ NH 2 p. H ≈ 7 p. H > p. I

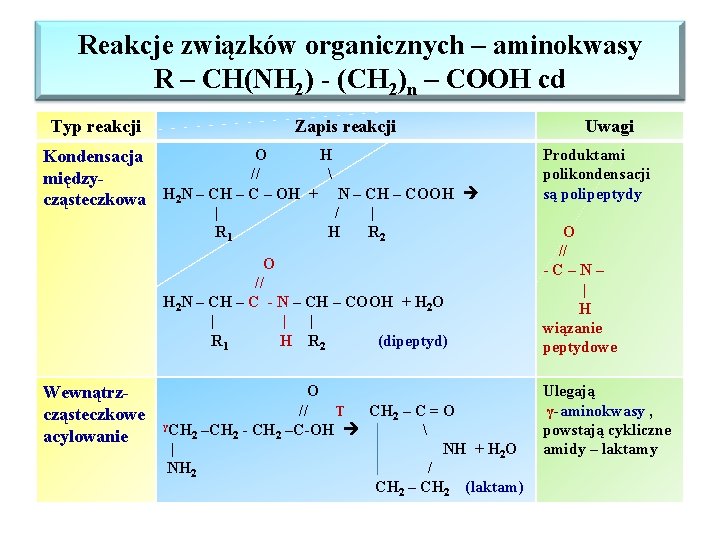
Reakcje związków organicznych – aminokwasy R – CH(NH 2) - (CH 2)n – COOH cd Typ reakcji Zapis reakcji O H Kondensacja // międzycząsteczkowa H 2 N – CH – C – OH + N – CH – COOH | R 1 / H | R 2 O // H 2 N – CH – C - N – CH – COOH + H 2 O | | | R 1 H R 2 (dipeptyd) Wewnątrzcząsteczkowe acylowanie O // T CH 2 – C = O γCH –CH - CH –C-OH 2 2 2 | NH + H 2 O NH 2 / CH 2 – CH 2 (laktam) Uwagi Produktami polikondensacji są polipeptydy O // -C–N– | H wiązanie peptydowe Ulegają γ-aminokwasy , powstają cykliczne amidy – laktamy

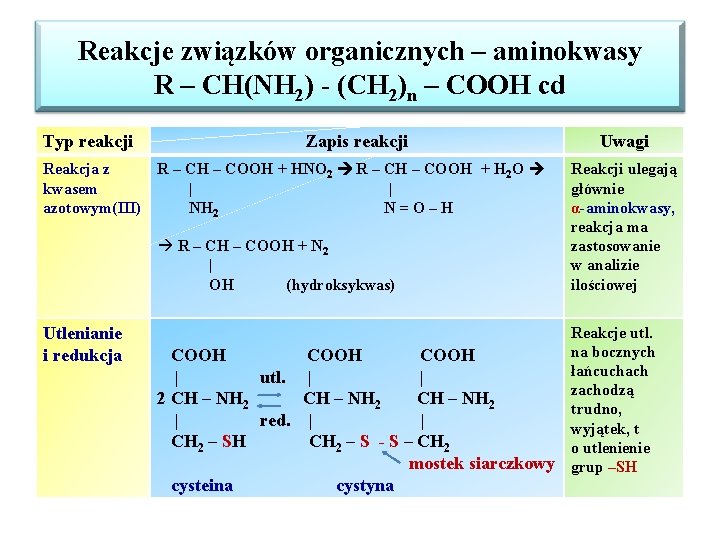
Reakcje związków organicznych – aminokwasy R – CH(NH 2) - (CH 2)n – COOH cd Typ reakcji Zapis reakcji Reakcja z R – CH – COOH + HNO 2 R – CH – COOH + H 2 O kwasem | | azotowym(III) NH 2 N=O–H à R – CH – COOH + N 2 | OH (hydroksykwas) Utlenianie i redukcja COOH | utl. | | 2 CH – NH 2 | red. | | CH 2 – SH CH 2 – S - S – CH 2 mostek siarczkowy cysteina cystyna Uwagi Reakcji ulegają głównie α-aminokwasy, reakcja ma zastosowanie w analizie ilościowej Reakcje utl. na bocznych łańcuchach zachodzą trudno, wyjątek, t o utlenienie grup –SH

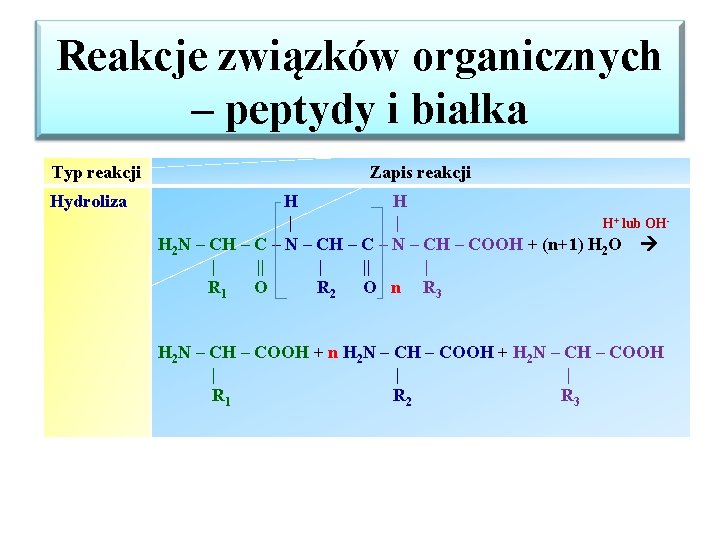
Reakcje związków organicznych – peptydy i białka Typ reakcji Hydroliza Zapis reakcji H H | | H+ lub OHH 2 N – CH – C – N – CH – COOH + (n+1) H 2 O | || | R 1 O R 2 O n R 3 H 2 N – CH – COOH + n H 2 N – CH – COOH + H 2 N – CH – COOH | | | R 1 R 2 R 3