Reakcje zwizkw organicznych Aldehydy Ketony Kwasy karboksylowe Reakcje

Reakcje związków organicznych Aldehydy Ketony Kwasy karboksylowe
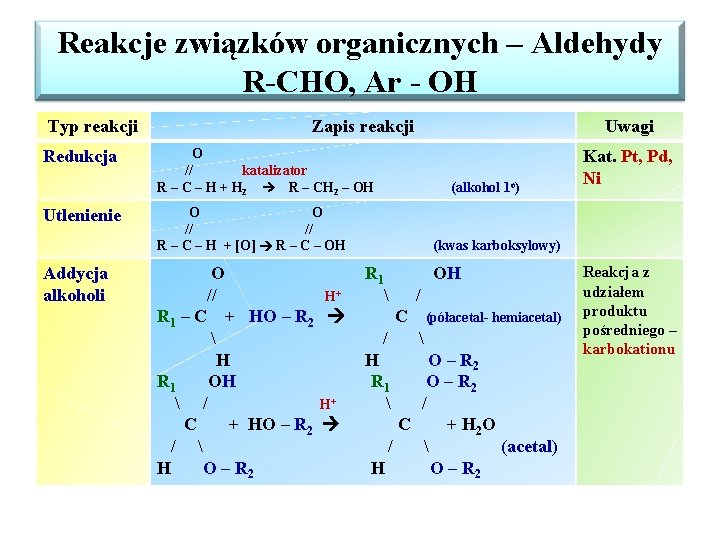
Reakcje związków organicznych – Aldehydy R-CHO, Ar - OH Typ reakcji Redukcja Utlenienie Addycja alkoholi Zapis reakcji Uwagi O // katalizator R – C – H + H 2 R – CH 2 – OH (alkohol 1 o) O O // // R – C – H + [O] R – C – OH O // H+ R 1 – C + HO – R 2 H R 1 OH / H+ C + HO – R 2 / H O – R 2 Kat. Pt, Pd, Ni (kwas karboksylowy) R 1 OH / C / H R 1 (półacetal- hemiacetal) O – R 2 / C + H 2 O / (acetal) H O – R 2 Reakcja z udziałem produktu pośredniego – karbokationu
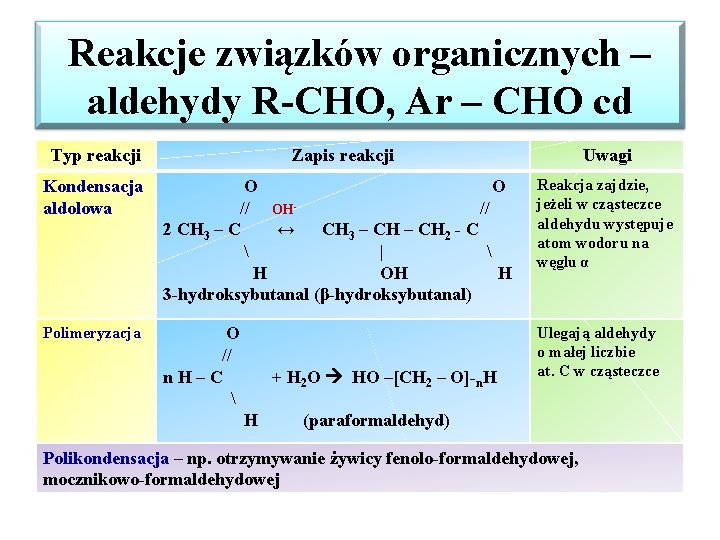
Reakcje związków organicznych – aldehydy R-CHO, Ar – CHO cd Typ reakcji Zapis reakcji Uwagi Kondensacja aldolowa O O // OH// 2 CH 3 – C ↔ CH 3 – CH 2 - C | H OH H 3 -hydroksybutanal (β-hydroksybutanal) Reakcja zajdzie, jeżeli w cząsteczce aldehydu występuje atom wodoru na węglu α Polimeryzacja O // n. H–C Ulegają aldehydy o małej liczbie at. C w cząsteczce + H 2 O HO –[CH 2 – O]-n. H H (paraformaldehyd) Polikondensacja – np. otrzymywanie żywicy fenolo-formaldehydowej, mocznikowo-formaldehydowej
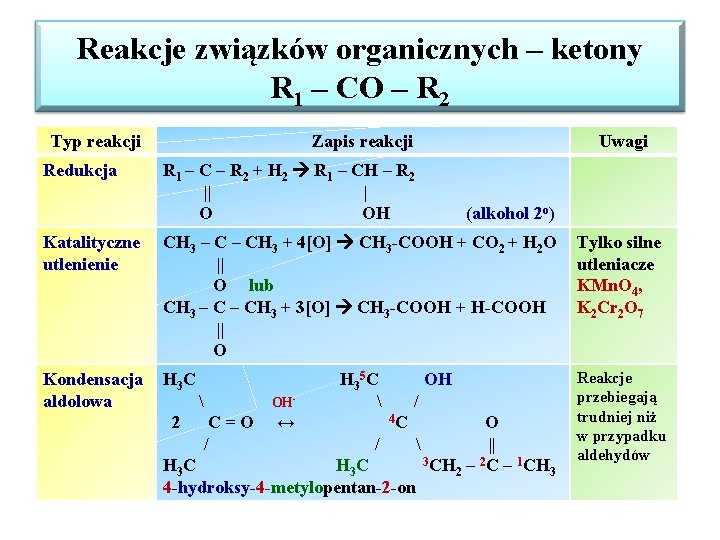
Reakcje związków organicznych – ketony R 1 – CO – R 2 Typ reakcji Redukcja Zapis reakcji Uwagi R 1 – C – R 2 + H 2 R 1 – CH – R 2 || | O OH (alkohol 2 o) Katalityczne utlenienie CH 3 – CH 3 + 4[O] CH 3 -COOH + CO 2 + H 2 O || O lub CH 3 – CH 3 + 3[O] CH 3 -COOH + H-COOH || O Tylko silne utleniacze KMn. O 4, K 2 Cr 2 O 7 Kondensacja aldolowa H 3 C Reakcje przebiegają trudniej niż w przypadku aldehydów 2 C=O / OH- ↔ H 3 5 C OH / 4 C O / || 3 CH – 2 C – 1 CH H 3 C 2 3 4 -hydroksy-4 -metylopentan-2 -on
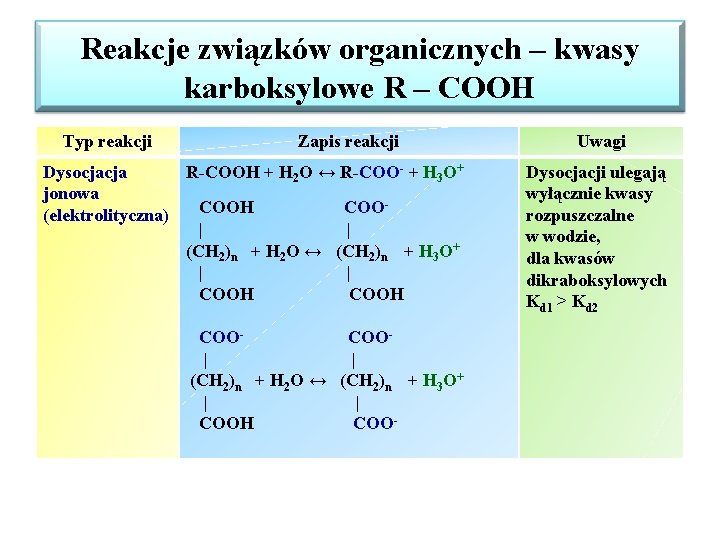
Reakcje związków organicznych – kwasy karboksylowe R – COOH Typ reakcji Zapis reakcji Dysocjacja R-COOH + H 2 O ↔ R-COO- + H 3 O+ jonowa COOH COO(elektrolityczna) | | (CH 2)n + H 2 O ↔ (CH 2)n + H 3 O+ | | COOH COOCOO| | (CH 2)n + H 2 O ↔ (CH 2)n + H 3 O+ | | COOH COO- Uwagi Dysocjacji ulegają wyłącznie kwasy rozpuszczalne w wodzie, dla kwasów dikraboksylowych Kd 1 > Kd 2
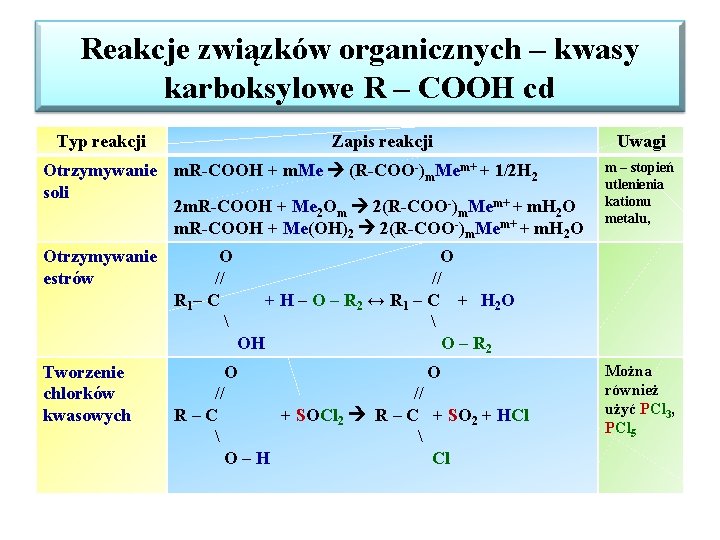
Reakcje związków organicznych – kwasy karboksylowe R – COOH cd Typ reakcji Zapis reakcji Otrzymywanie m. R-COOH + m. Me (R-COO-)m. Mem+ + 1/2 H 2 soli 2 m. R-COOH + Me 2 Om 2(R-COO-)m. Mem+ + m. H 2 O m. R-COOH + Me(OH)2 2(R-COO-)m. Mem+ + m. H 2 O Otrzymywanie estrów O // R 1 – C Tworzenie chlorków kwasowych O O // // R–C + SOCl 2 R – C + SO 2 + HCl O–H Cl Uwagi m – stopień utlenienia kationu metalu, O // + H – O – R 2 ↔ R 1 – C + H 2 O OH O – R 2 Można również użyć PCl 3, PCl 5
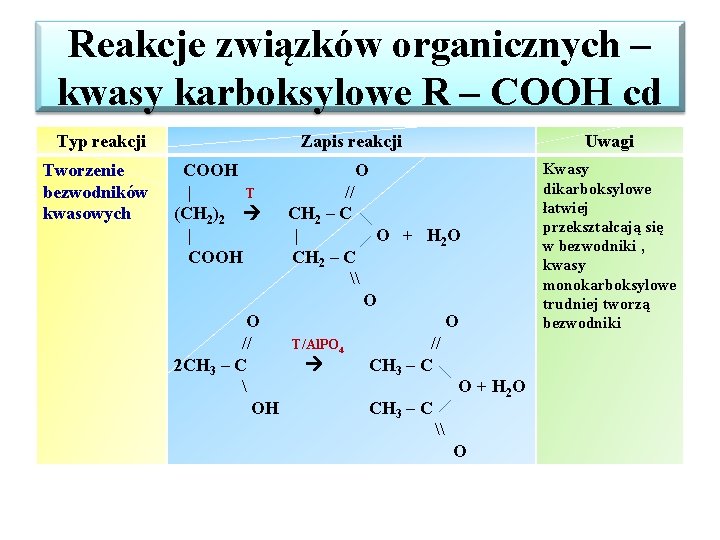
Reakcje związków organicznych – kwasy karboksylowe R – COOH cd Typ reakcji Tworzenie bezwodników kwasowych Zapis reakcji COOH | T (CH 2)2 | COOH O // CH 2 – C | O + H 2 O CH 2 – C \ O O O // T/Al. PO 4 // 2 CH 3 – C O + H 2 O OH CH 3 – C \ O Uwagi Kwasy dikarboksylowe łatwiej przekształcają się w bezwodniki , kwasy monokarboksylowe trudniej tworzą bezwodniki
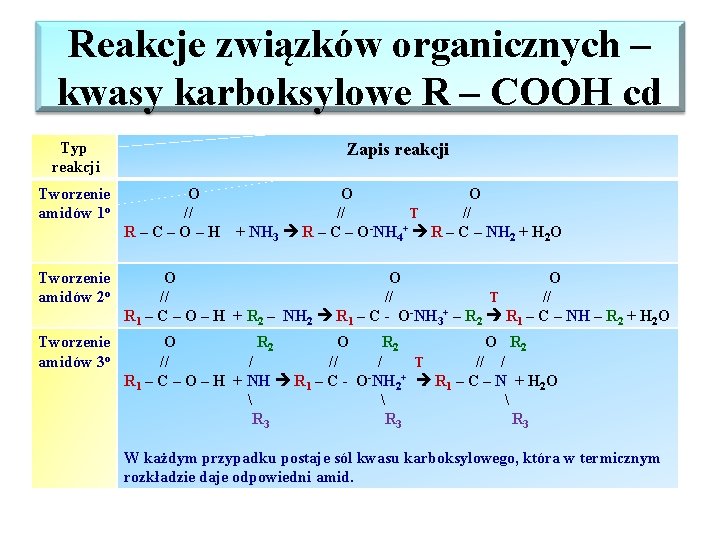
Reakcje związków organicznych – kwasy karboksylowe R – COOH cd Typ reakcji Zapis reakcji Tworzenie amidów 1 o O // R–C–O–H O O // T // + NH 3 R – C – O-NH 4+ R – C – NH 2 + H 2 O Tworzenie amidów 2 o O O O // // T // R 1 – C – O – H + R 2 – NH 2 R 1 – C - O-NH 3+ – R 2 R 1 – C – NH – R 2 + H 2 O Tworzenie amidów 3 o O R 2 // / T // / R 1 – C – O – H + NH R 1 – C - O-NH 2+ R 1 – C – N + H 2 O R 3 R 3 W każdym przypadku postaje sól kwasu karboksylowego, która w termicznym rozkładzie daje odpowiedni amid.
- Slides: 8