Reakcje w chemii organicznej mechanizmy reakcji v v

















- Slides: 32

Reakcje w chemii organicznej – mechanizmy reakcji v Ø Ø Ø v Ø Ø Czynniki reakcji w chemii organicznej: Czynniki elektrofilowe / elektrofil Czynniki nukleofilowe / nukleofil Rodnik / wolny rodnik Reakcja substytucji / substytucja / podstawianie / reakc. . . Substytucja rodnikowa / wolnorodnikowa – reakcja podstawi. . . Reakcja estryfikacji - substytucja nukleofilowa Substytucja elektrofilowa - halogenowanie arenów / reakc. . . Reakcja addycji / addycja / reakcja przyłączenia / przył. . . Reakcje addycji elektrofilowej wodoru Reakcje addycji nukleofilowej / addycja nuklefilowa – add. . .

Czynniki elektrofilowe / elektrofil v Czynnik elektrofilowy / elektrofil – drobina z niedoborem / deficytem elektronów / luką elektronową Ø najczęściej jest to kation (NO 2+) lub cząsteczka silnie spolaryzowana (CH 3 -Cl) z cząstkowym ładunkiem dodatnim na atomie węgla, Ø w reakcji substytucji lub addycji jest akceptorem pary elektronowej, tj. pobiera elektrony od innych drobin, Ø elektrofil jest kwasem w teorii kwasów i zasad Lewisa, reaguje z nukleofilem, Ø przykłady czynników elektrofilowych: NO 2+, Cl+, Br+, H+, SO 3 H+, R 3 C+, COR+, RNH 2+.

Czynniki nukleofilowe / nukleofil v Czynnik nukleofiowy / nukleofi – drobina z nadmiarem elektronów (niekiedy tylko lokalnym) Ø najczęściej jest to anion (– CN-, - OH-) lub cząsteczka silnie spolaryzowana (H – O – H) z cząstkowym ładunkiem ujemnym na atomie tlenu, Ø w reakcji substytucji lub addycji jest donorem pary elektronowej, tj. oddaje swoje elektrony do innych drobin, Ø nukleofil jest zasadą w teorii kwasów i zasad Lewisa, reaguje z elektrofilem, Ø przykłady czynników nukleofilowych: CN-, F-, Br-, OH-, NH 3, H 2 O, RNH 2.

Rodnik / wolny rodnik v Rodnik / wolny rodnik – atom lub grupa atomów posiadający/a niesparowany/e elektron/y – birodnik (posiada dwa niesparowane elektrony): Ø rodniki obdarzone ładunkiem wypadkowym są jednorodnikami: kationorodnik (ładunek dodatni) lub anionorodnik (ładunek ujemny), Ø rodniki organiczne są najczęściej nietrwałe, ponieważ niesparowany elektron jest bardzo aktywny Ø rodniki często są produktami przejściowymi reakcjach chemicznych: substytucji rodnikowej, addycji rodnikowej, polimeryzacji wolnorodnikowej, Ø przykłady rodników: ●Cl – rodnik chlorkowy, ● CH 3 – rodnik metylowy, ●CH 2 Cl – rodnik chlorometylowy.

Reakcja substytucji / substytucja / podstawianie / reakcja podstawiania v Reakcja wymiany atomu lub grupy atomów pomiędzy reagującymi cząsteczkami, ze względu na czynnik atakujący wyróżnia się: Ø czynnik elektrofilowy – substytucja elektrofilowa – np. nitrowanie / NO 2+ , sulfonowanie / SO 3 H+ benzenu, Ø czynnik nukleofilowy – substytucja nukleofilowa – np. reakcja halogenopochodnej alkanu R – X z jonem wodorotlenkowym OH-: ü (R – X + OH- R – OH + X-), Ø rodnik – substytucja rodnikowa – np. fluorowcowanie alkanów, grup alifatycznych pochodnych alkanów.

Substytucja rodnikowa / wolnorodnikowa – reakcja podstawiania v Substytucja rodnikowa – halogenownie / fluorowcowanie alkanów i ich pochodnych z udziałem rodnika / rodników Ø etap I: homoliza cząsteczek fluorowca pod wpływem światła uv lub podwyższonej temp. – powstanie rodnika: ü Cl ●● Cl ●Cl + ●Cl Ø etap II: atak rodnika chlorkowego na cząsteczkę alkanu i powstanie rodniak etylowego i chlorowodoru: ü H 3 C – CH 3 + ●Cl H 3 C – ●CH 2 + HCl Ø etap III: atak rodnika etylowego na cząsteczkę chloru, powstaje chloroetan i rodnik chlorkowy: ü H 3 C – ●CH 2 + Cl ●● Cl H 3 C – CH 2 Cl + ●Cl Ø etap IV: rodnik chlorkowy atakuje cząsteczkę chlorometanu, powstaje rodnik chloroetylowy i chlorowodór.

Substytucja rodnikowa / wolnorodnikowa – reakcja podstawiania v Reakcja przebiega współbieżnie, wieloetapowo / łańcuchowo i zgodnie z regułą Zajcewa. v Reakcja kończy się po wyczerpaniu się rodników, w ostatnim etapie rodniki w nadmiarze łączą się w cząsteczki: Ø kolejność podstawiania wynika z rzędowości atomów C i tym samym energii wiązania C – H: ü energia wiązania na C 1 o / 415 -420 k. J/mol, ü energia wiązania na C 2 o / 390 k. J/mol, ü energia wiązania na C 3 o / 370 k. J/mol Ø produktami reakcji jest mieszanina halogenowęglowodrów.

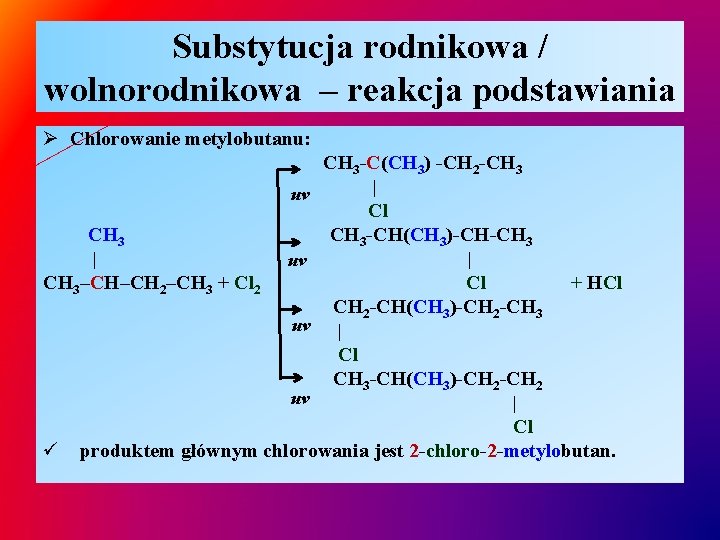
Substytucja rodnikowa / wolnorodnikowa – reakcja podstawiania Ø Chlorowanie metylobutanu: CH 3 -C(CH 3) -CH 2 -CH 3 | uv Cl CH 3 -CH(CH 3)-CH-CH 3 | | uv CH 3–CH–CH 2–CH 3 + Cl 2 Cl + HCl CH 2 -CH(CH 3)-CH 2 -CH 3 uv | Cl CH 3 -CH(CH 3)-CH 2 uv | Cl ü produktem głównym chlorowania jest 2 -chloro-2 -metylobutan.

Substytucja rodnikowa / wolnorodnikowa – reakcja podstawiania v W wysokiej temp. reakcji substytucji rodnikowej ulegają również alkeny: T Ø CH 2 = CH 2 + Cl 2 CH 2 = CH – Cl + HCl T Ø CH 2 = CH – CH 3 + Cl 2 CH 2 = CH – CH 2 – Cl + HCl v Chlorowanie grupy alifatycznej kwasów karboksylowych: CH 2 Cl–CH 2 -COOH Ø CH 3 -CH 2 – COOH + Cl 2 uv + HCl CH 3 -CHCl-COOH

Reakcja estryfikacji - substytucja nukleofilowa v Reakcja estryfikacji (reakcja Fischera): v substytucja nukleofilowa acylu oparta na: Ø elektrofilowości węgla karbonylowego δ+ δOδ// R – Cδ+ OH Ø nukleofilowości alkoholu R – Oδ-H v Etapy mechanizmu reakcji estryfikacji – na kolejnych slajdach.

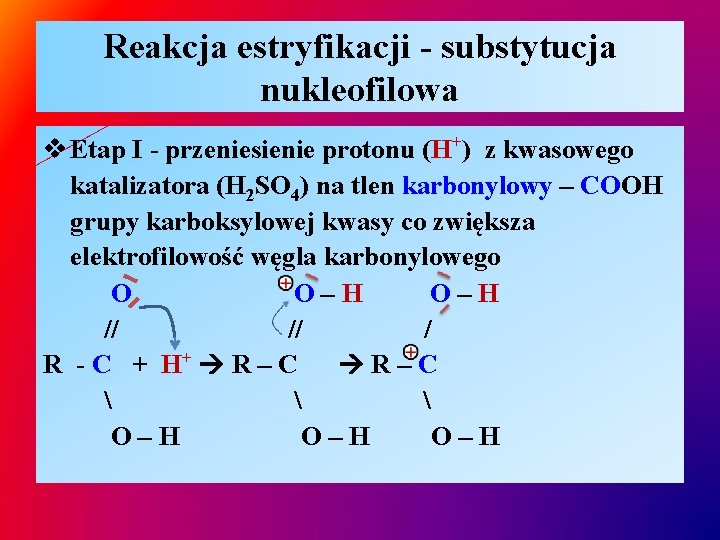
Reakcja estryfikacji - substytucja nukleofilowa v Etap I - przeniesienie protonu (H+) z kwasowego katalizatora (H 2 SO 4) na tlen karbonylowy – COOH grupy karboksylowej kwasy co zwiększa elektrofilowość węgla karbonylowego O O–H // // / R - C + H+ R – C R–C O–H O–H

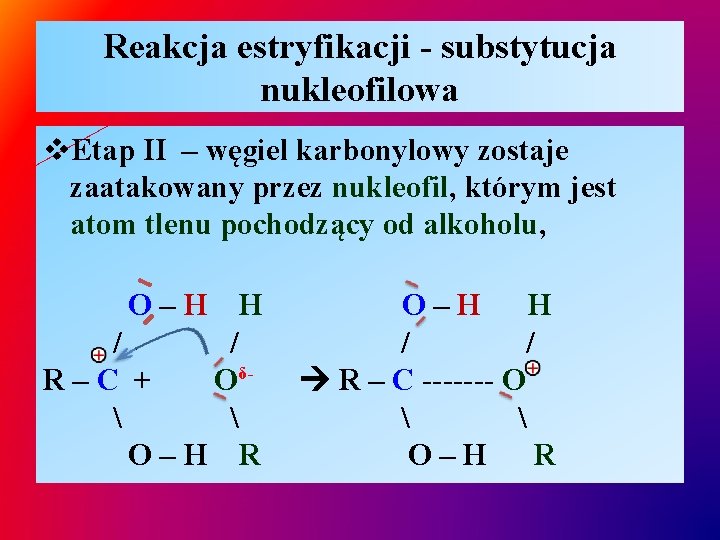
Reakcja estryfikacji - substytucja nukleofilowa v. Etap II – węgiel karbonylowy zostaje zaatakowany przez nukleofil, którym jest atom tlenu pochodzący od alkoholu, O–H H / / R–C + Oδ O–H R O–H H / / R – C ------- O O–H R

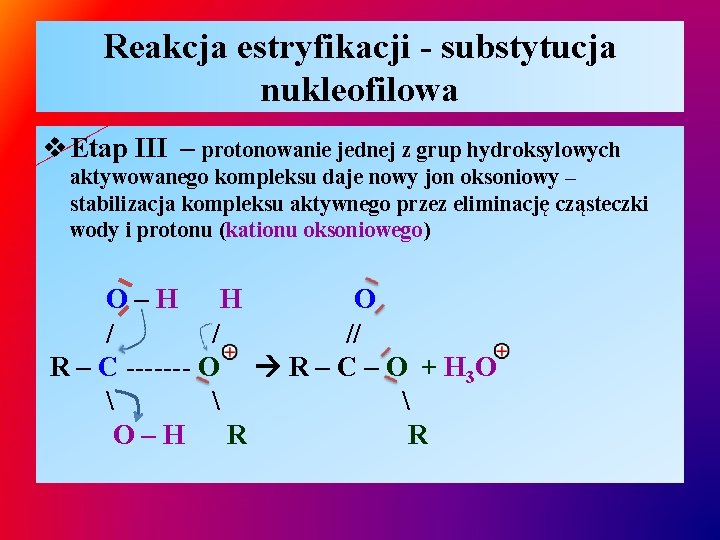
Reakcja estryfikacji - substytucja nukleofilowa v Etap III – protonowanie jednej z grup hydroksylowych aktywowanego kompleksu daje nowy jon oksoniowy – stabilizacja kompleksu aktywnego przez eliminację cząsteczki wody i protonu (kationu oksoniowego) O–H H O / / // R – C ------- O R – C – O + H 3 O O–H R R

Hydroliza halogenoalkanów w środowisku zasadowym - substytucja nukleofilowa v Mechanizmu reakcji: Ø atak odczynnika nukleofilowego OH (wodny roztwór mocnej zasady) na atom węgla związanego z halogenem – X, Ø stopniowe utworzenie wiązania między atomem węgla i grupą OH przez jedną z wolnych par elektronowych atomu tlenu z anionu OH Ø rozluźnienie wiązania węgiel / halogen (C – X) w wyniku przesunięcia się pary wiążącej w kierunku podstawnika halogenowego – X i rozerwanie tego wiązania z uwolnieniem podstawnika halogenowego w formie anionu X H H H | / R – Cδ+ – Xδ- + OH R – Cδ+ – X½δ- R – CH 2 + X | | | H O ½δ- H OH

Hydroliza halogenoalkanów w środowisku zasadowym - substytucja nukleofilowa v Hydroliza III-rzędowych halogenoalkanów w wodnym roztworze mocnej zasady Ø I etap mechanizmu reakcji – dysocjacja z odszczepieniem anionu X : R R R – C δ+ – X δ- R – C + X R R Ø II etap – atak czynnika nukleofilowego OH na karbokation R R -C + R R OH R – C – OH R

Reakcja halogenoalkanów i halogenoarenów z amoniakiem - substytucja nukleofilowa v Etapy reakcji (z nadmiarem amoniaku): Ø atak czynnika nuklefilowego NH 3 na czynnik elektrofilowy R - CH 2 – X R – CH 2 – X + NH 3 R – CH 2 – NH 3 X Ø atak czynnika nuklefilowego NH 3 na czynnik elektrofilowy R - CH 2 – NH 3 X R - CH 2 – NH 2 - X + NH 3 R – CH 2 – NH 2 + NH 4 X | H

Hydroliza halogenowodorów w środowisku obojętnym / w wodzie - substytucja nukleofilowa v W pierwszym etapie czynnik nukleofilowy – H 2 O atakuje słabszy elektrofil jakim jest R –X v R―X + HOH → R―OH + HX v Jest to reakcja podstawienia nukleofilowego przy dodatnio naładowanym, tetraedrycznym atomie węgla. v Przebieg reakcji zależy w dużej mierze od charakteru substratu. Halogenek etylu ulega hydrolizie wolniej niż halogenek metylu, gdyż w jego cząsteczce występuje mniejszy ładunek dodatni niż w cząsteczce halogenku metylu. v Kompleks aktywny H 2 O…C 2 H 5…X, powstaje trudniej, w związku z czym reakcja hydrolizy zachodzi wolniej R – CH 2 – X + O R – CH 2 – X R – CH 2 – OH + H -X / | H H H–O–H

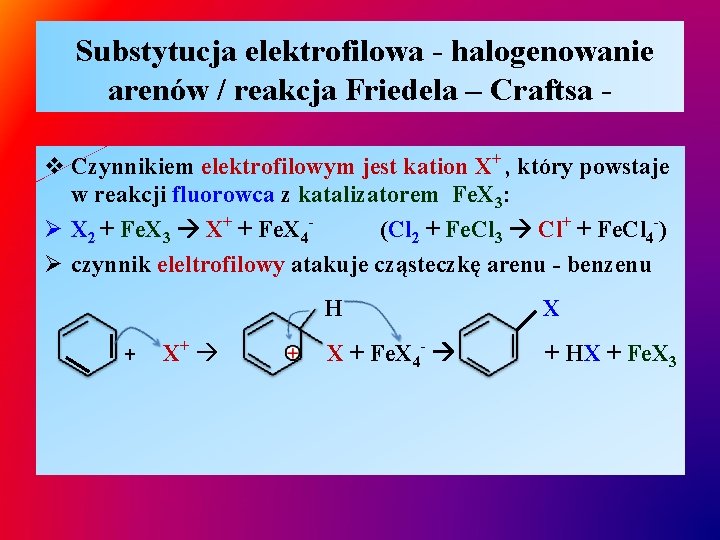
Substytucja elektrofilowa - halogenowanie arenów / reakcja Friedela – Craftsa v Czynnikiem elektrofilowym jest kation X+ , który powstaje w reakcji fluorowca z katalizatorem Fe. X 3: Ø X 2 + Fe. X 3 X+ + Fe. X 4(Cl 2 + Fe. Cl 3 Cl+ + Fe. Cl 4 -) Ø czynnik eleltrofilowy atakuje cząsteczkę arenu - benzenu + X+ H X X + Fe. X 4 - + HX + Fe. X 3

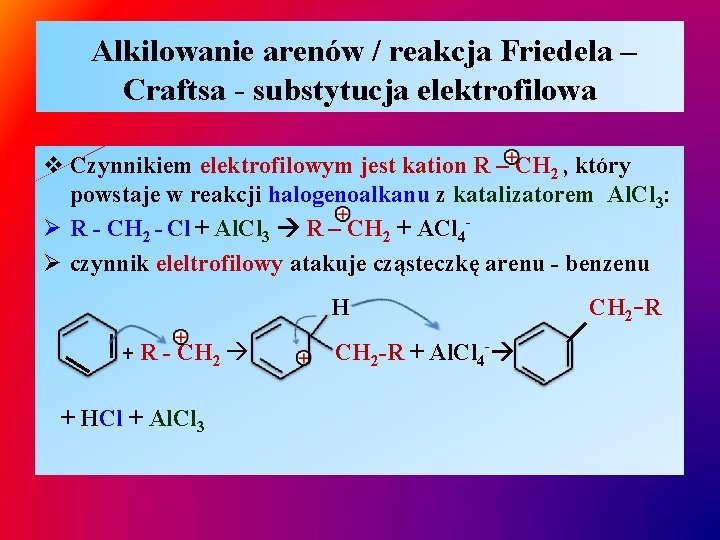
Alkilowanie arenów / reakcja Friedela – Craftsa - substytucja elektrofilowa v Czynnikiem elektrofilowym jest kation R – CH 2 , który powstaje w reakcji halogenoalkanu z katalizatorem Al. Cl 3: Ø R - CH 2 - Cl + Al. Cl 3 R – CH 2 + ACl 4Ø czynnik eleltrofilowy atakuje cząsteczkę arenu - benzenu H + R - CH 2 + HCl + Al. Cl 3 CH 2 -R + Al. Cl 4 - CH 2 -R

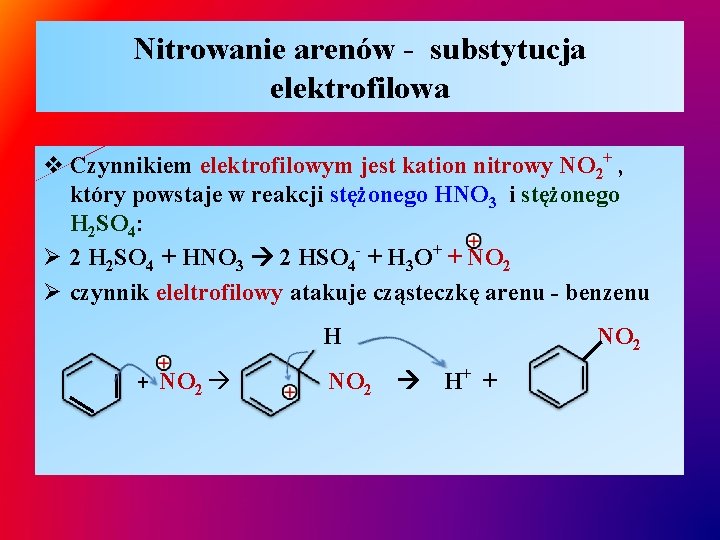
Nitrowanie arenów - substytucja elektrofilowa v Czynnikiem elektrofilowym jest kation nitrowy NO 2+ , który powstaje w reakcji stężonego HNO 3 i stężonego H 2 SO 4: Ø 2 H 2 SO 4 + HNO 3 2 HSO 4 - + H 3 O+ + NO 2 Ø czynnik eleltrofilowy atakuje cząsteczkę arenu - benzenu H + NO 2 H+ +

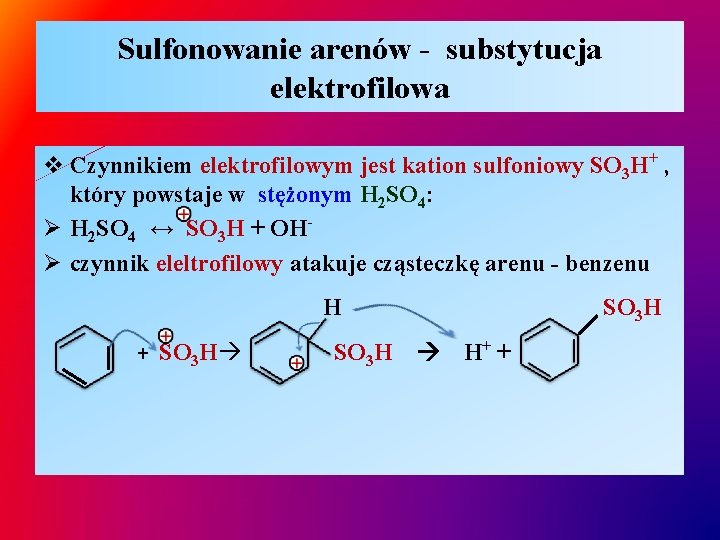
Sulfonowanie arenów - substytucja elektrofilowa v Czynnikiem elektrofilowym jest kation sulfoniowy SO 3 H+ , który powstaje w stężonym H 2 SO 4: Ø H 2 SO 4 ↔ SO 3 H + OHØ czynnik eleltrofilowy atakuje cząsteczkę arenu - benzenu H + SO 3 H H+ +

Reakcja addycji / addycja / reakcja przyłączenia / przyłączenie v Reakcja chemiczna polegająca na łączeniu się dwóch drobin w jedną, w chemii organicznej związane z atakiem na drobiny posiadające wiązania wielokrotne, pierścień aromatyczny lub pierścień cykloalifatyczny czynnika: Ø elektrofilowego – addycja elektrofilowa: ü addycja halogenowodoru - HX, H 2, X 2, H 2 O do alkenu, alkinu lub pochodnych zawierających w łańcuchu alifatycznym wiązanie wielokrotne, czynnikiem elektrofilowym jest H+, lub X+, ü W drugim etapie karbokation reaguje z anionem (odczynnik nukleofilowy) Ø nukleofilowego – addycja nukleofilowa: ü addycja cyjanowodoru H - CN do aldehydów R – CHO, czynnikiem nukleofilowym jest CN- z cząsteczki HCN, który atakuje węgiel grupy karbonylowej: R – CHO + H – CN R – CH(OH) – CN Ø rodnika – addycja rodnikowa – polimeryzacja wolnorodnikowa.

Reakcja addycji / addycja / reakcja przyłączenia / przyłączenie – cd. v Reakcja addycji wiąże się ze zmniejszeniem krotności wiązań wielokrotnych: ü wiązane podwójne „redukuje” się do wiązania pojedynczego, ü wiązanie potrójne „redukuje” się do wiązania podwójnego lub pojedynczego, ü w przypadku addycji do pierścienia aromatycznego układ sprzężonych wiązań podwójnych zostaje zniszczony i cząsteczka traci charakter aromatyczny, ü w przypadku pierścienia cykloalifatycznego powoduje jego rozerwanie

Reakcje addycji elektrofilowej wodoru v Reakcja przebiega obecności katalizatora (rozdrobniona platyna, pallad, lub nikiel w przypadku którego reakcja przebiega podwyższonej temp i wysokiego ciśnienia). v W przypadku addycji heterocząsteczek (HX, H 2 O) przez niesymetryczne alkeny i alkiny reakcja przebiega zgodnie z reguła Markownikowa. v Uproszczony schemat reakcji: R – CH CH 2 + H – H R – CH CH 2 + H H R – CH 2 – CH 3

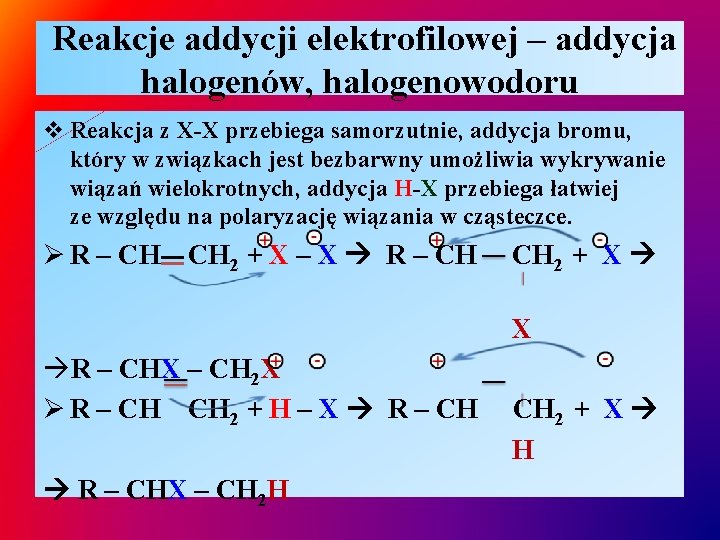
Reakcje addycji elektrofilowej – addycja halogenów, halogenowodoru v Reakcja z X-X przebiega samorzutnie, addycja bromu, który w związkach jest bezbarwny umożliwia wykrywanie wiązań wielokrotnych, addycja H-X przebiega łatwiej ze względu na polaryzację wiązania w cząsteczce. Ø R – CH CH 2 + X – X R – CH CH 2 + X X R – CHX – CH 2 X Ø R – CH CH 2 + H – X R – CHX – CH 2 H CH 2 + X H

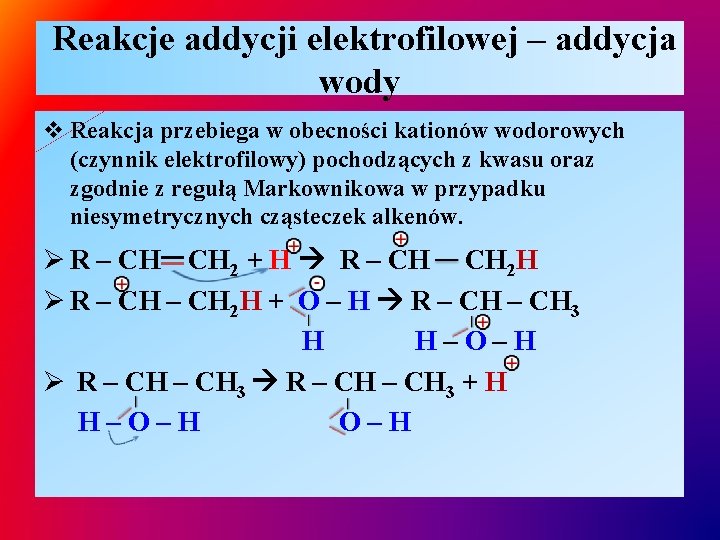
Reakcje addycji elektrofilowej – addycja wody v Reakcja przebiega w obecności kationów wodorowych (czynnik elektrofilowy) pochodzących z kwasu oraz zgodnie z regułą Markownikowa w przypadku niesymetrycznych cząsteczek alkenów. Ø R – CH CH 2 + H R – CH CH 2 H Ø R – CH 2 H + O – H R – CH 3 H H–O–H Ø R – CH 3 + H H–O–H

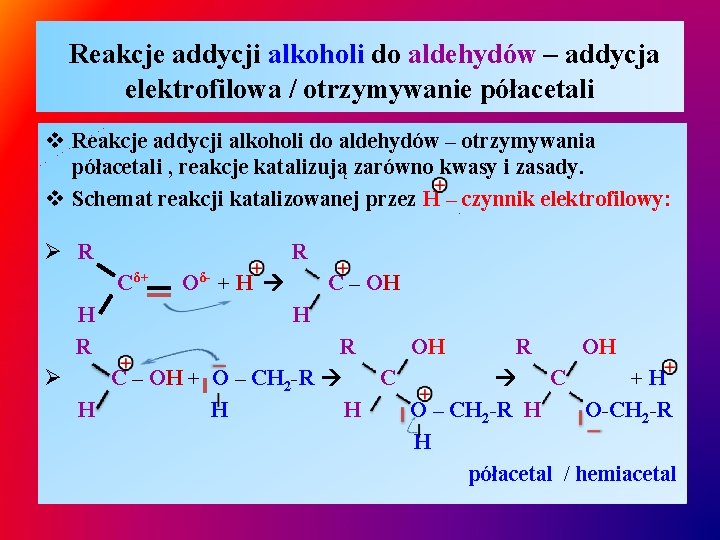
Reakcje addycji alkoholi do aldehydów – addycja elektrofilowa / otrzymywanie półacetali v Reakcje addycji alkoholi do aldehydów – otrzymywania półacetali , reakcje katalizują zarówno kwasy i zasady. v Schemat reakcji katalizowanej przez H – czynnik elektrofilowy: Ø R R Cδ+ H R Oδ- + H C – OH H R OH Ø C – OH + O – CH 2 -R C C +H H O – CH 2 -R H O-CH 2 -R H półacetal / hemiacetal

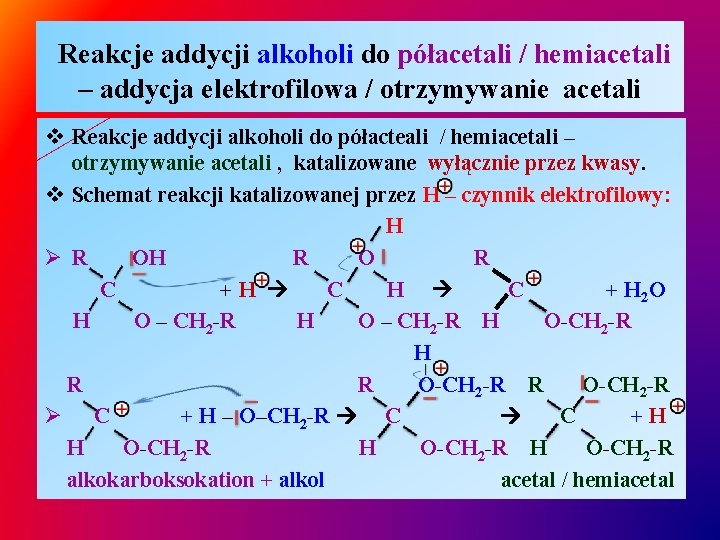
Reakcje addycji alkoholi do półacetali / hemiacetali – addycja elektrofilowa / otrzymywanie acetali v Reakcje addycji alkoholi do półacteali / hemiacetali – otrzymywanie acetali , katalizowane wyłącznie przez kwasy. v Schemat reakcji katalizowanej przez H – czynnik elektrofilowy: H Ø R OH R O R C +H C + H 2 O H O – CH 2 -R H O-CH 2 -R H R R O-CH 2 -R Ø C + H – O–CH 2 -R C C +H H O-CH 2 -R alkokarboksokation + alkol acetal / hemiacetal

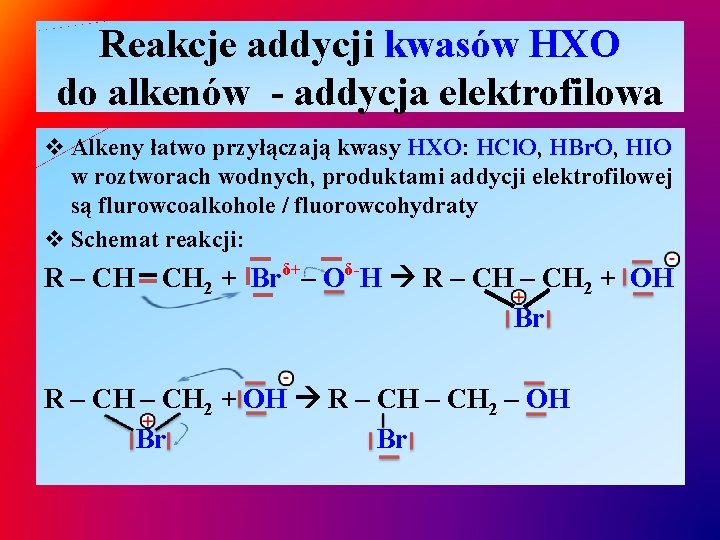
Reakcje addycji kwasów HXO do alkenów - addycja elektrofilowa v Alkeny łatwo przyłączają kwasy HXO: HCl. O, HBr. O, HIO w roztworach wodnych, produktami addycji elektrofilowej są flurowcoalkohole / fluorowcohydraty v Schemat reakcji: R – CH CH 2 + Brδ+– Oδ-H R – CH 2 + OH Br R – CH 2 + OH R – CH 2 – OH Br Br

Reakcje addycji nukleofilowej / addycja nuklefilowa – addycja HCN v. Produktami addycji H-C ≡ N do aldehydów lub ketonów są cyjanohydryny: Ø czynnikiem nukleofilowym jest anion CN, który powstaje w reakcji HCN w środowisku zasadowym lub w mieszaninie Na. CN/KCN z mocnym kwasem Ø Czynnik nukleofilowy atakuje węgiel karbonylowy C = O aldehydów lub ketonów, Ø W ostatnim etapie następuje regeneracja katalizatora OH

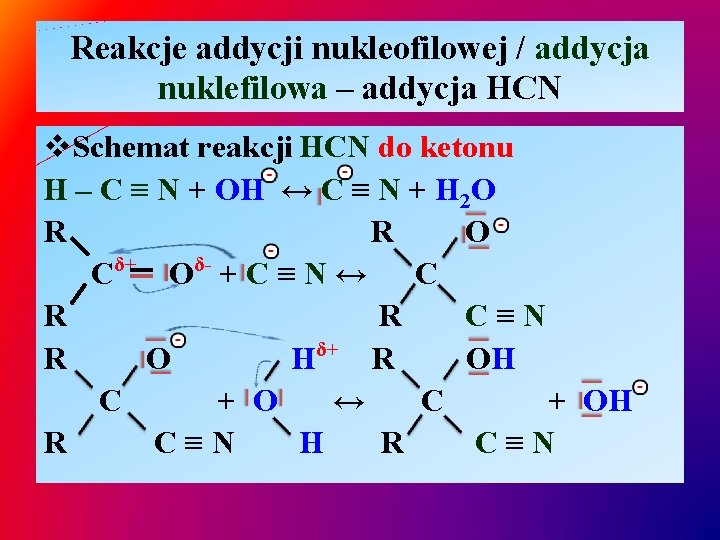
Reakcje addycji nukleofilowej / addycja nuklefilowa – addycja HCN v. Schemat reakcji HCN do ketonu H – C ≡ N + OH ↔ C ≡ N + H 2 O R R O δ+ δC O +C≡N↔ C R R C≡N δ+ R O H R OH C + O ↔ C + OH R C≡N

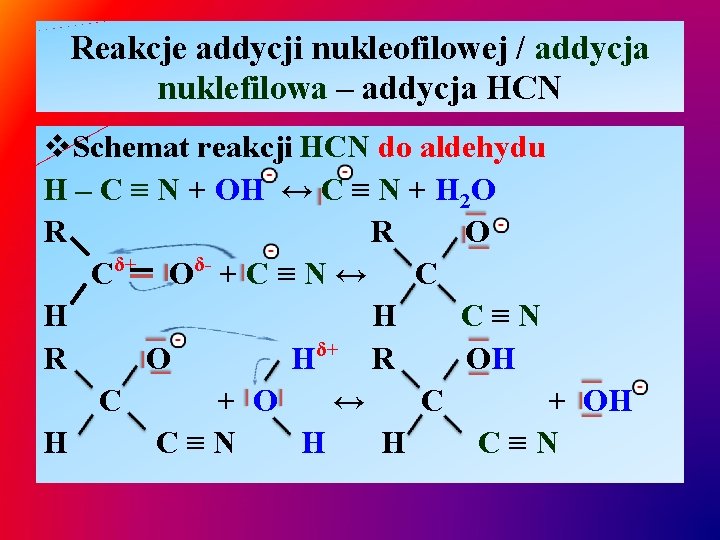
Reakcje addycji nukleofilowej / addycja nuklefilowa – addycja HCN v. Schemat reakcji HCN do aldehydu H – C ≡ N + OH ↔ C ≡ N + H 2 O R R O δ+ δC O +C≡N↔ C H H C≡N δ+ R O H R OH C + O ↔ C + OH H C≡N