Reakciegyenletek Az egyenleteket KEGLEVICH KRISTF gyjttte a fjlt



































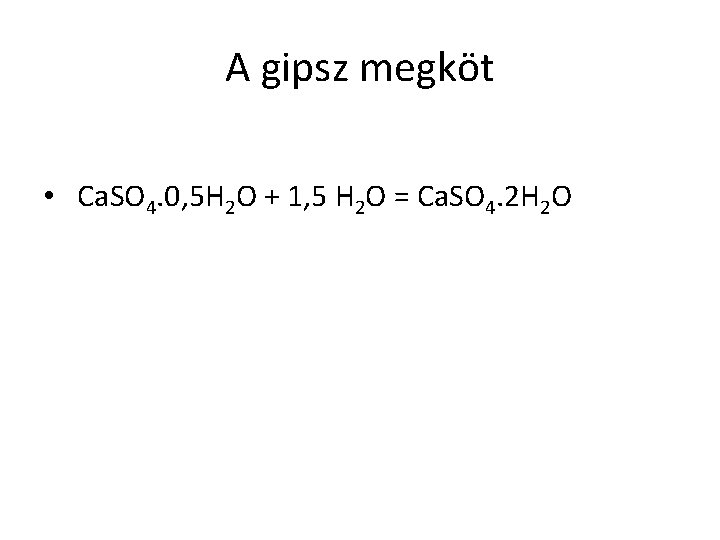









![Kikeverés (Al-gyártás I. ) • Na[Al(OH)4] = Al(OH)3 + Na. OH Kikeverés (Al-gyártás I. ) • Na[Al(OH)4] = Al(OH)3 + Na. OH](https://slidetodoc.com/presentation_image_h/f99d50b0630ecc4723fed2e6417bac7d/image-54.jpg)














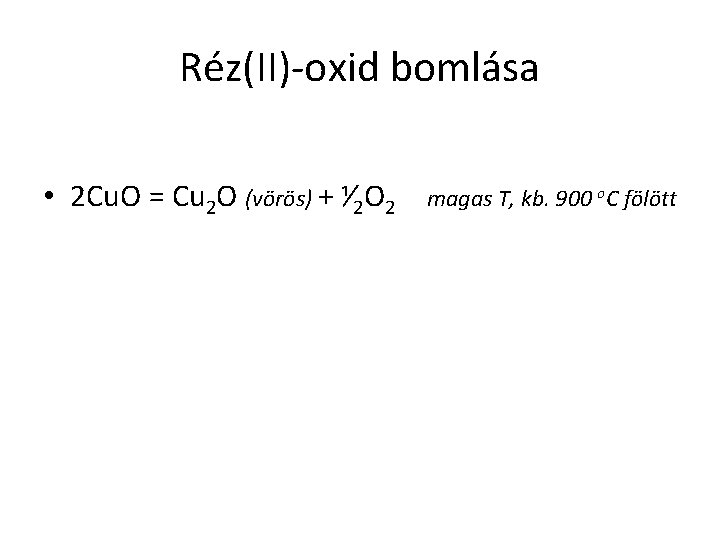



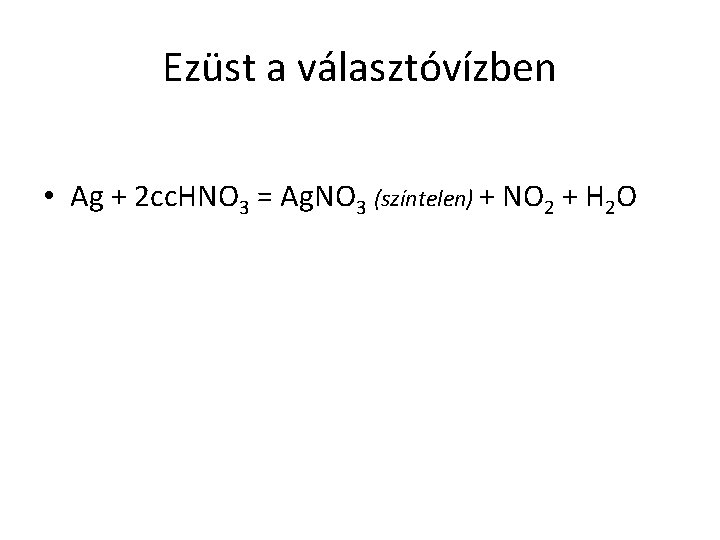

















![Etin vízaddíciója, majd izomerizáció • HC≡CH + H 2 O = [CH 2=CH–OH] = Etin vízaddíciója, majd izomerizáció • HC≡CH + H 2 O = [CH 2=CH–OH] =](https://slidetodoc.com/presentation_image_h/f99d50b0630ecc4723fed2e6417bac7d/image-94.jpg)












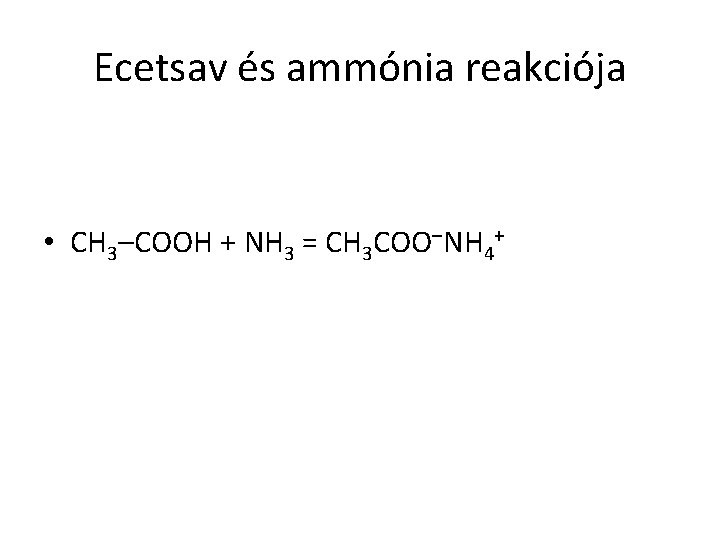








- Slides: 126

Reakcióegyenletek Az egyenleteket KEGLEVICH KRISTÓF gyűjtötte, a fájlt BENKŐ ZSOLT (2013 B) hozta létre

Leírás • A bemutató 127 egyenletet tartalmaz, tematizálva. • Az első kattintásra megjelenik az egyenlet (reakció) neve, ez a cím; majd második kattintásra az egyenlet. • Nem mindegyik reakció megy végbe! • Az egyensúlyi folyamatokat jelölni kell! • Ahol lehet, fel kell tüntetni a reakció körülményeit (nyomás, hőmérséklet, katalizátor stb. )!

1. Gázok lab. eá. , fiz. tul. (szín, szag, halmazállapot, vízoldhatóság és kimutatás)

Hidrogén előállítása • Zn + 2 HCl = Zn. Cl 2 + H 2

Klór előállítása • 2 KMn. O 4 + 16 HCl = 5 Cl 2 + 2 KCl + 2 Mn. Cl 2 + 8 H 2 O

Hidrogén-klorid előállítása • 2 Na. Cl + H 2 SO 4 = Na 2 SO 4 + 2 HCl

Oxigén előállítása • H 2 O 2 = H 2 O + ½ O 2 Mn. O 2 kat.

Kénhidrogén előállítása • Fe. S + 2 HCl = Fe. Cl 2 + H 2 S

Kén-dioxid előállítása (2) • Na 2 SO 3 + 2 HCl = 2 Na. Cl + H 2 O + SO 2 • Cu + 2 cc. H 2 SO 4 = Cu. SO 4 + SO 2 + 2 H 2 O

Nitrogén-monoxid előállítása • 3 Cu + 8 HNO 3 = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O

Nitrogén-dioxid előállítása • Cu + 4 cc. HNO 3 = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O

Ammónia előállítása • NH 4 Cl + cc. Na. OH = NH 3 + Na. Cl + H 2 O melegítve

Szén-dioxid előállítása • Ca. CO 3 + 2 HCl = Ca. Cl 2 + CO 2 + H 2 O

Szén-monoxid előállítása • cc. HCOOH = H 2 O + CO kat. : cc. H 2 SO 4, melegítve

Etén előállítása • CH 3 CH 2 OH = CH 2=CH 2 + H 2 O kat: cc. H 2 SO 4, Si. O 2, 180 o. C

Etin (acetilén) előállítása • Ca. C 2 + 2 H 2 O = HC≡CH + Ca(OH)2

2. Gázok ipari előállítása

Szintézisgáz gyártása • CH 4 + H 2 O(g) ⇌ CO + 3 H 2 1000 o. C, Ni kat.

Szintézis gáz II. (vízgáz) • C + H 2 O(g) ⇌ CO + H 2 1000 o. C

Klór gyártása • 2 Na. Cl = 2 Na + Cl 2 olvadékelektrolízis

HCl gyátrás (vinil-klorid melléktermék) • (CH 2=CH 2 + Cl 2 →) Cl–CH 2–Cl = CH 2=CHCl + HCl (E)

Kén-dioxid gyártás • S + O 2 = SO 2 kőolajból kivont kén égetése

Kén-trioxid gyártása • 2 SO 2 + O 2 ⇌ 2 SO 3 kat: V 2 O 5, nagy P

Ammóniagyártás • N 2 + 3 H 2 ⇌ 2 NH 3 kat. , nagy P, mérsékelten magas T (2– 300 o. C), nitrogénfölösleg

Etén gyártása • 2 CH 4 = CH 2=CH 2 + 2 H 2

Etin (acetilén) gyártása • 2 CH 4 = HC≡CH + 3 H 2

3. Szervetlen kémia

Li égése • 4 Li + O 2 = 2 Li 2 O

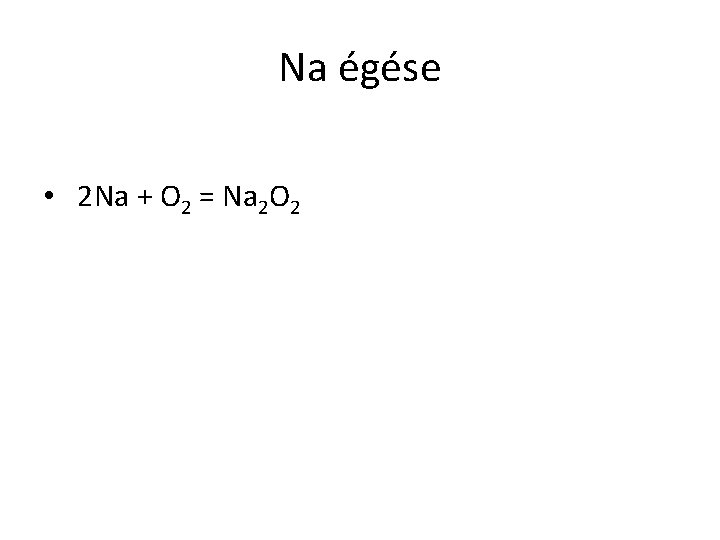
Na égése • 2 Na + O 2 = Na 2 O 2

K égése • K + O 2 = KO 2

Na reakciója vízzel • Na + H 2 O = Na. OH + 0, 5 H 2 (Li, K is)

Na és klór reakciója • 2 Na + Cl 2 = 2 Na. Cl (Li, K – többi halogén is)

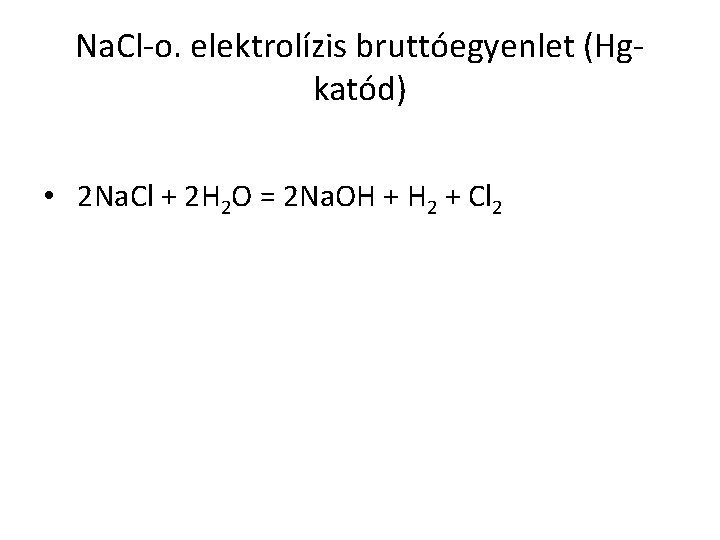
Na. Cl-o. elektrolízis bruttóegyenlet (Hgkatód) • 2 Na. Cl + 2 H 2 O = 2 Na. OH + H 2 + Cl 2

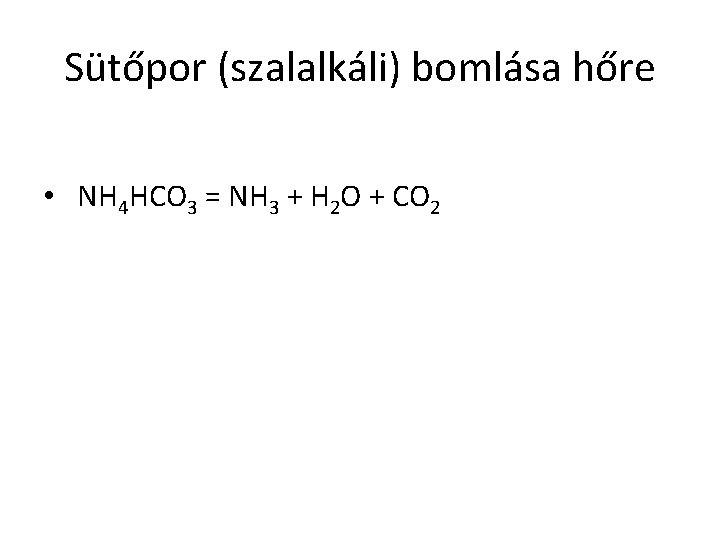
Sütőpor (szalalkáli) bomlása hőre • NH 4 HCO 3 = NH 3 + H 2 O + CO 2

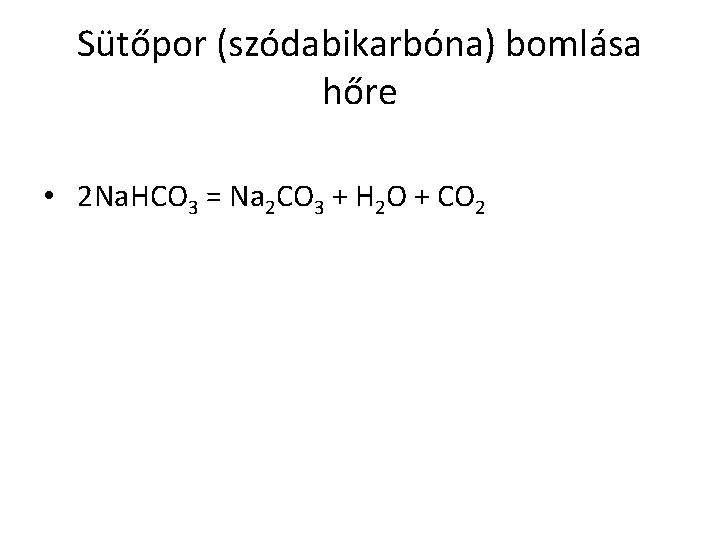
Sütőpor (szódabikarbóna) bomlása hőre • 2 Na. HCO 3 = Na 2 CO 3 + H 2 O + CO 2

Szódabikarbóna megköti a gyomorsavat • Na. HCO 3 + HCl = Na. Cl + H 2 O + CO 2

Hypó és sósav reakciója • Na. OCl + 2 HCl = Na. Cl +Cl 2 + H 2 O

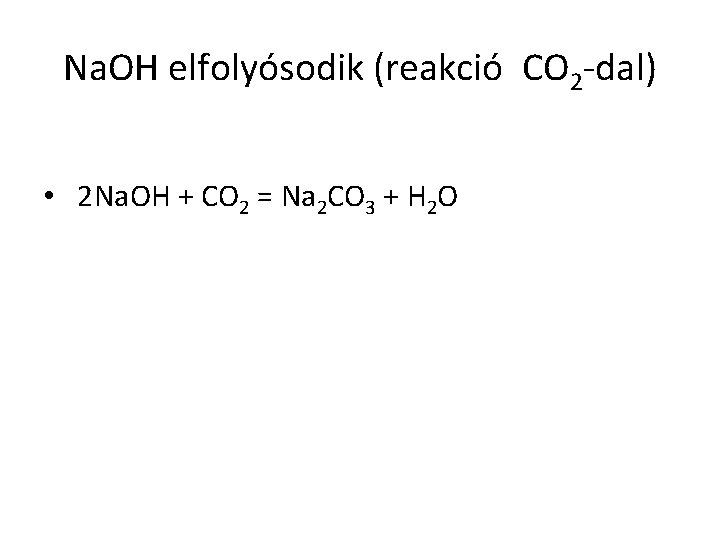
Na. OH elfolyósodik (reakció CO 2 -dal) • 2 Na. OH + CO 2 = Na 2 CO 3 + H 2 O

Magnézium égése • 2 Mg + O 2 = 2 Mg. O (többi alkáliföldfém is)

Kalcium és víz reakciója • Ca + 2 H 2 O = Ca(OH)2 + H 2

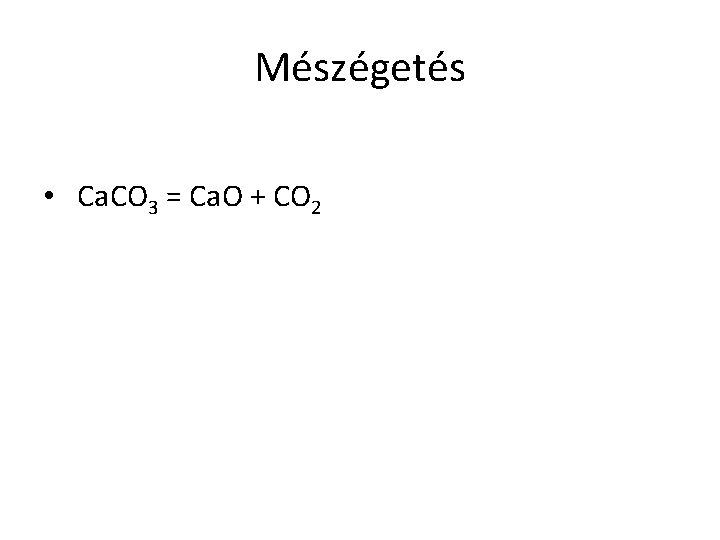
Mészégetés • Ca. CO 3 = Ca. O + CO 2

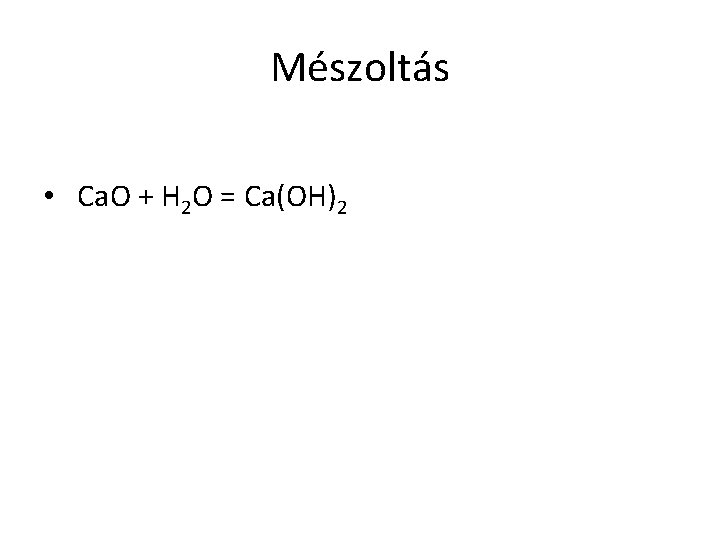
Mészoltás • Ca. O + H 2 O = Ca(OH)2

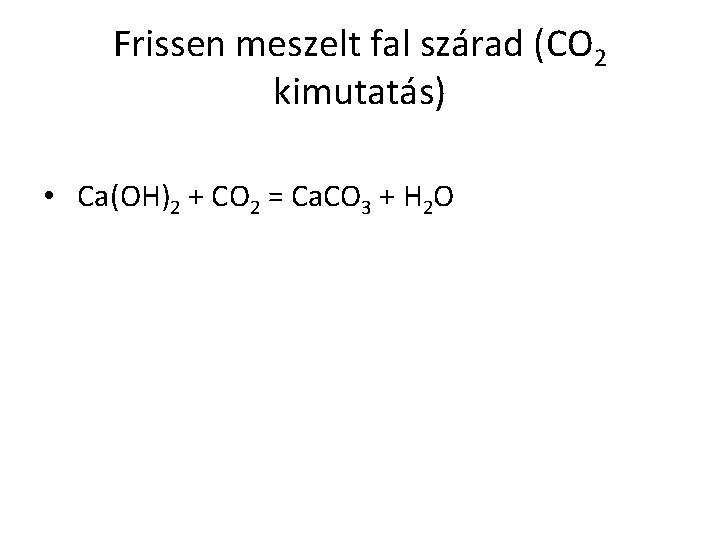
Frissen meszelt fal szárad (CO 2 kimutatás) • Ca(OH)2 + CO 2 = Ca. CO 3 + H 2 O
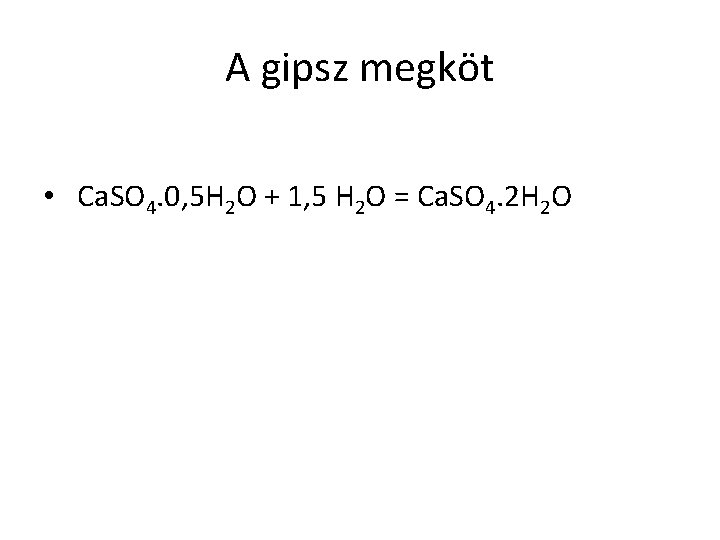
A gipsz megköt • Ca. SO 4. 0, 5 H 2 O + 1, 5 H 2 O = Ca. SO 4. 2 H 2 O

Mészkő oldódása / cseppkőképződés • Ca. CO 3 + H 2 O + CO 2 ⇌ Ca(HCO 3)2

Változó vízkeménység • Ca(HCO 3)2 = Ca. CO 3 + H 2 O + CO 2 (Mghidrogénkarbonát is)

Kemény víz lágyítása (trisó) • 3 Ca 2+ + 2 Na 3 PO 4 = 6 Na+ + Ca 3(PO 4)2

Al égése • 2 Al + 3/2 O 2 = Al 2 O 3

Al és jód reakciója • 2 Al + 3 I 2 = 2 Al. I 3 kat. : H 2 O

Alumínium és sósav • 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2

Alumínium és híg kénsav • 2 Al + 3 H 2 SO 4 = Al 2(SO 4)3 + 3 H 2

Alumínium és tömény salétromsav • SEMMI!!! Al + cc. HNO 3 ≠

Alumínium oldódása lúgban • Al + cc. Na. OH + 3 H 2 O = Na[Al(OH)4] + 1, 5 H 2
![Kikeverés Algyártás I NaAlOH4 AlOH3 Na OH Kikeverés (Al-gyártás I. ) • Na[Al(OH)4] = Al(OH)3 + Na. OH](https://slidetodoc.com/presentation_image_h/f99d50b0630ecc4723fed2e6417bac7d/image-54.jpg)
Kikeverés (Al-gyártás I. ) • Na[Al(OH)4] = Al(OH)3 + Na. OH

Kalcinálás (Al-gyártás II. ) • 2 Al(OH)3 = 3 H 2 O + Al 2 O 3 (T)

Olvadékelektrolízis (Al-gyártás III. ) • 2 Al 2 O 3 = 4 Al + 3 O 2 adalék: Na 3 Al. F 6 ; 6 Farad

Termitreakció • 2 Al + Fe 2 O 3 = Al 2 O 3 + 2 Fe

Ólomakkumulátor (feltöltés és kisülés) • Pb + Pb. O 2 + 2 H 2 SO 4 ⇌ 2 Pb. SO 4 + 2 H 2 O

Vas égése • 4 Fe + 3 O 2 = 2 Fe 2 O 3 (vörös)

Vas és híg salétromsav reakciója • 3 Fe + 8 HNO 3 = 3 Fe(NO 3)2 + 2 NO + 4 H 2 O

Vas és tömény salétromsav • SEMMI!!! Fe + cc. HNO 3 ≠

Vas, kobalt és nikkel reakciója klórral • Fe + 1, 5 Cl 2 = Fe. Cl 3 (okker) • Co + Cl 2 = Co. Cl 2 (kék, mert vízmentes) • Ni + Cl 2 = Ni. Cl 2 (sárga, mert vízmentes)

Vas és sósav • Fe + 2 HCl = Fe. Cl 2 + H 2 ([Fe(H 2 O)6]2+ halványzöld)

Vas és híg kénsav • Fe + híg H 2 SO 4 = Fe. SO 4 + H 2

Direkt redukció (Vasgyártás I. ) • Fe 2 O 3 + 3 C = 2 Fe + 3 CO

Indirekt redukció (Vasgyártás II. ) • Fe 2 O 3 + 3 CO = 2 Fe + 3 CO 2

Vas(II)-hidroxid redukálódik a levegőn • 2 Fe(OH)2 (piszkoszöld) + ⅟ 2 O 2 + H 2 O = 2 Fe(OH)3 (barna)

Réz égése • 2 Cu + O 2 = 2 Cu. O (fekete)
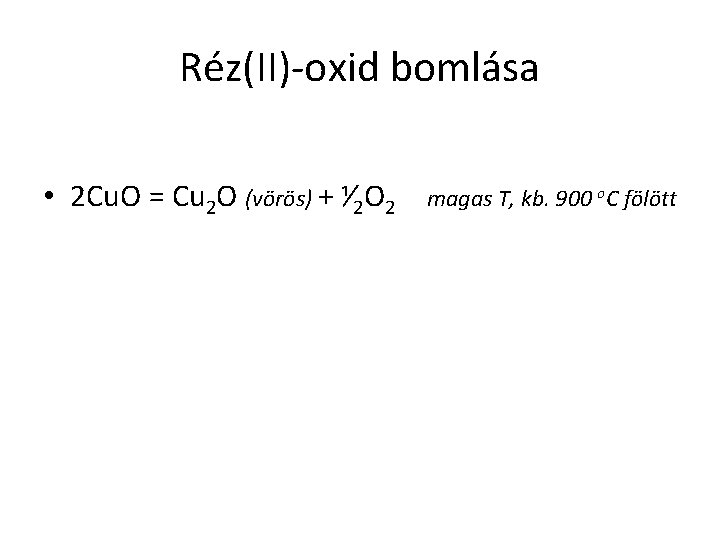
Réz(II)-oxid bomlása • 2 Cu. O = Cu 2 O (vörös) + ⅟ 2 O 2 magas T, kb. 900 o. C fölött

Réz(II)-oxid és hidrogén reakciója • Cu. O + H 2 = H 2 O + Cu

Réz(II)-oxid és sósav • Cu. O + 2 HCl = H 2 O + Cu. Cl 2 ([Cu(H 2 O)4]2+ kék)

Réz és sósav • SEMMI!!! Cu + HCl ≠

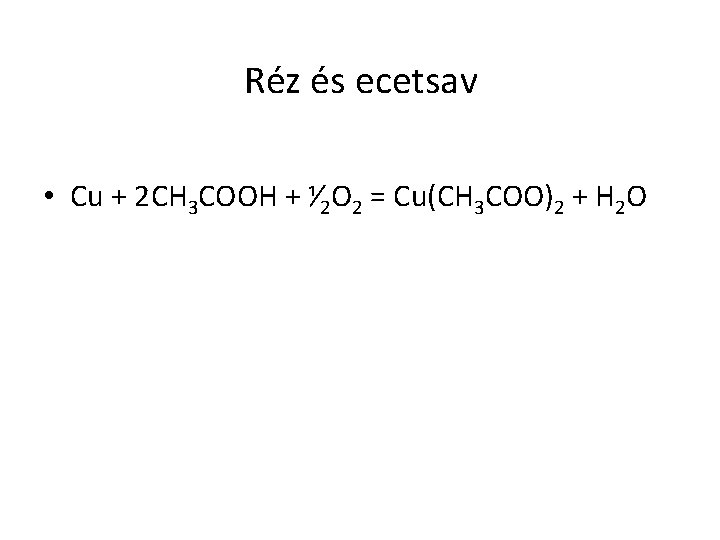
Réz és ecetsav • Cu + 2 CH 3 COOH + ⅟ 2 O 2 = Cu(CH 3 COO)2 + H 2 O
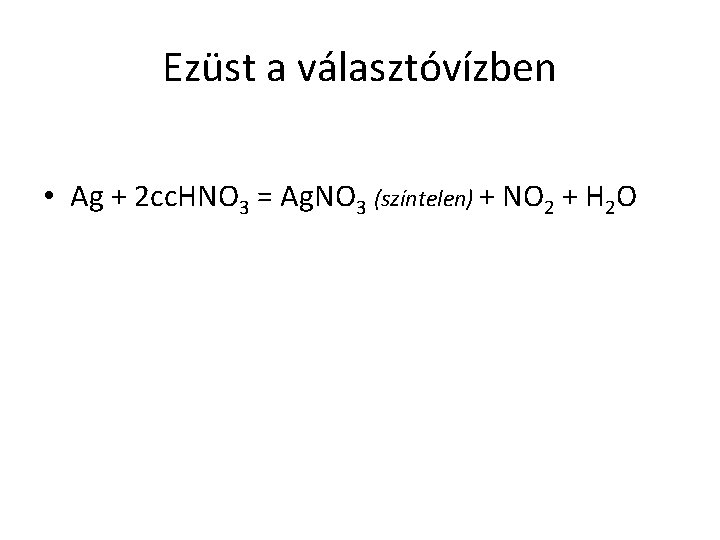
Ezüst a választóvízben • Ag + 2 cc. HNO 3 = Ag. NO 3 (színtelen) + NO 2 + H 2 O

Ezüst korrodálódik (kénhidrogén) • 2 Ag + H 2 S + ⅟ 2 O 2 = Ag 2 S + H 2 O

Hagyományos fotózás • 2 Ag. Br = 2 Ag + Br 2

Ezüst(I)-ion reakciója halogenid-ionnal • Ag+ + X– = Ag. X (Ag. F és Ag. Cl fehér, Ag. Br sárgásfehér, Ag. I fehéressárga)

Lugol-oldat (jód és KI reakció) • I 2 + KI = KI 3

Hypó gyártás, klór oldódása Na. OH-ban • Cl 2 + 2 Na. OH = Na. Cl + Na. OCl + H 2 O

Klór oldódása vízben • Cl 2 +H 2 O ⇌ HCl + HOCl

Üvegmaratás • Si. O 2 + 4 HF = Si. F 4 + 2 H 2 O

Vulkanikus kéntelep képződése • 2 H 2 S + SO 2 = 3 S + 2 H 2 O

Nitrogén égése ívfény hatására (villám) • N 2 + O 2 = 2 NO 3000 o. C

Li reakciója nitrogénnel • 6 Li + N 2 = 2 Li 3 N

Nitrogén-dioxid oldódik vízben (vegyes anhidrid) • 2 NO 2 + H 2 O = HNO 3 + HNO 2

Salétromsav bomlik fény hatására • 4 HNO 3 = 4 NO 2 + 2 H 2 O + O 2

Fehérfoszfor égése • P 4 + 5 O 2 = 2 P 2 O 5

Szén égése (tökéletes és tökéletlen) • C + O 2 = CO 2 • C + CO 2 = 2 CO

4. Szerves kémia

Metán és klór reakciója UV-fényre (4) • CH 4 + Cl 2 = CH 3 Cl + HCl • CH 4 + 2 Cl 2 = CH 2 Cl 2 + 2 HCl • CH 4 + 3 Cl 2 = CHCl 3 + 3 HCl • CH 4 + 4 Cl 2 = CCl 4 + 4 HCl

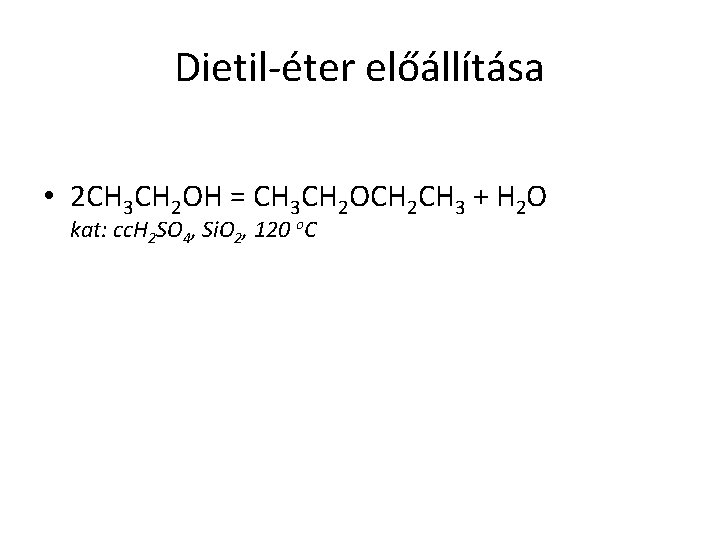
Dietil-éter előállítása • 2 CH 3 CH 2 OH = CH 3 CH 2 OCH 2 CH 3 + H 2 O kat: cc. H 2 SO 4, Si. O 2, 120 o. C

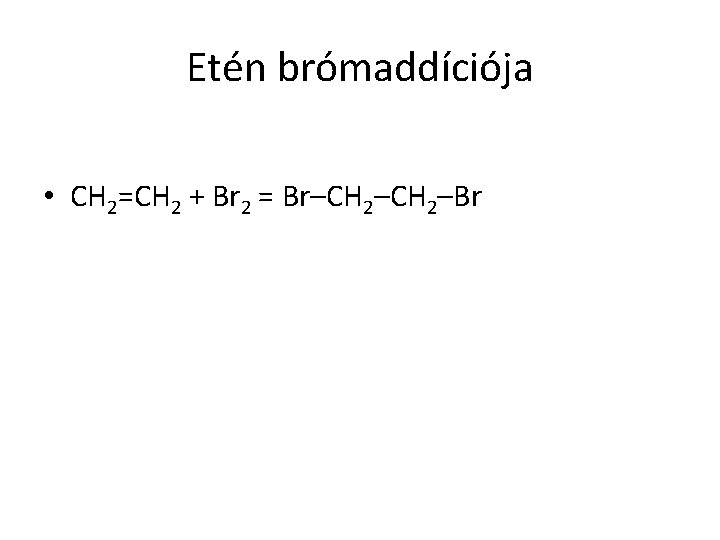
Etén brómaddíciója • CH 2=CH 2 + Br 2 = Br–CH 2–Br

Etin (acetilén) és Na reakciója • HC≡CH + 2 Na = Na 2 C 2 + H 2 CH 3 COCH 3 -os oldatban
![Etin vízaddíciója majd izomerizáció HCCH H 2 O CH 2CHOH Etin vízaddíciója, majd izomerizáció • HC≡CH + H 2 O = [CH 2=CH–OH] =](https://slidetodoc.com/presentation_image_h/f99d50b0630ecc4723fed2e6417bac7d/image-94.jpg)
Etin vízaddíciója, majd izomerizáció • HC≡CH + H 2 O = [CH 2=CH–OH] = CH 3–CHO kat: Hg. SO 4

Etin és sósav (régi vinil-klorid gyártás) • HC≡CH + HCl = CH 2=CH–Cl kat: Hg. Cl 2

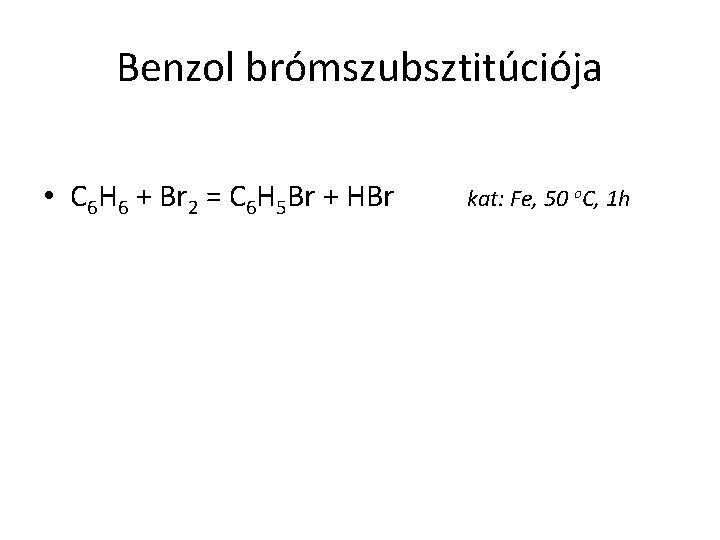
Benzol brómszubsztitúciója • C 6 H 6 + Br 2 = C 6 H 5 Br + HBr kat: Fe, 50 o. C, 1 h

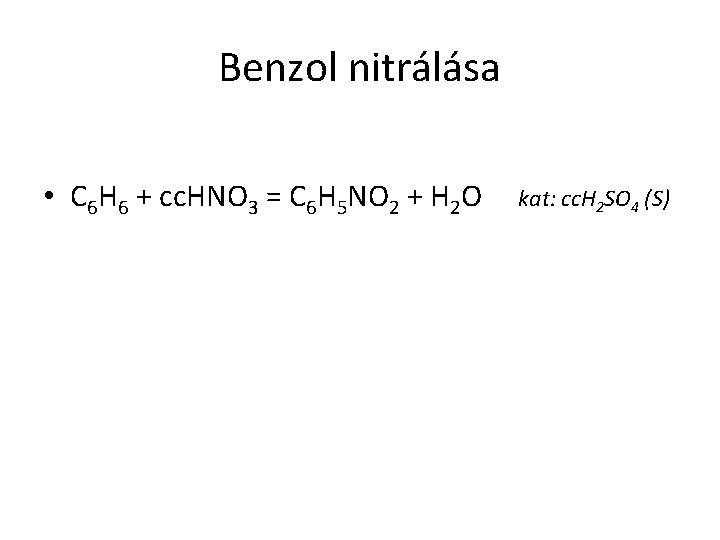
Benzol nitrálása • C 6 H 6 + cc. HNO 3 = C 6 H 5 NO 2 + H 2 O kat: cc. H 2 SO 4 (S)

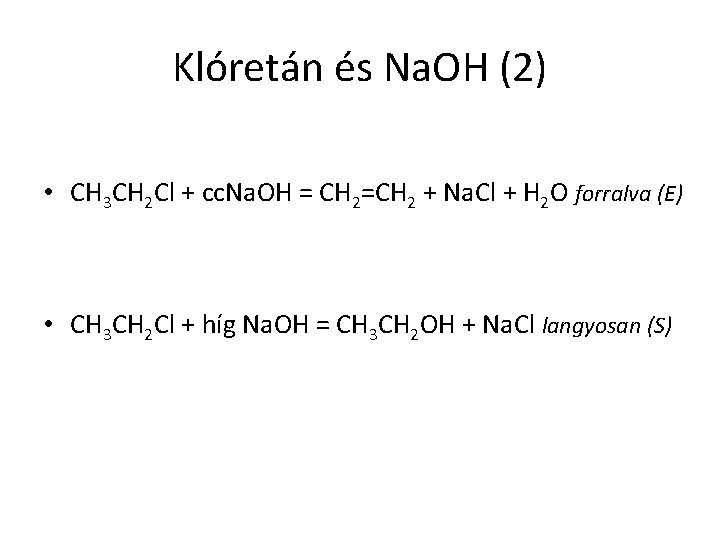
Klóretán és Na. OH (2) • CH 3 CH 2 Cl + cc. Na. OH = CH 2=CH 2 + Na. Cl + H 2 O forralva (E) • CH 3 CH 2 Cl + híg Na. OH = CH 3 CH 2 OH + Na. Cl langyosan (S)

Etén (etilén) hidratálása, etil-alkohol ip. eá. • CH 2=CH 2 + H 2 O ⇌ CH 3–CH 2–OH nagy P (70– 80 MPa), mérsékelten magas T (2– 300 o. C), kat. , vízfölösleg

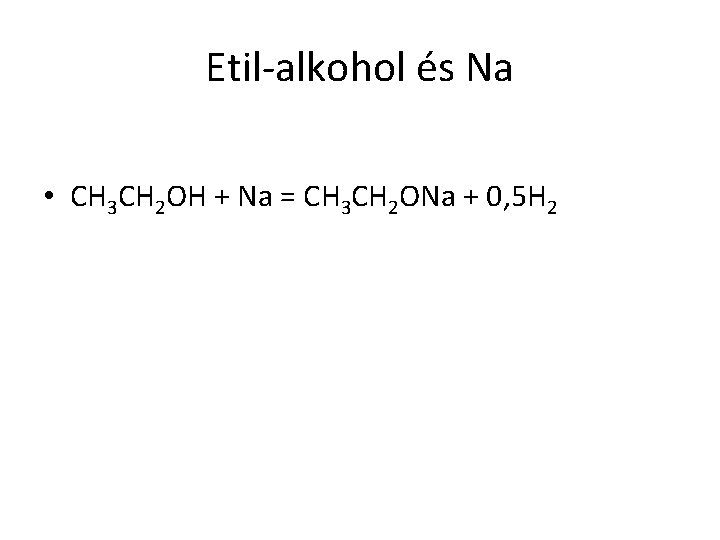
Etil-alkohol és Na • CH 3 CH 2 OH + Na = CH 3 CH 2 ONa + 0, 5 H 2

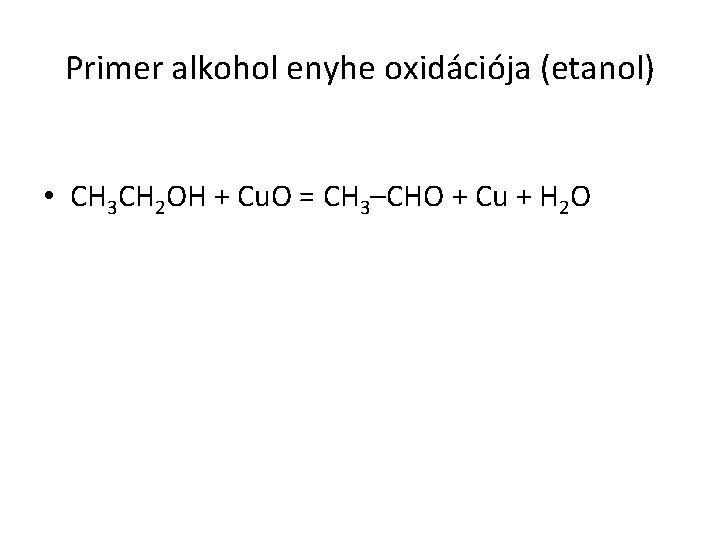
Primer alkohol enyhe oxidációja (etanol) • CH 3 CH 2 OH + Cu. O = CH 3–CHO + Cu + H 2 O

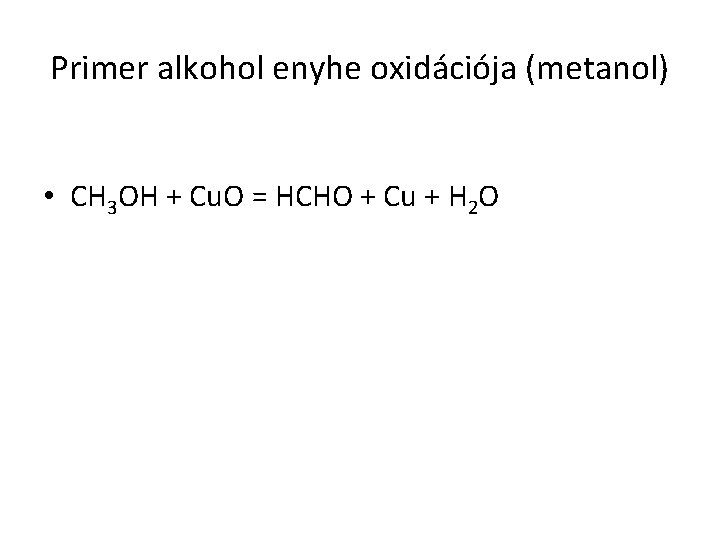
Primer alkohol enyhe oxidációja (metanol) • CH 3 OH + Cu. O = HCHO + Cu + H 2 O

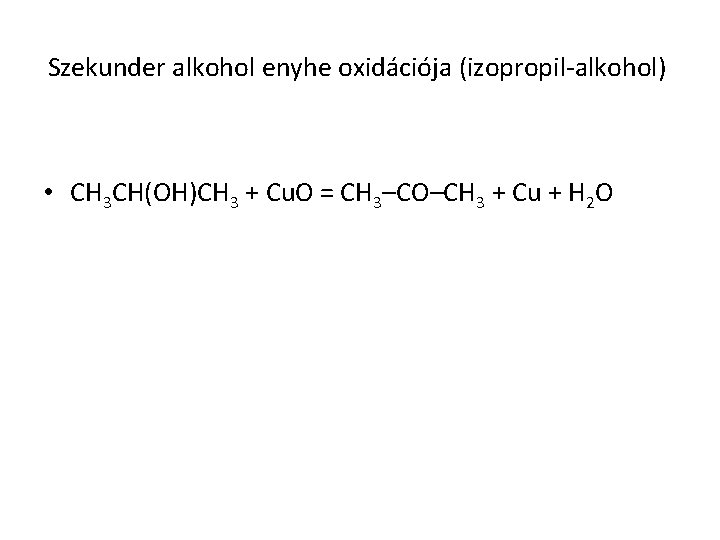
Szekunder alkohol enyhe oxidációja (izopropil-alkohol) • CH 3 CH(OH)CH 3 + Cu. O = CH 3–CO–CH 3 + Cu + H 2 O

Keton erélyes, lánchasadással járó oxidációja • CH 3–CO–CH 3 → HCOOH, CH 3–COOH, CO 2 kat. : cc. HNO 3

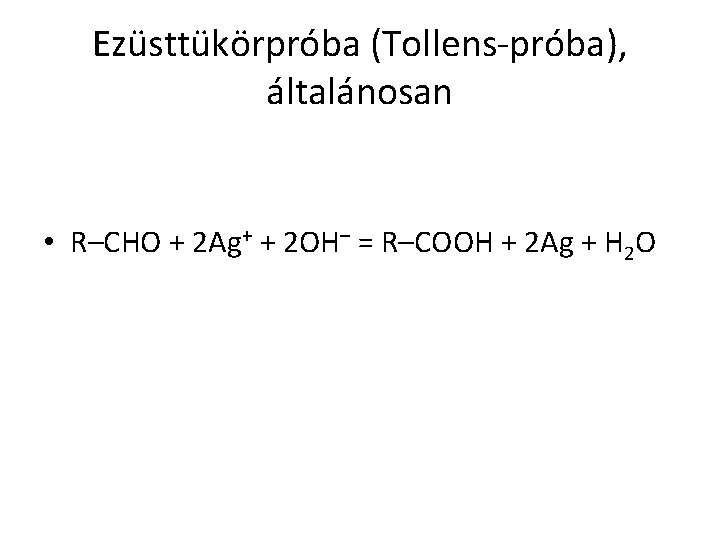
Ezüsttükörpróba (Tollens-próba), általánosan • R–CHO + 2 Ag+ + 2 OH– = R–COOH + 2 Ag + H 2 O

Formaldehid ezüsttükörpróbája • HCHO + 4 Ag+ + 4 OH– = CO 2 + 4 Ag + 3 H 2 O

Hangyasav ezüsttükörpróbája • HCOOH + 2 Ag+ + 2 OH– = CO 2 + 2 Ag + 2 H 2 O

Acetaldehid ezüsttükörpróbája • CH 3–CHO + 2 Ag+ + 2 OH– = CH 3–COOH + 2 Ag + H 2 O

Glükóz ezüsttükörpróbája • C 6 H 12 O 6 + 2 Ag+ + 2 OH– = C 6 H 12 O 7 + 2 Ag + H 2 O

Fehling-próba (általánosan) • R–CHO + 2 Cu 2+ + 4 OH– = R–COOH + Cu 2 O + 2 H 2 O

Formaldehid Fehling-próbája • HCHO + 2 Cu 2+ + 4 OH– = HCOOH + Cu 2 O + 2 H 2 O

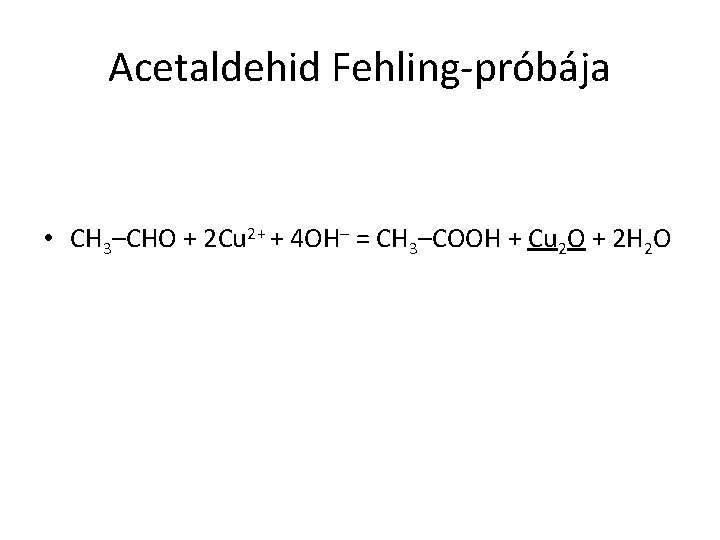
Acetaldehid Fehling-próbája • CH 3–CHO + 2 Cu 2+ + 4 OH– = CH 3–COOH + Cu 2 O + 2 H 2 O

Etil-acetát (észter) előállítása • CH 3–COOH + CH 3–CH 2–OH ⇌ CH 3–COO–CH 2–CH 3 + H 2 O kat: cc. H 2 SO 4

Etil-acetát (észter) lúgos hidrolízise (elszappanosítás) • CH 3–COO–CH 2 CH 3 + Na. OH = CH 3–COONa + CH 3 CH 2 OH

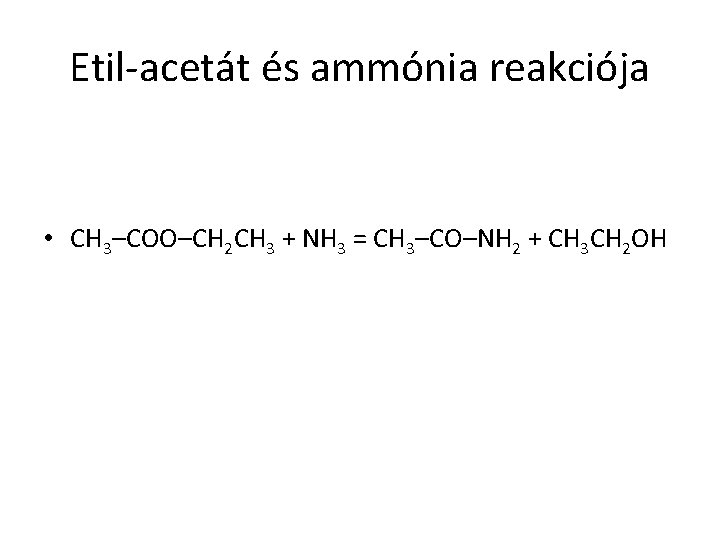
Etil-acetát és ammónia reakciója • CH 3–COO–CH 2 CH 3 + NH 3 = CH 3–CO–NH 2 + CH 3 CH 2 OH

Észter és amin reakciója • CH 3–COO–CH 2 CH 3 + CH 3 NH 2 = CH 3–CO–NH–CH 3 + CH 3 CH 2 OH

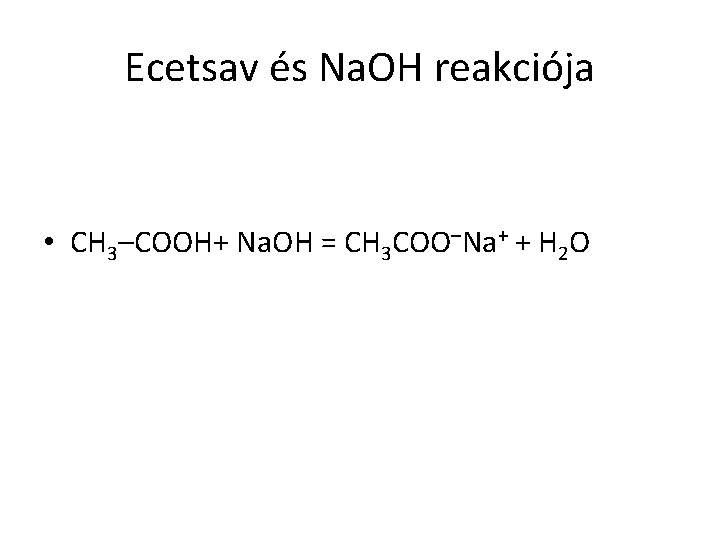
Ecetsav és Na. OH reakciója • CH 3–COOH+ Na. OH = CH 3 COO–Na+ + H 2 O
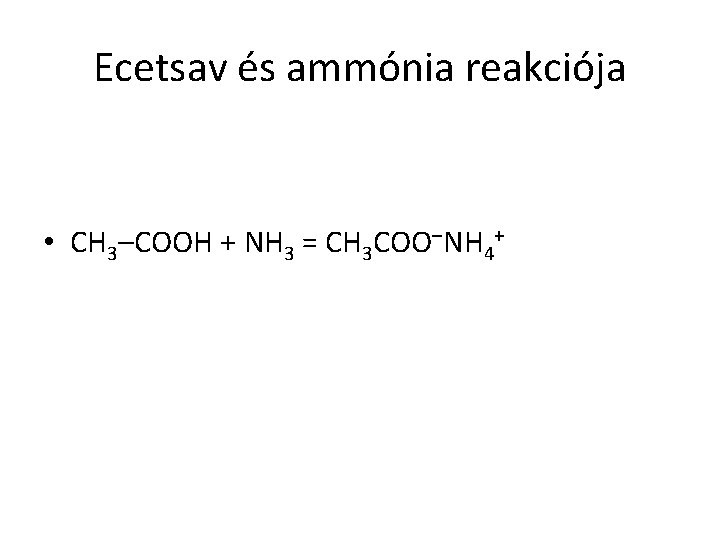
Ecetsav és ammónia reakciója • CH 3–COOH + NH 3 = CH 3 COO–NH 4+

Karbonsav és amin reakciója • CH 3–COOH+ CH 3 NH 2 = CH 3 COO–NH 3 CH 3+ metilammónium-acetát

Amin és kénsav reakciója • 2 CH 3 NH 2 + H 2 SO 4 = (CH 3 NH 3)2 SO 4 metil-ammónium - szulfát

Polietilén gyártás • n CH 2=CH 2 → (-CH 2 -)n kat. , T

Polipropilén gyártása • n CH 2=CH-CH 3 → (-CH-CH(CH 3)-)n kat. , T

Polivinil-klorid gyártása • n CH 2=CH-Cl → (-CH 2 -CH(Cl)-)n kat. , T

Polisztirol gyártása n → kat. , T

Teflon gyártása • n CF 2=CF 2 → (-CF 2 -)n

Vége a gyakorlásnak Esc gombbal léphet ki!























