Reakce aren CH 4 Chemick reakce a dje



- Slides: 12


Reakce arenů CH- 4 Chemické reakce a děje , DUM č. 14 septima osmiletého studia Mgr. Radovan Sloup Gymnázium Sušice Tento materiál byl vytvořen v rámci projektu Gymnázium Sušice – Brána vzdělávání II

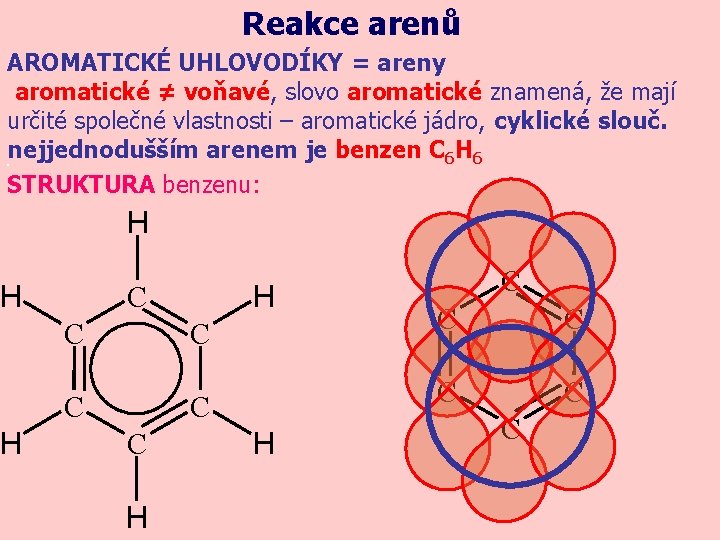
Reakce arenů AROMATICKÉ UHLOVODÍKY = areny aromatické ≠ voňavé, slovo aromatické znamená, že mají určité společné vlastnosti – aromatické jádro, cyklické slouč. nejjednodušším arenem je benzen C 6 H 6. STRUKTURA benzenu: H H C C C

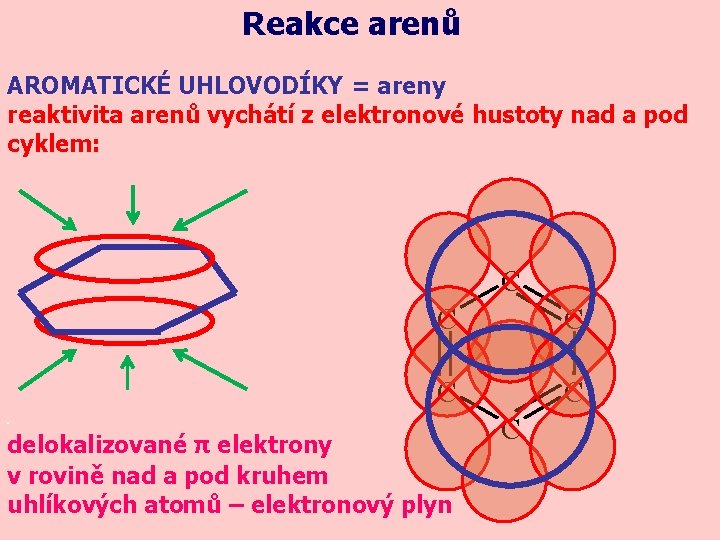
Reakce arenů AROMATICKÉ UHLOVODÍKY = areny reaktivita arenů vychátí z elektronové hustoty nad a pod cyklem: C C delokalizované π elektrony v rovině nad a pod kruhem uhlíkových atomů – elektronový plyn C

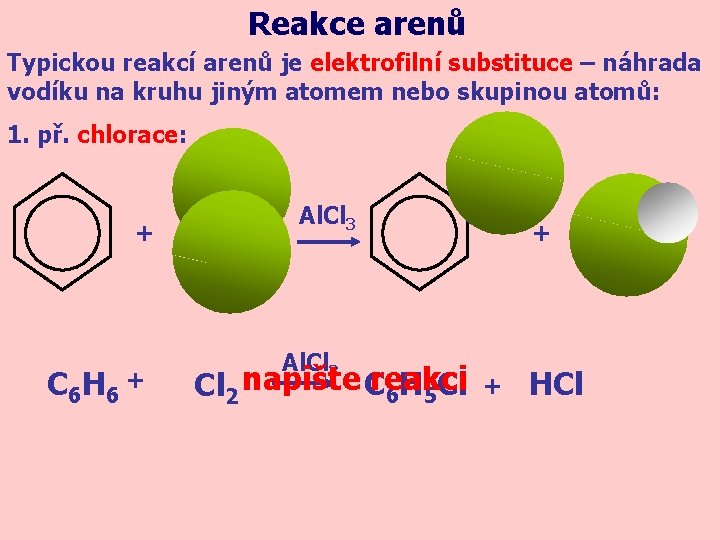
Reakce arenů Typickou reakcí arenů je elektrofilní substituce – náhrada vodíku na kruhu jiným atomem nebo skupinou atomů: 1. př. chlorace: + C 6 H 6 + Al. Cl 3 Cl 2 napište Creakci 6 H 5 Cl + + HCl

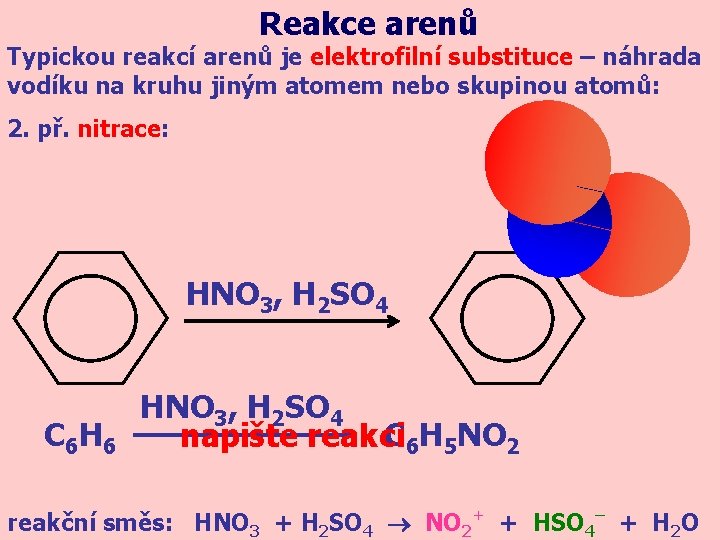
Reakce arenů Typickou reakcí arenů je elektrofilní substituce – náhrada vodíku na kruhu jiným atomem nebo skupinou atomů: 2. př. nitrace: HNO 3, H 2 SO 4 C 6 H 5 NO 2 napište reakci reakční směs: HNO 3 + H 2 SO 4 NO 2+ + HSO 4– + H 2 O

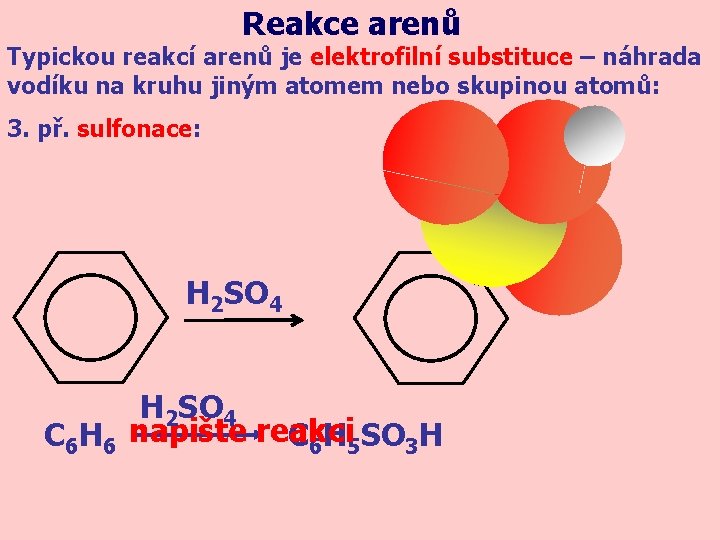
Reakce arenů Typickou reakcí arenů je elektrofilní substituce – náhrada vodíku na kruhu jiným atomem nebo skupinou atomů: 3. př. sulfonace: H 2 SO 4 C 6 H 6 napište reakci C 6 H 5 SO 3 H

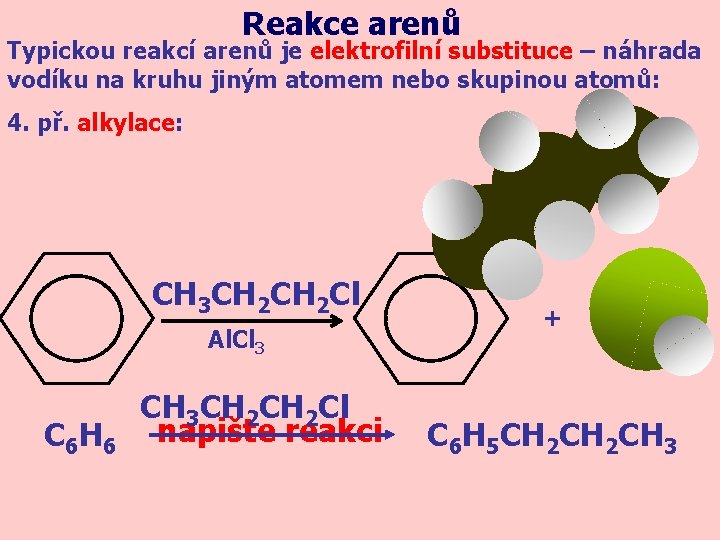
Reakce arenů Typickou reakcí arenů je elektrofilní substituce – náhrada vodíku na kruhu jiným atomem nebo skupinou atomů: 4. př. alkylace: CH 3 CH 2 Cl Al. Cl 3 C 6 H 6 CH 3 CH 2 Cl napište reakci + C 6 H 5 CH 2 CH 3

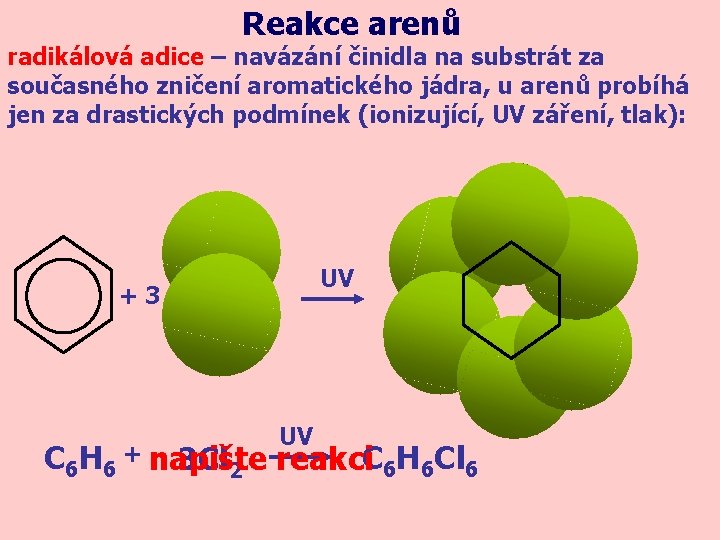
Reakce arenů radikálová adice – navázání činidla na substrát za současného zničení aromatického jádra, u arenů probíhá jen za drastických podmínek (ionizující, UV záření, tlak): UV +3 UV C 6 H 6 + napište 3 Cl 2 reakci. C 6 H 6 Cl 6

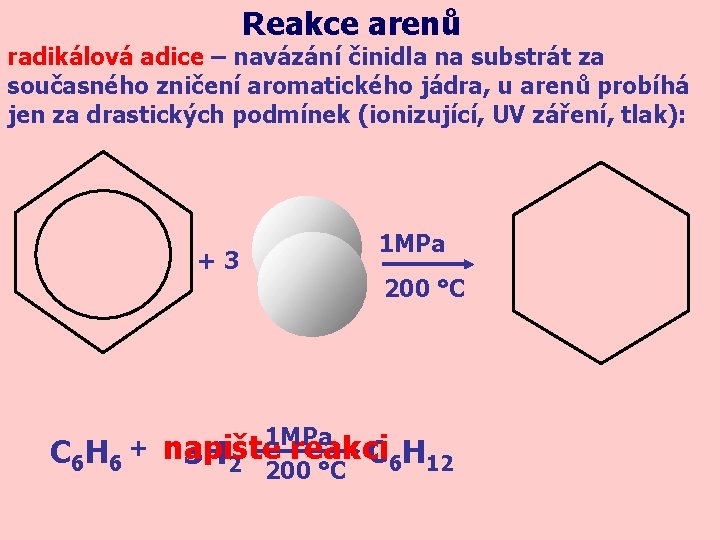
Reakce arenů radikálová adice – navázání činidla na substrát za současného zničení aromatického jádra, u arenů probíhá jen za drastických podmínek (ionizující, UV záření, tlak): +3 C 6 H 6 + 1 MPa 200 °C 1 MPa napište reakci C H 3 H 2 200 6 12 °C

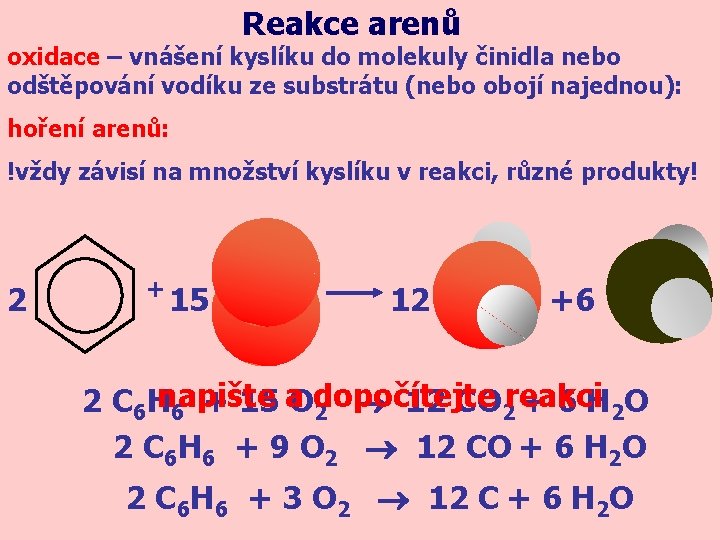
Reakce arenů oxidace – vnášení kyslíku do molekuly činidla nebo odštěpování vodíku ze substrátu (nebo obojí najednou): hoření arenů: !vždy závisí na množství kyslíku v reakci, různé produkty! 2 + 15 12 +6 a dopočítejte reakci 2 C 6 Hnapište + 15 O 12 CO 6 2 2 + 6 H 2 O 2 C 6 H 6 + 9 O 2 12 CO + 6 H 2 O 2 C 6 H 6 + 3 O 2 12 C + 6 H 2 O

REAKCE ARENŮ Vytvořeno v rámci projektu Gymnázium Sušice - Brána vzdělávání II Autor: Mgr. Radovan Sloup, Gymnázium Sušice Předmět: Chemie (Chemické reakce a děje) Třída: septima osmiletého studia Označení: VY_32_INOVACE_Ch-4_14 Datum vytvoření: září 2013 Anotace a metodické poznámky Reakce arenů vycházejí z tématu organických reakcí a jejich průběhu. Tato prezentace poskytuje přehled základních reakcí arenů s jejich konkrétními příklady. Pro připomenutí je v úvodu každého typu reakce arenů zmíněn i její základní mechanismus a charakteristika. Mezi základní reakce arenů patří elektrofilní substituce, radikálová adice a oxidace. Zvládnutí organické chemie spočívá v pochopení mechanismů a průběhu základních reakcí uhlovodíků. Během prezentace jsou jednoduchá cvičení k orientaci v reakcích a jejich zápisu. Prezentaci je možné doplnit dalšími reakcemi. Použité materiály: Honza, J. ; Mareček, A. ; Chemie pro čtyřletá gymnázia (2. díl). Brno: Da. Ta. Print, 1996; ISBN 80 -902200 -4 -5 Pacák, J. ; Chemie pro 2. ročník gymnázií. Praha: SPN, 1985 Obrázky, animace a schémata jsou dílem autora prezentace. Vše je vytvořeno pomocí nástrojů Power Point 2003, Chem. Sketch 11. 01, Malování Materiály jsou určeny pro bezplatné používání pro potřeby výuky a vzdělávání na všech typech škol a školských zařízení. Jakékoliv další využití podléhá autorskému zákonu.