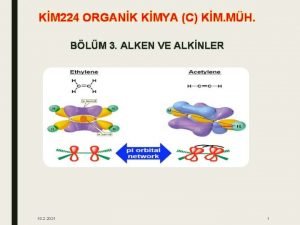
Reakce alken CH 4 Chemick reakce a dje







- Slides: 13


Reakce alkenů CH- 4 Chemické reakce a děje , DUM č. 11 septima osmiletého studia Mgr. Radovan Sloup Gymnázium Sušice Tento materiál byl vytvořen v rámci projektu Gymnázium Sušice – Brána vzdělávání II

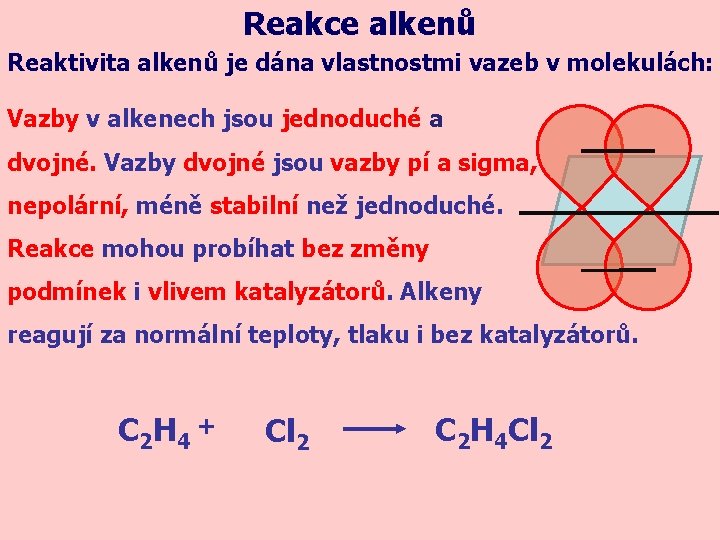
Reakce alkenů Reaktivita alkenů je dána vlastnostmi vazeb v molekulách: Vazby v alkenech jsou jednoduché a dvojné. Vazby dvojné jsou vazby pí a sigma, nepolární, méně stabilní než jednoduché. Reakce mohou probíhat bez změny podmínek i vlivem katalyzátorů. Alkeny reagují za normální teploty, tlaku i bez katalyzátorů. C 2 H 4 + Cl 2 C 2 H 4 Cl 2

Reakce alkenů Typickou reakcí alkenů je adice – navázání činidla na substrát za snížení násobnosti vazby v substrátu: Al. Cl 3 + Al. Cl 3 CH 2=CH 2 + Cl 2 C 2 H 4 Cl 2

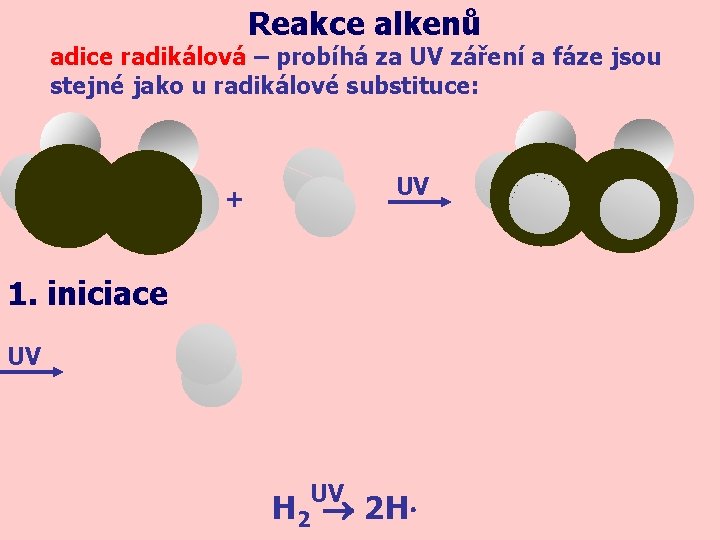
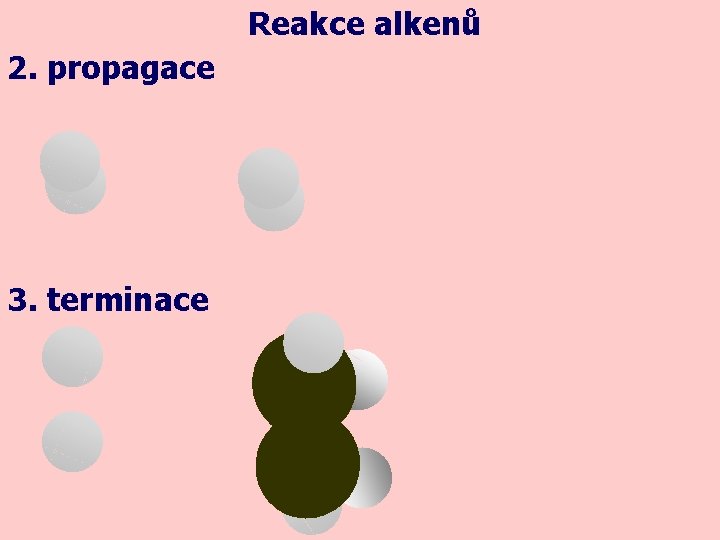
Reakce alkenů adice radikálová – probíhá za UV záření a fáze jsou stejné jako u radikálové substituce: UV + 1. iniciace UV UV H 2 2 H∙

Reakce alkenů 2. propagace 3. terminace

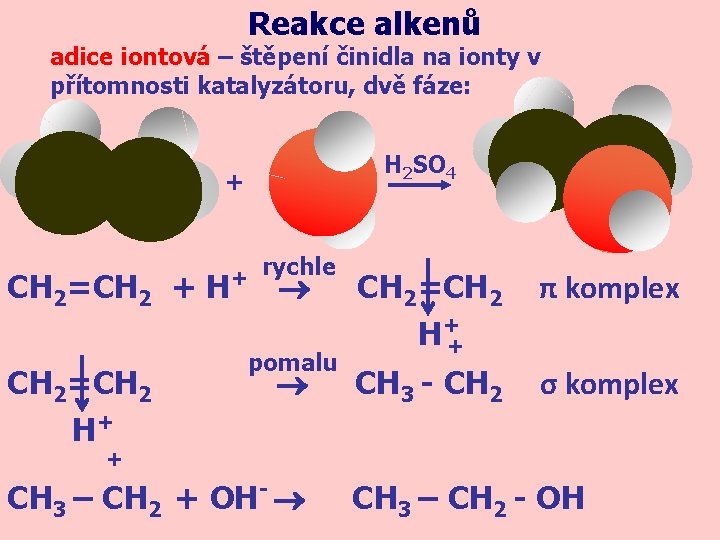
Reakce alkenů adice iontová – štěpení činidla na ionty v přítomnosti katalyzátoru, dvě fáze: H 2 SO 4 + CH 2=CH 2 + H CH 2=CH 2 H+ + rychle pomalu CH 2=CH 2 H++ π komplex CH 3 - CH 2 σ komplex + - CH 3 – CH 2 + OH CH 3 – CH 2 - OH

eliminace: Reakce alkenů 2. eliminace, reakce alkenů, kdy se zvyšuje násobnost vazby (při současném odštěpení molekul(y) vodíku). + CH 2=CH 2 - H 2 CH = CH Jak jinak můžeme napsat průběh této eliminace? CH 2=CH 2 CH = CH + H 2

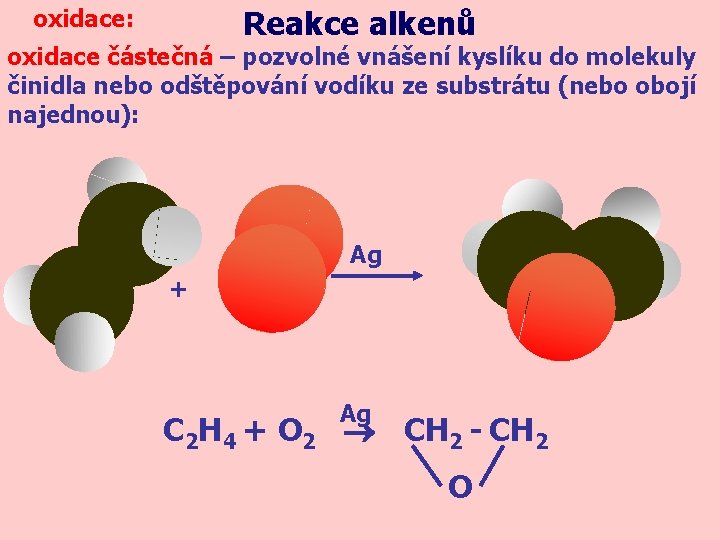
Reakce alkenů oxidace: oxidace částečná – pozvolné vnášení kyslíku do molekuly činidla nebo odštěpování vodíku ze substrátu (nebo obojí najednou): Ag + Ag C 2 H 4 + O 2 CH 2 - CH 2 O

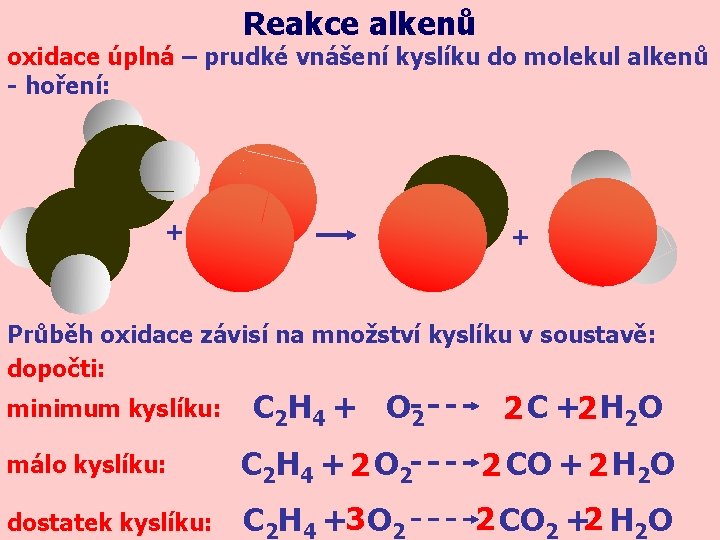
Reakce alkenů oxidace úplná – prudké vnášení kyslíku do molekul alkenů - hoření: + + Průběh oxidace závisí na množství kyslíku v soustavě: dopočti: minimum kyslíku: C 2 H 4 + O 2 2 C +2 H 2 O málo kyslíku: C 2 H 4 + 2 O 2 2 CO + 2 H 2 O dostatek kyslíku: C 2 H 4 +3 O 2 2 CO 2 +2 H 2 O

Reakce alkenů polymerace - reakce velkého množství monomerů za vzniku polymerů (nevzniká vedlejší produkt) - několikanásobná adice - podmínkou je přítomnost minimálně 1 dvojné vazby v monomeru např. polymerací ethylenu vzniká polyethylen n (CH 2 = CH 2) → -[ CH 2 – CH 2 -] n

Reakce alkenů izomerace - přesune se dvojná vazba v rámci molekuly, žádné činidlo - využívá se velmi často při výrobě syntetického kaučuku př. CH 3 – CH 2 – CH = CH 2 1 - buten Pojmenujte produkty: CH 3 – CH = CH - CH 3 2 - buten

REAKCE ALKENŮ Vytvořeno v rámci projektu Gymnázium Sušice - Brána vzdělávání II Autor: Mgr. Radovan Sloup, Gymnázium Sušice Předmět: Chemie (Chemické reakce a děje) Třída: septima osmiletého studia Označení: VY_32_INOVACE_Ch-4_11 Datum vytvoření: září 2013 Anotace a metodické poznámky Reakce alkenů vychází z tématu organických reakcí a jejich průběhu. Navazuje také na reakce alkanů. Proto nemusí být v úvodu každé reakce alkenů zmíněn její mechanismus. Mezi základní reakce alkanů patří radikálová a iontová adice, eliminace, oxidace a izomerace. Tato prezentace poskytuje přehled základních reakcí alkenů s jejich konkrétními příklady. Během prezentace je několik jednoduchých cvičení k orientaci v reakcích. Prezentaci je možné doplnit dalšími reakcemi, nebo praktickými ukázkami reakcí, např, adice bromu na ethen. Použité materiály: Honza, J. ; Mareček, A. ; Chemie pro čtyřletá gymnázia (3. díl). Brno: Da. Ta. Print, 2000; ISBN 80 -7182 -057 -1 Pacák, J. ; Chemie pro 2. ročník gymnázií. Praha: SPN, 1986 Obrázky, animace a schémata jsou dílem autora prezentace. Vše je vytvořeno pomocí nástrojů Power. Point 2003, Chem. Sketch 11. 01, Gimp 2 Materiály jsou určeny pro bezplatné používání pro potřeby výuky a vzdělávání na všech typech škol a školských zařízení. Jakékoliv další využití podléhá autorskému zákonu.