REACTII DE IDENTIFICARE Identificarea anionilor si cationilor Reactii




- Slides: 14

REACTII DE IDENTIFICARE Identificarea anionilor si cationilor

Reactii de precipitare Identificarea anionilor – grupele analitice de anioni Identificarea cationilor Scheme de separare a cationilor prin precipitare cu reactivi de grupa

Separarea anionilor Impartirea anionilor in grupe analitice se face cu ajutorul unor reactivi de grupa. Se obtin informatii privind prezenta sau absenta unor anioni nu si fractionarea amestecului pentru alte analize

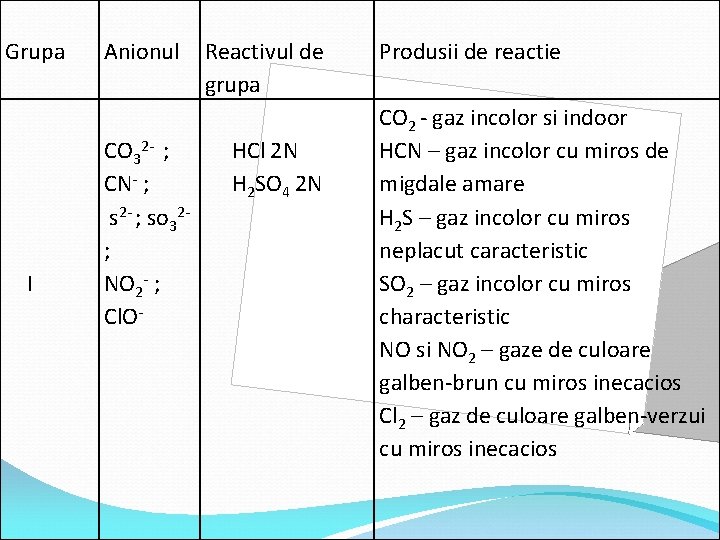
Grupa I Anionul CO 32 - ; CN- ; s 2 - ; so 32; NO 2 - ; Cl. O- Reactivul de grupa HCl 2 N H 2 SO 4 2 N Produsii de reactie CO 2 - gaz incolor si indoor HCN – gaz incolor cu miros de migdale amare H 2 S – gaz incolor cu miros neplacut caracteristic SO 2 – gaz incolor cu miros characteristic NO si NO 2 – gaze de culoare galben-brun cu miros inecacios Cl 2 – gaz de culoare galben-verzui cu miros inecacios

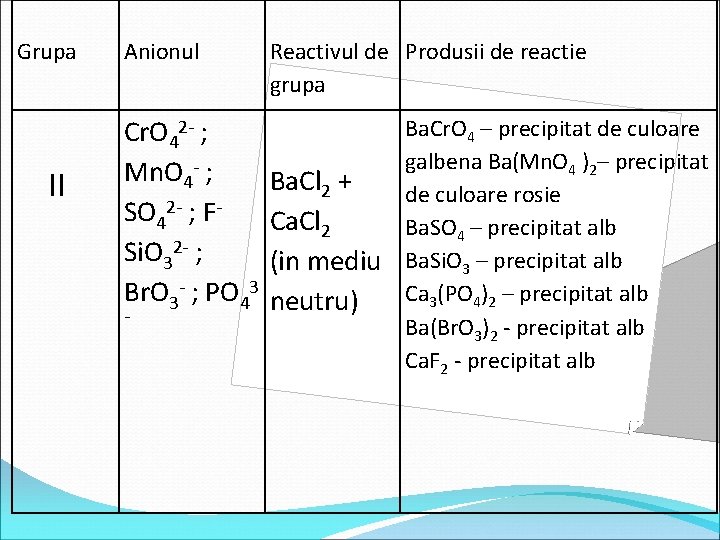
Grupa II Anionul Cr. O 42 - ; Mn. O 4 - ; SO 42 - ; FSi. O 32 - ; Br. O 3 - ; PO 43 - Reactivul de Produsii de reactie grupa Ba. Cl 2 + Ca. Cl 2 (in mediu neutru) Ba. Cr. O 4 – precipitat de culoare galbena Ba(Mn. O 4 )2– precipitat de culoare rosie Ba. SO 4 – precipitat alb Ba. Si. O 3 – precipitat alb Ca 3(PO 4)2 – precipitat alb Ba(Br. O 3)2 - precipitat alb Ca. F 2 - precipitat alb

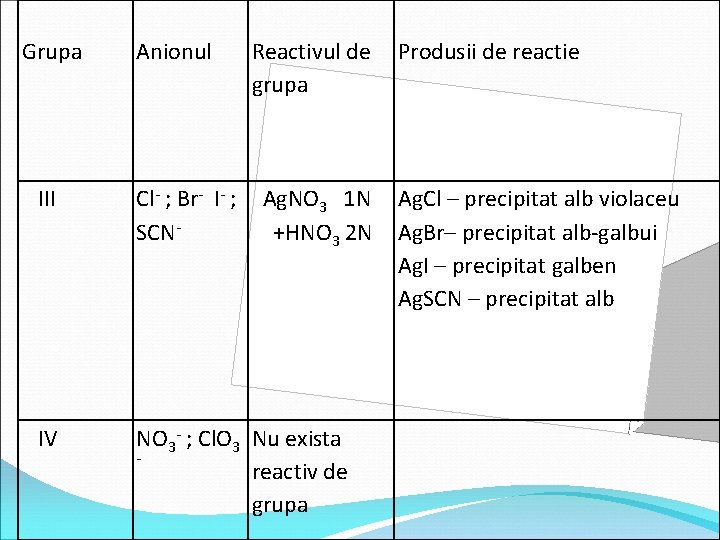
Grupa Anionul Reactivul de grupa III Cl- ; Br- I- ; SCN- Ag. NO 3 1 N +HNO 3 2 N IV NO 3 - ; Cl. O 3 Nu exista reactiv de grupa Produsii de reactie Ag. Cl – precipitat alb violaceu Ag. Br– precipitat alb-galbui Ag. I – precipitat galben Ag. SCN – precipitat alb

Metode de separare a cationilor Se cunosc numeroase reactii care permit identificarea cationilor in solutie dar putine dintre acestea sunt selective. Este necesara separarea cationilor din amestecuri, eventual o separare in grupuri pana la ioni care sa nu interfere , chiar un singur ion , pentru o analiza cat mai exacta.

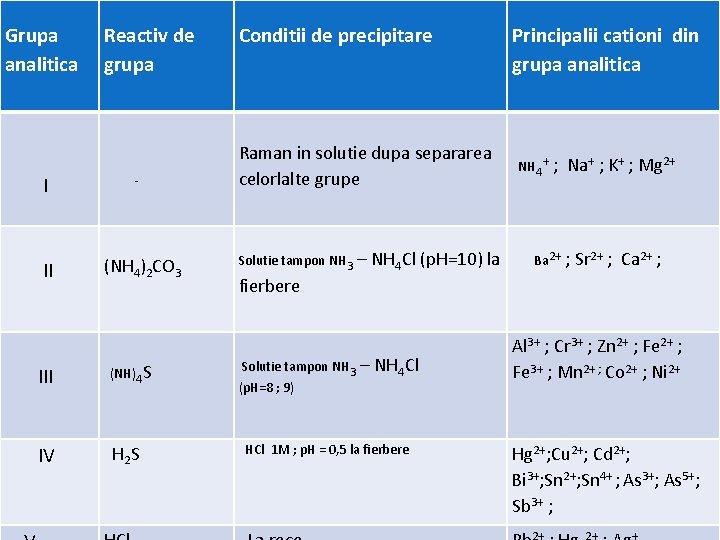
Grupa analitica Reactiv de grupa I II - (NH 4)2 CO 3 III (NH)4 S IV H 2 S Conditii de precipitare Raman in solutie dupa separarea celorlalte grupe Solutie tampon NH 3 – NH 4 Cl (p. H=10) la Principalii cationi din grupa analitica NH 4+ ; Na+ ; K+ ; Mg 2+ Ba 2+ ; Sr 2+ ; Ca 2+ ; fierbere Solutie tampon NH 3 (p. H=8 ; 9) – NH 4 Cl HCl 1 M ; p. H = 0, 5 la fierbere Al 3+ ; Cr 3+ ; Zn 2+ ; Fe 3+ ; Mn 2+ ; Co 2+ ; Ni 2+ Hg 2+; Cu 2+; Cd 2+; Bi 3+; Sn 2+; Sn 4+ ; As 3+; As 5+; Sb 3+ ;

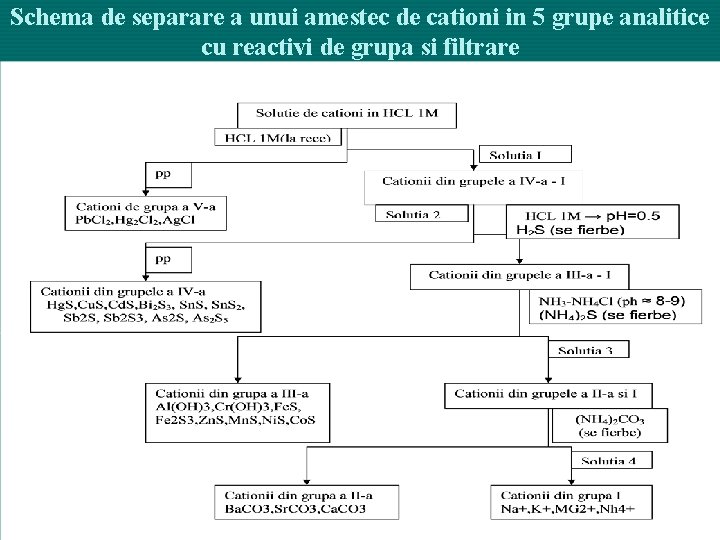
Schema de separare a unui amestec de cationi in 5 grupe analitice cu reactivi de grupa si filtrare

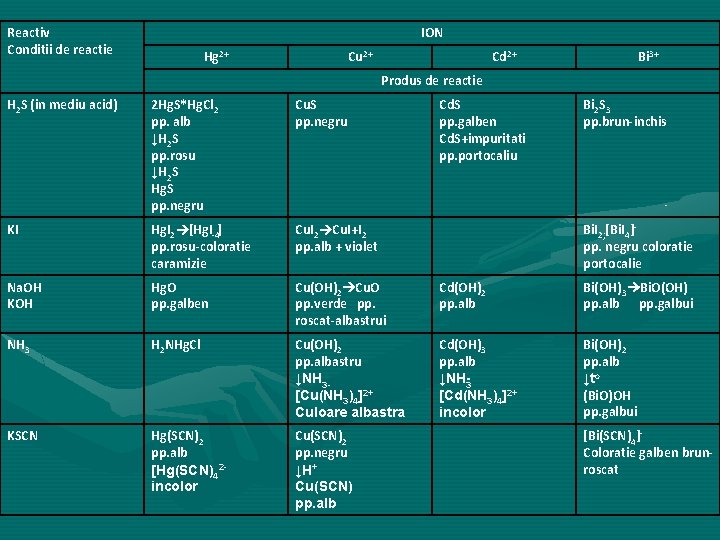
Reactiv Conditii de reactie ION Hg 2+ Cu 2+ Cd 2+ Bi 3+ Produs de reactie H 2 S (in mediu acid) 2 Hg. S*Hg. Cl 2 pp. alb ↓H 2 S pp. rosu ↓H 2 S Hg. S pp. negru Cu. S pp. negru Cd. S pp. galben Cd. S+impuritati pp. portocaliu Bi 2 S 3 pp. brun inchis KI Hg. I 2 [Hg. I 4] pp. rosu coloratie caramizie Cu. I 2 Cu. I+I 2 pp. alb + violet Na. OH KOH Hg. O pp. galben Cu(OH)2 Cu. O pp. verde pp. roscat albastrui Cd(OH)2 pp. alb Bi(OH)3 Bi. O(OH) pp. alb pp. galbui NH 3 H 2 NHg. Cl Cu(OH)2 pp. albastru ↓NH 3 [Cu(NH 3)4]2+ Culoare albastra Cd(OH)3 pp. alb ↓NH 3 [Cd(NH 3)4]2+ incolor Bi(OH)2 pp. alb ↓to (Bi. O)OH pp. galbui KSCN Hg(SCN)2 pp. alb [Hg(SCN)42 incolor Cu(SCN)2 pp. negru ↓H+ Cu(SCN) pp. alb Bi. I 2; [Bi. I 4] pp. negru coloratie portocalie [Bi(SCN)4] Coloratie galben brun roscat

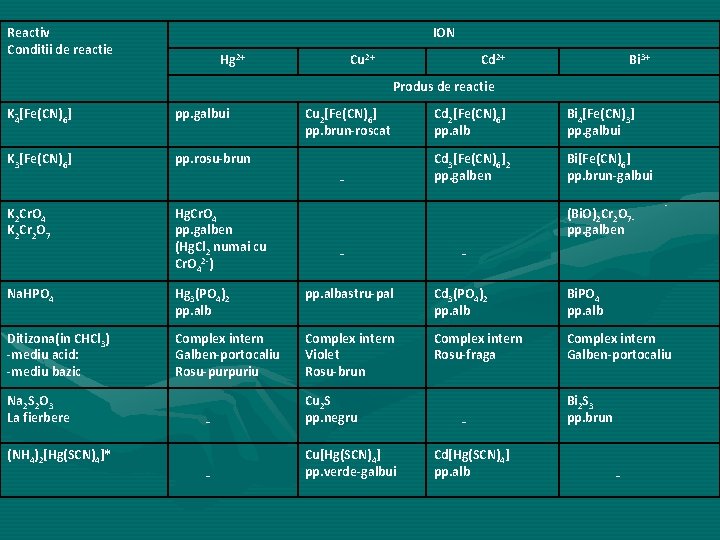
Reactiv Conditii de reactie ION Hg 2+ Cu 2+ Cd 2+ Bi 3+ Produs de reactie K 4[Fe(CN)6] pp. galbui K 3[Fe(CN)6] pp. rosu brun Cu 2[Fe(CN)6] pp. brun roscat - K 2 Cr. O 4 K 2 Cr 2 O 7 Hg. Cr. O 4 pp. galben (Hg. Cl 2 numai cu Cr. O 42 ) Cd 2[Fe(CN)6] pp. alb Bi 4[Fe(CN)3] pp. galbui Cd 3[Fe(CN)6]2 pp. galben Bi[Fe(CN)6] pp. brun galbui (Bi. O)2 Cr 2 O 7 pp. galben - - Na. HPO 4 Hg 3(PO 4)2 pp. albastru pal Cd 3(PO 4)2 pp. alb Bi. PO 4 pp. alb Ditizona(in CHCl 3) mediu acid: mediu bazic Complex intern Galben portocaliu Rosu purpuriu Complex intern Violet Rosu brun Complex intern Rosu fraga Complex intern Galben portocaliu Na 2 S 2 O 3 La fierbere - Cu 2 S pp. negru - Cu[Hg(SCN)4] pp. verde galbui (NH 4)2[Hg(SCN)4]* Cd[Hg(SCN)4] pp. alb Bi 2 S 3 pp. brun -

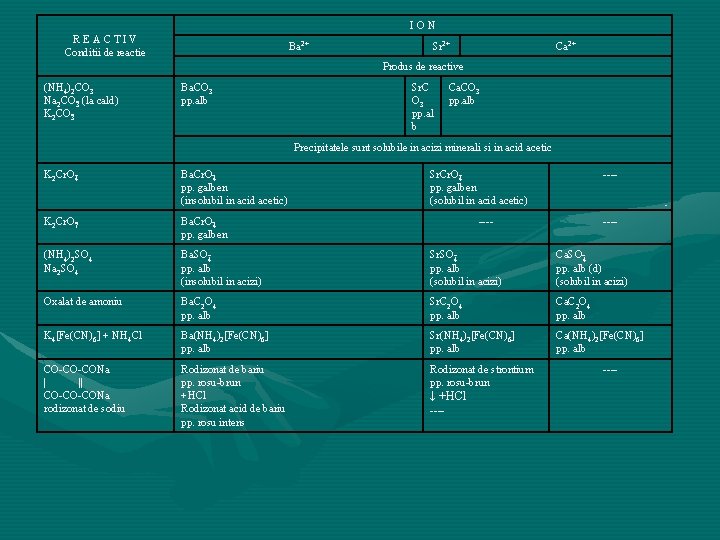
ION REACTIV Conditii de reactie Ba 2+ Sr 2+ Ca 2+ Produs de reactive (NH 4)2 CO 3 Na 2 CO 3 (la cald) K 2 CO 3 Ba. CO 3 pp. alb Sr. C O 3 pp. al b Ca. CO 3 pp. alb Precipitatele sunt solubile in acizi minerali si in acid acetic K 2 Cr. O 4 Ba. Cr. O 4 pp. galben (insolubil in acid acetic) Sr. Cr. O 4 pp. galben (solubil in acid acetic) K 2 Cr. O 7 Ba. Cr. O 4 pp. galben (NH 4)2 SO 4 Na 2 SO 4 Ba. SO 4 pp. alb (insolubil in acizi) Sr. SO 4 pp. alb (solubil in acizi) Ca. SO 4 pp. alb (d) (solubil in acizi) Oxalat de amoniu Ba. C 2 O 4 pp. alb Sr. C 2 O 4 pp. alb Ca. C 2 O 4 pp. alb K 4[Fe(CN)6] + NH 4 Cl Ba(NH 4)2[Fe(CN)6] pp. alb Sr(NH 4)2[Fe(CN)6] pp. alb Ca(NH 4)2[Fe(CN)6] pp. alb CO CO CONa | || CO CO CONa rodizonat de sodiu Rodizonat de bariu pp. rosu brun +HCl Rodizonat acid de bariu pp. rosu intens Rodizonat de strontium pp. rosu brun ↓ +HCl

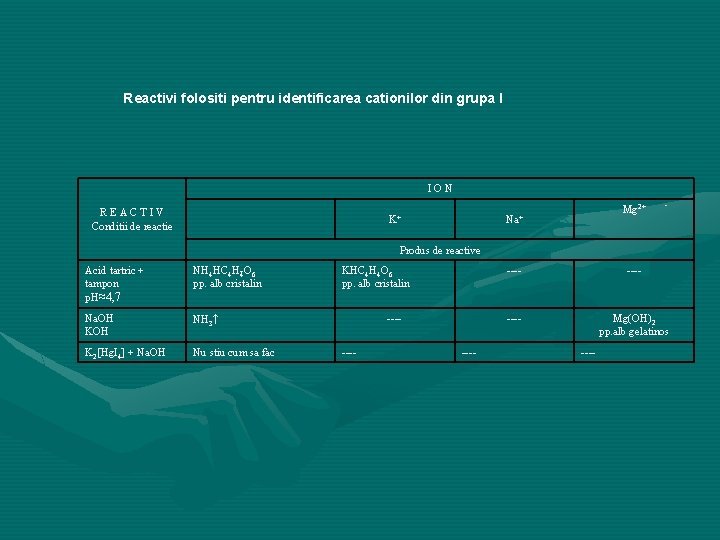
Reactivi folositi pentru identificarea cationilor din grupa I ION REACTIV Conditii de reactie K+ Mg 2+ Na+ Produs de reactive Acid tartric + tampon p. H≈4, 7 NH 4 HC 4 H 4 O 6 pp. alb cristalin Na. OH KOH NH 3↑ K 2[Hg. I 4] + Na. OH Nu stiu cum sa fac KHC 4 H 4 O 6 pp. alb cristalin Mg(OH)2 pp. alb gelatinos

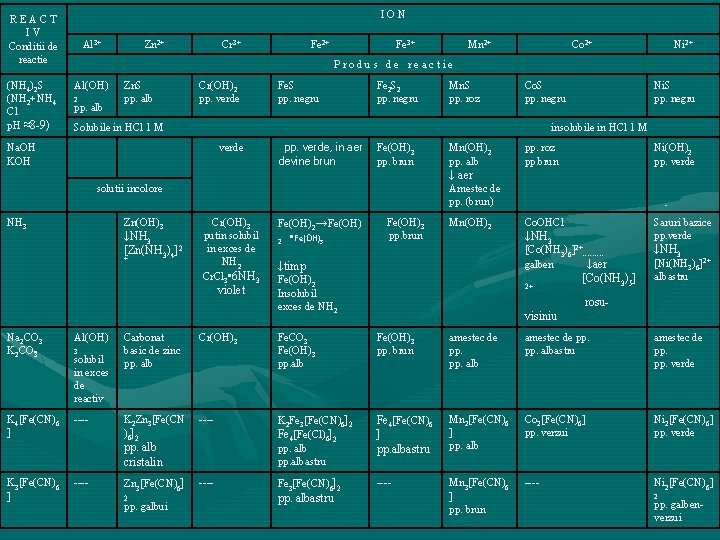
ION REACT IV Conditii de reactie (NH 4)2 S (NH 2+NH 4 Cl p. H ≈8 9) Al 3+ Zn 2+ Cr 3+ Fe 2+ Fe 3+ Mn 2+ Co 2+ Ni 2+ Produs de reactie Al(OH) 2 pp. alb Zn. S pp. alb Cr(OH)2 pp. verde Fe. S pp. negru Fe 2 S 2 pp. negru Mn. S pp. roz Co. S pp. negru Solubile in HCl 1 M Ni. S pp. negru insolubile in HCl 1 M Na. OH KOH verde pp. verde, in aer devine brun Fe(OH)3 pp. brun Mn(OH)2 pp. alb pp. roz pp. brun Ni(OH)2 pp. verde Co. OHCl Saruri bazice pp. verde ↓ aer Amestec de pp. (brun) solutii incolore NH 3 Zn(OH)3 ↓NH 3 [Zn(NH 3)4]2 + Cr(OH)3 putin solubil in exces de NH 2 Cr. Cl 3 • 6 NH 3 violet Na 2 CO 3 K 2 CO 3 Al(OH) K 4[Fe(CN)6 ] 3 solubil in exces de reactiv 2 • Fe(OH)3 pp. brun Mn(OH)2 ↓NH 3 [Co(NH 3)6]2+ galben ↓aer ↓timp Fe(OH)2 Insolubil exces de NH 2 2+ [Co(NH 3)5] ↓NH 3 [Ni(NH 3)6]2+ albastru rosu visiniu Carbonat basic de zinc pp. alb Cr(OH)3 Fe. CO 3 Fe(OH)3 pp. alb Fe(OH)3 pp. brun amestec de pp. pp. albastru amestec de pp. verde K 2 Zn 3[Fe(CN )6]2 K 2 Fe 3[Fe(CN)6]2 Fe 4[Fe(Cl)6]2 pp. albastru Fe 4[Fe(CN)6 ] pp. albastru Mn 2[Fe(CN)6 ] pp. alb Co 2[Fe(CN)6] pp. verzui Ni 2[Fe(CN)6] pp. verde Zn 3[Fe(CN)6] Fe 3[Fe(CN)6]2 Mn 3[Fe(CN)6 ] pp. brun Ni 2[Fe(CN)6] pp. alb cristalin K 3[Fe(CN)6 ] Fe(OH)2→Fe(OH) 2 pp. galbui pp. albastru 2 pp. galben verzui