Ravni strukture proteinov Primarna struktura Sekundarna struktura Terciarna



























- Slides: 55

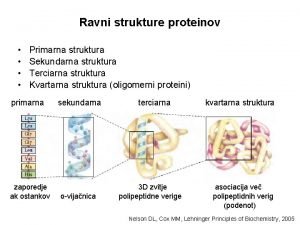
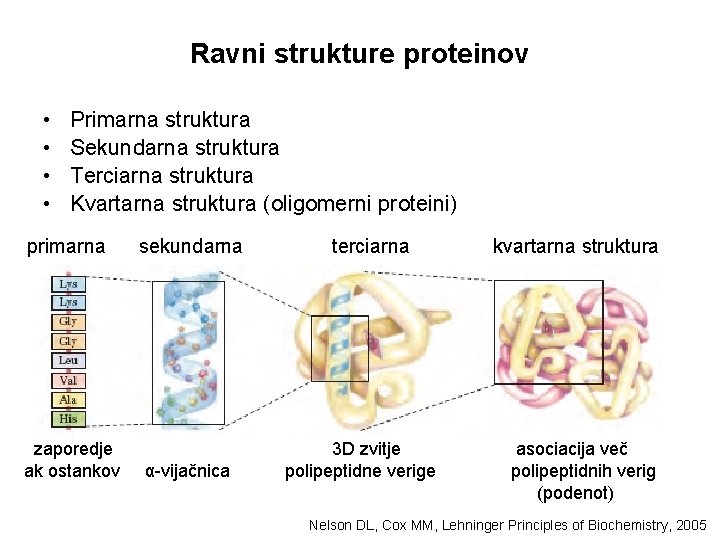
Ravni strukture proteinov • • Primarna struktura Sekundarna struktura Terciarna struktura Kvartarna struktura (oligomerni proteini) primarna zaporedje ak ostankov sekundarna α-vijačnica terciarna 3 D zvitje polipeptidne verige kvartarna struktura asociacija več polipeptidnih verig (podenot) Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

Ravni strukture proteinov • Primarna struktura: zaporedje aminokislinskih (ak) ostankov v polipeptidni verigi • Sekundarna struktura – nanaša se na lokalno konformacijo (bližnji ak ostanki) nekaterih delov polipeptida; primeri: - α-desnosučna vijačnica - β-struktura (paralelna, antiparalelna, mešana) - β-zavoj • Terciarna struktura – trodimenzionalna (3 D) struktura polipeptidne verige v prostoru • Kvartarna struktura – 3 D struktura več polipeptidnih verig (podenot), ki sestavljajo molekulo proteina (oligomerni proteini)

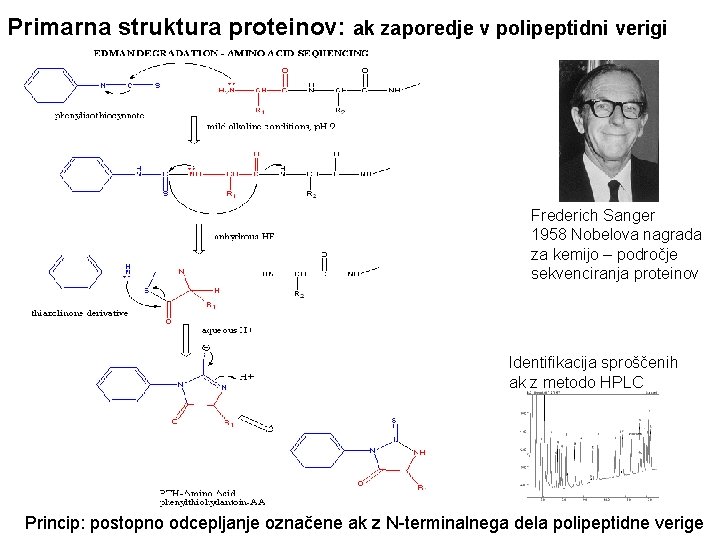
Primarna struktura proteinov: ak zaporedje v polipeptidni verigi Frederich Sanger 1958 Nobelova nagrada za kemijo – področje sekvenciranja proteinov Identifikacija sproščenih ak z metodo HPLC Princip: postopno odcepljanje označene ak z N-terminalnega dela polipeptidne verige

Glede na podobnost v zaporedju ak ostankov v polipeptidnih verigah razvrstimo proteine v družine in naddružine • Družine – velika podobnost v ak zaporedju (primarna struktura) in/ali v terciarni strukturi in funkciji (npr. globinski motiv). Proteini ene družine kažejo evolucijsko bližino organizmov. • Naddružine – dve ali več družin, katerih proteini ne kažejo podobnosti v ak zaporedju, imajo pa iste/podobne vzorce zvitja (motive) in opravljajo podobno funkcijo.

Informacije, ki jih dobimo iz znane primarne strukture proteinov • Primerjava primarne strukture proteinov → predvidevanje podobnosti glede strukture in funkcije proteinov. vrzel Primer: pravnava ak zaporedja dela proteina EF-Tu bakterij E. coli in Bacillus subtillis • Dve zaporedji sta homologni, če kažeta zaporedji visoko stopnjo podobnosti; izhajata iz istega gena • Konzervativna substitucija ak pomeni, da je prišlo do zamenjave ene ak z drugo, enako polarno ak (konzervativna substitucija je pogosta pri proteinih različnih živalskih vrst) • Če se določena ak nahaja na istem položaju v različnih proteinih – “invariant residues” - nespremenljivi ak ostanki; ti imajo ključno vlogo pri določanju strukture/funkcije proteina

Trodimenzionalna (3 D) struktura proteinov – konformacija (razporeditev vseh atomov v prostoru) • 3 D struktura je določena z ak zaporedjem polipeptida • Izolirani protein običajno obstaja v eni ali le nekaj stabilnih oblikah (nativna konformacija, ki odraža funkcijo proteina; je na najnižjem energijskem nivoju, G min. ) • Za stabilizacijo strukture so najpomembnejše šibke interakcije in v nekaterih primerih kovalentne disulfidne vezi (-S-S- mostički) • Le nekaj različnih osnovnih strukturnih vzorcev najdemo v tisočih naravnih proteinih • Funkcija proteina je odvisna od njegove strukture

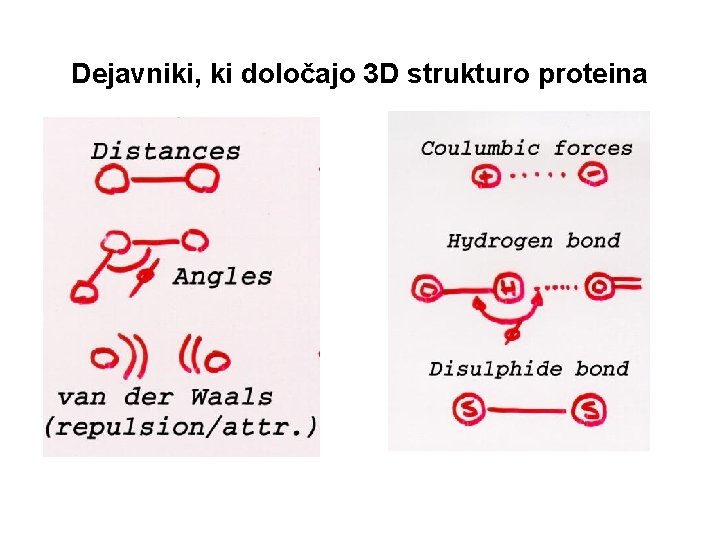
Dejavniki, ki določajo 3 D strukturo proteina

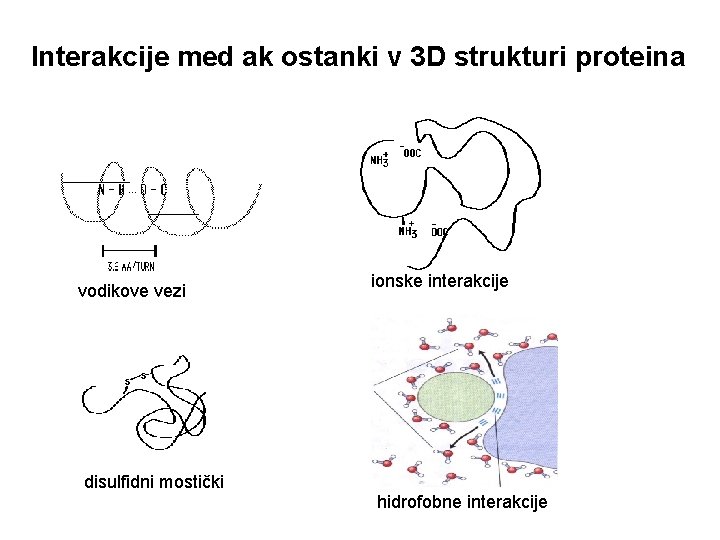
Interakcije med ak ostanki v 3 D strukturi proteina vodikove vezi ionske interakcije disulfidni mostički hidrofobne interakcije

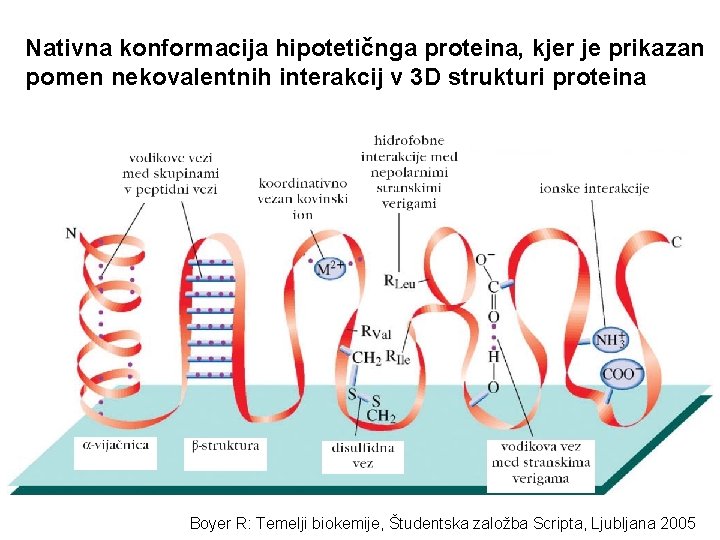
Nativna konformacija hipotetičnga proteina, kjer je prikazan pomen nekovalentnih interakcij v 3 D strukturi proteina Boyer R: Temelji biokemije, Študentska založba Scripta, Ljubljana 2005

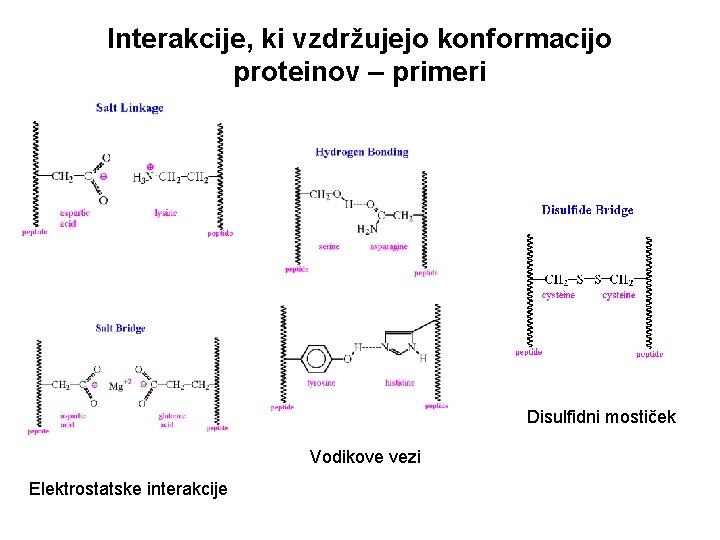
Interakcije, ki vzdržujejo konformacijo proteinov – primeri Disulfidni mostiček Vodikove vezi Elektrostatske interakcije

Zvijanje polipeptidne verige je omejeno z naslednjimi zahtevami • dolžine vezi med atomi in koti med vezmi naj bodo čim manj deformirani • atomi se ne morejo približati bolj, kot je vsota njihovih van der Waals -ovih radijev • zvitje proteinov je stabilizirano s šibkimi interakcijami (vodikove, hidrofobne, van der Waalsove, ionske interakcije) • zaradi omejitev, ki jo predstavlja toga amidna/peptidna vez (ni možna rotacija okrog CO-NH vezi), je dovoljena samo rotacija okrog enojnih vezi N-Cα in Cα-CO

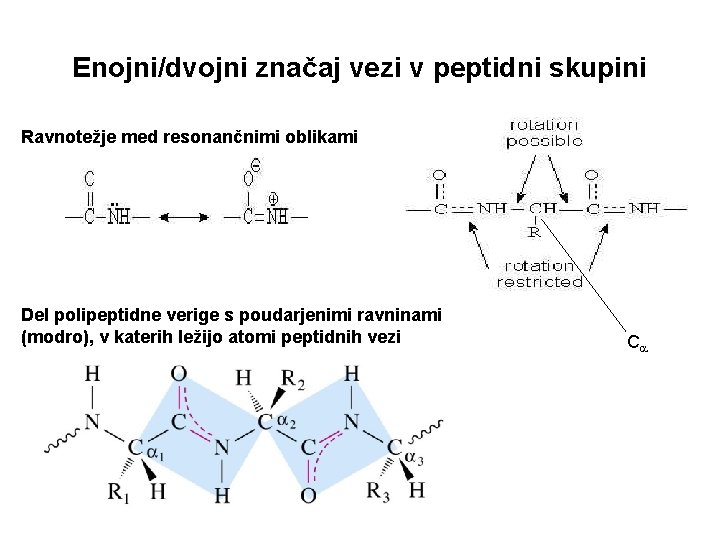
Enojni/dvojni značaj vezi v peptidni skupini Ravnotežje med resonančnimi oblikami Del polipeptidne verige s poudarjenimi ravninami (modro), v katerih ležijo atomi peptidnih vezi C

Prostorska orientacija atomov peptidne vezi in relativna orientacija ravnin, v katerih ležijo peptidne vezi Cis-trans izomerija peptidne vezi Rotacija okrog enojnih vezi peptidne skupine (99, 95%) (a) Možne rotacije kotov in za +1800 in -1800 (b) “prepovedana” vrednost kotov in zaradi prostorskih (steričnih) ovir Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

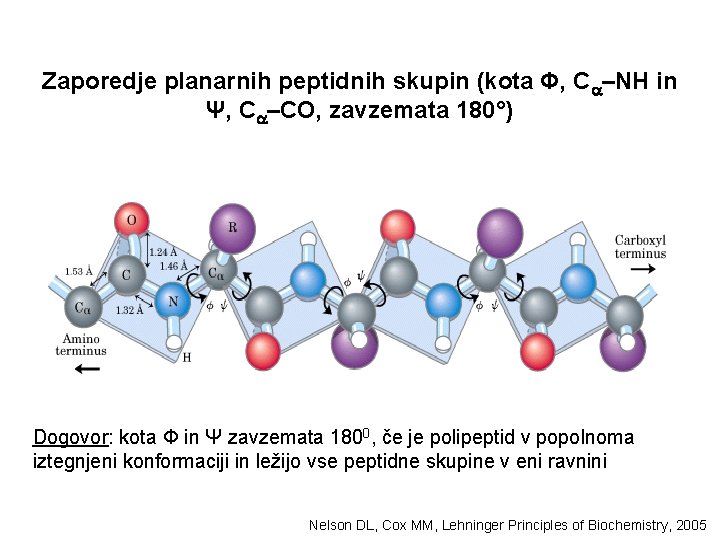
Zaporedje planarnih peptidnih skupin (kota Φ, C –NH in Ψ, C –CO, zavzemata 180°) Dogovor: kota Φ in Ψ zavzemata 1800, če je polipeptid v popolnoma iztegnjeni konformaciji in ležijo vse peptidne skupine v eni ravnini Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

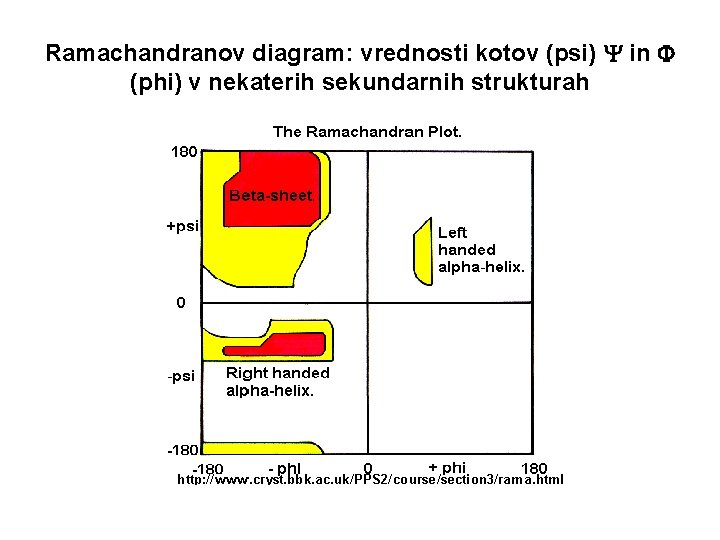
Ramachandranov diagram – soodvisnost vrednosti kotov Φ in Ψ belo področje – nedovoljene konformacije obarvano področje – različne proteinske strukture

Ravni strukture proteinov • Primarna struktura • Sekundarna struktura – nanaša se na lokalno konformacijo (bližnje ak) nekaterih delov polipeptida - α-desnosučna vijačnica - β-struktura (paralelna, antiparalelna, mešana) - β-zavoj • Terciarna struktura • Kvartarna struktura (oligomerni proteini)

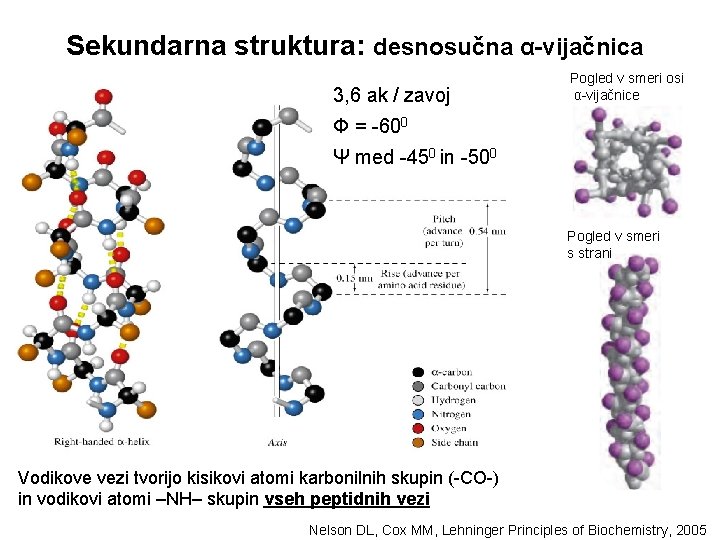
Sekundarna struktura: desnosučna α-vijačnica Interakcije, ki jo vzdržujejo: vodikove vezi, elektrostatske in hidrofobne interakcije med ak radikali Elektrostatske interakcije Položaj radikalov –R pogojuje njihove medsebojne interakcije vodikove vezi Pro in Gly redko v α-vijačnici

Sekundarna struktura: desnosučna α-vijačnica 3, 6 ak / zavoj Pogled v smeri osi α-vijačnice Φ = -600 Ψ med -450 in -500 Pogled v smeri s strani Vodikove vezi tvorijo kisikovi atomi karbonilnih skupin (-CO-) in vodikovi atomi –NH– skupin vseh peptidnih vezi Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

Dejavniki, ki vplivajo na stabilnost α-vijačnice • Elektrostatski odboji/privlaki med –R zaporednih ak ostankov v polipeptidu • Sterične motnje med velikimi –R zaporednih ak ostankov v polipeptidu • Interakcije med –R ak, ki so oddaljene za 3 oz. 4 ak v zaporedju (elektrostatski odboji/privlaki, hidrofobne interakcije, sterične ovire) • Pojav Gly ali Pro (redko v α-vijačnici) • Interakcije med nabitimi ak na konceh polipeptidne verige, kjer je ustvarjen električni dipol (– na C-koncu in + na N-koncu)

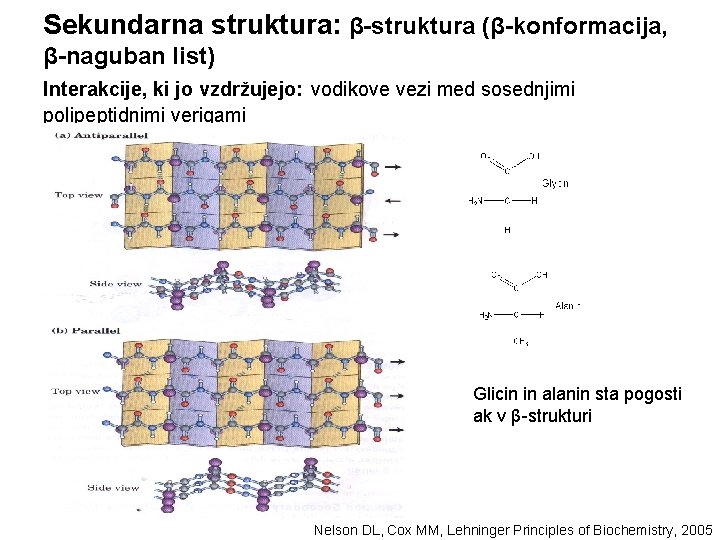
Sekundarna struktura: β-struktura (β-konformacija, β-naguban list) Interakcije, ki jo vzdržujejo: vodikove vezi med sosednjimi polipeptidnimi verigami Glicin in alanin sta pogosti ak v β-strukturi Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

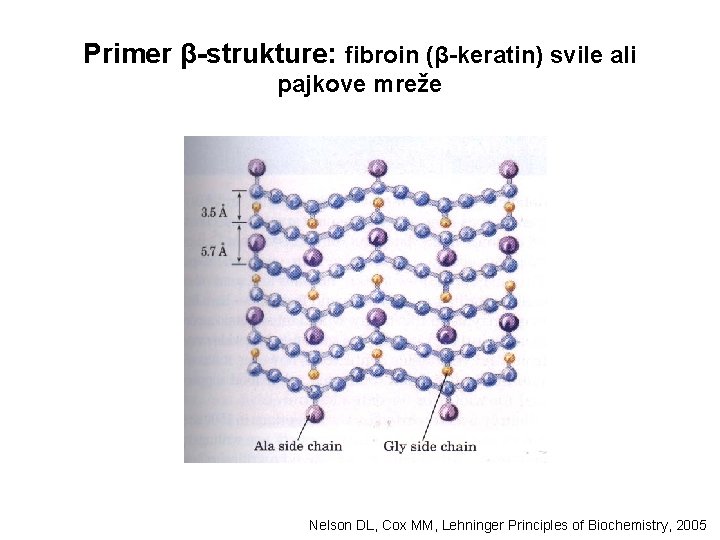
Primer β-strukture: fibroin (β-keratin) svile ali pajkove mreže Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

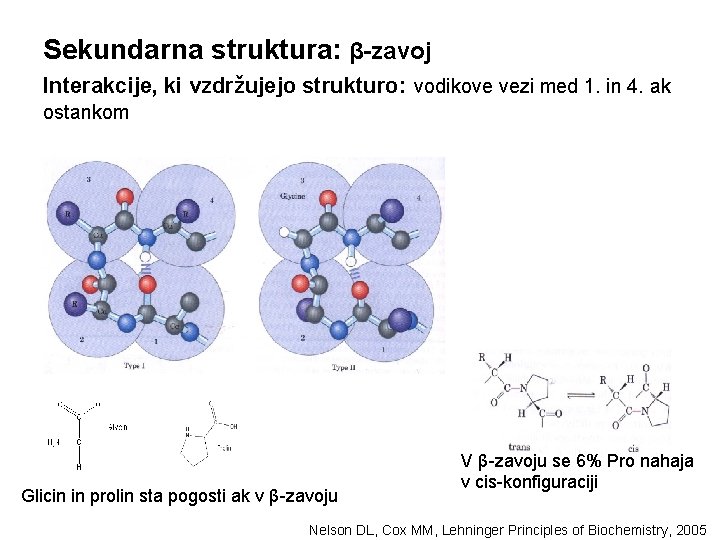
Sekundarna struktura: β-zavoj Interakcije, ki vzdržujejo strukturo: vodikove vezi med 1. in 4. ak ostankom Glicin in prolin sta pogosti ak v β-zavoju V β-zavoju se 6% Pro nahaja v cis-konfiguraciji Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

Relativna verjetnost za pojavljanje določene ak v treh vrstah sekundarne strukture Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

Ramachandranov diagram: vrednosti kotov (psi) in (phi) v nekaterih sekundarnih strukturah

Nivoji strukture proteinov • Primarna struktura • Sekundarna struktura • Terciarna struktura – 3 D razporeditev vseh atomov proteina, konformacija – vključuje tudi interakcije med oddaljenimi ak in ak, ki so v različnih vrstah sekundarnih struktur. Vzdržujejo jo šibke interakcije in -S-S- mostički. • Kvartarna struktura (oligomerni proteini)

Primerjava oblike in velikosti proteina, sestavljenega iz istega št. ak ostankov Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

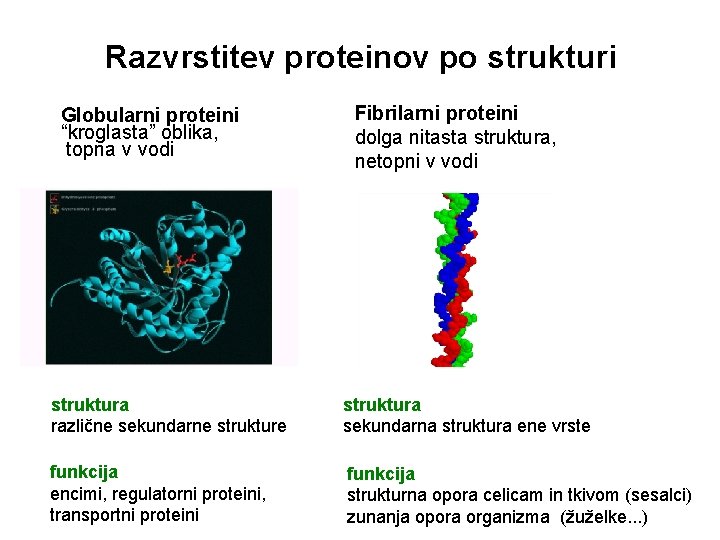
Razvrstitev proteinov po strukturi Globularni proteini “kroglasta” oblika, topna v vodi Fibrilarni proteini dolga nitasta struktura, netopni v vodi struktura različne sekundarne struktura sekundarna struktura ene vrste funkcija encimi, regulatorni proteini, transportni proteini funkcija strukturna opora celicam in tkivom (sesalci) zunanja opora organizma (žuželke. . . )

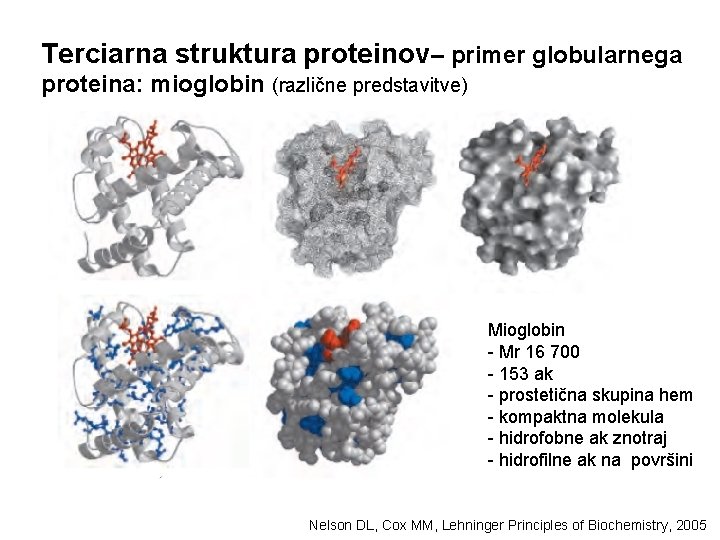
Terciarna struktura proteinov– primer globularnega proteina: mioglobin (različne predstavitve) Mioglobin - Mr 16 700 - 153 ak - prostetična skupina hem - kompaktna molekula - hidrofobne ak znotraj - hidrofilne ak na površini Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

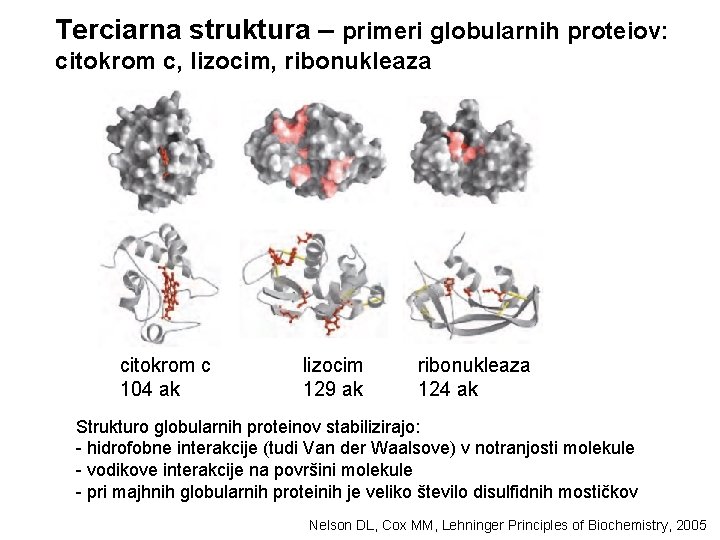
Terciarna struktura – primeri globularnih proteiov: citokrom c, lizocim, ribonukleaza citokrom c 104 ak lizocim 129 ak ribonukleaza 124 ak Strukturo globularnih proteinov stabilizirajo: - hidrofobne interakcije (tudi Van der Waalsove) v notranjosti molekule - vodikove interakcije na površini molekule - pri majhnih globularnih proteinih je veliko število disulfidnih mostičkov Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

Terciarna struktura proteinov – delež sekundarnih struktur v nekaterih globulatnih proteinih Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

Terciarna struktura proteinov - zvitje proteinov je osnova za strukturno klasifikacijo globularnih proteinov (podatkovna baza SCOP – Structural Clasification of Proteins) • Do danes znanih ~1000 različnih zvitij. Terciarna struktura je bolj ohranjena kot primarna struktura (znana 3 D struktura več kot 10 000 proteinov) • Primerjava terciarne strukture proteinov → podatki o evolucijski oddaljenosti organizmov • Isti strukturni motivi (zvitja) v različnih proteinih opravljajo podobno funkcijo, npr. vezava ligandov, vezava drugih proteinov. . . Primeri zvitja proteinov: - - zanka - kot povezava struktur križna povezava struktur -sodček Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

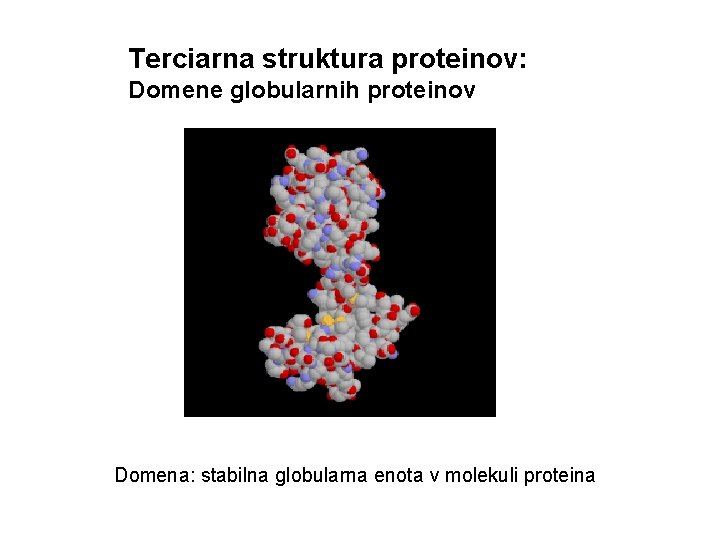
Terciarna struktura proteinov: Domene globularnih proteinov Domena: stabilna globularna enota v molekuli proteina

Razvrstitev proteinov • V družine – velika podobnost v ak zaporedju (visoka stopnja homologije) in/ali v terciarni strukturi in funkciji (npr. globinski motiv). Proteini ene družine kažejo evolucijsko bližino organizmov. • V naddružine – dve ali več družin, katerih proteini ne kažejo podobnosti v ak zaporedju, imajo pa iste/podobne vzorce zvitja (motive) in opravljajo podobno funkcijo.

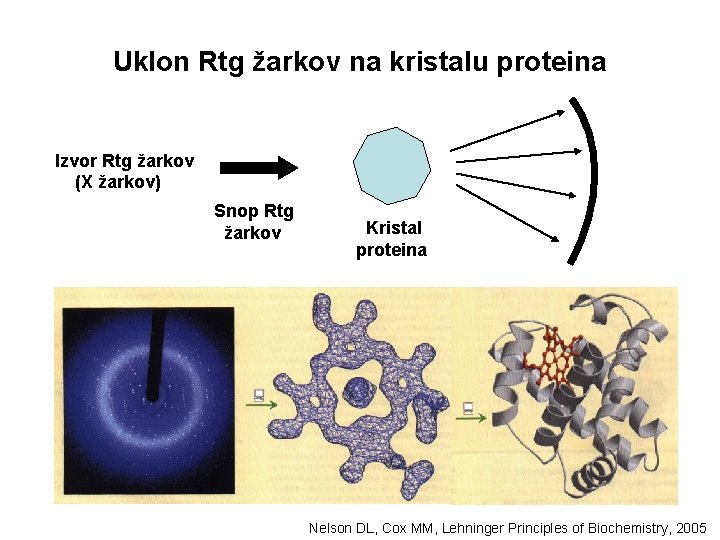
Kako določiti 3 D strukturo proteina? • Uklon Rtg žarkov na kristalu proteina • Nuklearna magnetna resonanca (NMR), protein v raztopini → metoda omogoča identifikacijo različnih konformacij proteina (merjenje jedrnega spinskega kotnega momenta – kvantnomehanska funkcija, ki jo vsebujejo nekatera jedra: (1 H, 13 C, 15 N, 10 F, 31 P)

Uklon Rtg žarkov na kristalu proteina Izvor Rtg žarkov (X žarkov) Snop Rtg žarkov Kristal proteina Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

Analiza 3 D strukture mioglobina z NMR Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

Ravni strukture proteinov • Primarna struktura • Sekundarna struktura • Terciarna struktura • Kvartarna struktura – oligomerni proteini (več polipeptidnih verig – podenot/protomerov, povezanih s šibkimi interakcijami) - dimer - oligomer (npr. tetramer) - multimer - različne podenote, asimetrična struktura - enake podenote ali skupki podenot, simetrična struktura;

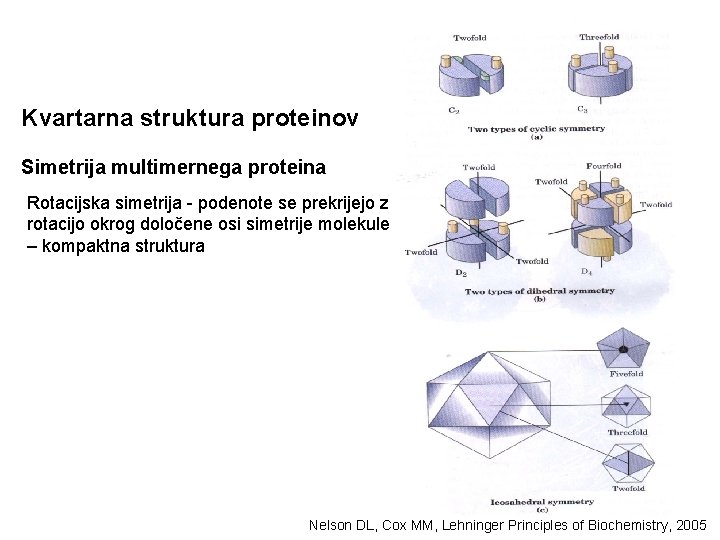
Kvartarna struktura: proteini iz več podenot (protomerov) – multimeri • Dimer – 2 podenoti • Oligomer – 4 -8 podenot (npr. tetramer) • Multimer – večje št. podenot - različne podenote, asimetrična struktura - enake podenote ali skupki podenot, simetrična struktura; - rotacijska simetrija - podenote se prekrijejo z rotacijo okrog določene osi simetrije molekule – kompaktna struktura - vijačna (helična) simetrija – podenote se dodajajo na način vijačnice (odprta struktura)

Kvartarna struktura proteinov Simetrija multimernega proteina Rotacijska simetrija - podenote se prekrijejo z rotacijo okrog določene osi simetrije molekule – kompaktna struktura Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

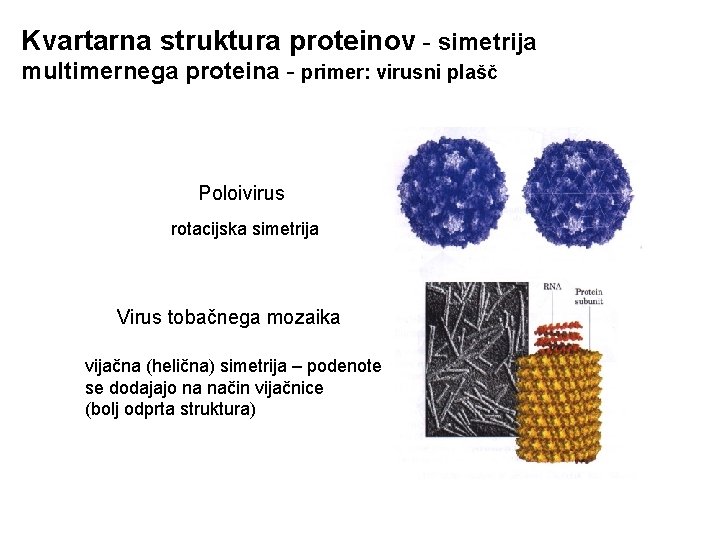
Kvartarna struktura proteinov - simetrija multimernega proteina - primer: virusni plašč Poloivirus rotacijska simetrija Virus tobačnega mozaika vijačna (helična) simetrija – podenote se dodajajo na način vijačnice (bolj odprta struktura)

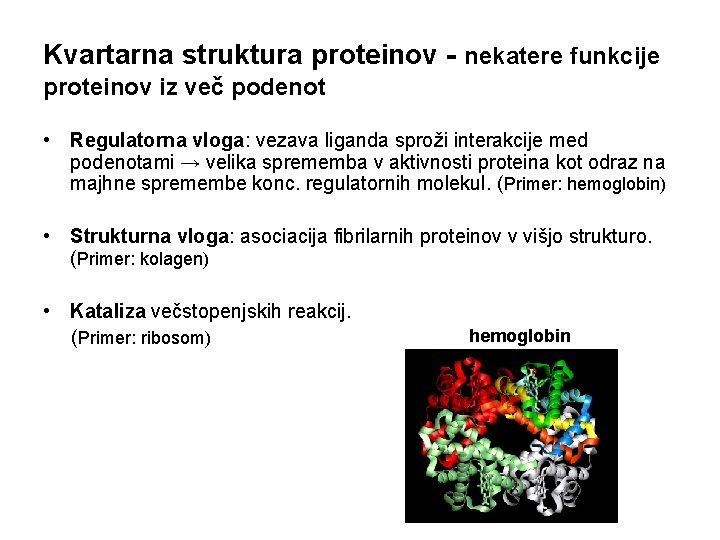
Kvartarna struktura proteinov - nekatere funkcije proteinov iz več podenot • Regulatorna vloga: vezava liganda sproži interakcije med podenotami → velika sprememba v aktivnosti proteina kot odraz na majhne spremembe konc. regulatornih molekul. (Primer: hemoglobin) • Strukturna vloga: asociacija fibrilarnih proteinov v višjo strukturo. (Primer: kolagen) • Kataliza večstopenjskih reakcij. (Primer: ribosom) hemoglobin

3 D struktura proteinov – denaturacija in zvitje; denaturacija/renaturacija proteinov • Denaturacija: porušenje 3 D strukture (terciarne, kvartarne) proteina, s tem tudi izguba njegove funkcije • Vzroki za denaturacijo: - povišana temperatura (poruši šibke interakcije, predvsem H-vezi) - sprememba p. H (spremenijo se elektrostatske interakcije med nabitimi –R in H-vezi) - organska topila kot etanol in aceton (porušijo se predvsem hidrofobne interakcije) - spojine kot je urea in gvanidin-hidroklorid, detergenti (porušijo se predvsem hidrofobne interakcije) • Renaturacija: odvzamemo vzrok za denaturacijo

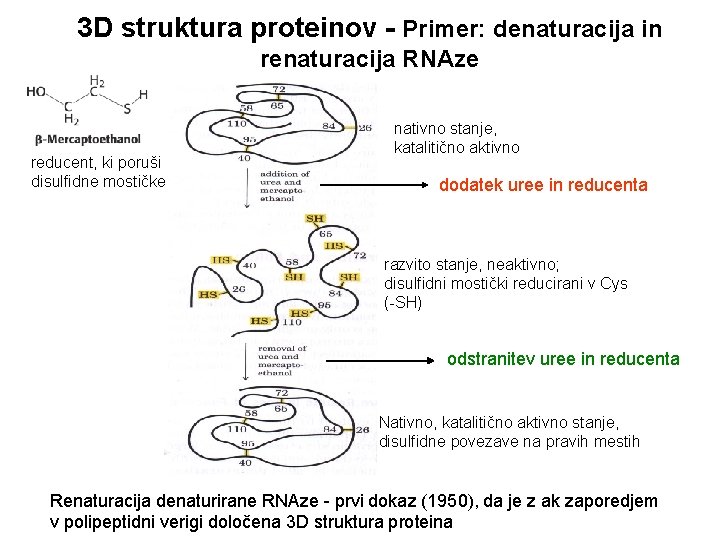
3 D struktura proteinov - Primer: denaturacija in renaturacija RNAze reducent, ki poruši disulfidne mostičke nativno stanje, katalitično aktivno dodatek uree in reducenta razvito stanje, neaktivno; disulfidni mostički reducirani v Cys (-SH) odstranitev uree in reducenta Nativno, katalitično aktivno stanje, disulfidne povezave na pravih mestih Renaturacija denaturirane RNAze - prvi dokaz (1950), da je z ak zaporedjem v polipeptidni verigi določena 3 D struktura proteina

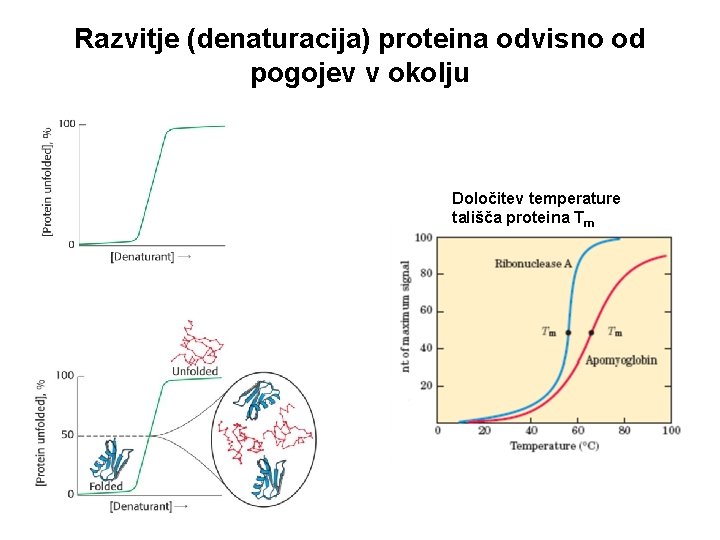
Razvitje (denaturacija) proteina odvisno od pogojev v okolju Določitev temperature tališča proteina Tm

3 D struktura proteinov - kako poteka zvitje polipeptida? • Hipoteza I : postopno zvitje polipeptida; lokalno se ustvarijo sekundarne strukture → supersekundarna struktura → domene → nativni protein (kooperativni proces) • Hipoteza II: zvitje se prične s spontanim kolapsom polipeptida v kompaktno stanje – “molten globule”/razrahljani klobčič - hidrofobni kolaps • Hipoteza III: Polipeptidi se zvijejo s pomočjo drugih molekul, šaperonov, ki usmerjajo in pospešujejo proces zvijajna. Šaperoni so v vseh kraljestvih (eubacteria, archaea in eukariontih) ---------------------Zvijanje proteina je zelo hiter proces; E. coli naredi aktivno molekulo proteina iz 100 ak v 5 sek; ni naključen proces, gre za vodeno zvijanje polipeptidne verige. (Če bi bil proces povsem slučajen, 1077 let)

Kako poteka zvitje polipeptida? Hipoteza I: postopno zvitje polipeptida Lokalno se ustvarijo sekundarne strukture → supersekundarna struktura → domene → nativni protein (kooperativni proces) Nelson DL, Cox MM, Lehninger Principles of Biochemistry, 2005

Kako poteka zvitje polipeptida? Hipoteza II: zvitje polipeptida poteka po”lijaku proste energije” (TD vidik) Stanje razrahljanega klobčiča Cilj zvitja proteina je nastanek maksimalnega števila šibkih interakcij (vodikovih, hidrofobnih, Van der Waalsovih, ionskih) - stabilna konformacija

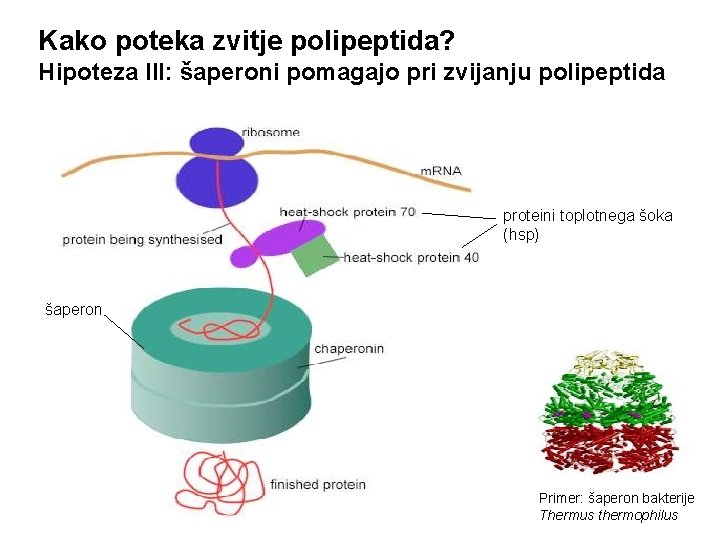
Kako poteka zvitje polipeptida? Hipoteza III: šaperoni pomagajo pri zvijanju polipeptida proteini toplotnega šoka (hsp) šaperon Primer: šaperon bakterije Thermus thermophilus

Kako poteka zvitje polipeptida? Hipoteza III: šaperoni pomagajo pri zvijanju polipeptida V nekaterih primerih je za zvijanje proteina s pomočjo šaperonov potrebna energija (hidroliza ATP)

Napake v zvitju polipeptida vodijo do nekaterih bolezni • Cistična fibroza – okvarjen je membranski protein, ki je odgovoren za prenos Cl • Bolezni vezivnega tkiva – okvarjen strukturni protein kolagen • Prionske bolezni, TSE (Transmissible Spongiform Encephalopathies) spremenjena konformacija proteina priona (proteinaceous infectious only), Mr = 28 000. “nore” krave kuru

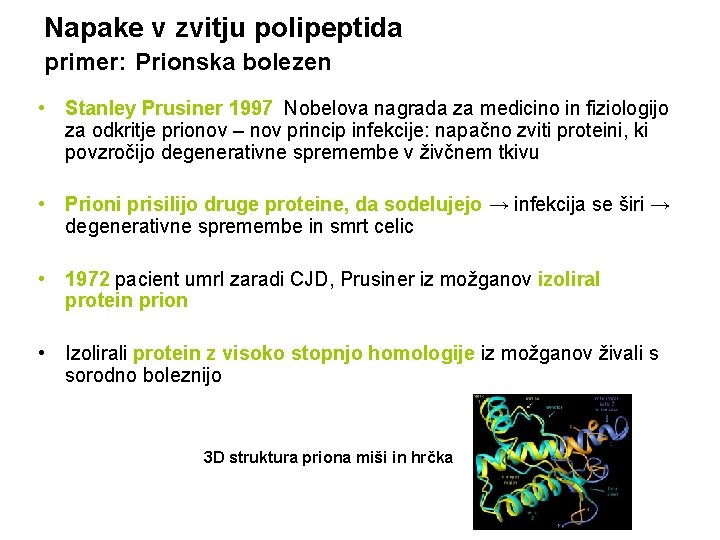
Napake v zvitju polipeptida primer: Prionska bolezen • Stanley Prusiner 1997 Nobelova nagrada za medicino in fiziologijo za odkritje prionov – nov princip infekcije: napačno zviti proteini, ki povzročijo degenerativne spremembe v živčnem tkivu • Prioni prisilijo druge proteine, da sodelujejo → infekcija se širi → degenerativne spremembe in smrt celic • 1972 pacient umrl zaradi CJD, Prusiner iz možganov izoliral protein prion • Izolirali protein z visoko stopnjo homologije iz možganov živali s sorodno boleznijo 3 D struktura priona miši in hrčka

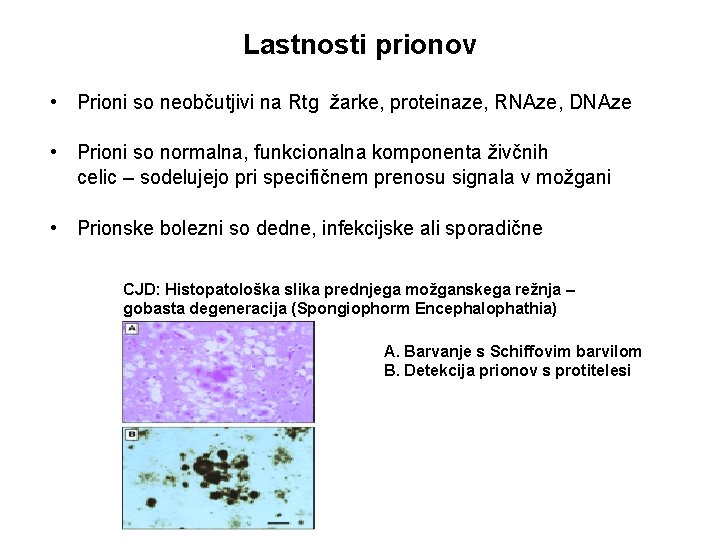
Lastnosti prionov • Prioni so neobčutjivi na Rtg žarke, proteinaze, RNAze, DNAze • Prioni so normalna, funkcionalna komponenta živčnih celic – sodelujejo pri specifičnem prenosu signala v možgani • Prionske bolezni so dedne, infekcijske ali sporadične CJD: Histopatološka slika prednjega možganskega režnja – gobasta degeneracija (Spongiophorm Encephalophathia) A. Barvanje s Schiffovim barvilom B. Detekcija prionov s protitelesi

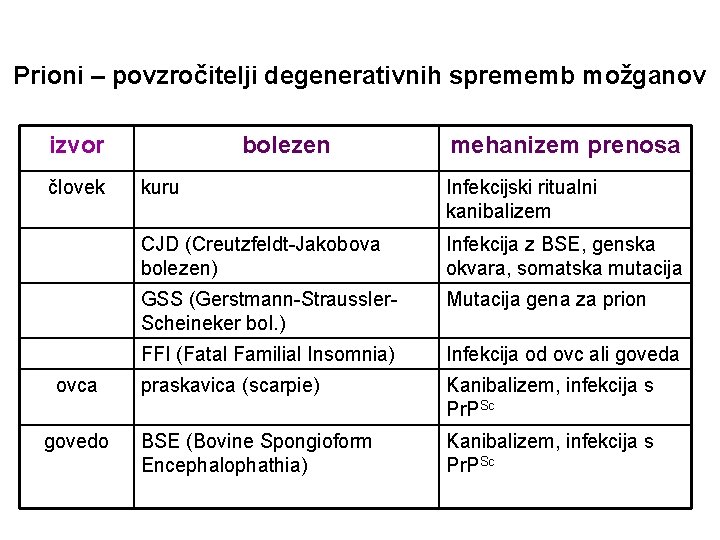
Prioni – povzročitelji degenerativnih sprememb možganov izvor človek ovca govedo bolezen mehanizem prenosa kuru Infekcijski ritualni kanibalizem CJD (Creutzfeldt-Jakobova bolezen) Infekcija z BSE, genska okvara, somatska mutacija GSS (Gerstmann-Straussler. Scheineker bol. ) Mutacija gena za prion FFI (Fatal Familial Insomnia) Infekcija od ovc ali goveda praskavica (scarpie) Kanibalizem, infekcija s Pr. PSc BSE (Bovine Spongioform Encephalophathia) Kanibalizem, infekcija s Pr. PSc

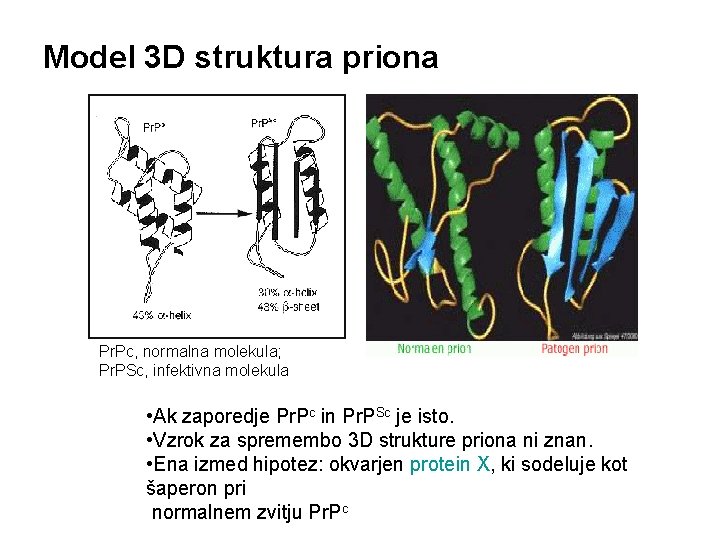
Model 3 D struktura priona Pr. Pc, normalna molekula; Pr. PSc, infektivna molekula • Ak zaporedje Pr. Pc in Pr. PSc je isto. • Vzrok za spremembo 3 D strukture priona ni znan. • Ena izmed hipotez: okvarjen protein X, ki sodeluje kot šaperon pri normalnem zvitju Pr. Pc

Preprečevanje in zdravljenje prionskih bolezni Preprečiti je treba pretvorbo Pr. Pc v Pr. PSc • Droge, ki stabilizirajo Pr. Pc , ki naj bi se vezale na normalni protein in ga s tem zaščitila • Droge, ki stabilizirajo šaperon protein X • Droge, ki destabilizirajo 3 D strukturo Pr. PSc • Droge, ki zmotijo interakcijo med Pr. Pc in Pr. PSc • Droge, ki upočasnijo ekspresijo gena za Pr. P
 Kvartarna struktura proteina
Kvartarna struktura proteina Metanefridije
Metanefridije Primarna sekundarna i tercijarna prevencija
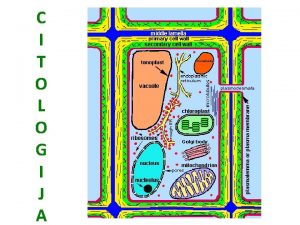
Primarna sekundarna i tercijarna prevencija Citologi
Citologi Polimer nukleotida
Polimer nukleotida Antitijela covid referentne vrijednosti
Antitijela covid referentne vrijednosti Stalni vjetrovi na zemlji
Stalni vjetrovi na zemlji Devijantnost
Devijantnost Trombocitoza simptomi
Trombocitoza simptomi Poprecni presek drveta
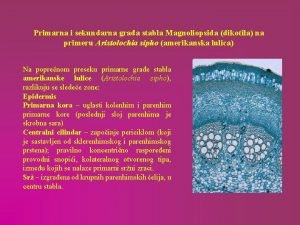
Poprecni presek drveta Primarna devijantnost
Primarna devijantnost Primarna porodica
Primarna porodica Primarna pediatria
Primarna pediatria Primarna socijalizacija
Primarna socijalizacija Primarna emisija novca
Primarna emisija novca Gradja stabla
Gradja stabla Primarna djelatnost
Primarna djelatnost Primárna ponuka cestovného ruchu
Primárna ponuka cestovného ruchu Struktura biocenoze
Struktura biocenoze Primarna sukcesija
Primarna sukcesija Seldingerova metoda
Seldingerova metoda матрична структура
матрична структура Programski jezici i strukture podataka
Programski jezici i strukture podataka Adhokratija
Adhokratija Tipovi organizacione strukture
Tipovi organizacione strukture Diviziona organizaciona struktura
Diviziona organizaciona struktura Programska petlja
Programska petlja Induktivni efekt
Induktivni efekt Strukture i vrste podataka u pythonu
Strukture i vrste podataka u pythonu Qbasic zadaci
Qbasic zadaci Težinski graf
Težinski graf Krovne strukture
Krovne strukture Rigorozni racio likvidnosti
Rigorozni racio likvidnosti Disulfidni most
Disulfidni most Strukture c++
Strukture c++ Odredjenost ravni
Odredjenost ravni Definicija prizme
Definicija prizme Kvadranti u koordinatnom sustavu
Kvadranti u koordinatnom sustavu Stajnerova teorema
Stajnerova teorema Opisna geometrija
Opisna geometrija Fruka
Fruka Dvije konvergentne leće
Dvije konvergentne leće Airyev disk
Airyev disk Talasni front
Talasni front Koronalna ravan
Koronalna ravan Sta su plavine
Sta su plavine Nives kocijan
Nives kocijan Obim i povrsina figura u ravni
Obim i povrsina figura u ravni Valna zraka
Valna zraka Struktura urzędu skarbowego
Struktura urzędu skarbowego Struktura os
Struktura os Struktura zużycia wody w gospodarstwie domowym
Struktura zużycia wody w gospodarstwie domowym Heterociklicna jedinjenja
Heterociklicna jedinjenja Struktura platební bilance
Struktura platební bilance Struktura administracji publicznej w polsce
Struktura administracji publicznej w polsce Heterociklicna jedinjenja
Heterociklicna jedinjenja