Radiokologie und Strahlenschutz Vorlesung FHH WS 201920 Ulrich










































- Slides: 61

Radioökologie und Strahlenschutz Vorlesung FHH: WS 2019/20 Ulrich J. Schrewe Themen: Anwendung kernphysikalischer Messverfahren in der industriellen Messtechnik Eigenschaften ionisierender Strahlungswirkung - Strahlenschutz Radioökologie und Strahlenschutz SS 17 - Schrewe 1

Inhaltsverzeichnis 1. 2. 3. 4. 5. 6. 7. 8. Radioökologie und Strahlenschutz SS 17 - Schrewe Einleitung Grundlagen Atomphysik Basiswissen Kernphysik Röntgenstrahlung Strahlungswechselwirkung Strahlungsnachweis Anwendungen Grundlagen Strahlenschutz 2

Zugang zu den Unterlagen Microsoft Power Point Dateien mit Vorlesungsunterlagen finden Sie als Web-Disk: https: //webdisk. hs-hannover. de Oder über die Homepage: http: //schrewe. wp. hs-hannover. de Fragen (jederzeit) auch per E-Mail: ulrich. schrewe@hs-hannover. de Radioökologie und Strahlenschutz SS 17 - Schrewe 3

Atomare Basisdaten Atome sind verglichen mit Objekten unserer Umwelt sehr einfach aufgebaut und durch wenige Kenngrößen charakterisierbar. Wichtige atomaren Eigenschaften sind: Atomgröße Atommasse Form Aufbau Anregungsenergien Radioökologie und Strahlenschutz SS 17 - Schrewe Atomdurchmesser und Atomvolumen. Massen aller Atomen eines Elements gleich; Massenwerte sehr genau bekannt. vereinfachend ist eine Kugelform mit weichem Rand vorstellbar. inhomogen - Kern enthält (fast) die gesamte Masse, Hülle ist (fast) masselos. nach Anregung ist Lichtaussendung möglich. 4

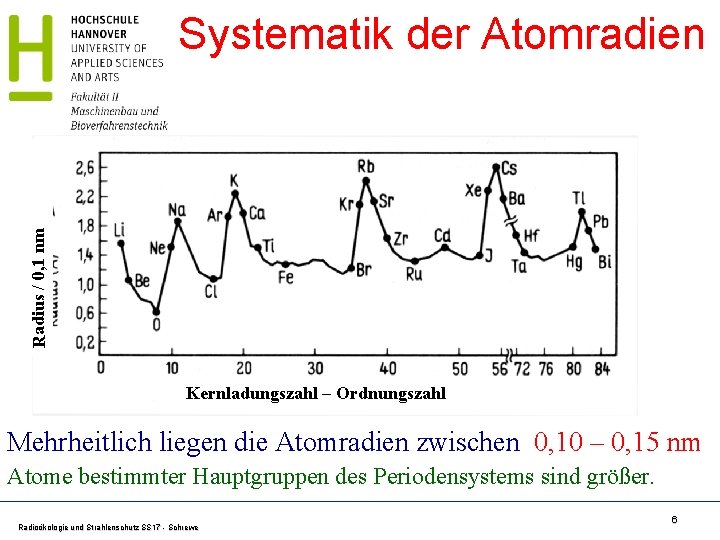
Abschätzung der Atomgröße Abschätzung des Atomvolumens VM aus molarer Masse M, Dichte ρ und Avogadro-Konstante NA: Makroskopische Dichte: = m/V und V = m/ Masse eines einzelnen Atoms: m. M = M/NA Die makroskopische Dichte ist gleich der Dichte des Atoms. . Atomvolumen: VM = m. M/ = (M/NA)/ Werte für Na: = 0, 97 g·cm-3 und M = 22, 99 g·mol-1 Atomvolumen: VM = 3, 9 · 10 -23 cm 3; VM ~ (4/3)· Rat 3 Atomradius: RM ~ 0, 2 · 10 -9 m = 0, 2 nm Radioökologie und Strahlenschutz SS 17 - Schrewe 5

Radius / 0, 1 nm Systematik der Atomradien Kernladungszahl – Ordnungszahl Mehrheitlich liegen die Atomradien zwischen 0, 10 – 0, 15 nm Atome bestimmter Hauptgruppen des Periodensystems sind größer. Radioökologie und Strahlenschutz SS 17 - Schrewe 6

Periodensystem der Elemente Rat groß Rat ~ 0, 10 - 0, 15 nm Rat groß Merkregel: Atome sind fast gleich groß. Elemente der Hauptgruppen 1, 2 und 8 sind jedoch deutlich größer als die Nachbarelemente Radioökologie und Strahlenschutz SS 17 - Schrewe 7

Elektrische Ladungen Atome sind elektrisch neutral. Atome können ionisiert werden. Dabei wird (üblicherweise) ein positives Ion und ein freies Elektron mit negativer Ladung gebildet. (Das umgekehrte ist auch möglich. ) Elektronen sind Bausteine der Atome. Freie Elektronenstrahlen bezeichnet man auch als Kathodenstrahlen. Elektronen besitzen eine konstante negative elektrische Ladung und eine konstante, sehr kleine Masse. Radioökologie und Strahlenschutz SS 17 - Schrewe 8

Messung der Elementarladung e Optisch sichtbare Öltröpfchen werden mit einzelnen Elektron aufgeladen. Geladene Tröpfchen bewegen sich elektrischen Feld des Kondensators. Ergebnis: e = 1, 602. 176. 6208(98) 10 -19 C Radioökologie und Strahlenschutz SS 17 - Schrewe 9

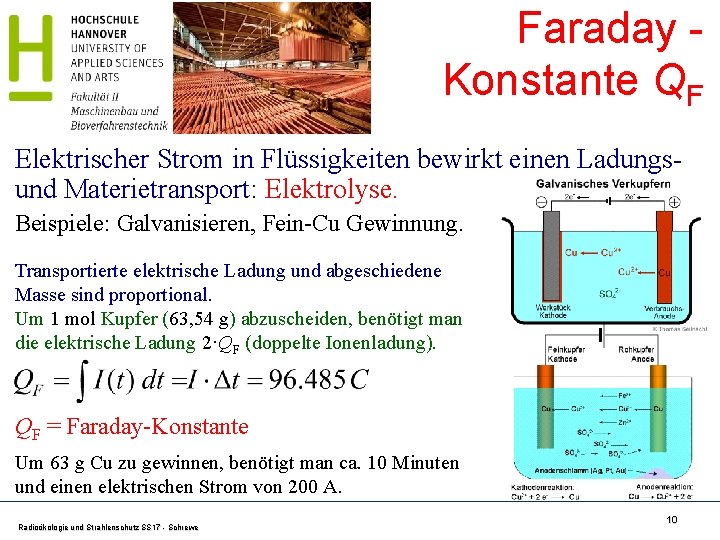
Faraday Konstante QF Elektrischer Strom in Flüssigkeiten bewirkt einen Ladungsund Materietransport: Elektrolyse. Beispiele: Galvanisieren, Fein-Cu Gewinnung. Transportierte elektrische Ladung und abgeschiedene Masse sind proportional. Um 1 mol Kupfer (63, 54 g) abzuscheiden, benötigt man die elektrische Ladung 2·QF (doppelte Ionenladung). QF = Faraday-Konstante Um 63 g Cu zu gewinnen, benötigt man ca. 10 Minuten und einen elektrischen Strom von 200 A. Radioökologie und Strahlenschutz SS 17 - Schrewe 10

Bestimmung von NA aus QF und e Faraday-Konstante QF und elektrische Elementarladung e sind nach klassischer Physik (makroskopisch) messbar. Die Kombination von QF und e ergibt die Avogadro Zahl NA. QF = 96. 485, 332. 89(59) C mol-1 ist die elektrische Ladung zum Abscheiden von einem Mol bei der Elektrolyse, e = 1, 602. 176. 6208(98)· 10 -19 C ist die elektrische Elementarladung und entspricht der Ladung des Elektrons. Daraus folgt für die Zahl der Teilchen pro 1 mol NA = QF/e = 6, 022. 140. 857(74)· 1023 mol-1 Heute: NA = 6, 022. 140. 76· 1023 mol-1 Quelle: Naturkonstanten: http: //www. ptb. de/de/naturkonstanten/_zahlenwerte. html Radioökologie und Strahlenschutz SS 17 - Schrewe 11

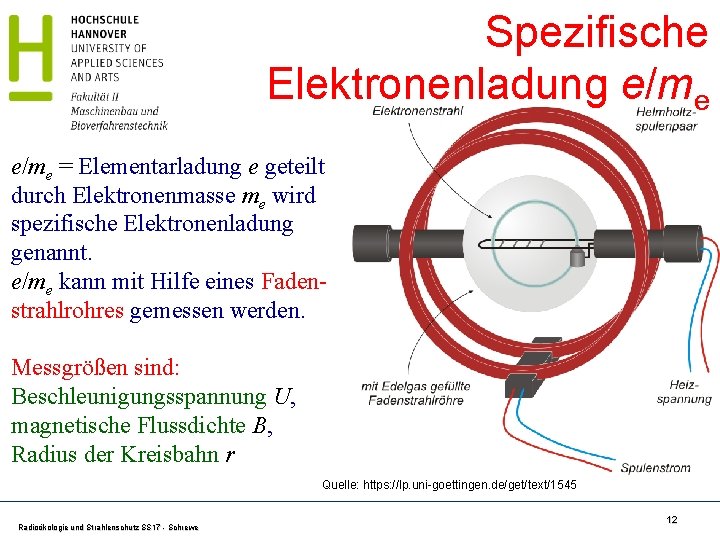
Spezifische Elektronenladung e/me = Elementarladung e geteilt durch Elektronenmasse me wird spezifische Elektronenladung genannt. e/me kann mit Hilfe eines Fadenstrahlrohres gemessen werden. Messgrößen sind: Beschleunigungsspannung U, magnetische Flussdichte B, Radius der Kreisbahn r Quelle: https: //lp. uni-goettingen. de/get/text/1545 Radioökologie und Strahlenschutz SS 17 - Schrewe 12

e/me Bestimmung Beschleunigungsspannung U (1) Zentrifugalkraft = Lorentzkraft (2) Beschleunigungsarbeit = kinetische Energie Kombination von (1) u. (2) Radioökologie und Strahlenschutz SS 17 - Schrewe Magnetfeld B Kathodenstrahlröhre Ergebnis: e/me= 1, 758. 820. 024(11)· 1011 C kg-1 13

Atommassenkonstante und Elektronenmasse u entspricht der Masse eines Wasserstoffatoms. Hinweis: Atommassen beziehen sich stets auf neutrale Atome ( = Kern + Hülle) u = 0, 001 kg/mol / NA = 1, 660. 539. 040(20) 10 -27 kg Elektronenmasse: me = e/(e/me) = 9, 109. 383. 56(11)· 10 -31 kg Elektronenmasse me in Einheiten von und u: me/u = 5, 485. 799. 090. 70(16)· 10 -4 u; Kehrwert: u/me = 1822, 888… Merkregel: Atommasse/Elektronenmasse ~ 2000/1 Radioökologie und Strahlenschutz SS 17 - Schrewe Quelle: http: //physics. nist. gov/cuu/Constants/ oder: http: //www. ptb. de/de/naturkonstanten/_zahlenwerte. html verwenden Sie Naturkonstanten aus diesen Quellen Die Atommassenkonstante dient als Einheit für die Angabe von Atommassen: u = (1/12) m 12 C/NA 14

Zusammenfassung Die elektrische Elementarladungen e kann aus der Bewegung mikroskopisch kleiner geladener Objekten (Tröpfchen) bestimmt werden. Die Faraday-Konstante QF ist die elektrische Ladung, die zur Elektrolyse von 1 mol einfach geladener Ionen erforderlich ist. Aus Faraday-Konstante QF und Elementarladung e erhält man die Avogadro-Konstante NA = QF/e Aus der molaren Masse M, Dichte und Avogadro-Konstante NA erhält man eine Abschätzung für die Atomgröße: Radius ~ 0, 1 nm Durch Ablenkung von Kathodenstrahlen in magnetischen Feldern kann man die spezifische Elektronenladung e/me bestimmen. Kombination der Ergebnisse: u = 1, 660· 10 -27 kg und me = 9, 109· 10 -31 kg und das Verhältnis: me/u ~ 1/2000 Radioökologie und Strahlenschutz SS 17 - Schrewe 15

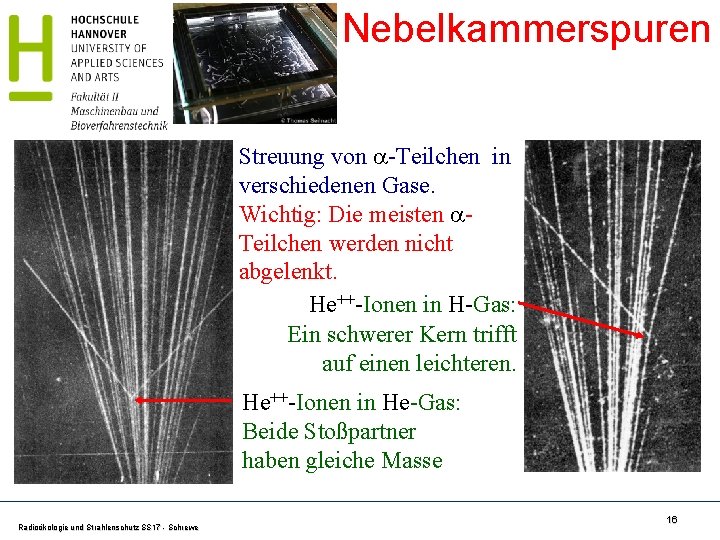
Nebelkammerspuren Streuung von -Teilchen in verschiedenen Gase. Wichtig: Die meisten Teilchen werden nicht abgelenkt. He++-Ionen in H-Gas: Ein schwerer Kern trifft auf einen leichteren. He++-Ionen in He-Gas: Beide Stoßpartner haben gleiche Masse Radioökologie und Strahlenschutz SS 17 - Schrewe 16

C. T. R. Wilson (1869 - 1959) Wilsonsche Nebelkammer weitere Beispiele für Streuungen von -Teilchen He++ mit H Gas Radioökologie und Strahlenschutz SS 17 - Schrewe He++ mit He Gas He++ mit F Gas 17

Rutherfordstreuung 1913 untersucht Rutherford die Streuung von -Teilchen in einer dünnen Gold Folie. Die Beobachtung konnten durch einfaches Atommodel beschrieben werden. Atome bestehen aus massereichen Kernen mit positiver Ladung und einer fast masselosen Hülle mit negativen Elektronen. Radioökologie und Strahlenschutz SS 17 - Schrewe Schematischer Aufbau des Experiments 1: Radioaktives Radium, 2: Bleimantel zur Abschirmung, 3: Alpha-Teilchenstrahl, 4: Leuchtschirm bzw. Fotografieschirm 5: Goldfolie 6: Punkt, an dem die Strahlen auf die Folie treffen, 18

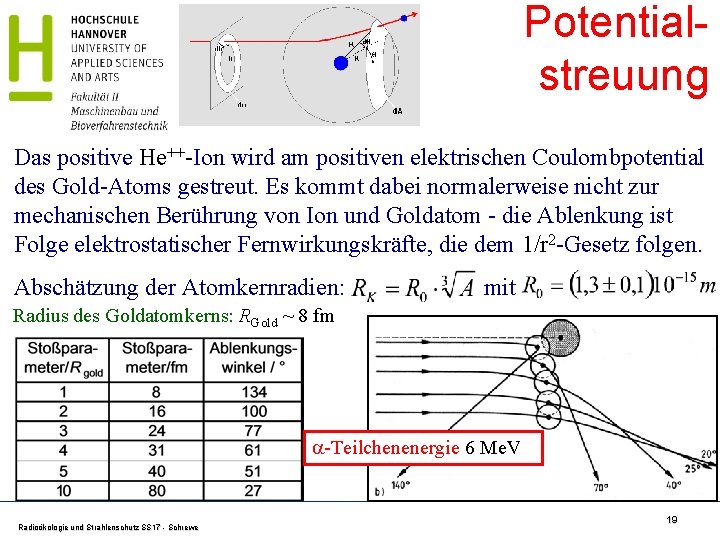
Potentialstreuung Das positive He++-Ion wird am positiven elektrischen Coulombpotential des Gold-Atoms gestreut. Es kommt dabei normalerweise nicht zur mechanischen Berührung von Ion und Goldatom - die Ablenkung ist Folge elektrostatischer Fernwirkungskräfte, die dem 1/r 2 -Gesetz folgen. Abschätzung der Atomkernradien: mit Radius des Goldatomkerns: RGold ~ 8 fm -Teilchenenergie 6 Me. V Radioökologie und Strahlenschutz SS 17 - Schrewe 19

Ernest Rutherford (1871 - 1937) Rutherfordsche Streuformel Ablenkung positiver He++-Ionen (Q 1 = Z 1·e mit Z 1 = 4) am Coulomb-potential des Goldatomkerns (Q 2 = Z 2·e mit Z 2 = 79) Ergebnis: Streuintensität I(J) für den Streuwinkel J Radioökologie und Strahlenschutz SS 17 - Schrewe 20

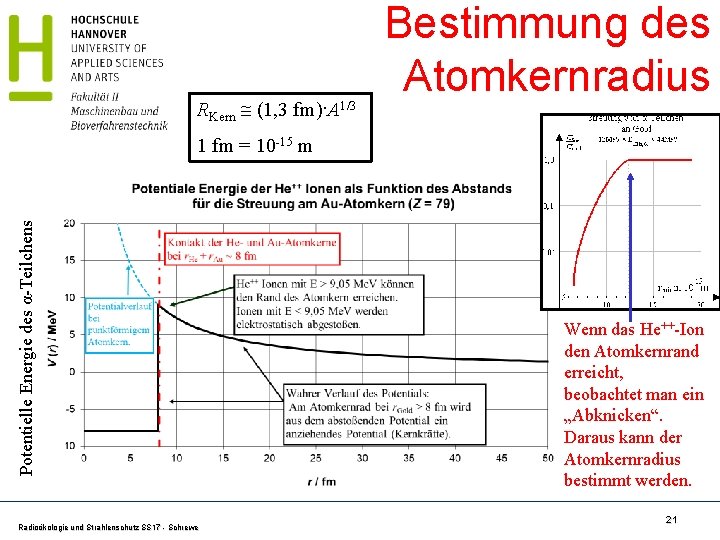
RKern (1, 3 fm)·A 1/3 Bestimmung des Atomkernradius Potentielle Energie des α-Teilchens 1 fm = 10 -15 m Radioökologie und Strahlenschutz SS 17 - Schrewe Wenn das He++-Ion den Atomkernrand erreicht, beobachtet man ein „Abknicken“. Daraus kann der Atomkernradius bestimmt werden. 21

Atomgröße Atomkerngröße Atomgröße: Atomkerngröße: Atomradius RAtom ~ 0, 1 nm = 1·10 -10 m für alle Elemente, mit Ausnahme der Elemente der 1. , 2. und 8. Hauptgruppe. Keine Abhängigkeit von der Atommasse. Es gilt: mit Beispiele: Li mit A = 7: RLi = 2, 5·10 -15 m U mit A = 238: RU = 8, 1·10 -15 m Verhältnis der Durchmesser: Verhältnis der Volumina: Atomkernvolumina sind im Verhältnis zur Atomgröße also sehr klein. Radioökologie und Strahlenschutz SS 17 - Schrewe 22

Licht erscheint als elektromagnetische Wellenstrahlung. Interferenz und Beugung offenbaren die Welleneigenschaften des Lichts. Lichtquellen sind z. B. heiße Oberflächen (Temperaturstrahler) oder angeregte Atome/Moleküle (meist gasförmig). Temperaturstrahler besitzen eine kontinuierliches Spektrum aus vielen Wellenlängen, angeregte Atome/Moleküle senden Linienspektren mit diskreten Wellenlängen aus. Aus den Linienspektren kann man viele wichtige Eigenschaften der Atome ableiten. Radioökologie und Strahlenschutz SS 17 - Schrewe 23

Schwarze Körper Ein Körper, der auftreffende Strahlung vollständig absorbiert und anschließend nur Temperaturstrahlung aussendet, heißt in der Physik „schwarzer Körper“. „Schwarze Körper“ sind ideale Strahler (Emissionsgrad 1). Das Strahlungsspektrum hängt ausschließlich von seiner Oberflächentemperatur ab. Dies verwendet die Thermographie, um aus Eigenschaften des Strahlungsspektrums die Temperaturen von Körpern berührungslos zu bestimmen (z. B. Pyrometrie, Wärmebilder). Radioökologie und Strahlenschutz SS 17 - Schrewe 24

(Fast) das schwärzeste Schwarz? - Vantablack Lambertsches Kosinusgesetz Radioökologie und Strahlenschutz SS 17 - Schrewe 25

Beispiele für "schwarze Körper" Mit Wärmebad T ~ 80 K Sonne T ~ 6000 K Als Keramikrohr T ~ 1000 K Aus Kohle T ~ 2000 K Quelle: http: //www. otto-lummer. de/waermestrahlung. html Radioökologie und Strahlenschutz SS 17 - Schrewe 26

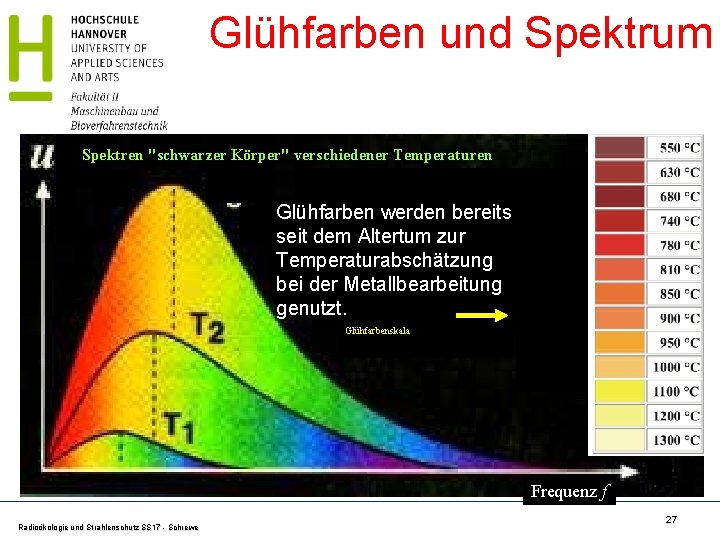
Glühfarben und Spektrum Spektren "schwarzer Körper" verschiedener Temperaturen A A A Glühfarben werden bereits A seit dem Altertum zur Temperaturabschätzung bei der Metallbearbeitung genutzt. Glühfarbenskala A Frequenz f Radioökologie und Strahlenschutz SS 17 - Schrewe 27

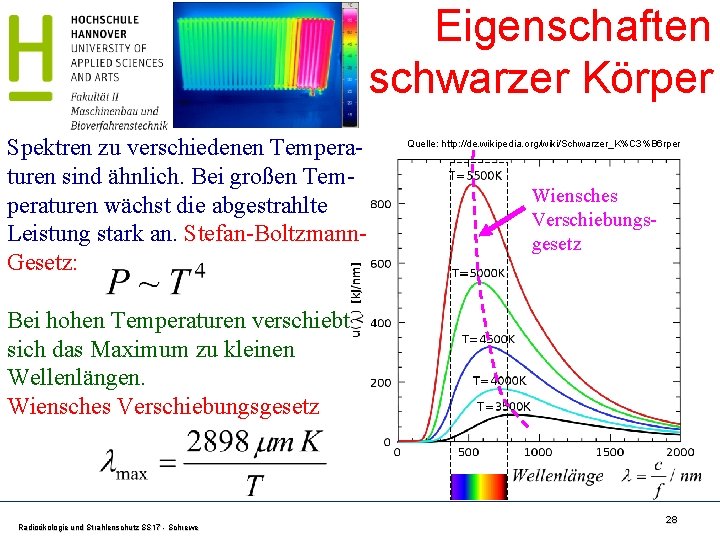
Eigenschaften schwarzer Körper Spektren zu verschiedenen Temperaturen sind ähnlich. Bei großen Temperaturen wächst die abgestrahlte Leistung stark an. Stefan-Boltzmann. Gesetz: Quelle: http: //de. wikipedia. org/wiki/Schwarzer_K%C 3%B 6 rper Wiensches Verschiebungsgesetz Bei hohen Temperaturen verschiebt sich das Maximum zu kleinen Wellenlängen. Wiensches Verschiebungsgesetz Radioökologie und Strahlenschutz SS 17 - Schrewe 28

Gesetz von Max Planck (1858 - 1947) 1900 fand Max Planck ein Gesetz zur Beschreibung der Spektren schwarzer Körper. Das Gesetz gilt unabhängig von der speziellen Bauart und für alle Temperaturen. Bemerkenswert ist, dass Planck die Formel zunächst erraten und danach einige Zeit benötigte, um die richtige Herleitung im Rahmen der statistischen Physik zu finden. Eine Herleitung aus Gesetzen der klassischen Physik ist nicht möglich. Man musste die neue Naturkonstante h einführen. Planck-Konstante: h = 6, 626. 070. 040(81)·10 -34 Js = 4, 135. 667. 662(25)·10 -15 e. Vs Planck-Formel für Spektren schwarzer Körper Radioökologie und Strahlenschutz SS 17 - Schrewe 29

Plancksche Strahlungsspektren Wie erkennbar, liegt das Maximum des Sonnenspektrums (T ~ 5777 K) im Bereich des für Menschen sichtbaren Lichtes. Warum? ? ? Radioökologie und Strahlenschutz SS 17 - Schrewe IR - Infrarot UV UV - Ultraviolett Quelle: http: //de. wikipedia. org/wiki/Schwarzer_K%C 3%B 6 rper 30

Photoeffekt Philipp Lenard 1862 - 1947 Licht kann Elektronen aus Metalloberflächen auslösen - Photoeffekt. 1902 untersuchte Lenard den Photoeffekt mit monochromatischem Licht (Spektrallinien, die mit Prisma und Blenden isoliert wurden). Er zeigte, dass verschieden farbiges Licht unterschiedlich viel Energie auf die Elektronen übertrug. Licht kann durch die Frequenz f oder die Wellenlänge charakterisiert werden. Es gilt: c = Lichtgeschwindigkeit. Lenard zeigte: Energie der Elektronen ist proportional zur Frequenz Radioökologie und Strahlenschutz SS 17 - Schrewe Herstellung monochromatischen Lichtes 31

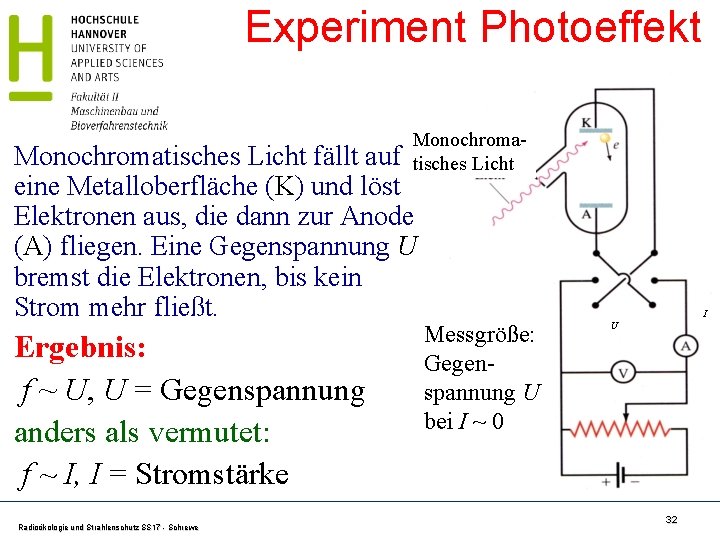
Experiment Photoeffekt Monochromatisches Licht fällt auf eine Metalloberfläche (K) und löst Elektronen aus, die dann zur Anode (A) fliegen. Eine Gegenspannung U bremst die Elektronen, bis kein Strom mehr fließt. Ergebnis: f ~ U, U = Gegenspannung anders als vermutet: f ~ I, I = Stromstärke Radioökologie und Strahlenschutz SS 17 - Schrewe I Messgröße: Gegenspannung U bei I ~ 0 U 32

Ergebnis Photoeffekt Unerwartet taucht hierbei die Planck-Konstante auf: Steigung = Planck-Konstante / Elementarladung Ergebnis: Gegenspannung U und Lichtfrequenz f sind proportional. Steigung m: Steigung: m. ST Multiplikation mit e: U f f Radioökologie und Strahlenschutz SS 17 - Schrewe oder: U·e entspricht einer Änderung der potentiellen Elektronenenergie um E 33

Albert Einstein (1879 - 1955) Interpretation von Einstein Für die Interpretation des Photoeffekts erhielt Einstein 1922 den Nobelpreis. Einstein gelang 1905 das Auftreten der Planck-Konstante h in der Planck-Formel und beim Photoeffekt einheitlich zu interpretieren. Obwohl Licht eine elektromagnetische Welle ist, verhält es sich in bestimmten Situation wie eine Teilchenstrahlung. Die Lichtteilchen heißen Photonen. Die Photonenenergie ist: Die Planck-Formel ergibt sich nach Einstein aus statistischen Betrachtungen für ein Photonengas. Beim Photoeffekt handelt es sich um einen Photon-Elektron-Stoß. Radioökologie und Strahlenschutz SS 17 - Schrewe 34

Deutsche Physik von Philipp Lenard Bewegung für „Deutsche Physik“ Philipp Lenard 1862 - 1947 Nobelpreis 1905 Johannes Stark 1874 - 1957 Nobelpreis 1919 Zwei Dinge scheinen unendlich: Das Universum und die menschliche Dummheit. Beim Universum bin ich mir allerdings nicht ganz sicher. Albert Einstein Radioökologie und Strahlenschutz SS 17 - Schrewe Nobelpreis 35 1921

Energie, Frequenz, Wellenlänge Licht einer bestimmten "Farbe" entspricht einer bestimmten Photonenenergie E, Frequenz f und Wellenlänge . Umrechnungsformeln: Berechnen Sie die entsprechenden Werte für 1. verschiedene Farben des sichtbaren Lichtes 2. Infrarotstrahlung (IR) Einheit der Photonenenergie: 3. Ultraviolettstrahlung (UV) 4. Mikrowellenstrahlung -19 As·V = 1 e. V = 1, 602·10 5. Röntgenstrahlung (x-rays) -19 J = 1, 602·10 6. - Strahlung Radioökologie und Strahlenschutz SS 17 - Schrewe 36

Beispiele Radioökologie und Strahlenschutz SS 17 - Schrewe 37

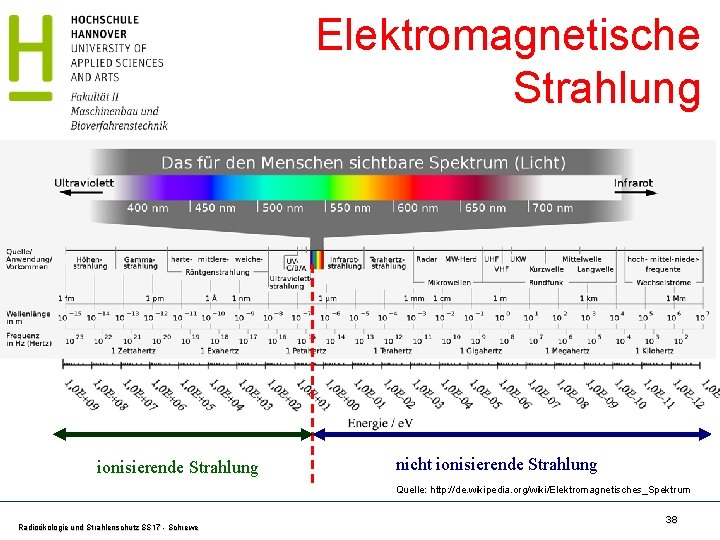
Elektromagnetische Strahlung ionisierende Strahlung nicht ionisierende Strahlung Quelle: http: //de. wikipedia. org/wiki/Elektromagnetisches_Spektrum Radioökologie und Strahlenschutz SS 17 - Schrewe 38

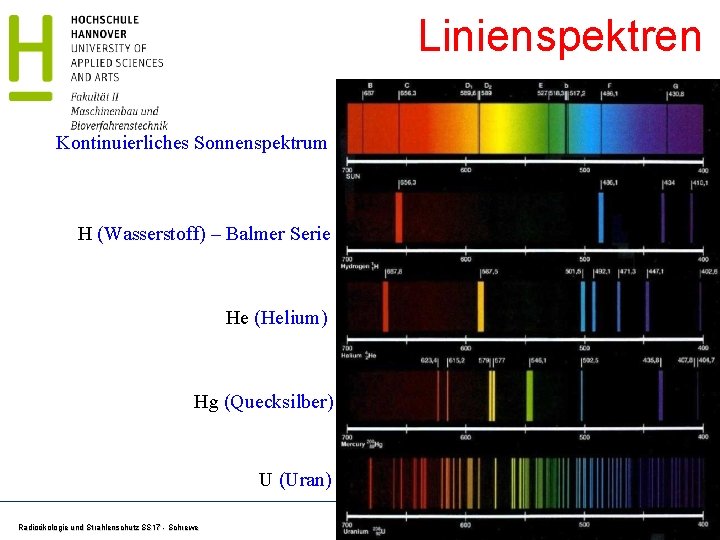
Linienspektren Kontinuierliches Sonnenspektrum H (Wasserstoff) – Balmer Serie He (Helium) Hg (Quecksilber) U (Uran) Radioökologie und Strahlenschutz SS 17 - Schrewe 39

H-Spektrum im Weltall 90% aller Atome bzw. 75% der Masse des Universums sind Wasserstoff Die intensivste Linie des Wasserstoffs ist die H Linie (l = 656, 3 nm). Interstellarer Wasserstoff leuchtet deshalb in roter Farbe. Der Pferdekopfnebel zeichnet sich als Dunkelnebel (Staubnebel) vor einer dahinter leuchtenden Wasserstoffwolke ab. Im gesamten Universum findet man gleiche Spektrallinienspektren wie in den Gasentladungen im Labor. a H Radioökologie und Strahlenschutz SS 17 - Schrewe Hb 40

Wasserstoffspektrum Wasserstoff ist das einzige Element, dass einfaches, weil mathematisch beschreibbares Spektrum besitzt. Balmer-Serie H Hb Hc Balmer untersuchte 1885 das Spektrum der Wasserstoffgasentladung und fand eine Zuordnung zu der einfachen mathematischen Folge: . Allgemeines Gesetz Rydberg 1890 Rydberg-Konstante Später fand man weitere Serien des H mit gleicher Struktur. m = 1, f 1 n = Roo·c·((1/1) - (1/n 2)) Lyman 1906 m = 2, f 2 n = Roo·c·((1/4) - (1/n 2)) Balmer 1885 m = 3, f 3 n = Roo·c·((1/9) - (1/n 2)) Paschen 1908 m = 4, f 4 n = Roo·c·((1/16) - (1/n 2)) Brackett 1922 m = 5, f 5 n = Roo·c·((1/25) - (1/n 2)) Pfund 1924 Die Rydberg-Konstante hat eine relative Standardunsicherheit von 6·10 -12. Radioökologie und Strahlenschutz SS 17 - Schrewe Sie ist damit die genaueste bekannte Naturkonstante. 41

Absorption - Emission von Photonen Atom können Photonen (Licht) absorbieren und emittieren. Photonen besitzen die Energie E = h·f. Durch Absorption eines Photon kann ein Atom angeregt oder ionisiert werden. Photonen können emittiert werden, wenn ein Atom vorher angeregt wurde (z. B. durch Stöße oder Photonenabsorption). Angeregte Atome geben ihre Anregungsenergie entweder spontan oder stimuliert von außen (LASER) durch Photonenemission ab. Radioökologie und Strahlenschutz SS 17 - Schrewe 42

Prinzip des LASER - Akronym für light amplification by stimulated emission of radiation Anregungszustände besitzen endliche Lebensdauer. Optisches Pumpen und schneller Übergang in einen langlebigen Zustand (Energie Em) erzeugt eine Überbesetzung (Inversion). Einfallende Photonen können einen Übergang von Em (überbesetzt) nach Ef (leer) induzieren und ein neues Photon erzeugen. Es entsteht eine Lawine von Photonen identischer Energien und Impulse. Während Photonen aus spontaner Emission ungerichtet sind, besitzen Lichtwellen der induzierten Photonen gleiche Richtung, gleiche Frequenz und gleiche Phasenlage. Radioökologie und Strahlenschutz SS 17 - Schrewe 43

Atommodell von Bohr/Rutherford Ø Atome bestehen aus Kern und Hülle. Ø Atomkerne besitzen (fast) die gesamte Atommasse aber nur sehr kleines Volumen (VAtom/VKern = 1012/1). Ø In der Atomhüllen befinden sich die Elektronen. Ø Zwischen Kern und Elektronen wirken elektrostatische Kräfte (Coulomb-Kraft). Ø Elektronen der Hülle haben feste Energien. Ø Klassische Physik ergäbe keine stabilen Bahnen. Ø Quantenbedingung: Elektronen bewegen sich auf Bahnen mit Drehimpulsen von n·(h/2 ). Radioökologie und Strahlenschutz SS 17 - Schrewe 44

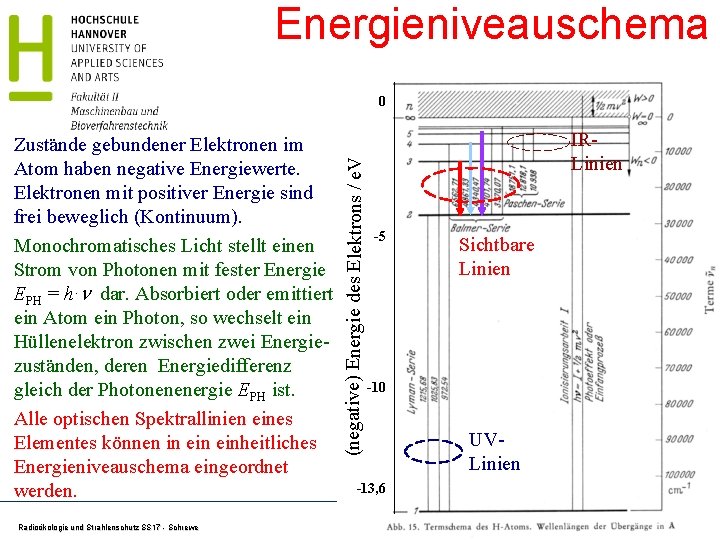
Energieniveauschema Zustände gebundener Elektronen im Atom haben negative Energiewerte. Elektronen mit positiver Energie sind frei beweglich (Kontinuum). Monochromatisches Licht stellt einen Strom von Photonen mit fester Energie EPH = h·n dar. Absorbiert oder emittiert ein Atom ein Photon, so wechselt ein Hüllenelektron zwischen zwei Energiezuständen, deren Energiedifferenz gleich der Photonenenergie EPH ist. Alle optischen Spektrallinien eines Elementes können in einheitliches Energieniveauschema eingeordnet werden. Radioökologie und Strahlenschutz SS 17 - Schrewe (negative) Energie des Elektrons / e. V 0 IRLinien -5 Sichtbare Linien -10 UVLinien -13, 6 45

Niels Bohrsches Atommodell (1885 – 1962) Mit einem einfachen Modell gelang Bohr 1913 die Energiezustände des Wasserstoffs zu berechnen. Modell: Der Kern (+) bleibt in Ruhe, das Elektron (-) bewegt sich auf Kreisbahnen im elektrischen Feld des Kerns, erlaubt sind nur Kreisbahnen, deren Bahndrehimpulse ein Vielfaches von ist (h = Planck-Konstante). Für Kreisbahnen gilt: Zentrifugalkraft = Coulombkraft Für den Bahndrehimpuls L gilt: Radioökologie und Strahlenschutz SS 17 - Schrewe 46

Bohrsches Atommodell Die Gleichungen (1) und (2) können nach vn und rn aufgelöst werden. Bemerkenswert ist, dass vn und rn ausschließlich durch atomare Konstanten ausgedrückt werden. Die Größenordnung von rn passt zu bekannten Atomgrößen. Geschwindigkeit auf der n-ten Bahn: Radius der n-ten Bahn: Für Wasserstoff im Grundzustand (n = 1, Z = 1) ergibt sich ein Bohrscher Radius von 0, 0529 nm. Der experimentelle Wert beträgt (0, 025 - 0, 037) nm. (Empirischer Radius 0, 025 nm, k ovalenter Radius 0, 037 nm. Quelle: http: //www. periodensystem. info/elemente/wasserstoff/) Radioökologie und Strahlenschutz SS 17 - Schrewe 47

Bohrsches Atommodell Aus vn und rn können die Energien der Zustände des Wasserstoffs bestimmt werden. Für den Wasserstoff-Grundzustand (n = 1, Z = 1) ergibt sich ein Wert von -13, 6 e. V. Um ein H-Atom zu ionisieren, ist eine Energie von mindestens 13, 6 e. V nötig. den. Die Frequenzen der Spektrallinien ergeben sich aus den Energiedifferenzen der Zustände m und n. Lösung entspricht dem Rydberggesetz von 1885. Rydberg-Konstante kann aus Naturkonstanten berechnet werden. Radioökologie und Strahlenschutz SS 17 - Schrewe 48

Wellenmechanik Louis de Broglie 1892 -1987 Licht erscheint oft als elektromagnetische Welle (Beugung, Interferenz), verhält sich beim Photoeffekt wie ein Strom von Teilchen mit der Energie Nach De Broglie (1924) gilt auch die Umkehrung: Teilchen mit dem Impuls p (z. B. Elektronen) können als Welle aufgefasst werden. Für die Wellenlänge gilt: Davisson und Germer gelang der experimentelle Beweis (1927). Vergleich von (a) Beugungseffekten an einer Kante (a) und am Atomgitter des Al (b): (b) Licht Radioökologie und Strahlenschutz SS 17 - Schrewe Elektronen 49

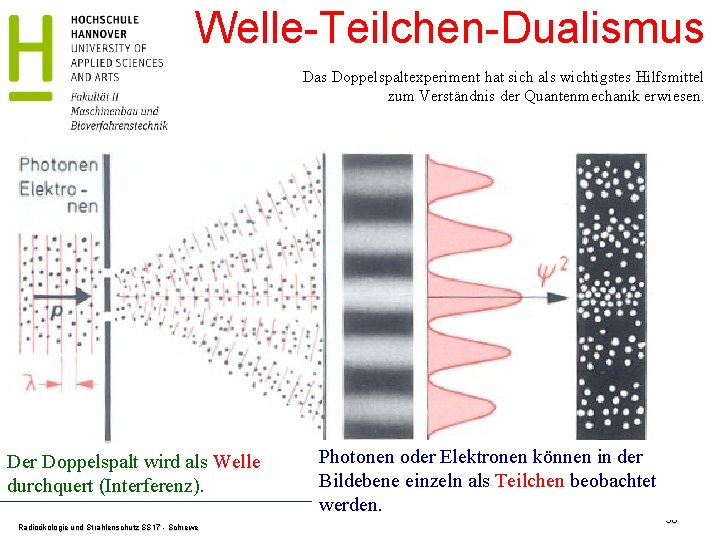
Welle-Teilchen-Dualismus Das Doppelspaltexperiment hat sich als wichtigstes Hilfsmittel zum Verständnis der Quantenmechanik erwiesen. Der Doppelspalt wird als Welle durchquert (Interferenz). Radioökologie und Strahlenschutz SS 17 - Schrewe Photonen oder Elektronen können in der Bildebene einzeln als Teilchen beobachtet werden. 50

Schrödingergleichung Erwin Schrödinger (1887 - 1961) In der klassischen Mechanik verwendet man zur Beschreibung eines Objektes den Ortsvektor und den Impulsvektor. Quantenmechanische Objekte beschreibt man durch eine Wellenfunktion. Die zeitunabhängige Schrödingergleichung für ein Teilchen im Potential lautet: Bei negativen Potential V(x) ergeben sich diskrete Lösungen (Eigenfunktionen ) mit festen Energiewerten (Eigenwerte En mit n = 1, 2, 3. . . ). Für ein Coulombpotential der Ladung +e und Elektronen ergeben sich die selben Energieeigenwerte En wie beim Bohrschen Atommodel. Der Laufindex n wird auch Hauptquantenzahl genannt. Radioökologie und Strahlenschutz SS 17 - Schrewe 51

Physik in Cartoons Radioökologie und Strahlenschutz SS 17 - Schrewe 52

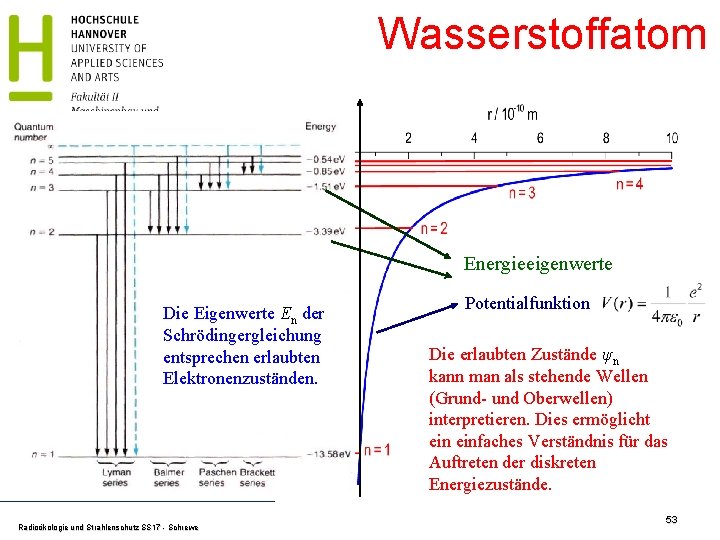
Wasserstoffatom Energieeigenwerte Die Eigenwerte En der Schrödingergleichung entsprechen erlaubten Elektronenzuständen. Radioökologie und Strahlenschutz SS 17 - Schrewe Potentialfunktion Die erlaubten Zustände ψn kann man als stehende Wellen (Grund- und Oberwellen) interpretieren. Dies ermöglicht einfaches Verständnis für das Auftreten der diskreten Energiezustände. 53

H-Atom quantenmechanisch Die Energiewerte sind klassisch und quantenmechanisch gleich. Radioökologie und Strahlenschutz SS 17 - Schrewe Klassisch: Dieser Bereich ist für Hüllenelektronen energetisch verboten Quantenmechanisch: Welle kann in verbotene Bereiche eindringen 54

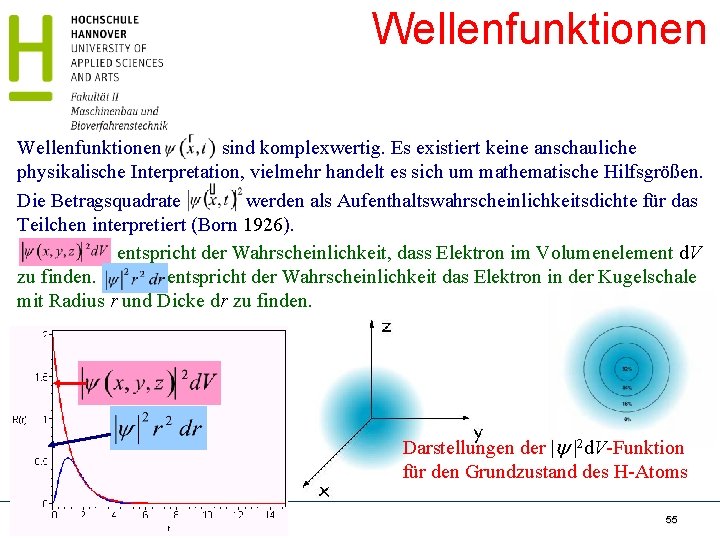
Wellenfunktionen sind komplexwertig. Es existiert keine anschauliche physikalische Interpretation, vielmehr handelt es sich um mathematische Hilfsgrößen. Die Betragsquadrate werden als Aufenthaltswahrscheinlichkeitsdichte für das Teilchen interpretiert (Born 1926). entspricht der Wahrscheinlichkeit, dass Elektron im Volumenelement d. V zu finden. entspricht der Wahrscheinlichkeit das Elektron in der Kugelschale mit Radius r und Dicke dr zu finden. 1 s Darstellungen der 2 d. V-Funktion für den Grundzustand des H-Atoms Radioökologie und Strahlenschutz SS 17 - Schrewe 55

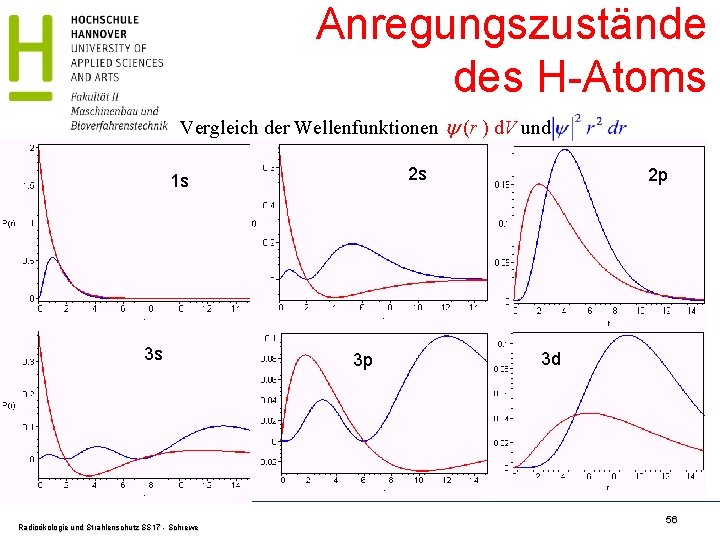
Anregungszustände des H-Atoms Vergleich der Wellenfunktionen (r ) d. V und 2 s 1 s 3 s Radioökologie und Strahlenschutz SS 17 - Schrewe 3 p 2 p 3 d 56

2 s und 2 p Orbitale 2 s Radioökologie und Strahlenschutz SS 17 - Schrewe 57

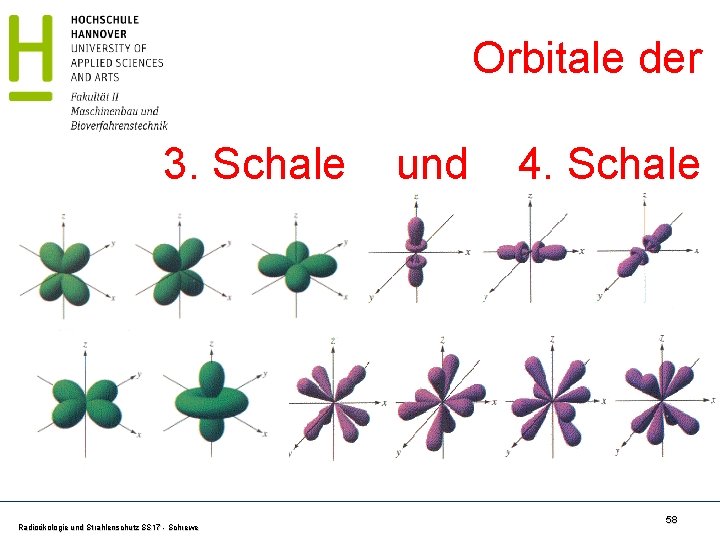
Orbitale der 3. Schale Radioökologie und Strahlenschutz SS 17 - Schrewe und 4. Schale 58

Pauli-Prinzip Wolfgang Pauli (1900 - 1958) Fermionen – Teilchen mit halbzahligem Spin, e, p, n, µ, …. . Bosonen – Teilchen mit ganzzahligem Spin, Photonen, W, Z, Higgs, … Fermionen und Bosonen folgen unterschiedlichen Statistiken. Mit Hilfe des Pauli Prinzips kann man den Aufbau der Atomhüllen für Z > 1 verstehen. Es besagt, dass Fermionen einen Quantenzustand nur einfach besetzen können. Die erlaubten Zuständen in der Atomhülle werden deshalb sukzessive durch die Hüllenelektronen aufgefüllt. Die Besetzungszahlen, die sich daraus ergeben, sind die Basis der Systematik im Periodensystem. Hüllenelektronen besitzen sowohl Bahndrehimpulse mit n = 0, 1, 2, . . . als auch einen Spin. Die beiden koppeln zu Gesamtdrehimpulsen, z. B. Radioökologie und Strahlenschutz SS 17 - Schrewe 59

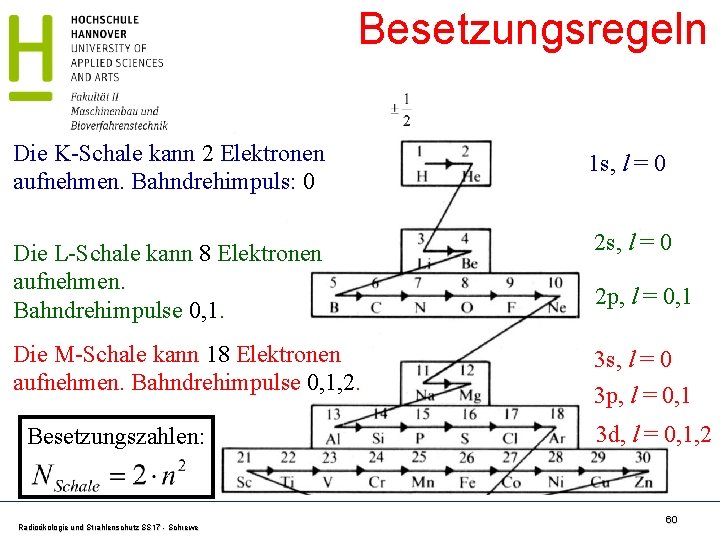
Besetzungsregeln Die K-Schale kann 2 Elektronen aufnehmen. Bahndrehimpuls: 0 1 s, l = 0 Die L-Schale kann 8 Elektronen aufnehmen. Bahndrehimpulse 0, 1. 2 s, l = 0 Die M-Schale kann 18 Elektronen aufnehmen. Bahndrehimpulse 0, 1, 2. 3 s, l = 0 3 p, l = 0, 1 Besetzungszahlen: Radioökologie und Strahlenschutz SS 17 - Schrewe 2 p, l = 0, 1 3 d, l = 0, 1, 2 60

Unschärferelation Werner Heisenberg (1901 - 1976) Die Unschärferelationen von Heisenberg (1927) können als Grundbeziehungen der Quantenmechanik aufgefasst werden: Es ist unmöglich, Ort x und Impuls px eines Teilchens, oder Zeitpunkt t und Energie E eines Vorgangs gleichzeitig genau zu bestimmen. Bei der Messung solcher Größen bleibt immer eine Unschärfe x und px, oder t und E, deren Produkt nicht kleiner als gemacht werden kann: Allein aus der Unschärferelation kann die Existenz stabiler Atome in der beobachteten Größenordnung abgeleitet werden. Radioökologie und Strahlenschutz SS 17 - Schrewe 61
 Kathodenstrahlröhre
Kathodenstrahlröhre Strahlenschutz
Strahlenschutz Vorlesung
Vorlesung Repurchase agreement (repo) und wertpapierleihe
Repurchase agreement (repo) und wertpapierleihe Vorlesung
Vorlesung Risikotragfähigkeit
Risikotragfähigkeit Sachenrecht vorlesung
Sachenrecht vorlesung Rvs tu dortmund
Rvs tu dortmund Vorlesung finanzmathematik
Vorlesung finanzmathematik Refinanzierungsrisiko
Refinanzierungsrisiko Vorlesung
Vorlesung Ulrich heintz
Ulrich heintz Employee champion ulrich
Employee champion ulrich Ulrich schroeter
Ulrich schroeter Kinderhilfswerk international
Kinderhilfswerk international Ulrich hohenester
Ulrich hohenester Ulrich kampffmeyer
Ulrich kampffmeyer Ulrich deinet
Ulrich deinet Schachtschneider oldenburg
Schachtschneider oldenburg Ulrich kampffmeyer
Ulrich kampffmeyer Ulrich pluta
Ulrich pluta Ulrich heck
Ulrich heck Diletation
Diletation Ulrich kampffmeyer
Ulrich kampffmeyer Ulrich kampffmeyer
Ulrich kampffmeyer Ulrich heintz
Ulrich heintz Ulrich uwer
Ulrich uwer Auswahlkriterien eim
Auswahlkriterien eim Agente de cambio ulrich
Agente de cambio ulrich Risikosamfund beck
Risikosamfund beck Ulrich wanderer
Ulrich wanderer Hans ulrich franck
Hans ulrich franck Ulrich uwer
Ulrich uwer Ulrich hellmann
Ulrich hellmann Hans ulrich goessl
Hans ulrich goessl Ulrich zwingli
Ulrich zwingli Modello di ulrich
Modello di ulrich Modello di ulrich
Modello di ulrich Fickle
Fickle Ulrich classen
Ulrich classen Ulrich kampffmeyer
Ulrich kampffmeyer Autorenrecht
Autorenrecht Ulrich zwingli
Ulrich zwingli Ulrich heck
Ulrich heck Ulrich frischknecht
Ulrich frischknecht Ulrich uwer
Ulrich uwer Test de ulrich
Test de ulrich Haas
Haas Ulrich ellenborg
Ulrich ellenborg Ulrich hohenester
Ulrich hohenester Ulrich kerzel
Ulrich kerzel Marburské spisy
Marburské spisy Neisserin havaintokehä
Neisserin havaintokehä Ulrich kampffmeyer
Ulrich kampffmeyer Ulrich goerlach
Ulrich goerlach Ulrich ellenborg
Ulrich ellenborg Modello di ulrich
Modello di ulrich Dr. ulrich kampffmeyer
Dr. ulrich kampffmeyer Ulrich kampffmeyer
Ulrich kampffmeyer Ulrich schuh
Ulrich schuh Ulrich's three legged model
Ulrich's three legged model Ulrich zwingli nationality
Ulrich zwingli nationality