RADIACTIVIDAD Y EMISIONES 1 Naturaleza de las reacciones














- Slides: 38

RADIACTIVIDAD Y EMISIONES

1. Naturaleza de las reacciones nucleares Algunos núcleos son inestables y espontáneamente emiten partículas y/o radiaciones electromagnéticas. A este fenómeno se le llama radioactividad. La radioactividad es una propiedad de los isótopos que son "inestables", es decir, que se mantienen en un estado excitado en sus capas electrónicas o nucleares, con lo que, para alcanzar su estado fundamental, deben perder energía. Todos los elementos que tienen número atómico mayor a 83 son radioactivos. Las reacciones nucleares pueden ser endotérmicas o exotérmicas.

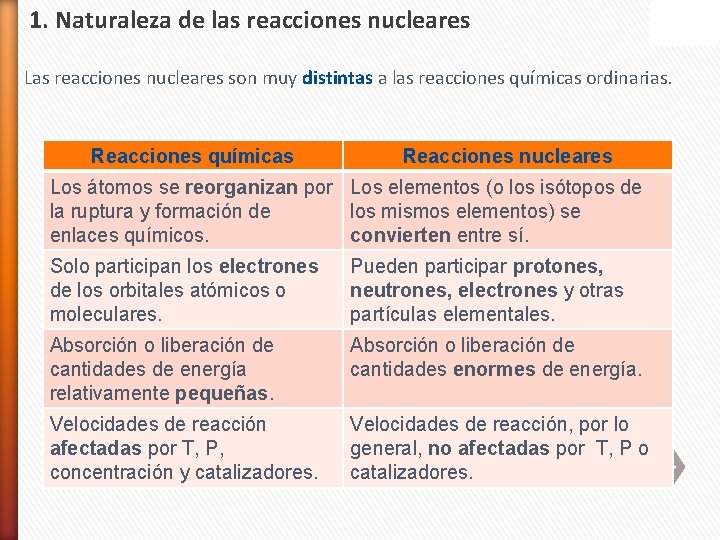
1. Naturaleza de las reacciones nucleares Las reacciones nucleares son muy distintas a las reacciones químicas ordinarias. Reacciones químicas Reacciones nucleares Los átomos se reorganizan por Los elementos (o los isótopos de la ruptura y formación de los mismos elementos) se enlaces químicos. convierten entre sí. Solo participan los electrones de los orbitales atómicos o moleculares. Pueden participar protones, neutrones, electrones y otras partículas elementales. Absorción o liberación de cantidades de energía relativamente pequeñas. Absorción o liberación de cantidades enormes de energía. Velocidades de reacción afectadas por T, P, concentración y catalizadores. Velocidades de reacción, por lo general, no afectadas por T, P o catalizadores.

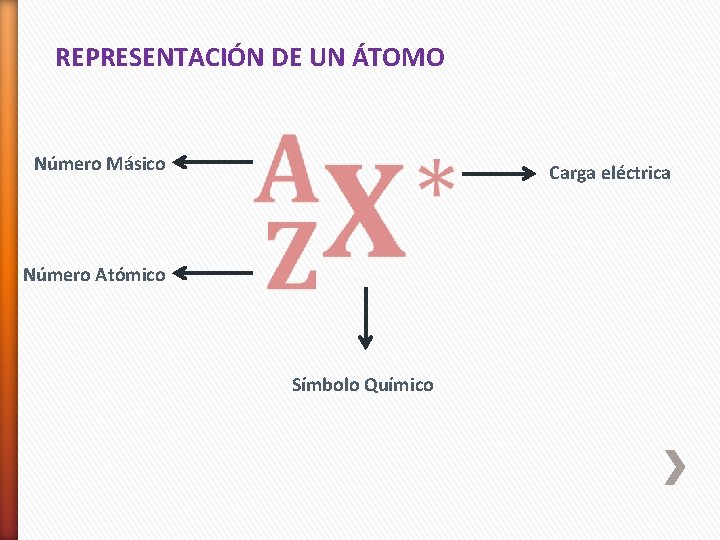
REPRESENTACIÓN DE UN ÁTOMO Número Másico Carga eléctrica Número Atómico Símbolo Químico

NÚMERO ATÓMICO (Z) § (Z): Se define como la cantidad de protones presentes en el núcleo de un átomo. § Conceptualmente identifica e individualiza a un elemento § Si el átomo es neutro, el número atómico COINCIDE con el número de electrones § El número atómico se anota en la parte inferior izquierda del símbolo químico ZX; 13 Al; 8 O; 92 U

NÚMERO MÁSICO (A) § (A): corresponde al total de partículas presente en el núcleo del átomo § Se obtiene sumando los protones y los neutrones Sí A = p + + n 0 Y Z = p+ Entonces A = Z + n 0 Por lo tanto: n 0 = A - Z

ISÓTOPOS § Átomos que poseen igual Z y diferente A § Si los átomos tienen igual Z, quiere decir que son del mismo elemento § Si los átomos tienen el mismo Z, pero el A es diferente, entonces ¿cuál es la verdadera diferencia entre los isótopos? EL NÚMERO DE NEUTRONES Ejemplos: p+ = 8 8 8 n 0 = 8 9 10

ISÓTOPOS Ejemplos: p+ = 6 6 6 n 0 = 6 7 8 PROTIO DEUTERIO TRITIO p+ = 1 1 1 n 0 = 0 1 2

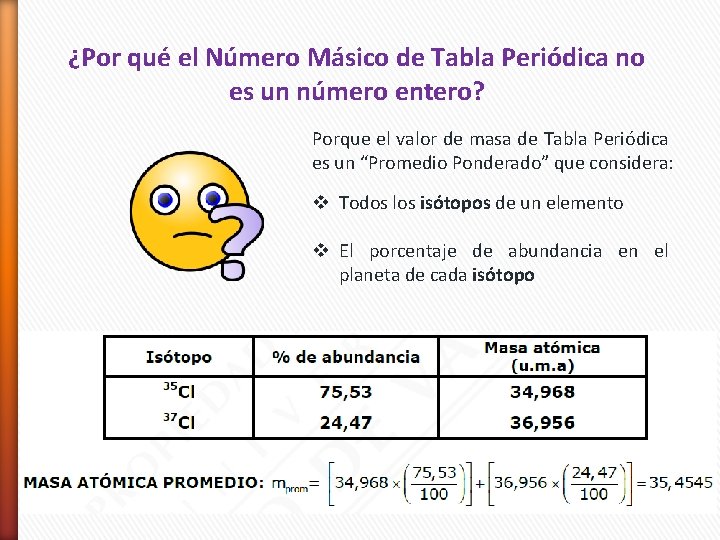
¿Por qué el Número Másico de Tabla Periódica no es un número entero? Porque el valor de masa de Tabla Periódica es un “Promedio Ponderado” que considera: v Todos los isótopos de un elemento v El porcentaje de abundancia en el planeta de cada isótopo

ISÓBAROS § Átomos que poseen igual A y diferente Z § Si los átomos tienen diferente Z, quiere decir que NO son del mismo elemento Ejemplos: ISÓTONOS § Átomos que poseen diferente A y diferente Z § Poseen igual número de neutrones (n 0 = A – Z) Ejemplos:

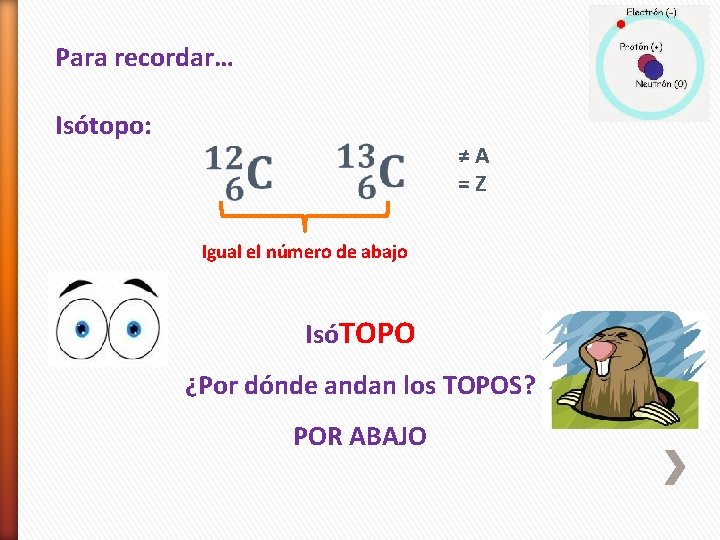
Para recordar… Isótopo: ≠A =Z Igual el número de abajo IsóTOPO ¿Por dónde andan los TOPOS? POR ABAJO

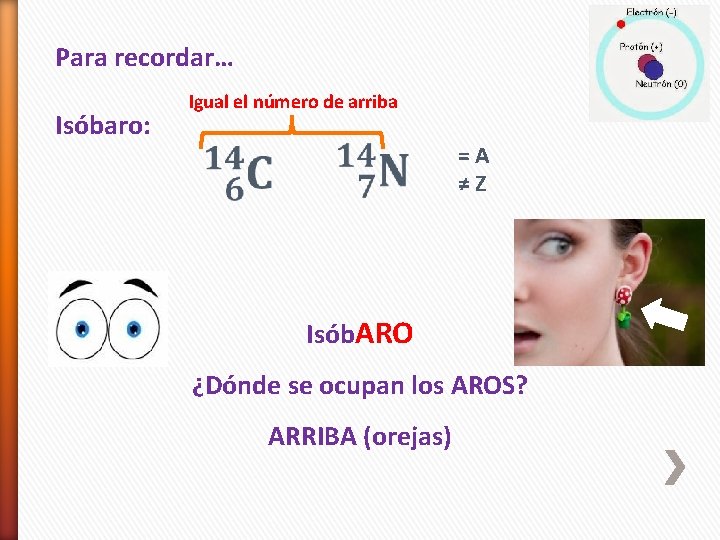
Para recordar… Isóbaro: Igual el número de arriba =A ≠Z Isób. ARO ¿Dónde se ocupan los AROS? ARRIBA (orejas)

CANTIDAD DE ELECTRONES EN UN IÓN O ÁTOMO § Si el átomo es NEUTRO: los electrones coinciden con el Z 19 ELECTRONES § Si el átomo es NEGATIVO (anión): se suma el valor absoluto de la carga al Z 18 ELECTRONES § Si el átomo es POSITIVO (catión): se resta el valor absoluto de la carga al Z 10 ELECTRONES

ÁTOMOS Y IONES ISOELECTRÓNICOS § Son átomos y iones que tienen la misma cantidad de electrones, por ejemplo: Todos tienen 10 electrones

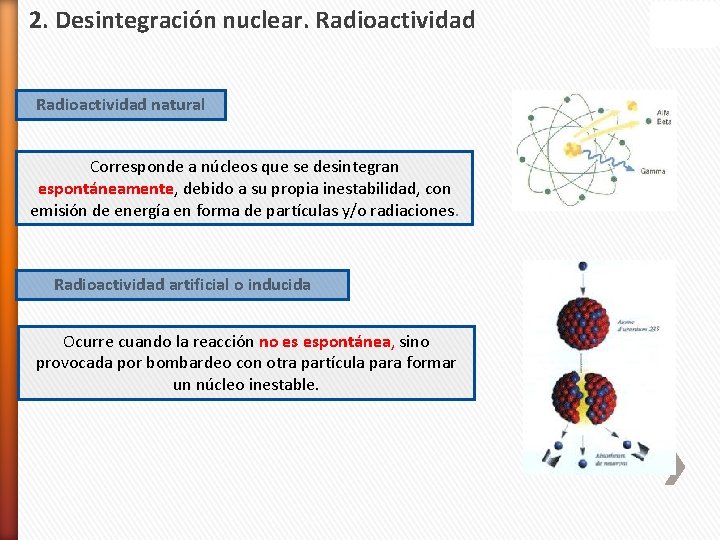
2. Desintegración nuclear. Radioactividad natural Corresponde a núcleos que se desintegran espontáneamente, debido a su propia inestabilidad, con emisión de energía en forma de partículas y/o radiaciones. Radioactividad artificial o inducida Ocurre cuando la reacción no es espontánea, sino provocada por bombardeo con otra partícula para formar un núcleo inestable.

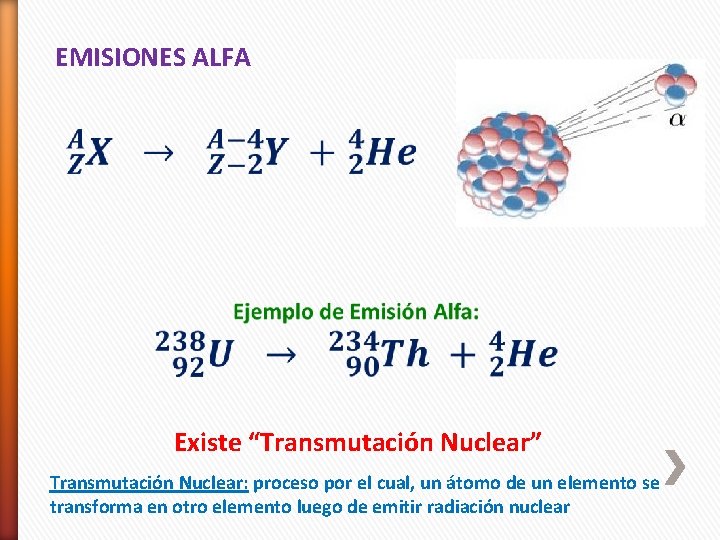
EMISIONES ALFA Existe “Transmutación Nuclear” Transmutación Nuclear: proceso por el cual, un átomo de un elemento se transforma en otro elemento luego de emitir radiación nuclear

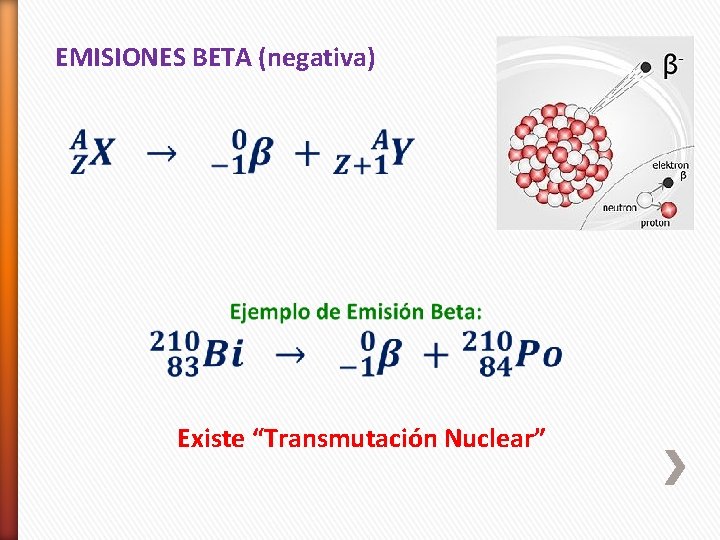
EMISIONES BETA (negativa) Existe “Transmutación Nuclear”

EMISIONES GAMMA NO Existe “Transmutación Nuclear”

EMISIÓN DE POSITRONES CAPTURA ELECTRÓNICA

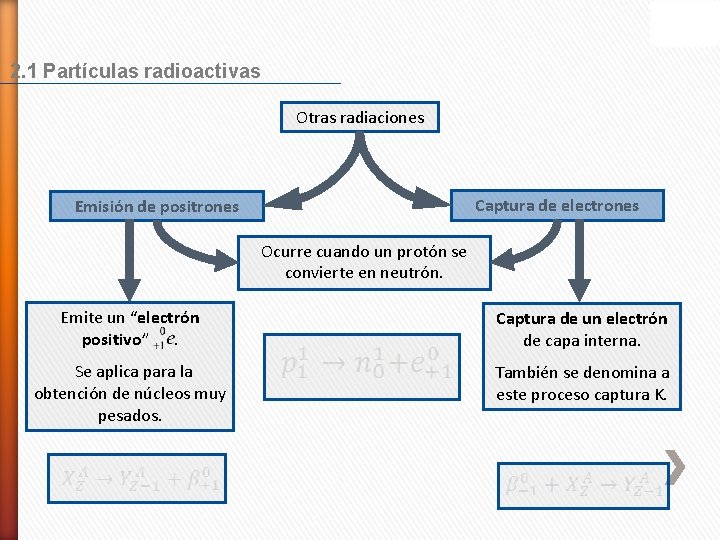
2. 1 Partículas radioactivas Otras radiaciones Captura de electrones Emisión de positrones Ocurre cuando un protón se convierte en neutrón. Emite un “electrón positivo”. Captura de un electrón de capa interna. Se aplica para la obtención de núcleos muy pesados. También se denomina a este proceso captura K.

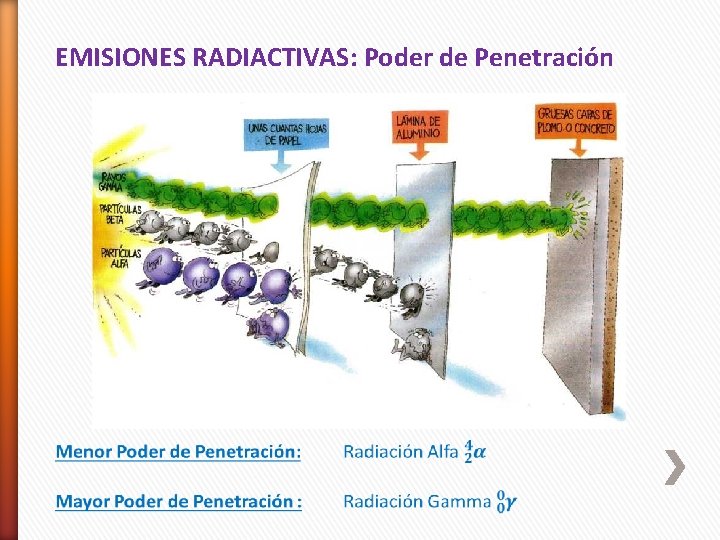
EMISIONES RADIACTIVAS: Poder de Penetración

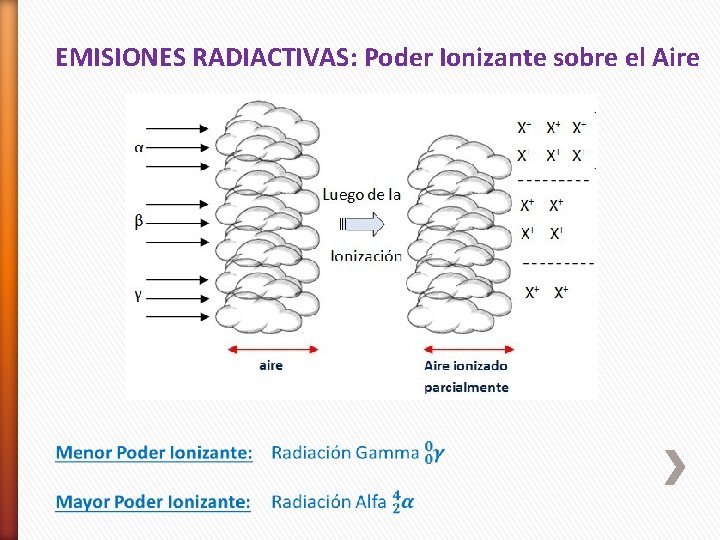
EMISIONES RADIACTIVAS: Poder Ionizante sobre el Aire

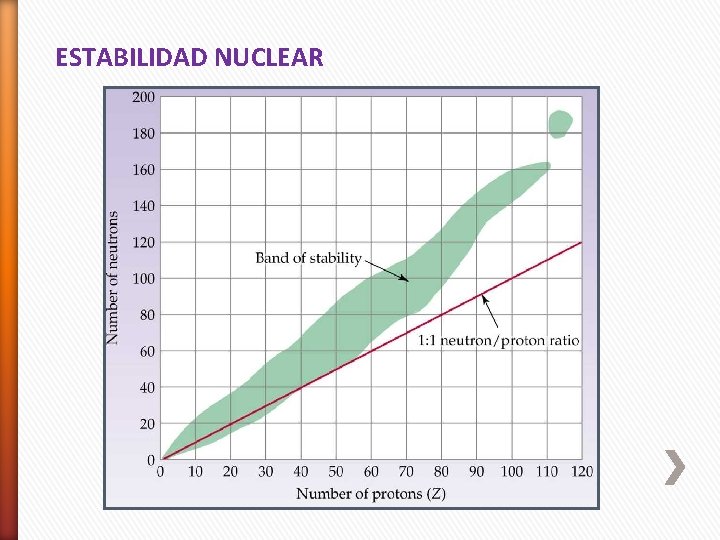
ESTABILIDAD NUCLEAR

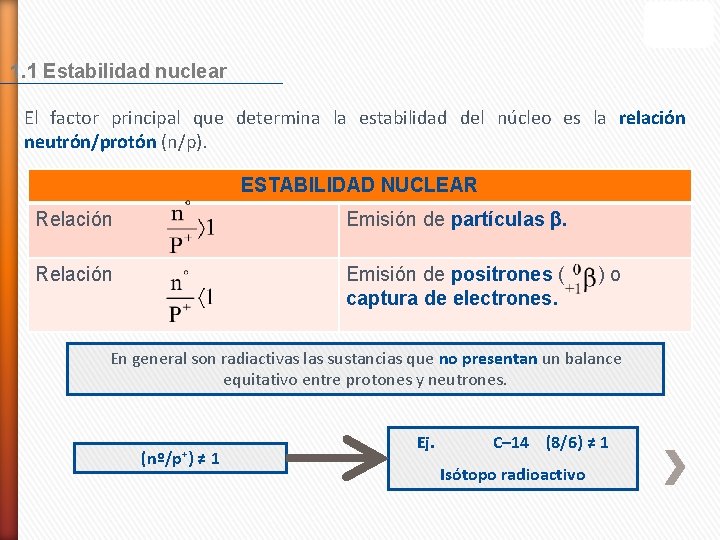
1. 1 Estabilidad nuclear El factor principal que determina la estabilidad del núcleo es la relación neutrón/protón (n/p). ESTABILIDAD NUCLEAR Relación Emisión de partículas . Relación Emisión de positrones ( captura de electrones. )o En general son radiactivas las sustancias que no presentan un balance equitativo entre protones y neutrones. (nº/p+) ≠ 1 Ej. C– 14 (8/6) ≠ 1 Isótopo radioactivo

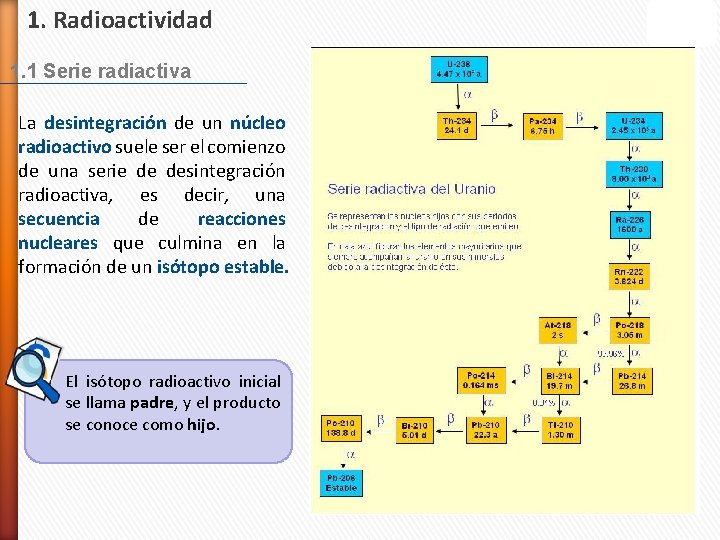
1. Radioactividad 1. 1 Serie radiactiva La desintegración de un núcleo radioactivo suele ser el comienzo de una serie de desintegración radioactiva, es decir, una secuencia de reacciones nucleares que culmina en la formación de un isótopo estable. El isótopo radioactivo inicial se llama padre, y el producto se conoce como hijo.

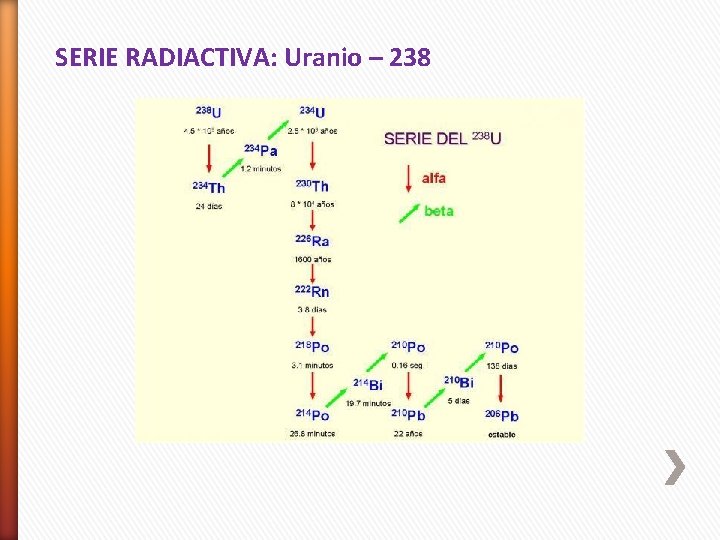
SERIE RADIACTIVA: Uranio – 238

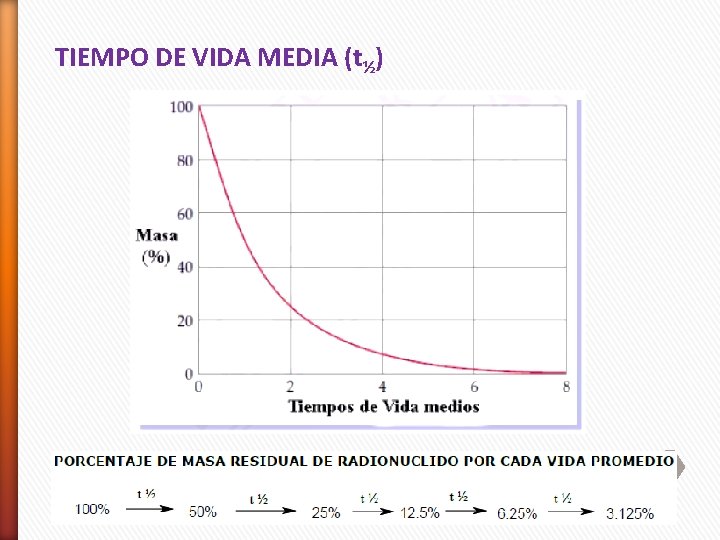
TIEMPO DE VIDA MEDIA (t½)

Ejemplo 1: Se dispone de 16 g de un isótopo radioactivo, cuya vida media es de 15 días. Después de 60 días, la cantidad residual del mismo será: 16, 0 g iniciales 15 días 8, 0 g 15 días (30 días) 4, 0 g 15 días (45 días) 15 días 2, 0 g 60 días 1, 0 g Después de 4 vidas medias (60 días) queda 1, 0 g de isótopo radioactivo

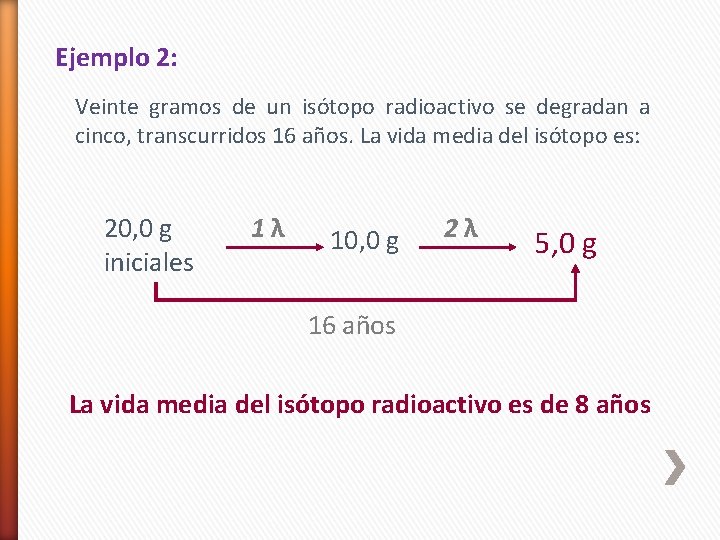
Ejemplo 2: Veinte gramos de un isótopo radioactivo se degradan a cinco, transcurridos 16 años. La vida media del isótopo es: 20, 0 g iniciales 1λ 10, 0 g 2λ 5, 0 g 16 años La vida media del isótopo radioactivo es de 8 años

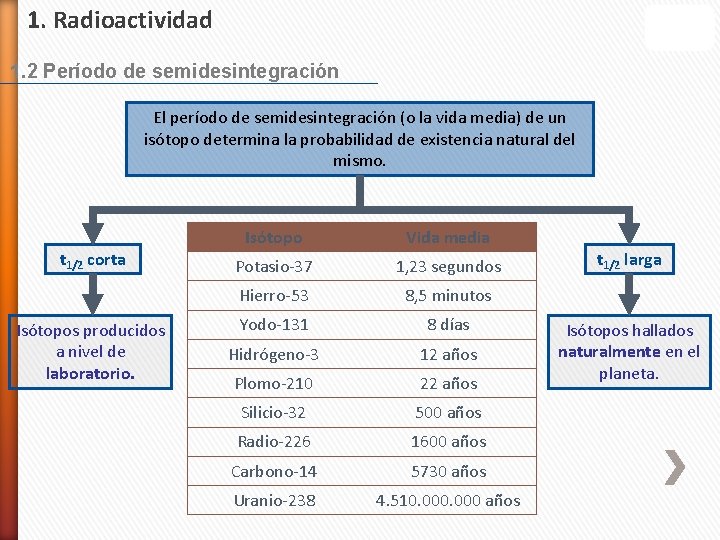
1. Radioactividad 1. 2 Período de semidesintegración El período de semidesintegración (o la vida media) de un isótopo determina la probabilidad de existencia natural del mismo. t 1/2 corta Isótopos producidos a nivel de laboratorio. Isótopo Vida media Potasio-37 1, 23 segundos Hierro-53 8, 5 minutos Yodo-131 8 días Hidrógeno-3 12 años Plomo-210 22 años Silicio-32 500 años Radio-226 1600 años Carbono-14 5730 años Uranio-238 4. 510. 000 años t 1/2 larga Isótopos hallados naturalmente en el planeta.

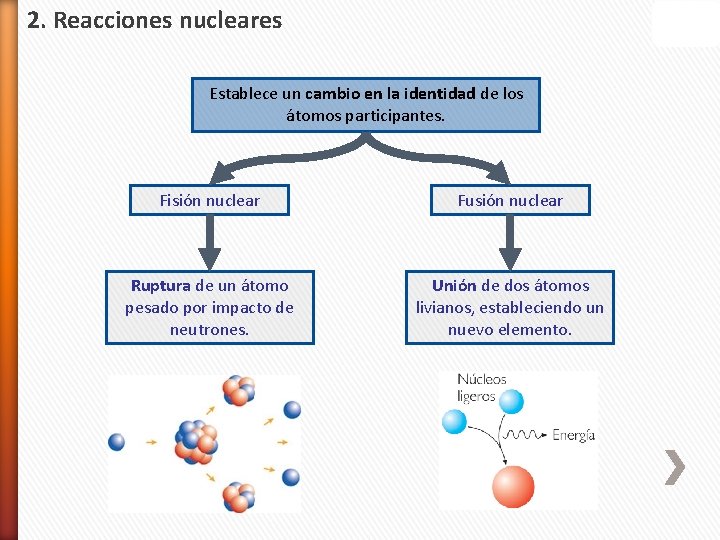
2. Reacciones nucleares Establece un cambio en la identidad de los átomos participantes. Fisión nuclear Fusión nuclear Ruptura de un átomo pesado por impacto de neutrones. Unión de dos átomos livianos, estableciendo un nuevo elemento.

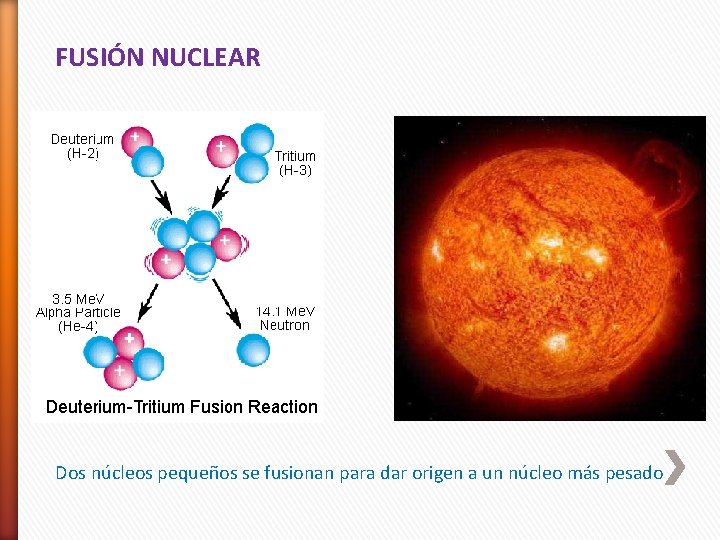
2. Reacciones nucleares 2. 4 Fusión nuclear Corresponde a la combinación de pequeños núcleos en otros más grandes, está exenta en gran parte del problema asociado al desecho de los desperdicios. Proceso continuo en el Sol, el cual se compone principalmente de hidrógeno y helio. Las reacciones de fusión suelen llamarse también reacciones termonucleares porque se llevan a cabo solo a temperaturas muy elevadas.

FUSIÓN NUCLEAR Dos núcleos pequeños se fusionan para dar origen a un núcleo más pesado

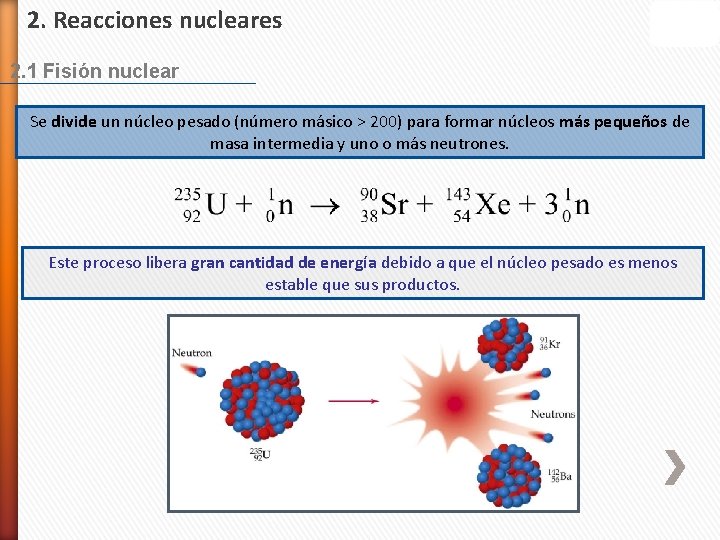
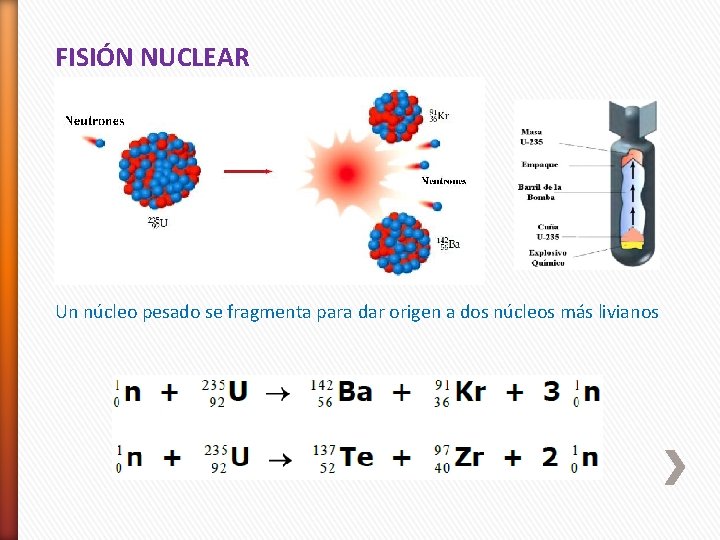
2. Reacciones nucleares 2. 1 Fisión nuclear Se divide un núcleo pesado (número másico > 200) para formar núcleos más pequeños de masa intermedia y uno o más neutrones. Este proceso libera gran cantidad de energía debido a que el núcleo pesado es menos estable que sus productos.

FISIÓN NUCLEAR Un núcleo pesado se fragmenta para dar origen a dos núcleos más livianos

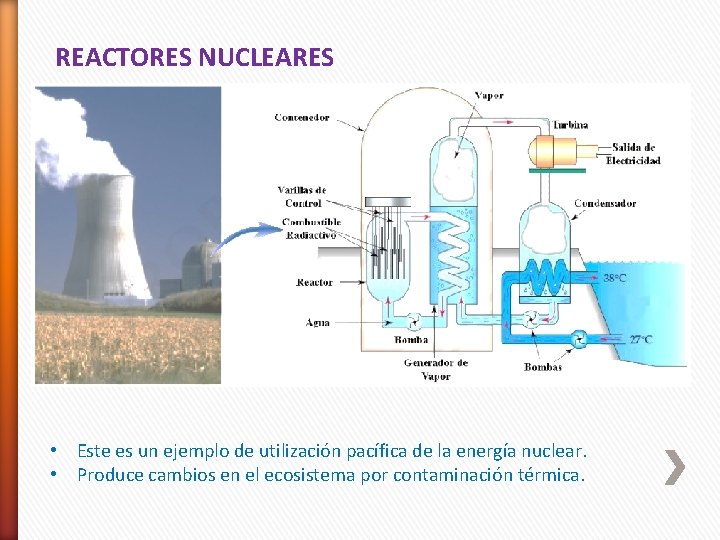
REACTORES NUCLEARES • Este es un ejemplo de utilización pacífica de la energía nuclear. • Produce cambios en el ecosistema por contaminación térmica.

RADIACTIVIDAD Y SUS APLICACIONES Medicina Nuclear Agricultura Arqueología: Datación con Carbono-14

3. Aplicaciones y efectos de la energía nuclear 3. 2 Efectos biológicos de la radiación El efecto biológico de la radiación depende de diversos factores como la dosis recibida, el tiempo de exposición, la región del cuerpo que se haya expuesto y el tipo de radiación. estroncio– 90 → emisor beta, es capaz de reemplazar el calcio de los huesos. iones superóxido (O 2–) → atacan membranas celulares de los tejidos y compuestos orgánicos, como enzimas y ADN. Los efectos son múltiples y de diversa gravedad, incluyendo quemaduras, mutaciones genéticas, esterilidad, cáncer (crecimiento celular anormal), entre muchos otros.