Qumica Orgnica Profa Karen Farias Ementa QOFundamental 1








































- Slides: 58

Química Orgânica Profa. Karen Farias

Ementa QOFundamental 1. Teoria estrutural 1. 1 Histórico. 1. 2 Teoria atômica e o átomo de carbono. 1. 4 Estrutura de lewis e kekulé. 1. 5 Teoria das ligações: hibridização de orbitais atômicos 1. 3 Ligações quimicas 1. 6 Ressonância 1. 7 Carga formal 1. 8 Aromaticidade 2. Funções orgânicas: estrutura, nomenclatura e propriedades 1. 5 Alcanos 1. 5 Alcenos 1. 5 Alcinos 1. 5 Compostos aromáticos 1. 5 Haletos de alquila 1. 5 Compostos oxigenados: álcoois, éteres e fénois 1. 5 Compostos carbonilados: aldeídos, cetonas, ácidos carboxílicos e derivados 1. 5 Aminas

3. Ácidos e bases 1. 5 Teoria ácido-base: bronsted-lowry e lewis 3. 2. Constante de dissociação ácida e básica 3. 3. Origem da acidez e basicidade dos compostos orgânicos 3. 4. Influência do solvente 3. 5. Influência da estrutura e dos substituintes dos compostos orgânicos 4. Estereoquímica 1. 5 Quiralidade 1. 5 Configuração r e s 1. 5 Projeção de fischer 1. 5 Estereoisômeros: enantiômero, diastereoisômero e composto meso. 5. Isomeria 1. 5 Isomeria cis-trans e e/z 1. 5 Análise conformacional de compostos acíclicos e cíclicos 1. 5 Atividade óptica.

NASCIMENTO DA QUÍMICA ORG NICA No século XVIII, Scheele (1742 -1786) conseguiu isolar ácido tartárico (C 4 H 6 O 6) da uva, ácido cítrico (C 6 H 8 O 7) do limão, ácido lático (C 3 H 6 O 3) do leite, glicerina (C 3 H 8 O 3) da gordura, uréia (CH 4 N 2 O) da urina etc. Foi por esse motivo que Bergman (1735 -1784) definiu, em 1777, a Química Orgânica como a Química dos compostos existentes nos organismos vivos, vegetais e animais, enquanto a Química Inorgânica seria a Química dos compostos existentes no reino mineral.

Nessa mesma época, Lavoisier (1743 -1794) conseguiu analisar vários compostos orgânicos e constatou que todos continham o elemento químico carbono, representado pela letra C. Em 1807, Berzelius lançou a idéia que apenas os organismos vivos eram capazes de produzir compostos orgânicos devido a uma força misteriosa. Esta teoria foi chamada de TEORIA FORÇA VITAL. Ser vivo No ano de 1828, essa teoria foi posta em dúvida quando o químico alemão Friedrich Wöhler, aquecendo cianato de amônio, provocou uma reação, na qual um composto inorgânico se transformou em um composto orgânico, a URÉIA.


CARACTERÍSTICAS DO ÁTOMO DE CARBONO O átomo de carbono apresenta certas particularidades que o tornam diferente dos demais elementos químicos; Esse fato foi percebido na metade do século XIX, inicialmente por Kekulé, e possibilitou uma melhor compreensão da estrutura das substâncias orgânicas. Dentre as principais características do átomo de carbono devemos citar:

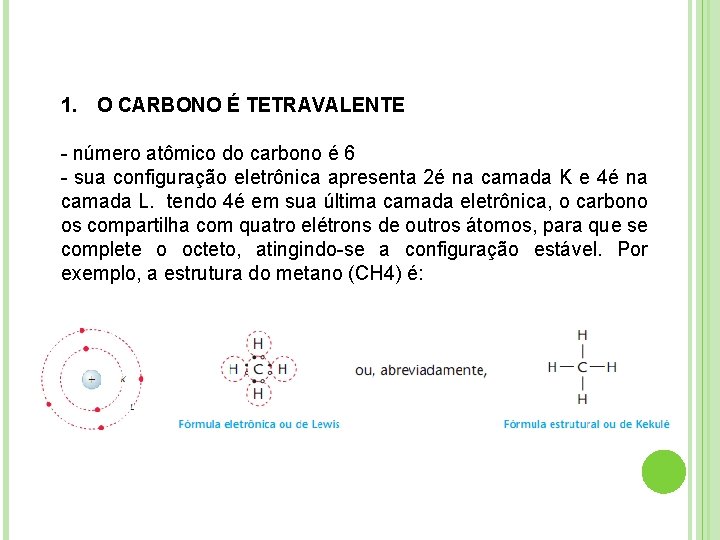
1. O CARBONO É TETRAVALENTE - número atômico do carbono é 6 - sua configuração eletrônica apresenta 2é na camada K e 4é na camada L. tendo 4é em sua última camada eletrônica, o carbono os compartilha com quatro elétrons de outros átomos, para que se complete o octeto, atingindo-se a configuração estável. Por exemplo, a estrutura do metano (CH 4) é:


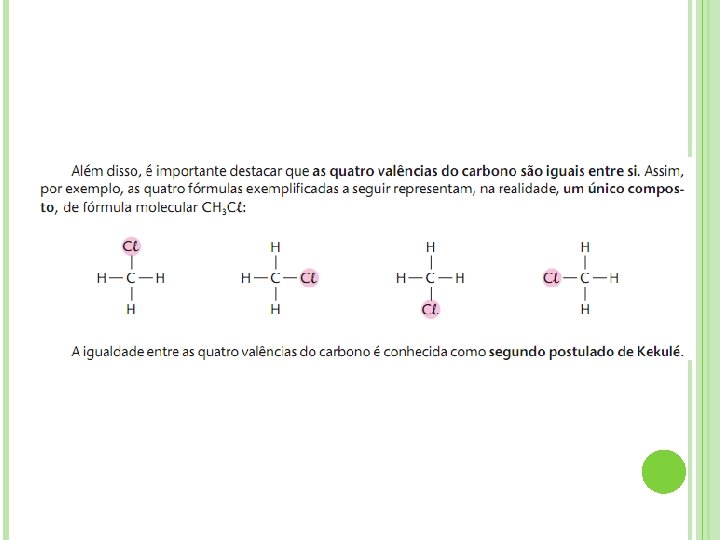
2. O CARBONO FORMA LIGAÇÕES MÚLTIPLAS Nos exemplos anteriores (CH 4 e CH 3 Cl), vimos o carbono formando uma única ligação — ligação simples—com cada átomo de hidrogênio ou de cloro. Entretanto, um átomo de carbono pode estabelecer duas ou três ligações com um segundo átomo, formando, respectivamente, uma ligação dupla ou uma ligação tripla. Por exemplo:

3. O CARBONO LIGA-SE A VÁRIAS CLASSES DE ELEMENTOS QUÍMICOS O carbono está na coluna 4 A, no “meio” do 2º período da Tabela Periódica: O carbono fica, portanto, a “meio caminho” entre os metais e os nãometais, isto é, entre os elementos eletropositivos eletronegativos. O carbono pode ligar-se ora a elementos eletropositivos (como o hidrogênio), ora a elementos eletronegativos (como o oxigênio).

4. O CARBONO FORMA CADEIAS O átomo de carbono tem uma capacidade extraordinária de se ligar a outros átomos — de carbono, de oxigênio, de nitrogênio etc. — formando encadeamentos ou cadeias curtas ou longas e com as mais variadas disposições (esse fato é conhecido como terceiro postulado de Kekulé). São exatamente essas cadeias que irão constituir o “esqueleto” das moléculas das substâncias orgânicas.

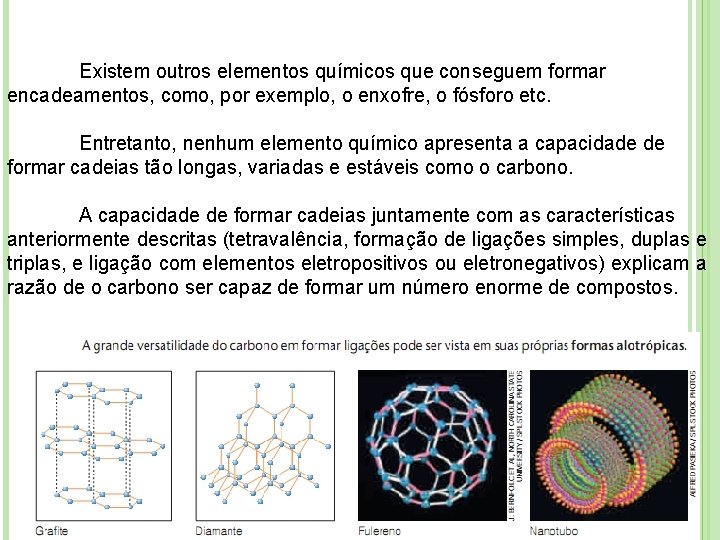
Existem outros elementos químicos que conseguem formar encadeamentos, como, por exemplo, o enxofre, o fósforo etc. Entretanto, nenhum elemento químico apresenta a capacidade de formar cadeias tão longas, variadas e estáveis como o carbono. A capacidade de formar cadeias juntamente com as características anteriormente descritas (tetravalência, formação de ligações simples, duplas e triplas, e ligação com elementos eletropositivos ou eletronegativos) explicam a razão de o carbono ser capaz de formar um número enorme de compostos.




CLASSIFICAÇÃO DOS ÁTOMOS DE CARBONO EM UMA CADEIA Conforme a posição em que se encontram na cadeia, os átomos de carbono classificam-se em:

Na cadeia carbônica abaixo, classifique os carbonos em primários, secundários, terciários e quartenários.


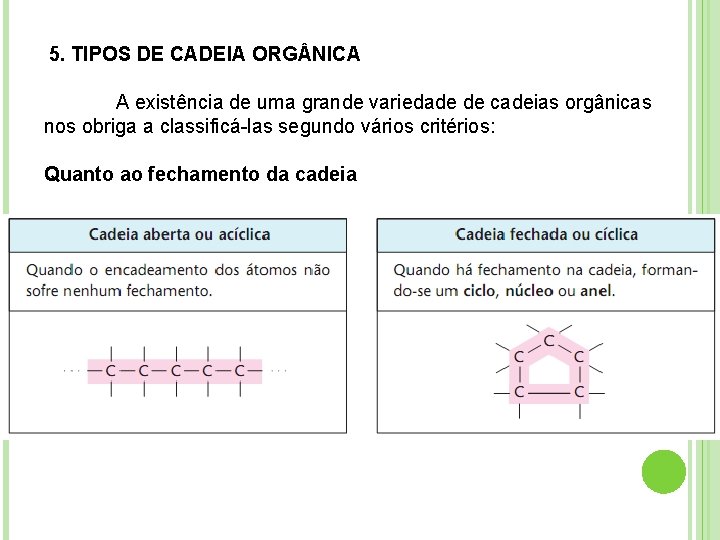
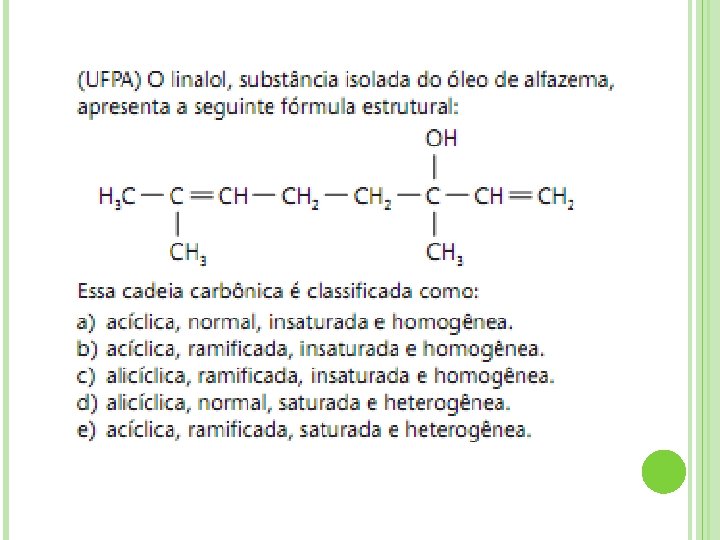
5. TIPOS DE CADEIA ORG NICA A existência de uma grande variedade de cadeias orgânicas nos obriga a classificá-las segundo vários critérios: Quanto ao fechamento da cadeia

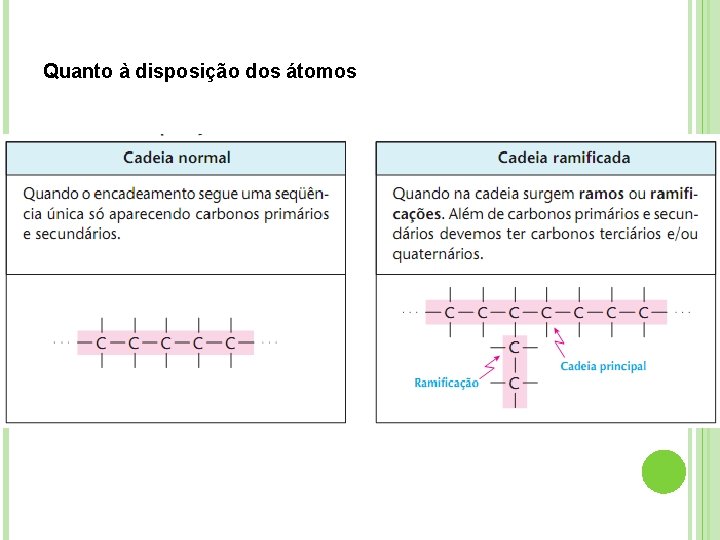
Quanto à disposição dos átomos

Quanto aos tipos de ligação

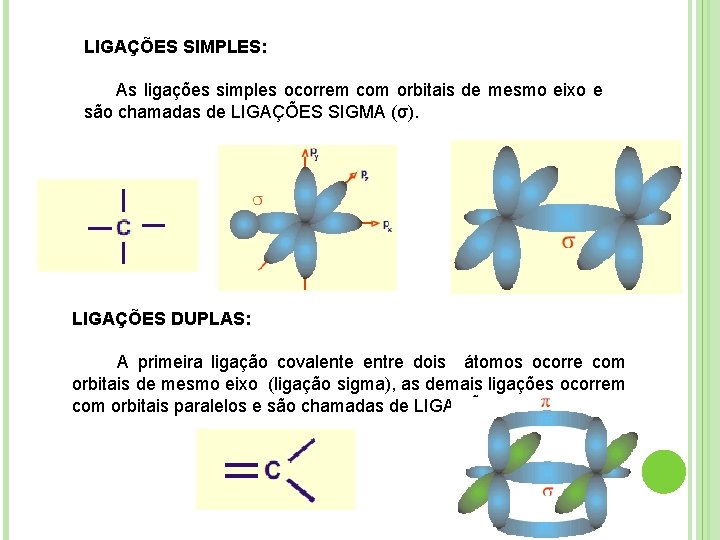
LIGAÇÕES SIMPLES: As ligações simples ocorrem com orbitais de mesmo eixo e são chamadas de LIGAÇÕES SIGMA (σ). LIGAÇÕES DUPLAS: A primeira ligação covalente entre dois átomos ocorre com orbitais de mesmo eixo (ligação sigma), as demais ligações ocorrem com orbitais paralelos e são chamadas de LIGAÇÕES pi (π).

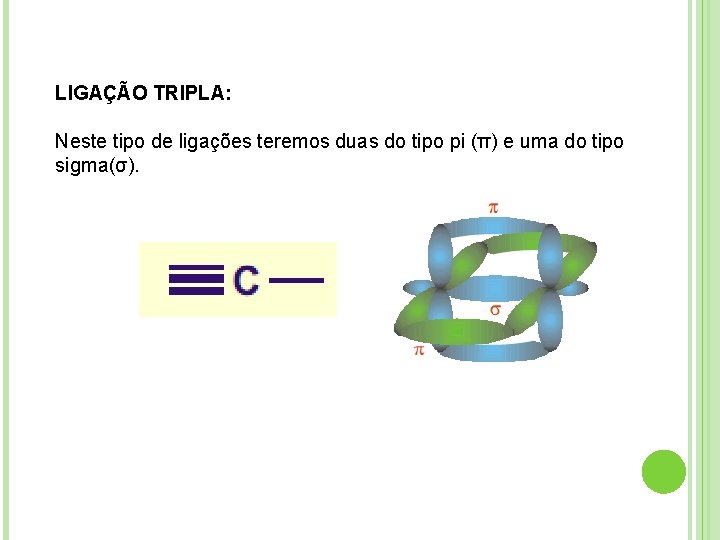
LIGAÇÃO TRIPLA: Neste tipo de ligações teremos duas do tipo pi (π) e uma do tipo sigma(σ).

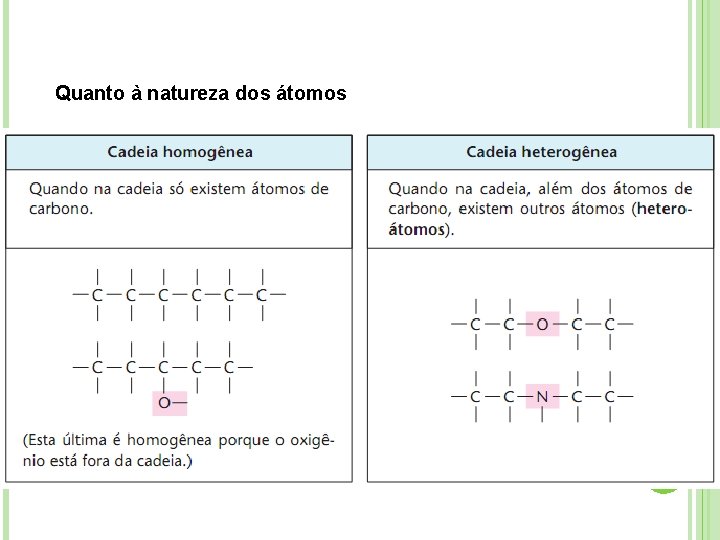
Quanto à natureza dos átomos




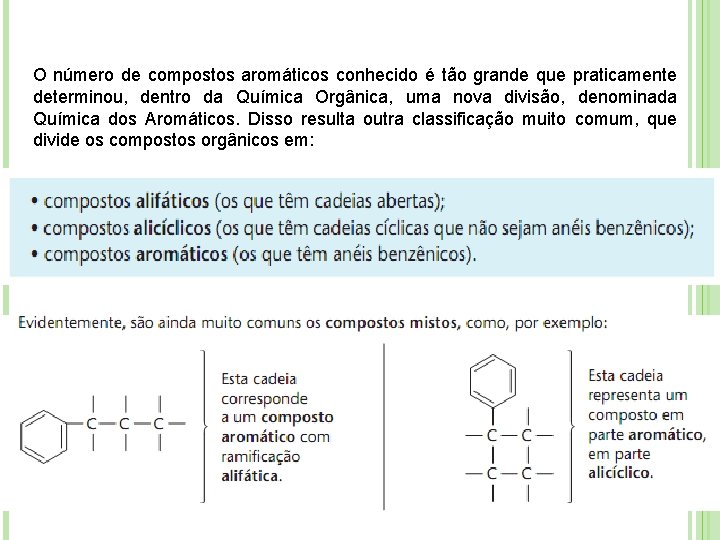
O número de compostos aromáticos conhecido é tão grande que praticamente determinou, dentro da Química Orgânica, uma nova divisão, denominada Química dos Aromáticos. Disso resulta outra classificação muito comum, que divide os compostos orgânicos em:

Resumo


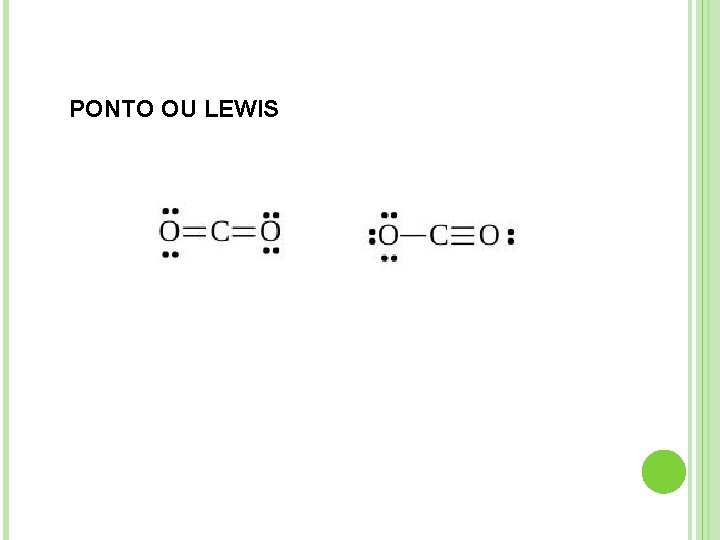
FÓRMULA ESTRUTURAL : Em virtude da grande variedade de cadeias carbônicas que podem aparecer nos compostos orgânicos, são muito importantes as chamadas fórmulas estruturais, que nos revelam a estrutura, isto é, a arrumação ou disposição dos átomos dentro das moléculas. PONTOS OU LEWIS KEKULÉ CONDENSADA LINHA

PONTO OU LEWIS

TRAÇO OU KEKULÉ Por exemplo, uma estrutura muito encontrada na gasolina é a seguinte: CONDENSADA

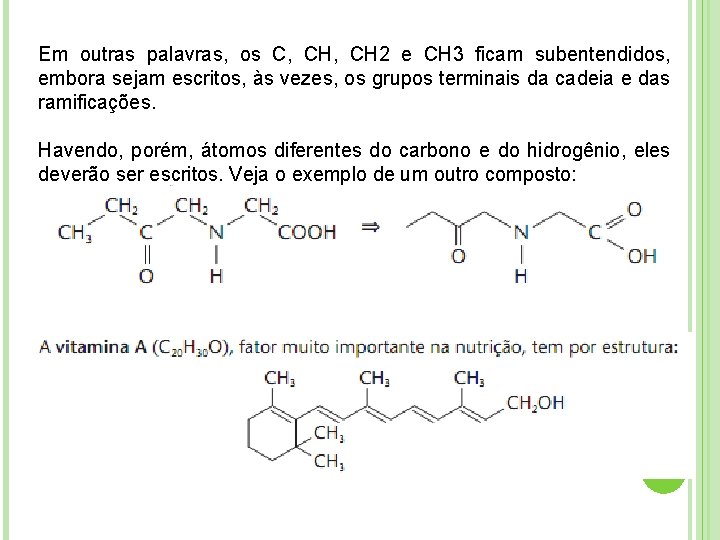
Esta última, denominada fórmula estrutural condensada, é a mais usada, pois, sem dúvida, é mais fácil de se escrever do que a primeira. Outra versão ainda mais simplificada da mesma fórmula, seria: na qual a cadeia principal é representada por uma linha em ziguezague. Podemos simplificá-la ainda mais omitindo os grupos CH 3, resultando então: LINHA

Em outras palavras, os C, CH 2 e CH 3 ficam subentendidos, embora sejam escritos, às vezes, os grupos terminais da cadeia e das ramificações. Havendo, porém, átomos diferentes do carbono e do hidrogênio, eles deverão ser escritos. Veja o exemplo de um outro composto:



Estrutura atômica: orbitais Como os elétrons se distribuem em um átomo? O comportamento de um elétron específico em um átomo pode ser descrito por uma expressão matemática chamada equação de onda. A solução de uma equação de onda é denominada função de onda ou orbital. O orbital aparece como uma nuvem borrada indicando a região do espaço próximo ao núcleo onde o elétron esteve. Essa nuvem eletrônica não tem fronteira bem definida, logo dizemos que um orbital representa o espaço onde o elétron passa a maior parte do tempo.

Mas qual a aparência de um orbital? Existem 4 tipos de orbitais, todos com um formato diferente.

Os orbitais são organizados em diferentes camadas ou níveis eletrônicos, de tamanho e energia sucessivamente maiores. Camadas diferentes contém diferentes números e tipos de orbitais, e cada orbital dentro de um nível pode ser ocupado por dois elétron. s 1 orbital p 3 orbitais d 5 orbitais

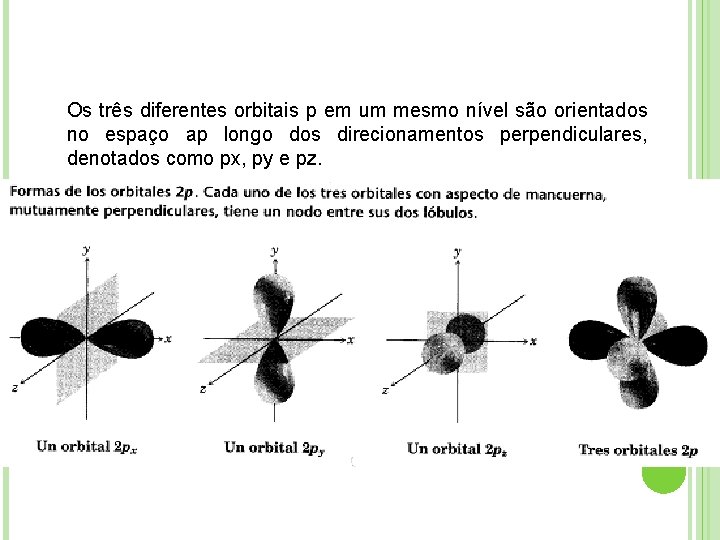
Os três diferentes orbitais p em um mesmo nível são orientados no espaço ap longo dos direcionamentos perpendiculares, denotados como px, py e pz.

Estrutura atômica: configuração eletrônica O arranjo de menor energia, ou a configuração eletrônica do EF, de um átomo é uma lista de orbitais ocupados por seu elétron. Podemos prever esse arranjo seguindo três regras: REGRA 1 REGRA 2

REGRA 3 Escreva a configuração eletrônica do EF dos seguintes elementos: H 1 C 6 P 15

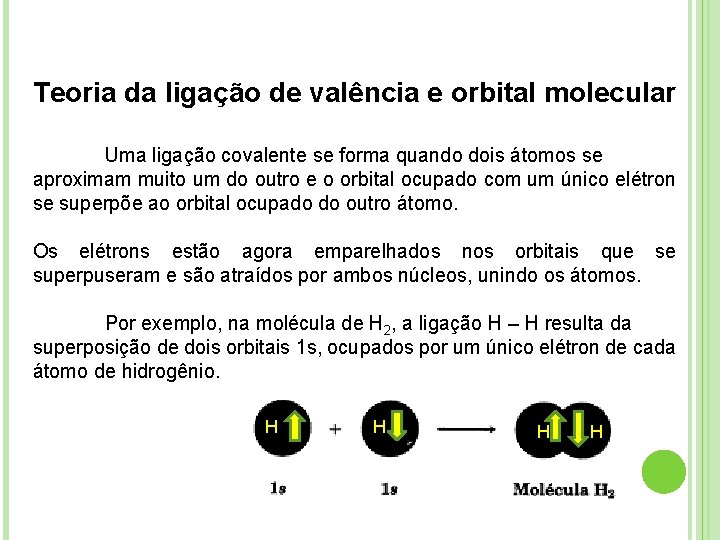
Teoria da ligação de valência e orbital molecular Uma ligação covalente se forma quando dois átomos se aproximam muito um do outro e o orbital ocupado com um único elétron se superpõe ao orbital ocupado do outro átomo. Os elétrons estão agora emparelhados nos orbitais que se superpuseram e são atraídos por ambos núcleos, unindo os átomos. Por exemplo, na molécula de H 2, a ligação H – H resulta da superposição de dois orbitais 1 s, ocupados por um único elétron de cada átomo de hidrogênio. H H

Pergunta: Por que os átomos se ligam? O carbono liga-se a outros átomos não pela ganho ou perda de elétron, mas sim pelo compartilhamento de elétron. Tal compartilhamento foi proposto por Lewis e é chamada de ligação covalente.


Hibridação

Hibridação sp 3 e a estrutura do metano



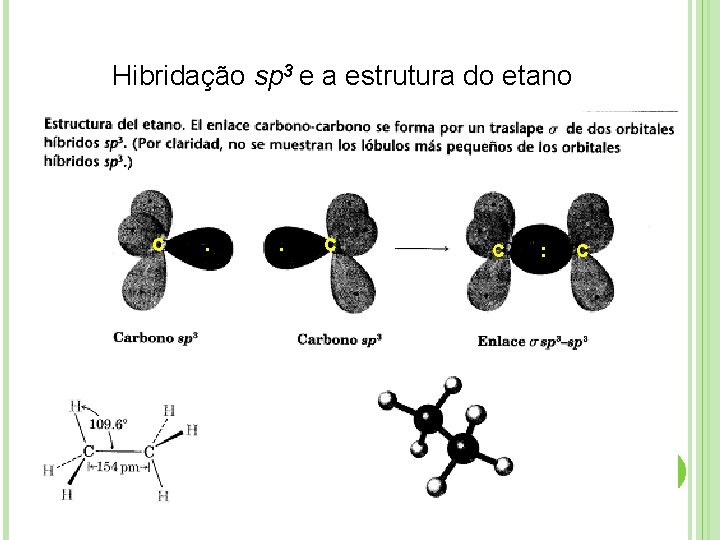
Hibridação sp 3 e a estrutura do etano C . . C C : C

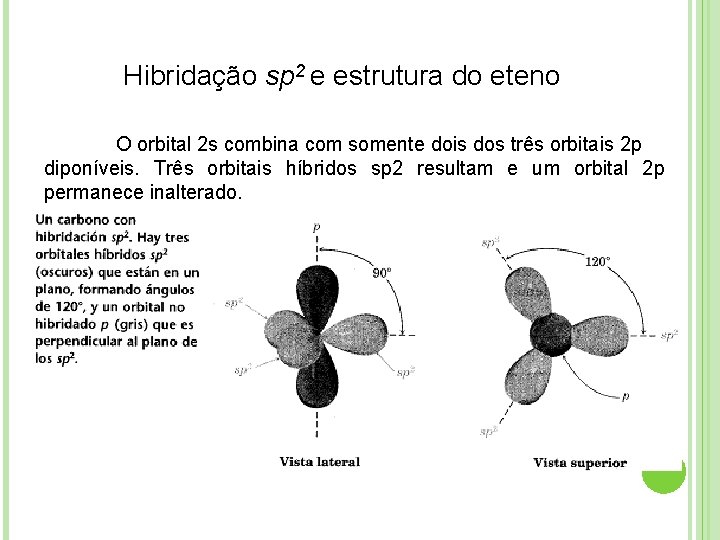
Hibridação sp 2 e estrutura do eteno O orbital 2 s combina com somente dois dos três orbitais 2 p diponíveis. Três orbitais híbridos sp 2 resultam e um orbital 2 p permanece inalterado.


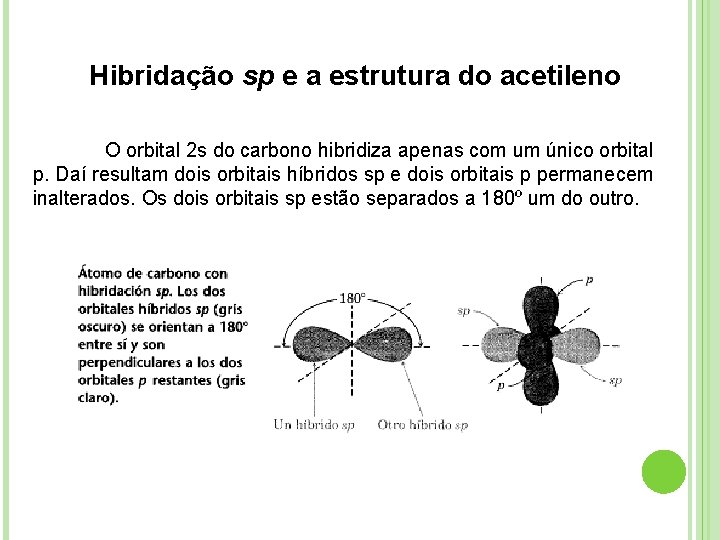
Hibridação sp e a estrutura do acetileno O orbital 2 s do carbono hibridiza apenas com um único orbital p. Daí resultam dois orbitais híbridos sp e dois orbitais p permanecem inalterados. Os dois orbitais sp estão separados a 180º um do outro.

Quando os dois átomos de carbono sp aproximam-se um do outro, os orbitais híbridos sp de cada carbono se superpõem frontalmente para formar uma ligação forte sigma sp-sp. Além do mais , os orbitais pz de cada átomo de carbono formam uma ligação pi pz-pz através da superposição lateral e os orbitais py, se sobrepõem de forma análoga para formar uma ligação pi py-py. O efeito total é o compartilhamento de 6 elétron.

Observações • Uma ligação p é mais fraca do que uma ligação s. • Quanto maior a densidade eletrônica na região de sobreposição dos orbitais, mais forte é a ligação. • Quanto maior o caráter s, menor e mais forte é a ligação. • Quanto maior o caráter s, maior é o ângulo de ligação.

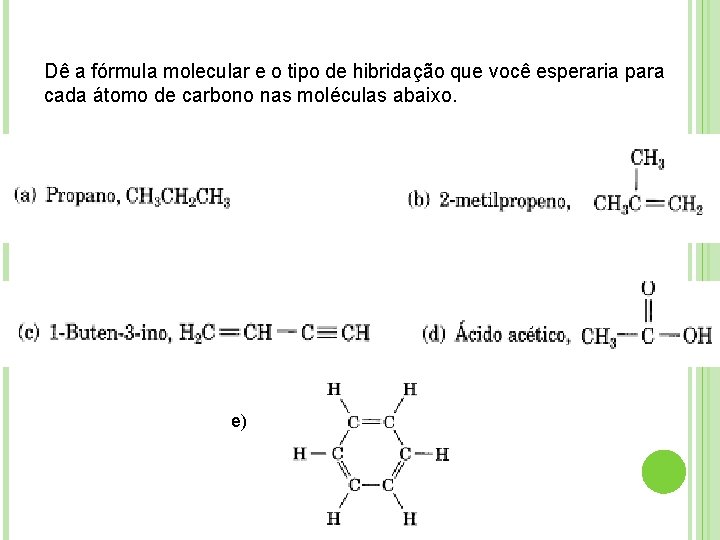
Dê a fórmula molecular e o tipo de hibridação que você esperaria para cada átomo de carbono nas moléculas abaixo. e)
 Plínio afonso de farias mello
Plínio afonso de farias mello Veronica ruz farias
Veronica ruz farias 7 saberes de edgar morin
7 saberes de edgar morin Www.profa
Www.profa Profa kempis multiplicaciones con número decimal
Profa kempis multiplicaciones con número decimal Internet profa
Internet profa Internet profa
Internet profa Profa campis
Profa campis Hr valentin gomez farias
Hr valentin gomez farias Livresq
Livresq Qumica
Qumica Etapas da análise gravimétrica
Etapas da análise gravimétrica Nomenclatura das bases
Nomenclatura das bases Qumica
Qumica Teoria cinetica de los gases
Teoria cinetica de los gases Reacciones de los halogenuros de alquilo
Reacciones de los halogenuros de alquilo Reação endergônica
Reação endergônica Qumica
Qumica Qumica
Qumica Enlace covalente coordinado
Enlace covalente coordinado Mistura quimica
Mistura quimica Qumica
Qumica Istopos
Istopos Qumica
Qumica Qumica
Qumica Qumica
Qumica C qumica
C qumica Entalpia
Entalpia Enantiomeros
Enantiomeros Qumica
Qumica Na
Na Qumica
Qumica Cintica
Cintica Entalpia
Entalpia Fenilmetilamina
Fenilmetilamina Química orgânica resumo
Química orgânica resumo Qumica
Qumica Postprecipitación
Postprecipitación Tabla qumica
Tabla qumica Qumica
Qumica Formulas estruturais
Formulas estruturais Que es el proyecto genoma humano
Que es el proyecto genoma humano Qumica
Qumica Qumica
Qumica Qumica moderna
Qumica moderna Qumica
Qumica Temperatura de congelacion
Temperatura de congelacion Qumica
Qumica Qumica
Qumica Quimica geral
Quimica geral Haletos
Haletos Homogneo
Homogneo Qumica
Qumica Qumica
Qumica Notação de lewis
Notação de lewis Carbonos primarios secundarios terciarios y cuaternarios
Carbonos primarios secundarios terciarios y cuaternarios Qumica
Qumica Unip mecatronica
Unip mecatronica Qumica
Qumica