QUMICA INSTRUMENTAL 2 ao del Ciclo de Licenciatura






































- Slides: 47

QUÍMICA INSTRUMENTAL 2° año del Ciclo de Licenciatura en Criminalística

Espectrofotometría de absorción molecular UV-visible n. Absorción de radiación Proceso en que la energía electromagnética se transfiere a átomos, iones o moléculas. La absorción provoca que la partícula pase de un estado fundamental a u estado excitado de energía superior. Los átomos, moléculas o iones poseen un número limitado de niveles de energía discretos. Para que se produzca la absorción, la energía de los fotones excitadores debe coincidir exactamente con la diferencia de energía del estado fundamental y de uno de los estados excitados de la especie absorbente. Como estas diferencias de energía son características, el estudio de la radiación absorbida proporciona un medio para caracterizar los componentes de la muestra.

Absorción de la radiación n. Absorción atómica: Absorción de sólo unas pocas bien definidas. La simplicidad del espectro se debe al pequeño número de estados de energía de la partícula absorbente. La excitación solo puede producirse mediante un proceso electrónico en el que uno o más electrones se promocionan a un nivel de energía superior. El vapor de sodio presenta dos picos de absorción agudos muy poco separados entre en la región amarilla del espectro (589, 0 y 589, 6 nm), que son consecuencia de la excitación del electrón 3 s a dos estados 3 p que difieren muy poco en energía.

Absorción de la radiación n. Absorción molecular: Espectro más complejo que en los átomos. Mayor número de estados energéticos. La energía E asociada al espectro de bandas de una molécula está formada por tres componentes. E = Eelectrónica + Evibracional + Erotacional Eelectrónica : estados energéticos provenientes de distintos electrones enlazantes. Evibracional : energía total asociada al elevado número de vibraciones interatómicas. Erotacional : energía asociada a los movimientos rotacionales dentro de la molécula. Para cada estado de energía electrónica de una molécula existen varios niveles cuantizados de estados vibracionales posibles, y a su vez, para cada uno de esos estados vibracionales existen numerosos estados rotacionales posibles.


Observando el diagrama anterior n Diferencia de energía entre los estados fundamental y excitados tanto en la transición electrónica como en la vibracional. n La energía se calcula con: E = hv (vi = 1/h (E 1 + e´i – E 0). n Entre estados vibracionales: vi = 1/h ( ei – e 0). n Aunque no se muestre en el diagrama para cada estado vibracional se encuentra asociado un estado rotacional, la diferencia de energía entre estados rotacionales es pequeña respecto de los estados vibracionales.


Procesos de relajación n En general el tiempo de vida de un átomo o una molécula en el estado excitado es muy breve (10 -8 s 10 -15 s), ya que existen diversos procesos de relajación que permiten el regreso al estado fundamental. n Relajación no radiante. (conversión interna y externa) n Relajación o desactivación radiante (fluorescencia y fosforescencia). n El mecanismo más probable hacia el estado fundamental es aquel que minimiza el tiempo e vida del estado excitado.

Relajación no radiante n Consiste en la pérdida de energía en una serie de etapas donde la energía de excitación se transforma en energía cinética mediante la colisiones con otras moléculas. n Otra posibilidad es la transformación de dicha energía en calor, aunque no detectable, se considera como una leve perturbación del sistema. n La relajación con entrega de calor es la más común.

Relajación radiante n Fluorescencia y fosforescencia. Procesos de emisión de radiación. n La fluorescencia sucede más rápido que la fosforescencia. n La emisión de fosforescencia tiene lugar durante períodos más largos, puede continuar durante minutos, incluso horas después de que la irradiación haya finalizado.

Fluorescencia de resonancia y no resonante n F. de resonancia: la frecuencia de la radiación emitida es igual a n n n la utilizada para la excitación. Se da en átomos en estado gaseoso que no poseen estados vibracionales superpuestos a los estados electrónicos. F. no resonante, se da en moléculas en disolución o en estado gaseoso. La radiación promueve a la molécula a cualquiera de los estados vibracionales excitados. Como el tiempo de vida de estos estados es mucho más corto (10 -15 s) que cualquier otro estado, la relajación vibracional ocurre primero que la relajación electrónica. En consecuencia la frecuencia de la radiación emitida es menor que la frecuencia de la radiación excitante en una cantidad igual a la frecuencia vibracional de excitación. (desplazamiento Stokes). ¿Cuál predomina?

Relajación vibracional = relajación no radiante n Proceso de relajación muy efectivo, cómo se dijo, el tiempo de vida medio de una molécula excitada vibracionalmente es muy corto respecto de un estado excitado electrónicamente. n Como consecuencia, la fluorescencia de la disolución, siempre implica transiciones desde el nivel vibracional más bajo de un estado electrónico excitado. n Sin embargo se producen picos muy próximos ya que el electrón puede volver a cualquiera de los estados vibracionales del estado fundamental hasta relajarse por completo.


Fosforescencia n Una transición singulete/triplete (o viceversa), que implica un cambio en el estado electrónico es significativamente menos probable que la transición singulete/singulete. n Se verá, que en ciertas moléculas, un estado triplete puede ser ocupado desde un estado excitado singulete; la última consecuencia de este proceso es a menudo la fosforescencia. n Fosforescencia: Se produce cuando una molécula se relaja a un estado electrónico excitado metaestable (denominado estado triplete), que tiene un tiempo de vida mayor a otras relajaciones.


Conversión interna, externa, cruzamiento entre sistemas y Fosforescencia n La conversión interna describe procesos intermoleculares por lo que la molécula pasa a un estado electrónico de más baja energía sin emisión de radiación. n Particularmente eficaz cuando dos niveles de energía electrónicos están próximos para que haya solapamiento de los niveles de energía vibracional. n Proceso más probable que la pérdida de energía por fluorescencia desde un estado excitado más alto.

Conversión interna, externa, cruzamiento entre sistemas y Fosforescencia n La desactivación de un estado electrónico excitado puede implicar interacción y transferencia de energía entre la molécula excitada y el disolvente u otros solutos. Conversión externa. n Evidencia: marcado efecto sobre la intensidad de fluorescencia. n Reducir el nro. de colisiones exalta la fluorescencia (baja temp. y alta viscosidad).

Conversión interna, externa, cruzamiento entre sistemas y Fosforescencia n Proceso en el que el espín del electrón excitado se invierte. Estado triplete excitado. n La probabilidad de esta transición aumenta si los niveles vibracionales de los dos estados se solapan. n La desactivación posterior puede tener lugar tanto por conversión interna o externa como por fosforescencia.

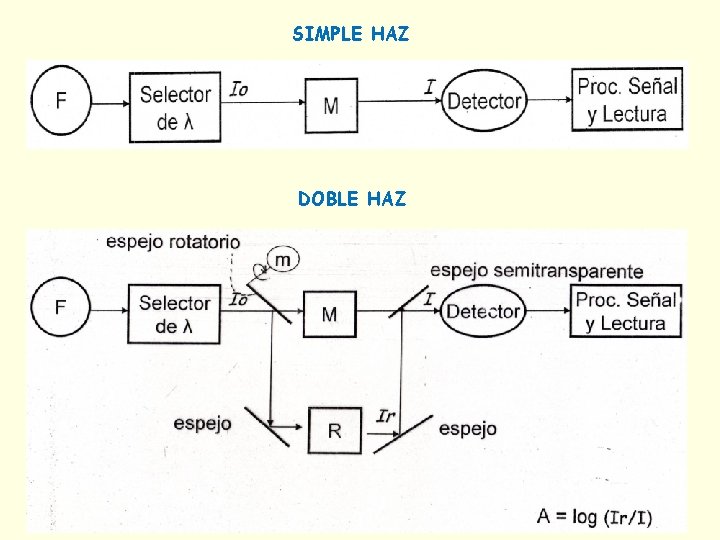
Instrumentación n La mayoría de los instrumentos espectroscópicos n n n incluyen cinco componentes: una fuente estable de energía radiante. un selector de longitud de onda que aísla una región limitada del espectro para hacer la medición. uno o más recipientes para la muestra. un detector de radiación, que convierte la energía radiante en una señal medible (generalmente eléctrica). un sistema que procesa y lee la señal, y la visualiza en una escala de medida.

SIMPLE HAZ DOBLE HAZ

Fuentes n Suficiente energía radiante en el intervalo de longitudes de onda utilizado. n La intensidad debe mantenerse estable y constante durante la medición. n Para solucionar los problemas de fluctuación de la fuente se utilizan sistemas de doble haz. n Se distinguen fuentes continuas y fuentes de líneas.

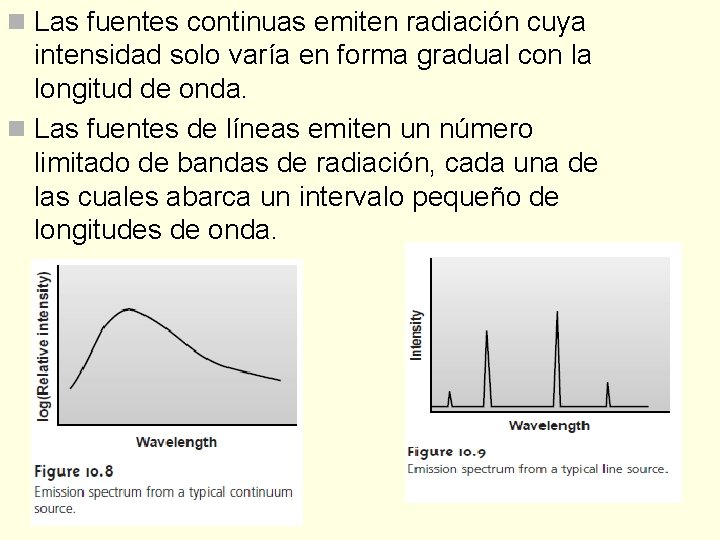
n Las fuentes continuas emiten radiación cuya intensidad solo varía en forma gradual con la longitud de onda. n Las fuentes de líneas emiten un número limitado de bandas de radiación, cada una de las cuales abarca un intervalo pequeño de longitudes de onda.

n La fuente continua más común para la región UV es la lámpara de deuterio (160 – 380 nm). n Para la región visible se emplea universalmente la lámpara de wolframio (320 – 2400 nm).

Lámpara de deuterio (D 2) n Excitación eléctrica del deuterio o hidrógeno a baja presión. n D 2 + E(e) D 2 D’ + D” + hv n E(e) = E D 2 = E D’ + E D” + hv (energía cinética) el resultado es un espectro continuo



Volumen reducido Camino óptico variable

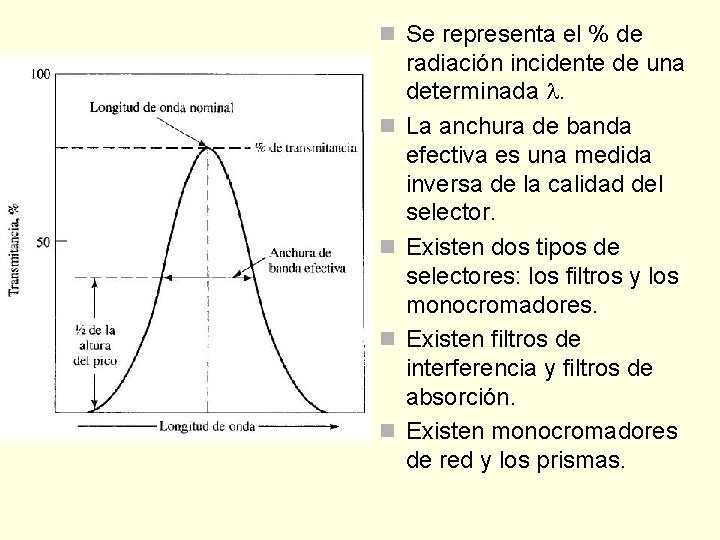
Selectores de longitud de onda n Se necesita una radiación constituida por un grupo limitado, estrecho y continuo de denominado banda. n Una banda estrecha aumenta la sensibilidad de las medidas de absorbancia, proporciona selectividad y es un requisito para obtener una relación lineal entre la señal óptica y la concentración. n Las situación ideal sería una señal de salida de sólo una .

n Se representa el % de n n radiación incidente de una determinada . La anchura de banda efectiva es una medida inversa de la calidad del selector. Existen dos tipos de selectores: los filtros y los monocromadores. Existen filtros de interferencia y filtros de absorción. Existen monocromadores de red y los prismas.

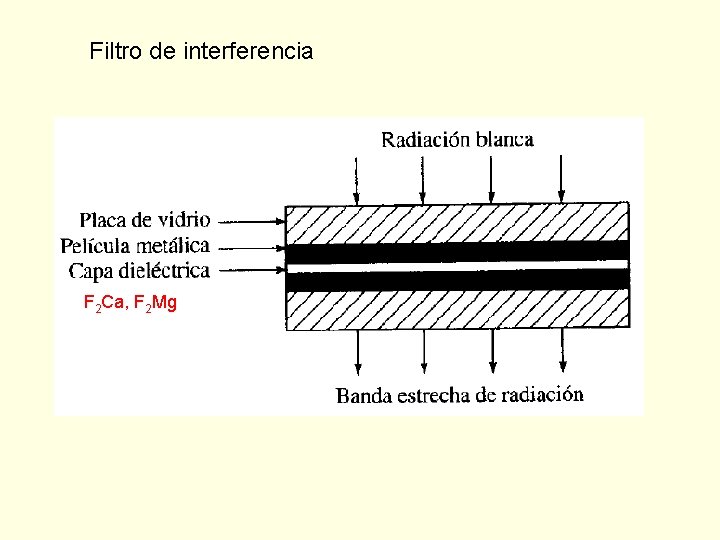
Filtro de interferencia F 2 Ca, F 2 Mg

n Una fracción atraviesa la primer capa metálica, la parte que ha pasado sufre una partición similar en la segunda capa metálica. Si la parte reflejada de ésta segunda interacción es de adecuada, se refleja parcialmente desde la cara inferior de la primer capa, en fase con la luz incidente de la misma . n El resultado es que se refuerza esta , mientras que el resto sufre una interferencia destructiva.

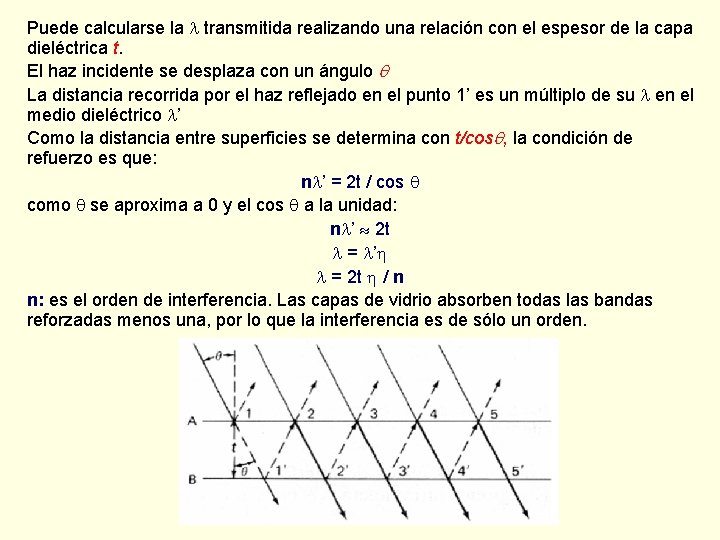
Puede calcularse la transmitida realizando una relación con el espesor de la capa dieléctrica t. El haz incidente se desplaza con un ángulo La distancia recorrida por el haz reflejado en el punto 1’ es un múltiplo de su en el medio dieléctrico ’ Como la distancia entre superficies se determina con t/cos , la condición de refuerzo es que: n ’ = 2 t / cos como se aproxima a 0 y el cos a la unidad: n ’ 2 t = ’ = 2 t / n n: es el orden de interferencia. Las capas de vidrio absorben todas las bandas reforzadas menos una, por lo que la interferencia es de sólo un orden.




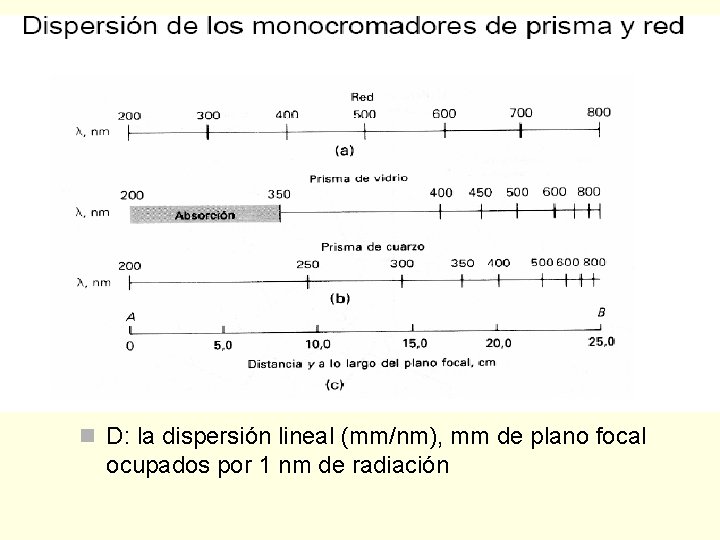
n D: la dispersión lineal (mm/nm), mm de plano focal ocupados por 1 nm de radiación

Rendijas del monocromador n D: la dispersión lineal (mm/nm), mm de plano focal ocupados por 1 nm de radiación


Detectores de radiación n Un detector ideal debe tener elevada sensibilidad, elevada relación señal / ruido, una respuesta constante en un intervalo considerable de longitudes de onda. n Tiempo de respuesta rápido y una señal de salida igual a cero en ausencia de iluminación. n La señal eléctrica producida debe ser proporcional a intensidad de la radiación. n Muchos detectores reales presentan una pequeña respuesta en ausencia de iluminación que se denomina corriente oscura.

Detectores de fotones n Fototubos de vacíos n Fotomultiplicadores n Fotodiodos de silicio n Fotodiodos en serie

Fototubos de vacío n Consiste en un cátodo semicilíndrico y un ánodo de alambre sellados al vacío dentro de una cubierta transparente de vidrio o cuarzo. n la superficie cóncava del cátodo sostiene una capa de material fotoemisor, como puede ser un metal alcalino o un óxido metálico, que tiende a emitir electrones cuando es irradiado. n Cuando se aplica un potencial a través de los electrodos, los electrones emitidos fluyen hacia el ánodo produciendo una corriente eléctrica, que fácilmente se puede amplificar y registrar. n El número de electrones sacados de una superficie fotoemisora es directamente proporcional a la intensidad radiante del rayo que incide en la superficie.


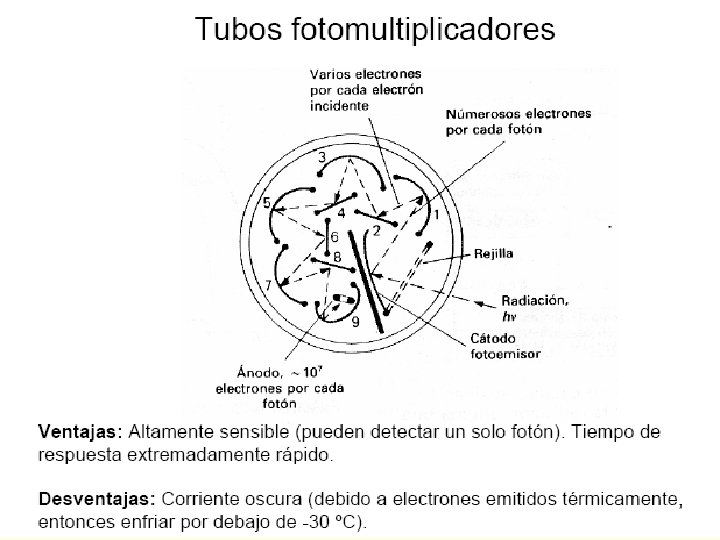
Fotomultiplicadores n Es de construcción similar al fototubo. n Los electrones emitidos son acelerados hacia un dínodo que se mantiene a un potencial de 90 V más positivo que el cátodo. Cada uno de los electrones acelerados que chocan en la superficie del dínodo, produce algunos electrones más; éstos a su vez son acelerados hacia el dínodo siguiente, cuyo voltaje es 90 V más positivo que le primer dínodo, y nuevamente se repite el proceso de amplificación. n Después de repetirse este proceso en cada uno de los dínodos restantes, se originan 106 a 107 electrones por cada fotón. Esta cascada de electrones se recoge al final del ánodo.



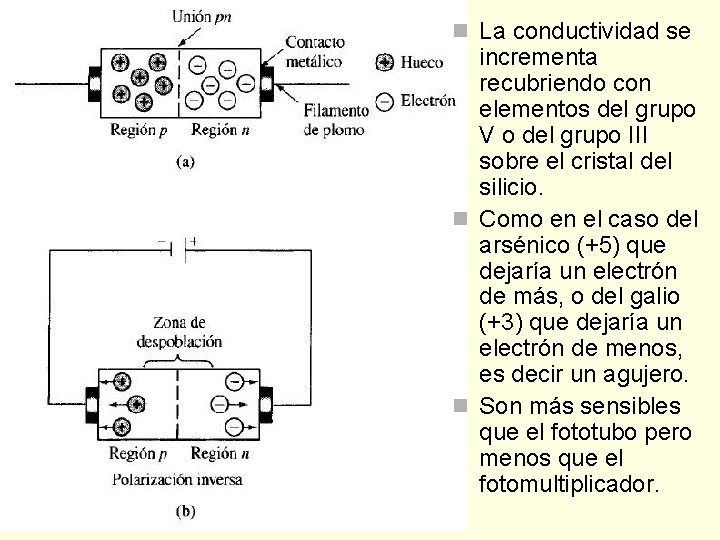
Silicio como semiconductor n cuya conductividad eléctrica es menor que la de un metal n n pero mayor que la de un aislante. elemento del grupo IV, tiene 4 electrones de valencia. En un cristal cada uno de los electrones se combina con otros cuatro átomos formando cuatro enlaces covalentes. A temperatura ambiente, hay suficiente agitación térmica para liberar un electrón que se mueve libremente en el cristal. El electrón deja atrás una región cargada positivamente que se llama agujero que, como el electrón también es móvil. El movimiento del agujero sucede por etapas: un electrón unido a un átomo de silicio vecino brinca a la región deficiente de electrones, creando así otro agujero positivo en su huella.

n La conductividad se incrementa recubriendo con elementos del grupo V o del grupo III sobre el cristal del silicio. n Como en el caso del arsénico (+5) que dejaría un electrón de más, o del galio (+3) que dejaría un electrón de menos, es decir un agujero. n Son más sensibles que el fototubo pero menos que el fotomultiplicador.
 Plan de estudios lmad
Plan de estudios lmad Plan de estudios 1999 preescolar
Plan de estudios 1999 preescolar Certificado parcial de licenciatura
Certificado parcial de licenciatura Ceneval acuerdo 286 carreras
Ceneval acuerdo 286 carreras Residencia licenciatura en obstetricia
Residencia licenciatura en obstetricia Titulo por experiencia laboral ceneval
Titulo por experiencia laboral ceneval Exoal ceneval
Exoal ceneval Externos ceneval
Externos ceneval Plan de estudios 2012 licenciatura en educación preescolar
Plan de estudios 2012 licenciatura en educación preescolar Licenciatura antropologia
Licenciatura antropologia Licenciatura en seguridad y defensa
Licenciatura en seguridad y defensa Licenciatura en lenguas uaem texcoco
Licenciatura en lenguas uaem texcoco Fotosintesis ciclo de krebs
Fotosintesis ciclo de krebs Metabolismo de las proteínas
Metabolismo de las proteínas Ciclo otto ciclo diesel
Ciclo otto ciclo diesel Funciones halliday
Funciones halliday Objetivos del ciclo del agua
Objetivos del ciclo del agua Etapas del ciclo del agua
Etapas del ciclo del agua Estrategias del ciclo de vida del producto ejemplos
Estrategias del ciclo de vida del producto ejemplos Fases del ciclo del nitrógeno
Fases del ciclo del nitrógeno Orden del ciclo del agua
Orden del ciclo del agua Lecturas del domingo xxvii del tiempo ordinario ciclo b
Lecturas del domingo xxvii del tiempo ordinario ciclo b Domingo 28 del tiempo ordinario ciclo b
Domingo 28 del tiempo ordinario ciclo b Lectura del domingo
Lectura del domingo Qué es el
Qué es el Qumica
Qumica Qumica moderna
Qumica moderna Acidos organicos
Acidos organicos Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Carbonos primarios secundarios terciarios y cuaternarios
Carbonos primarios secundarios terciarios y cuaternarios (ch3)3cch3 tipo de hidrocarburo
(ch3)3cch3 tipo de hidrocarburo Nomenclatura das bases
Nomenclatura das bases Tabla qumica
Tabla qumica Qumica
Qumica Pilha de daniell
Pilha de daniell Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Nitrila
Nitrila Clasificacion de compuesto inorganico
Clasificacion de compuesto inorganico Geometria trigonal plana
Geometria trigonal plana Definição de alcinos
Definição de alcinos Considere os íons
Considere os íons