Qumica Geral Introduo Matria e Medida Prof Armando


































- Slides: 40

Química Geral Introdução: Matéria e Medida Prof. Armando Rodrigues

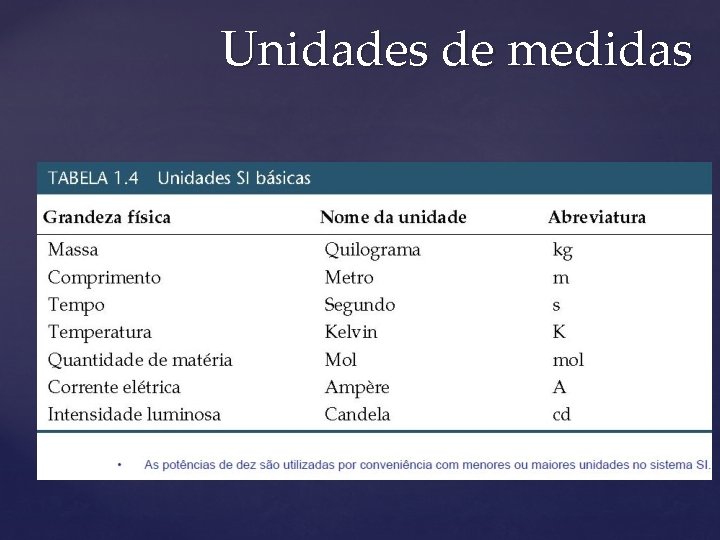
Unidades de medidas Medida É um número que expressa uma quantidade. Unidades SI • Existem dois tipos de unidades: Unidades fundamentais (Ou básicas) Unidades derivadas • Existem 7 unidades básicas no SI

Unidades de medidas

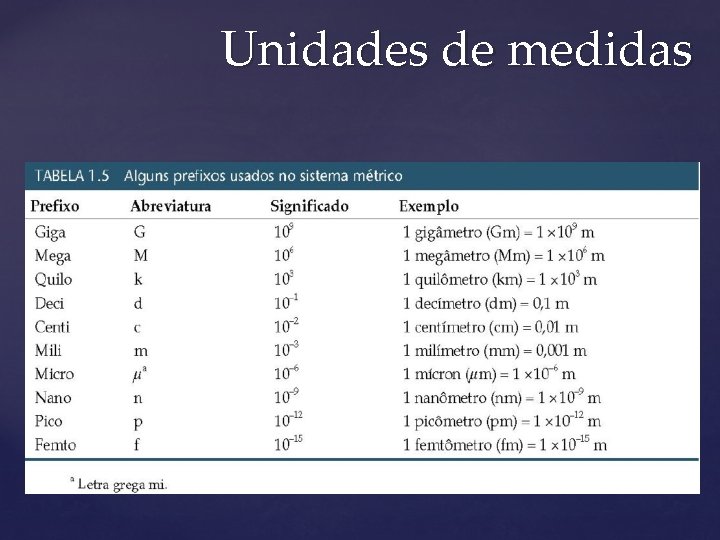
Unidades de medidas

Unidades de medidas Massa de um corpo representa a quantidade de matéria que ele possui. Obs: O peso mede a atração gravitacional sobre um objeto, que depende de sua massa. • Unidade SI = quilograma (kg) • É comum medir-se a massa em gramas (g) ou miligramas (mg) Volume O volume de um corpo é a quantidade de espaço ocupada por esse corpo. • Unidade derivada • Medida da quantidade de espaço ocupada • Unidade SI = metro cúbico (m 3) • Geralmente, mede-se o volume de um sólido em centímetros cúbicos (cm 3) • Geralmente, mede-se o volume de um líqido em milímetros cúbicos (m. L 3)

Unidades de medidas Temperatura é a medida da energia cinética das partículas em uma determinada substância. Existem 3 escalas de temperatura: • Escala Celsius Escala mais utilizada em trabalhos científicos Dois pontos importantes: Temperatura de fusão da água: 0 °C Temperatura de ebulição da água: 100 °C Escala centígrada, ou seja, está dividida em cem partes iguais.

Unidades de medidas Temperatura • Escala Kelvin Recomendada pelo SI Zero absoluto = Zero kelvin T(K) = T(°C) + 273 Também é uma escala centígrada. • Escala Fahrenheit

Unidades de medidas Pressão é a relação entre uma força exercida em uma área de uma determinada superfície. • Unidade padrão do SI = kg/m. s 2 , denominada pascal (Pa) • Relação de pressões: 1 atm = 760 mm. Hg = 760 torr = 101. 325 Pa

Classificações da matéria O que é matéria? “Matéria é tudo que tem massa e ocupa um lugar no espaço. ” • A matéria pode ser classificada como sólida, líquida ou gasosa com base nas seguintes características :

Classificações da matéria • Sólido Partículas ordenadas Sem liberdade de movimento Formam retículos cristalinos • Líquidos Partículas desordenadas Liberdade de movimento • Gases Grandes espaços entre as partículas Grande liberdade de movimento

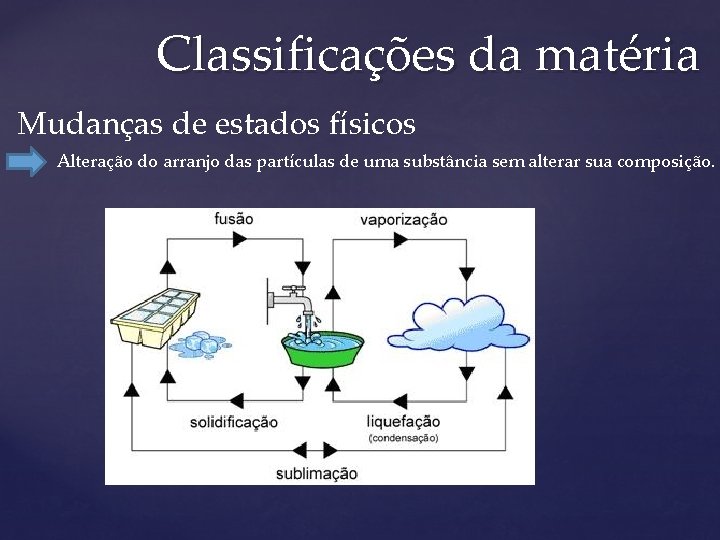
Classificações da matéria Mudanças de estados físicos Alteração do arranjo das partículas de uma substância sem alterar sua composição.

Propriedades da matéria Propriedades gerais Propriedades comuns a toda e qualquer porção de matéria. • Massa Todos os corpos possuem massa. • Extensão Todos os corpos ocupam lugar no espaço. • Impenetrabilidade Dois corpos não ocupam, ao mesmo tempo, um mesmo lugar no espaço. • Divisibilidade Os corpos podem ser divididos em partes cada vez menores. • Compressibilidade Os corpos possuem a propriedade de poder diminuir de tamanho, sob a ação de forças externas.

Propriedades da matéria Propriedades gerais • Elasticidade Os corpos possuem a propriedade de voltar à forma e volume originais, cessada a causa que os deformou. • Inércia Propriedade que a matéria tem em permanecer na situação em que se encontra, seja em movimento, seja em repouso. • Descontinuidade A matéria não é contínua, ou seja, há espaços vazios entre as moléculas.

Propriedades da matéria Propriedades específicas São as propriedades que variam conforme as substâncias de que a matéria é feita. Propriedades físicas

Propriedades da matéria Propriedades específicas Propriedades Químicas • Combustão Queima de alguma substância • Oxidação Ferrugem em uma barra de ferro. • Fermentação Preparação da cerveja.

Propriedades da matéria Propriedades específicas Propriedades organolépticas São propriedades perceptíveis pelos nossos sentidos Ex: Cor, brilho, sabor, odor. . .

Propriedades da matéria Constituição Química da matéria • Substância É um tipo de matéria que contém a mesma composição em toda sua extensão. Ex. : H 2 O , O 2 , Açúcar. . . As substância são classificadas em dois grupos: Substâncias simples e compostas. ü Substâncias simples São substâncias formadas por apenas um elemento químico. Ex. : H 2 , O 2 , Cl 2 , Cn. . . ü Substâncias compostas São substâncias formadas por mais de um elemento químico. Ex. : H 2 O , H 2 SO 4 , Na. Cl. . .

Propriedades da matéria Constituição Química da matéria • Misturas Reunião de duas ou mais substâncias que não reagem entre si. • Principais Características ü Não têm composição química fixa ü Não pode ser representado por formúlas ü Não têm nomenclatura específica ü Não têm constantes físicas bem definidas Ex. : Água + Álcool , Água + Areia, etc. . .

Propriedades da matéria Constituição Química da matéria • Tipos de misturas ü Mistura Homogênea Apresentam as mesmas propriedades em qualquer parte de sua extensão. Ex. : Água + Sal Obs: As misturas homogêneas são denominadas soluções. As misturas homogêneas são monofásicas. As misturas gasosas são SEMPRE homogêneas. ü Mistura Heterogênea Não apresentam as mesmas propriedades em qualquer parte de sua extensão. Ex. : Água + Óleo Obs: As misturas heterogêneas são polifásicas. As misturas de sólidos são SEMPRE heterogêneas, com exceção das ligas metálicas.

Propriedades da matéria Constituição Química da matéria ü Mistura Eutética Apresentam temperatura de fusão constante. Ex. : Gelo + Sal

Propriedades da matéria Constituição Química da matéria ü Mistura Azeotrópica Apresentam temperatura de ebulição constante. Ex. : Etanol

Processos de separação de misturas Vidrarias de Laboratório • Becker Instrumento de uso geral em laboratório, é empregado para administrar reações entre soluções, dissolver substâncias sólidas, efetuar reações de precipitação e aquecer líquidos.

Processos de separação de misturas Vidrarias de Laboratório • Condensador Tem como finalidade condensar vapores gerados pelo aquecimento de líquidos em processos de destilação simples.

Processos de separação de misturas Vidrarias de Laboratório • Erlenmeyer É ideal para armazenar e misturar produtos e soluções.

Processos de separação de misturas Vidrarias de Laboratório • Funil de Büchner É usado junto com o Kitassato em filtrações a vácuo.

Processos de separação de misturas Vidrarias de Laboratório • Funil de seperação ou Funil de Bromo É utilizadas em laboratório com principal função de separar uma mistura É líquida heterogênea por simples ação da gravidade.

Processos de separação de misturas Vidrarias de Laboratório • Kitassato vácuo. É normalmente usado junto com o funil de Büchner em filtrações a

Processos de separação de misturas Vidrarias de Laboratório • Tubo de Ensaio É usado para efetuar reações químicas de pequena escala com pequenas quantidades de reagentes de cada vez e em separação de misturas por centrifugação.

Processos de separação de misturas Decantação ü Separa misturas heterogêneas. ü Separa líquidos imiscíveis com auxílio do funil de separação. ü Quando é uma mistura Sólido + Líquido, as partículas sólidas se depositam no fundo pela ação da gravidade.

Processos de separação de misturas Centrifugação ü Separar misturas imiscíveis do tipo sólido – líquido, quando o sólido está finamente disperso no líquido. ü Submete-se a mistura a uma intensa rotação chamada centrifugação, onde as partículas de maior densidade são arremessadas para o fundo do tubo de ensaio, por inércia.

Processos de separação de misturas Filtração simples ü Separar misturas de um líquido com o sólido não dissolvido. ü Deve-se haver uma diferença no tamanho das partículas. Ex. : Água + Areia, Penerar areia + pedra. . .

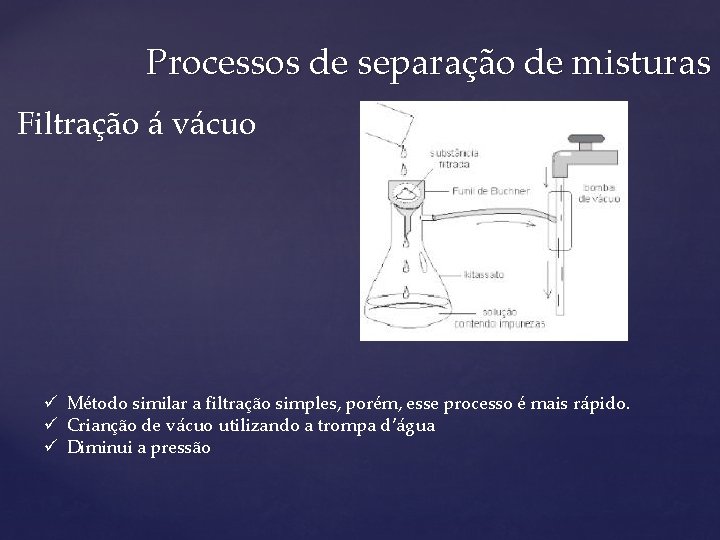
Processos de separação de misturas Filtração á vácuo ü Método similar a filtração simples, porém, esse processo é mais rápido. ü Crianção de vácuo utilizando a trompa d’água ü Diminui a pressão

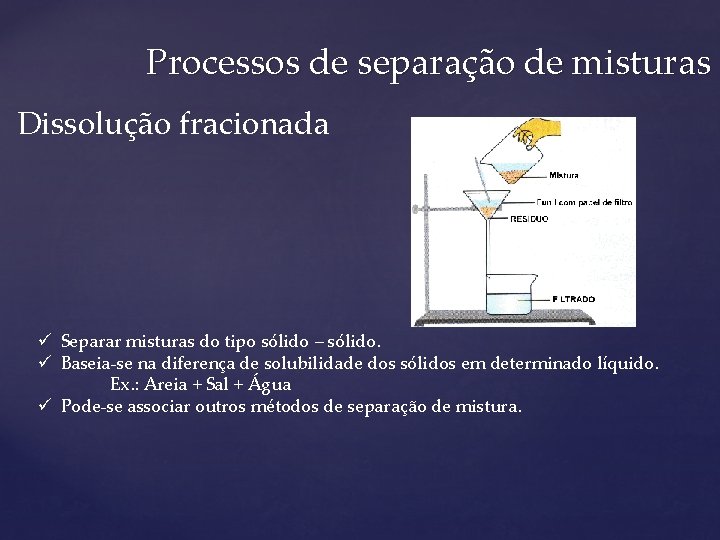
Processos de separação de misturas Dissolução fracionada ü Separar misturas do tipo sólido – sólido. ü Baseia-se na diferença de solubilidade dos sólidos em determinado líquido. Ex. : Areia + Sal + Água ü Pode-se associar outros métodos de separação de mistura.

Processos de separação de misturas Flotação ü Separa sólido – sólido com uma diferença acentuada de densidade. Ex. : Areia + Serragem

Processos de separação de misturas Separação magnética ü Separar misturas do tipo sólido – sólido na quais um dos componentes tem propriedade magnéticas e é atraída por um imã. Ex. : Enxofre + Limalha de ferro

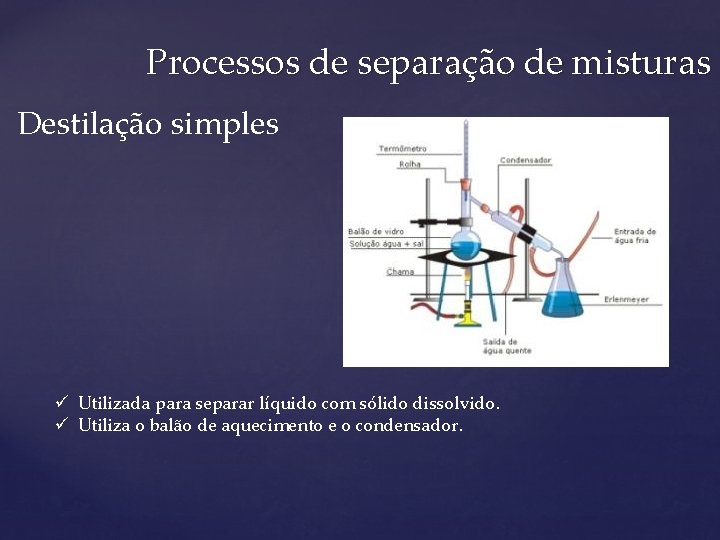
Processos de separação de misturas Destilação simples ü Utilizada para separar líquido com sólido dissolvido. ü Utiliza o balão de aquecimento e o condensador.

Processos de separação de misturas Destilação fracionada ü Separar misturas de dois ou mais líquidos. ü Aprimoração da Destilação simples. ü Utiliza balão, coluna de vidro, condensador e termômetro.

Processos de separação de misturas Evaporação ü Separar soluções/misturas quando o sólido está dissolvido no solvente. ü Ação do calor solar. Ex. : Obtenção do sal de cozinha.

Tipos de reações químicas São transformações de um ou mais reagentes em outras substâncias chamadas produtos. Em uma reação química há mudanças na estrutura da matéria. • Tipos de reações: ü Reação de Análise ou Decomposição: É quando um reagente é decomposto em seus componentes. Ex. : 2 H 2 O 2 H 2 + O 2 2 NH 3 N 2 + 3 H 2 ü Reação de Síntese ou Formação: É quando um produto é obtido atráves de dois ou mais reagentes. Ex. : 2 SO 2 + O 2 2 SO 3 Ca. O + H 2 O Ca(OH)2

Tipos de reações químicas • Tipos de reações: ü Reação de Deslocamento ou simples-troca: É uma reação onde um elemento substitui outro em um composto químico para produzir um novo composto, porém, o elemento que irá deslocar, deve ser mais forte do que o elemento que será deslocado. Ex. : 2 Na + 2 H 2 O 2 Na. OH + H 2 Au + HCl Não reage. ü Reação de Dupla-Troca: Reações de dupla troca ocorrem entre dois reagentes compostos originando dois produtos compostos: AB + CD → AD + BC Ex. : HCl + Na. OH Na. Cl + H 2 O Obs: Pelo menos um dos produtos deve ser insolúvel, no caso acima, como a água é um dos produtos a reação ocorre.