Qumica Data 29022012 Jamais considere seus estudos como









- Slides: 26

Química!!!? ? ? Data: 29/02/2012

“Jamais considere seus estudos como uma obrigação, mas como uma oportunidade invejável para aprender a conhecer a influência libertadora da beleza do reino do espírito, para seu próprio prazer pessoal e para proveito da comunidade à qual seu futuro trabalho pertencer. " Albert Einstein

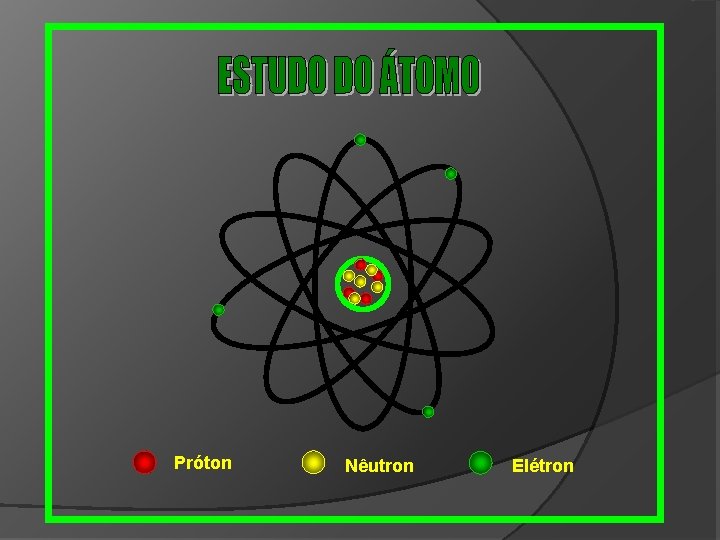
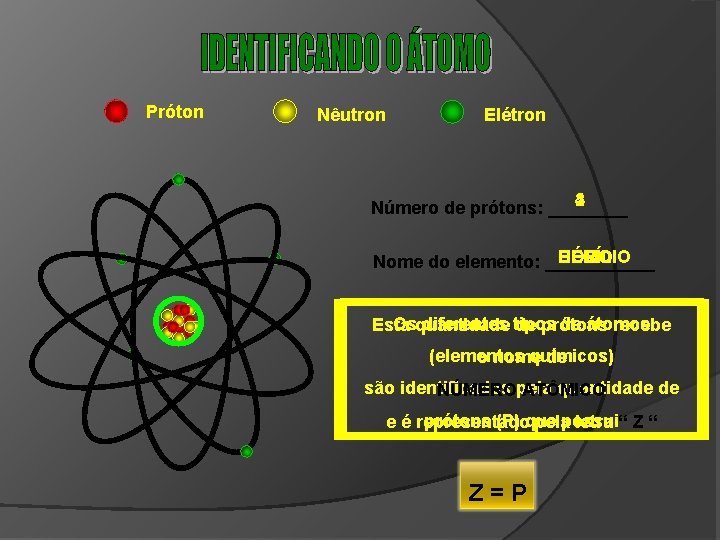
Próton Nêutron Elétron

Próton Nêutron Elétron 5 4 2 Número de prótons: ____ BORO BERÍLIO HÉLIO Nome do elemento: ______ Osquantidade diferentes tipos de átomos Esta de prótons recebe (elementos químicos) o nome de são identificados quantidade de NÚMEROpela ATÔMICO prótons (P) que e é representado pelapossui letra “ Z=P

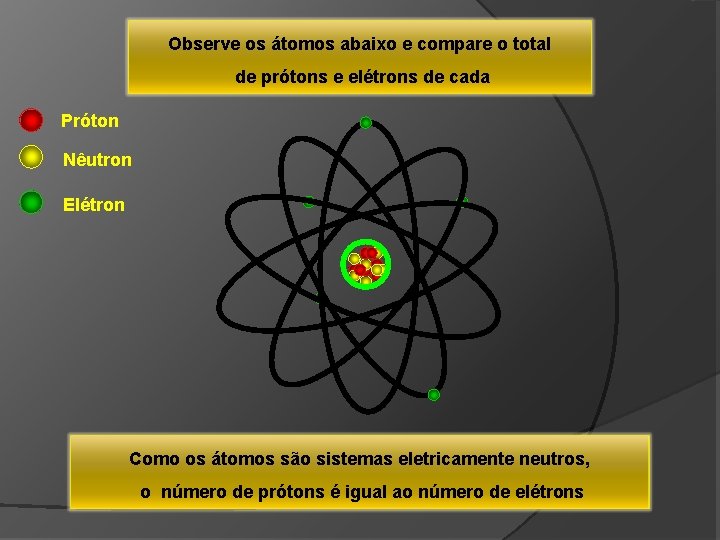
Observe os átomos abaixo e compare o total de prótons e elétrons de cada Próton Nêutron Elétron Como os átomos são sistemas eletricamente neutros, o número de prótons é igual ao número de elétrons

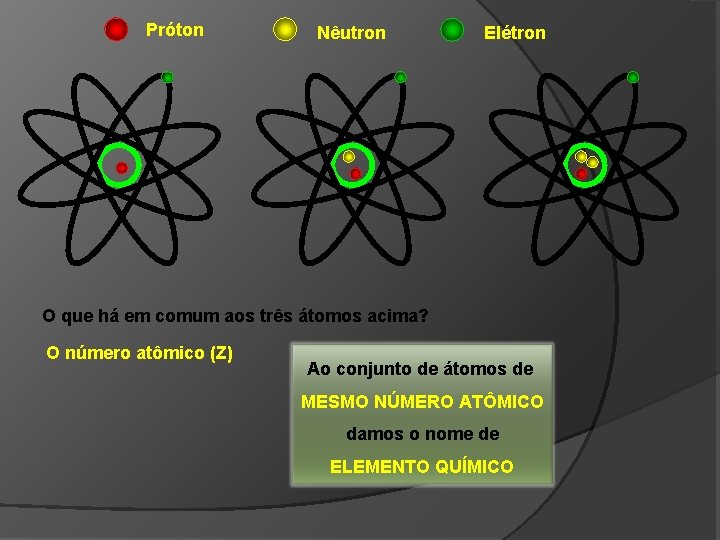
Próton Nêutron Elétron O que há em comum aos três átomos acima? O número atômico (Z) Ao conjunto de átomos de MESMO NÚMERO ATÔMICO damos o nome de ELEMENTO QUÍMICO

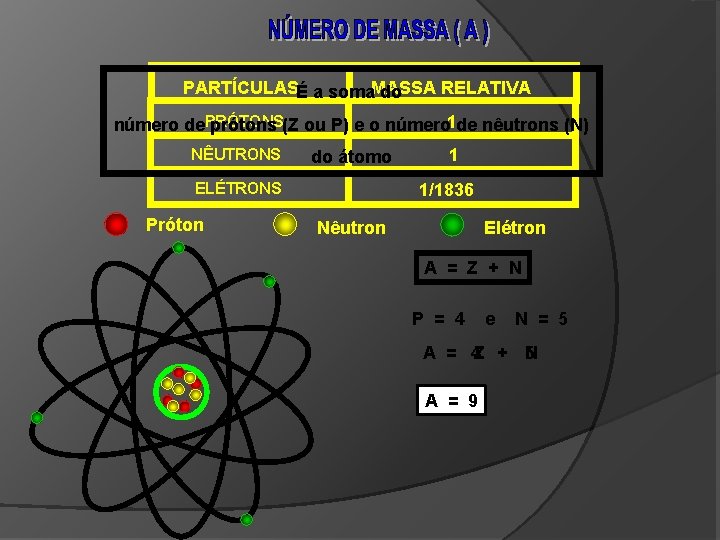
PARTÍCULASÉ a soma. MASSA RELATIVA do número de. PRÓTONS prótons (Z ou P) e o número 1 de nêutrons (N) NÊUTRONS do átomo ELÉTRONS Próton 1 1/1836 Nêutron Elétron A = Z + N P = 4 e N = 5 A = 4 Z + 5 N A = 9

01) São dados os átomos A, B e C: A: número atômico 20 e tem 21 nêutrons. B: número de massa 40 e 22 nêutrons. C: 20 prótons e 20 nêutrons. Pertencem ao mesmo elemento químico os átomos: a) A e B. b) A e C. c) B e C. d) A, B e C. e) A, B e C são de elementos diferentes. Átomos de mesmo elemento químico têm mesmo número de prótons A: Tem 20 prótons. B: tem Z = 40 – 22 = 18 prótons C: Tem 20 prótons.

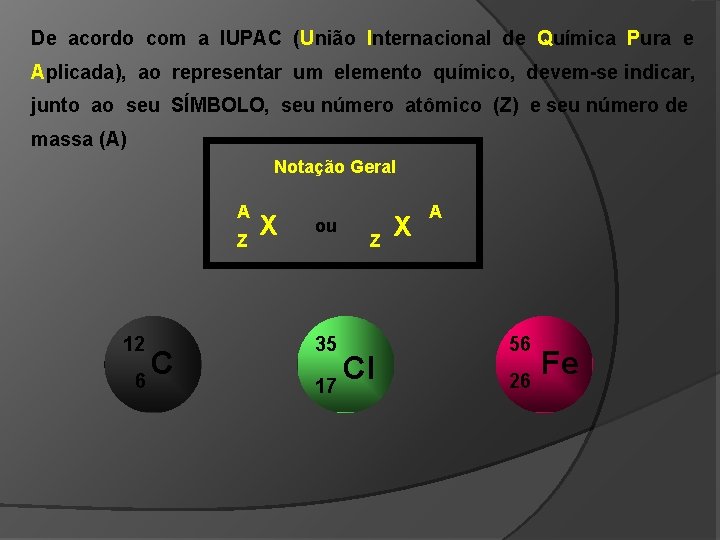
De acordo com a IUPAC (União Internacional de Química Pura e Aplicada), ao representar um elemento químico, devem-se indicar, junto ao seu SÍMBOLO, seu número atômico (Z) e seu número de massa (A) Notação Geral A Z 12 6 C X ou 35 Z Cl 17 X A 56 26 Fe

Nome do elemento: _____ cloro Nome do elemento: _____ ferro 35 A = ______ 35 Cl 17 17 Z = ______ 56 A = ______ 56 Fe 26 26 Z = ______ 17 P = ______ 26 P = ______ 17 E = ______ 26 E = ______ 18 N = ______ 30 N = ______

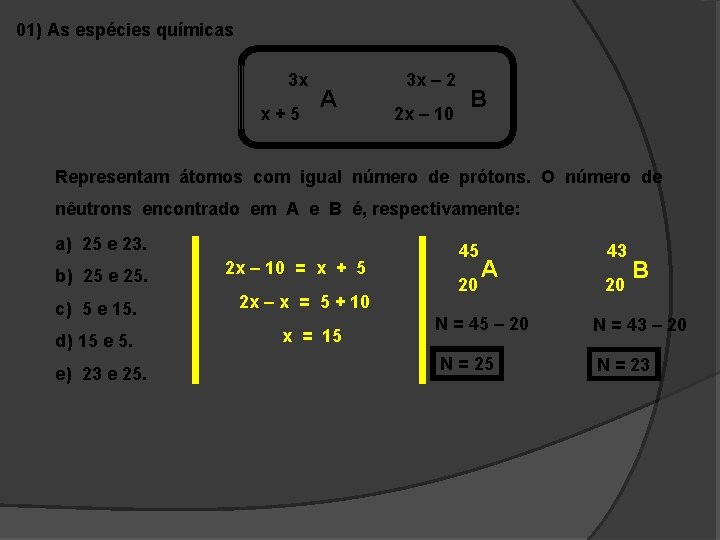
01) As espécies químicas 3 x x+5 A 3 x – 2 2 x – 10 B Representam átomos com igual número de prótons. O número de nêutrons encontrado em A e B é, respectivamente: a) 25 e 23. b) 25 e 25. c) 5 e 15. d) 15 e 5. e) 23 e 25. 2 x – 10 = x + 5 2 x – x = 5 + 10 x = 15 45 20 A 43 20 B N = 45 – 20 N = 43 – 20 N = 25 N = 23

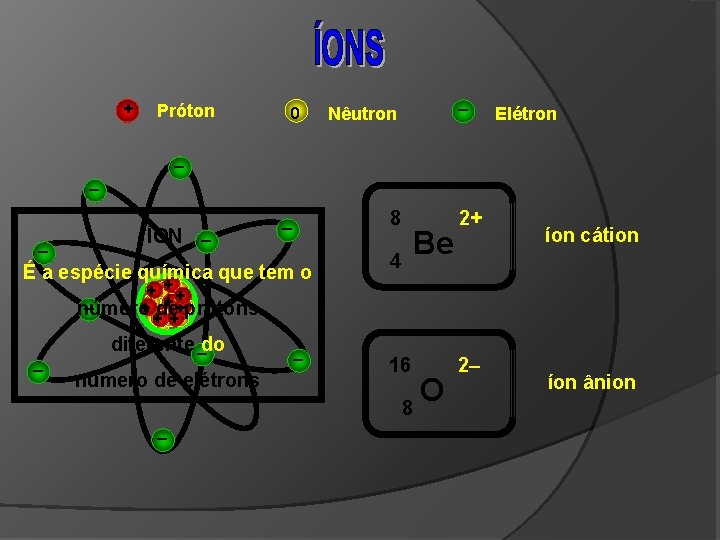
+ Próton 0 – Nêutron Elétron – – – ÍON – 8 – É a espécie química que tem o Be 4 2+ íon cátion ++ ++ + +prótons – + +de número ++ – diferente –do número de elétrons – – 16 O 8 2– íon ânion

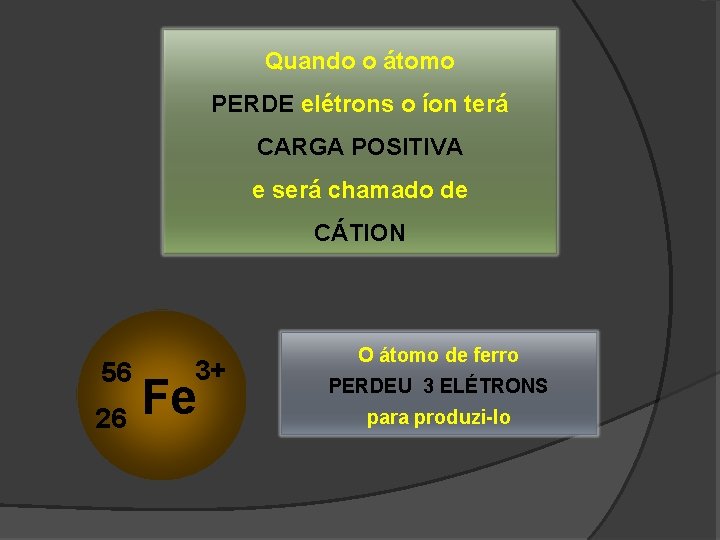
Quando o átomo PERDE elétrons o íon terá CARGA POSITIVA e será chamado de CÁTION 56 26 3+ Fe O átomo de ferro PERDEU 3 ELÉTRONS para produzi-lo

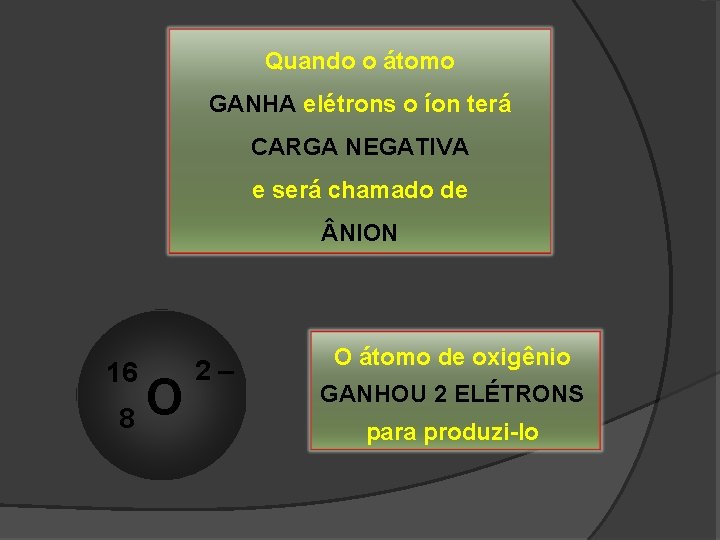
Quando o átomo GANHA elétrons o íon terá CARGA NEGATIVA e será chamado de NION 16 8 O 2– O átomo de oxigênio GANHOU 2 ELÉTRONS para produzi-lo

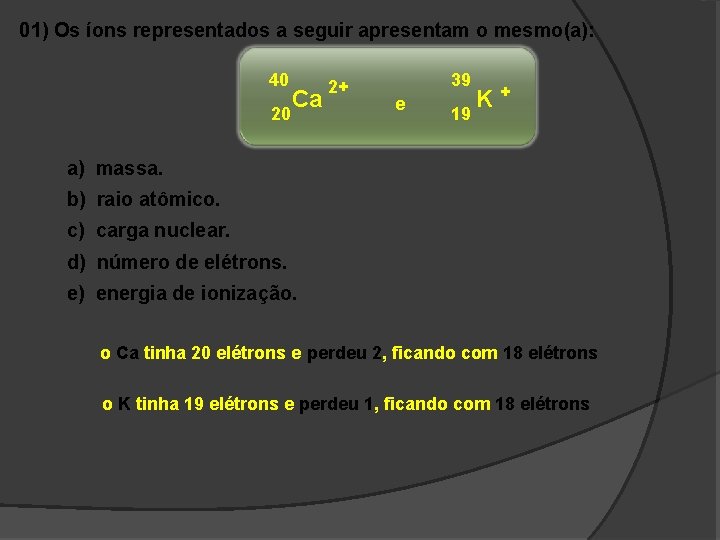
01) Os íons representados a seguir apresentam o mesmo(a): 40 20 Ca 2+ 39 e 19 K+ a) massa. b) raio atômico. c) carga nuclear. d) número de elétrons. e) energia de ionização. o Ca tinha 20 elétrons e perdeu 2, ficando com 18 elétrons o K tinha 19 elétrons e perdeu 1, ficando com 18 elétrons

03) (Covest-2002) Isótopos radiativos de iodo são utilizados no diagnóstico e tratamento de problemas da tireóide, e são, em geral, ministrados na forma de sais de iodeto. O número de prótons, nêutrons e elétrons no isótopo 131 – do iodeto 53 I são, respectivamente: a) 53, 78 e 52. 131 – I 53 b) 53, 78 e 54. c) 53, 131 e 53. P = 53 d) 131, 53 e 131. N = 131 – 53 = 78 e) 52, 78 e 53. E = 53 + 1 = 54

Comparando-se dois ou mais átomos, podemos observar algumas semelhanças entre eles A depender da semelhança, teremos para esta relação uma denominação especial

35 17 Cl 37 17 Cl A = 35 A = 37 Z = 17 N = 18 N = 20 átomos possuem o atômico e Átomos que. Estes possuem mesmo número atômico diferentes números de e diferentes números de nêutrons, massa são denominados de conseqüentemente, ISÓTOPOS números de massa diferentes

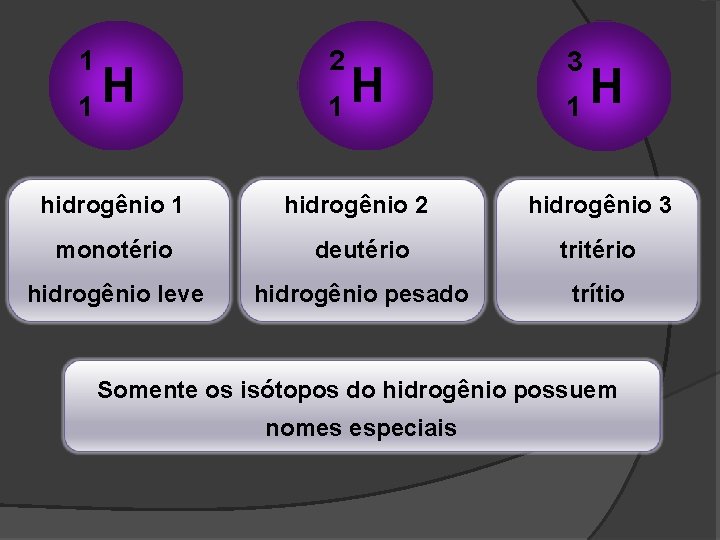
1 1 H 2 1 H 3 1 H hidrogênio 1 hidrogênio 2 hidrogênio 3 monotério deutério tritério hidrogênio leve hidrogênio pesado trítio Somente os isótopos do hidrogênio possuem nomes especiais

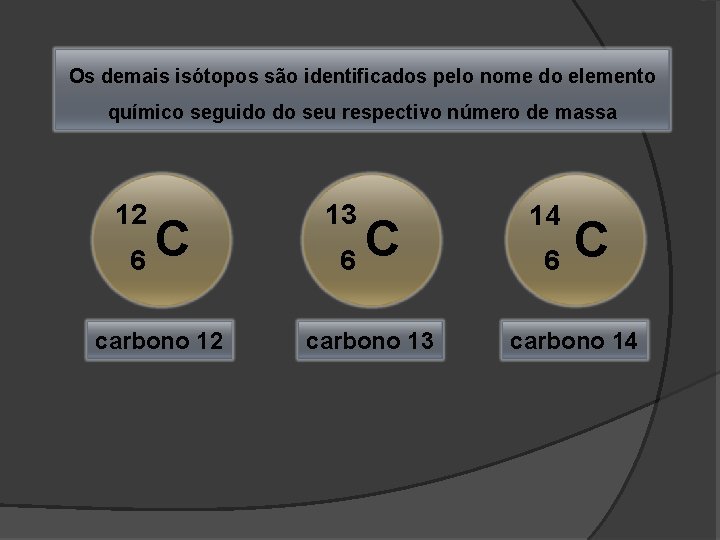
Os demais isótopos são identificados pelo nome do elemento químico seguido do seu respectivo número de massa 12 6 C carbono 12 13 6 C carbono 13 14 6 C carbono 14

40 20 Ca 40 19 K A = 40 Z = 20 Z = 19 N = 20 N = 21 Átomos que possuem mesmo número de massa e Estes átomos possuem o mesmo número de massa diferentes números atômicos são denominados de e diferentes números atômicos ISÓBAROS

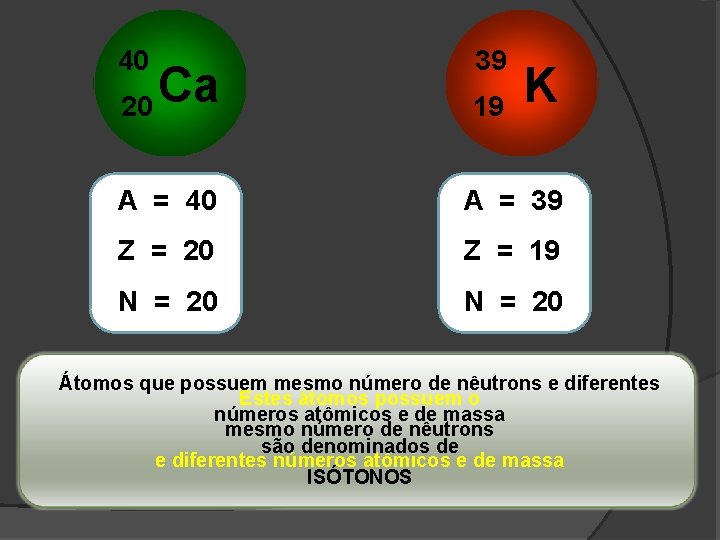
40 20 Ca 39 19 K A = 40 A = 39 Z = 20 Z = 19 N = 20 Átomos que possuem mesmo número de nêutrons e diferentes Estes átomos possuem o números atômicos e de massa mesmo número de nêutrons são denominados de e diferentes números atômicos e de massa ISÓTONOS

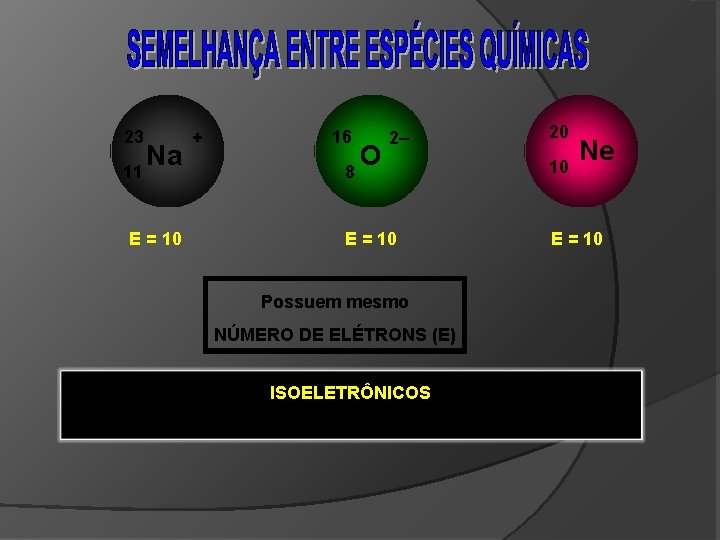
23 Na 11 E = 10 + 16 O 8 2– E = 10 20 10 Ne E = 10 Possuem mesmo NÚMERO DE ELÉTRONS (E) ISOELETRÔNICOS são espécies químicas que possuem mesmo número de elétrons

02) (Vunesp) O elemento químico B possui 20 nêutrons, é isótopo do elemento químico A, que possui 18 prótons, e isóbaro do elemento químico C, que tem 16 nêutrons. Com base nessas informações, pode-se afirmar que os elementos A, B e C apresentam, respectivamente, números atômicos iguais a: a) 16, 16 e 20. b) 16, 18 e 20. 18 A 38 18 B 38 C c) 16, 20 e 21. N = 20 N = 16 d) 18, 16 e 22. A = Z + N Z = A–N e) 18, 18 e 22. A = 18 + 20 Z = 38 – 16 A = 38 Z = 22

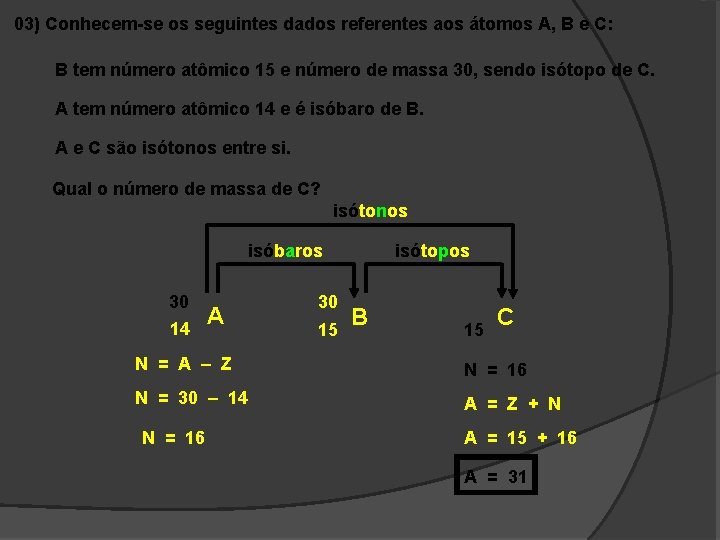
03) Conhecem-se os seguintes dados referentes aos átomos A, B e C: B tem número atômico 15 e número de massa 30, sendo isótopo de C. A tem número atômico 14 e é isóbaro de B. A e C são isótonos entre si. Qual o número de massa de C? isótonos isóbaros 30 14 A 30 15 isótopos B 15 C N = A – Z N = 16 N = 30 – 14 A = Z + N N = 16 A = 15 + 16 A = 31

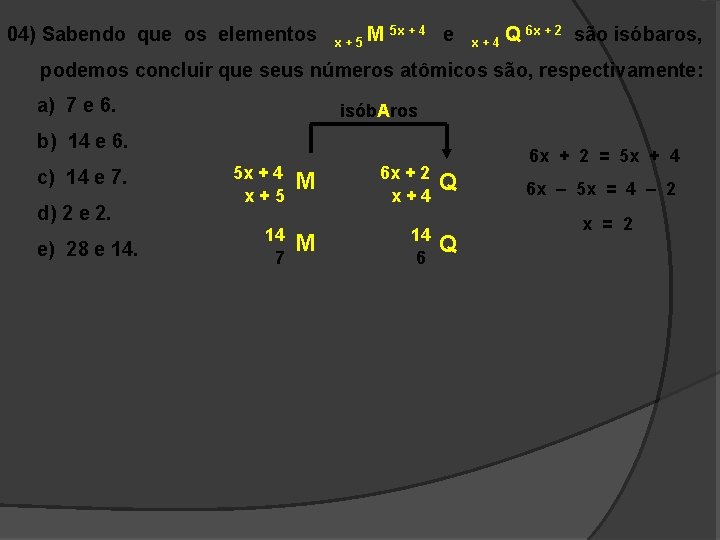
04) Sabendo que os elementos x+5 M 5 x + 4 e x+4 Q 6 x + 2 são isóbaros, podemos concluir que seus números atômicos são, respectivamente: a) 7 e 6. isób. Aros b) 14 e 6. c) 14 e 7. d) 2 e 2. e) 28 e 14. 5 x + 4 x+5 14 7 M 6 x + 2 x+4 M 14 6 6 x + 2 = 5 x + 4 Q Q 6 x – 5 x = 4 – 2 x = 2