QUIMICA APLICADA Celdas Comerciales Celdas comerciales pilas Celda











- Slides: 17

QUIMICA APLICADA Celdas Comerciales

Celdas comerciales (pilas) Celda de Leclanché: celda seca Ánodo Cátodo Zn (s) → Zn 2+ (ac) + 2 e 2 NH 4+ (ac)+ 2 Mn. O 2 (s)+ 2 e- → Mn 2 O 3 (s)+ 2 NH 3 (ac)+ H 2 O (l) Voltaje: 1, 5 V

Pila de mercurio Cátodo Ánodo Hg. O (s) + H 2 O (l) + 2 e- → Hg (l) + 2 OH- (ac) Zn(Hg) + 2 OH- (ac) → Zn. O (s) + H 2 O (l) + 2 e- Voltaje: 1, 35 V Relojes y marcapasos

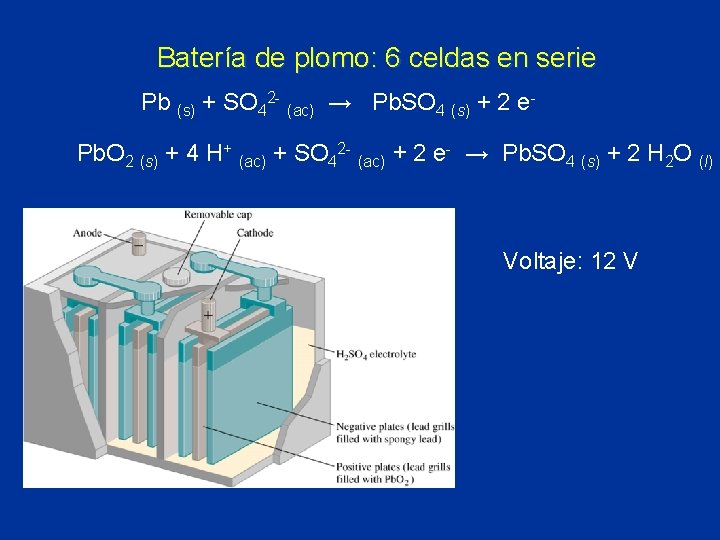
Batería de plomo: 6 celdas en serie Pb (s) + SO 42 - (ac) → Pb. SO 4 (s) + 2 e. Pb. O 2 (s) + 4 H+ (ac) + SO 42 - (ac) + 2 e- → Pb. SO 4 (s) + 2 H 2 O (l) Voltaje: 12 V

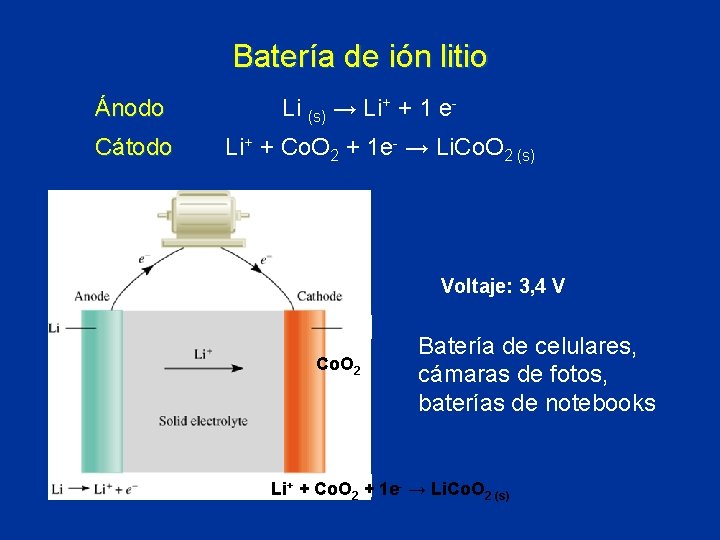
Batería de ión litio Ánodo Cátodo Li (s) → Li+ + 1 e. Li+ + Co. O 2 + 1 e- → Li. Co. O 2 (s) Voltaje: 3, 4 V Co. O 2 Batería de celulares, cámaras de fotos, baterías de notebooks Li+ + Co. O 2 + 1 e- → Li. Co. O 2 (s)

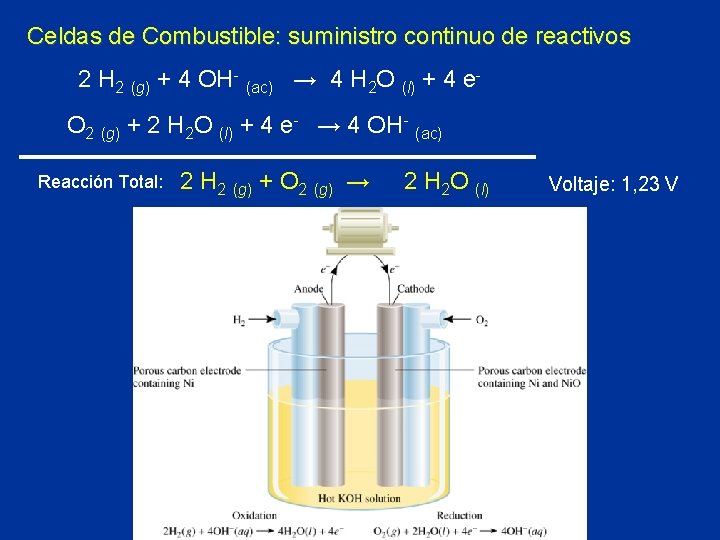
Celdas de Combustible: suministro continuo de reactivos 2 H 2 (g) + 4 OH- (ac) → 4 H 2 O (l) + 4 e. O 2 (g) + 2 H 2 O (l) + 4 e- → 4 OH- (ac) Reacción Total: 2 H 2 (g) + O 2 (g) → 2 H 2 O (l) Voltaje: 1, 23 V

QUIMICA APLICADA ELECTROLISIS

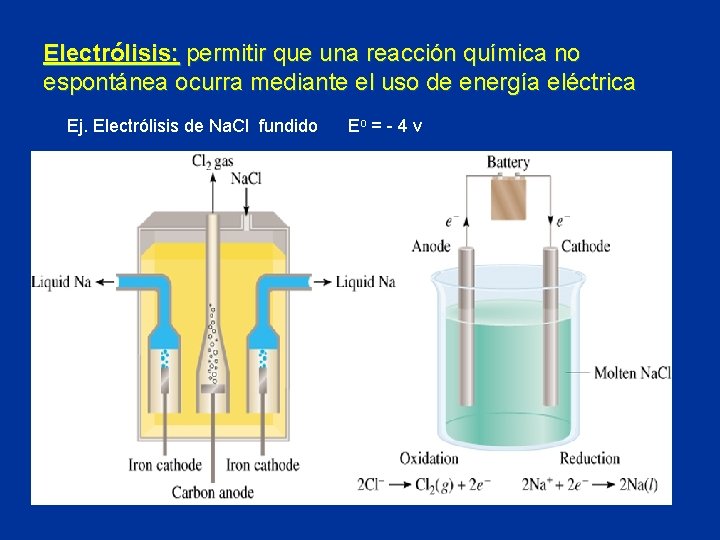
Electrólisis: permitir que una reacción química no espontánea ocurra mediante el uso de energía eléctrica Ej. Electrólisis de Na. Cl fundido Eo = - 4 v

Electrólisis del agua:

Cálculos relacionados con la electrólisis Carga de 1 mol e- = 96. 500 C = 1 Faraday Carga (C) = corriente (A) x tiempo (s) Cuando se deposita un metal, la carga necesaria depende de la reacción de reducción correspondiente Al 3+ (ac) + 3 e- → Al (s) Se necesitan 3 moles de electrones por mol de Al 3+ a depositar Se necesitan 3 x 96. 500 C por mol de Al 3+ a depositar

¿Cuánto calcio se producirá en una celda electrolítica de Ca. Cl 2 fundido si se aplica una corriente de 0, 452 A durante 1, 5 horas? Ca 2+ (l) + 2 e- → Ca (s) Q = corriente (A) x tiempo (s) 1, 5 h = 5400 s Q = 0, 452 A. 5400 s = 2441 C 96. 500 C___ 1 mol de e 2. 441 C ___ 0, 0253 mol de e 2 mol e- ______1 mol Ca 0, 0253 mol e-__ 0, 01265 mol Ca 0, 506 g de Ca

Usos de la electrólisis v Obtención de sustancias químicas (ej: Al, Cl 2 , Na. OH) v Recubrimientos metálicos (plateado, cobreado, cromado, etc) v Protecciones para evitar corrosión.

QUIMICA APLICADA CORROSION

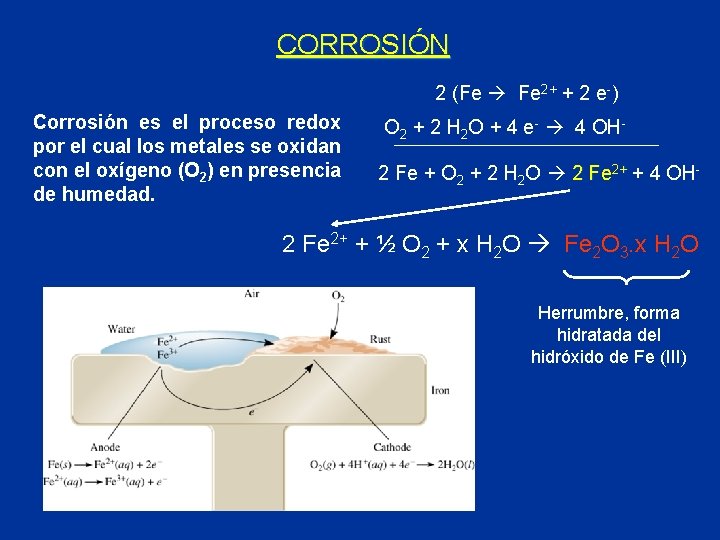
CORROSIÓN 2 (Fe Fe 2+ + 2 e-) Corrosión es el proceso redox por el cual los metales se oxidan con el oxígeno (O 2) en presencia de humedad. O 2 + 2 H 2 O + 4 e- 4 OH 2 Fe + O 2 + 2 H 2 O 2 Fe 2+ + 4 OH- 2 Fe 2+ + ½ O 2 + x H 2 O Fe 2 O 3. x H 2 O Herrumbre, forma hidratada del hidróxido de Fe (III)

Otros metales: Oro (E° = +1, 5 V) no se corroe Plata formando Ag 2 S, se ennegrece Cobre (E° = + 0, 3 V) Forma pátina verde de Cu. CO 3, que protege de corrosión posterior Aluminio (E° = -1, 66 V) forma óxido de aluminio que protege de posterior corrosión

Protección de la Corrosión: Ø PINTURA Ø PASIVACIÓN: Oxidante fuerte genera capa de óxido. Ej. HNO 3 Ø ALEACIÓN: Acero inoxidable (Fe + Cr) Ø Cubrir superficie con otro metal: Fe con Sn o Zn Ø PROTECCIÓN CATÓDICA

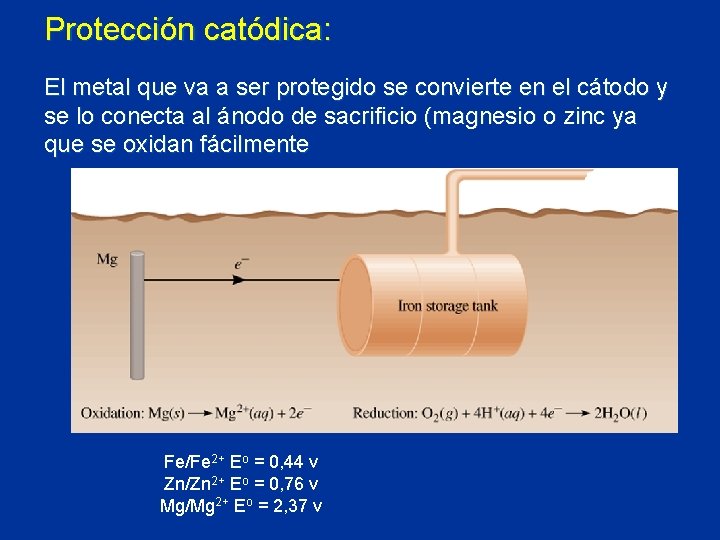
Protección catódica: El metal que va a ser protegido se convierte en el cátodo y se lo conecta al ánodo de sacrificio (magnesio o zinc ya que se oxidan fácilmente Fe/Fe 2+ Eo = 0, 44 v Zn/Zn 2+ Eo = 0, 76 v Mg/Mg 2+ Eo = 2, 37 v
 Quimica aplicada que estudia
Quimica aplicada que estudia Bienes no comercializables
Bienes no comercializables Acto de comercio mixto
Acto de comercio mixto Celda de aireación diferencial
Celda de aireación diferencial Celda flash
Celda flash Celda cubica simple
Celda cubica simple Referencia mista excel
Referencia mista excel Direccion
Direccion Tiroides y timo
Tiroides y timo Modelo de celda fija
Modelo de celda fija Diferencia de potencial
Diferencia de potencial Celda de gilbert
Celda de gilbert Tda pila
Tda pila Hojas de clculo
Hojas de clculo Celdas unitarias
Celdas unitarias Disposicion de pilas usadas
Disposicion de pilas usadas Ecuacion de nernst
Ecuacion de nernst Formula excel para juntar texto de dos celdas
Formula excel para juntar texto de dos celdas