Qual il p H di una soluzione acquosa




![p. H di soluzioni di BASI forti Na. OH Na+ + OH- [OH-]= [OH-]acqua p. H di soluzioni di BASI forti Na. OH Na+ + OH- [OH-]= [OH-]acqua](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-6.jpg)

![p. H di soluzioni di ACIDI deboli Ka [H 3 O+]2 Ca [H 3 p. H di soluzioni di ACIDI deboli Ka [H 3 O+]2 Ca [H 3](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-9.jpg)

![p. H di soluzioni di BASI deboli Kb [OH-]2 Cb [OH-] Kb Cb p. p. H di soluzioni di BASI deboli Kb [OH-]2 Cb [OH-] Kb Cb p.](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-12.jpg)
![p. H di soluzioni di BASI deboli d) di NH 3 1 M [OH-] p. H di soluzioni di BASI deboli d) di NH 3 1 M [OH-]](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-13.jpg)









![Sale basico dissociazione KCN K+ + CN- p. OH = - log [OH-] -log Sale basico dissociazione KCN K+ + CN- p. OH = - log [OH-] -log](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-30.jpg)
![Sale acido p. H = - log [H 3 O+] - log Kw/Kb (NH Sale acido p. H = - log [H 3 O+] - log Kw/Kb (NH](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-32.jpg)



![K a= [H 3 O+] [CH 3 COO- ] [H 3 O+] = Ka K a= [H 3 O+] [CH 3 COO- ] [H 3 O+] = Ka](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-39.jpg)
![Ki = [CH 3 COOH ] [OH-] [CH 3 COO-] Kw [OH-] = Ka Ki = [CH 3 COOH ] [OH-] [CH 3 COO-] Kw [OH-] = Ka](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-40.jpg)
![~ Ca CH 3 COOH = [H 3 O+] = Ka CH 3 COO- ~ Ca CH 3 COOH = [H 3 O+] = Ka CH 3 COO-](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-41.jpg)
![Equazione di Henderson - Hasselbach [H 3 O+] = Ka Ca Cs - log Equazione di Henderson - Hasselbach [H 3 O+] = Ka Ca Cs - log](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-42.jpg)
![a) base debole e suo sale: [OHKw [H 3 O+] Kb Cb [H 3 a) base debole e suo sale: [OHKw [H 3 O+] Kb Cb [H 3](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-45.jpg)
![Sperimentalmente si è verificato che un sistema tamponante risulta efficace quando: [H 3 O+] Sperimentalmente si è verificato che un sistema tamponante risulta efficace quando: [H 3 O+]](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-46.jpg)






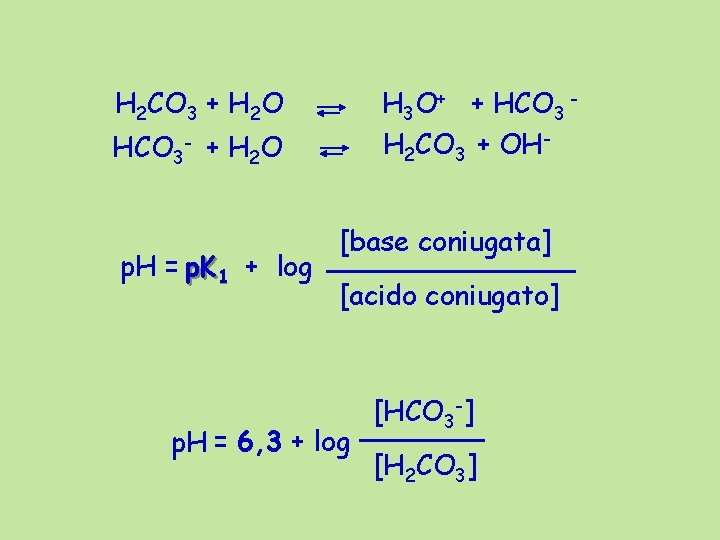
- Slides: 59


Qual’ è il p. H di una soluzione acquosa … a) di HCl 0. 1 M b) di Na. OH 10 m. M c) di CH 3 COOH 100 m. M d) di NH 3 1 M FORTI DEBOLI


p. H di soluzioni di ACIDI forti HCl + H 2 O H 3 O+ + Cl- [H 3 O+]= [H 3 O+]acqua + [H 3 O+]HCl Ca [H 3 O+] Ca p. H - log Ca

p. H di soluzioni di ACIDI forti a) di HCl 0. 1 M [H 3 O+] Ca = 0. 1 p. H - log -1 10 = 1
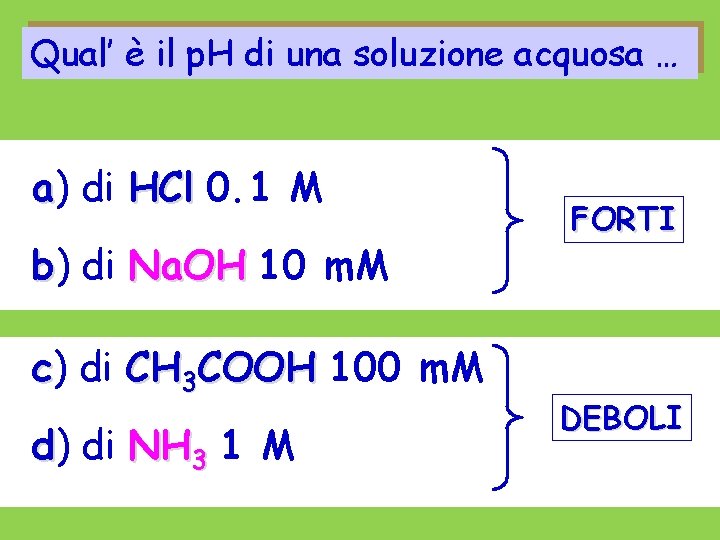
![p H di soluzioni di BASI forti Na OH Na OH OH OHacqua p. H di soluzioni di BASI forti Na. OH Na+ + OH- [OH-]= [OH-]acqua](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-6.jpg)
p. H di soluzioni di BASI forti Na. OH Na+ + OH- [OH-]= [OH-]acqua + [OH-]Na. OH Cb [OH-] Cb p. H 14 - log Cb

p. H di soluzioni di BASI forti b) di Na. OH 10 m. M [OH-] Cb = 0. 01 p. OH= 2 p. H 14 - p. OH= 14 -2= 12

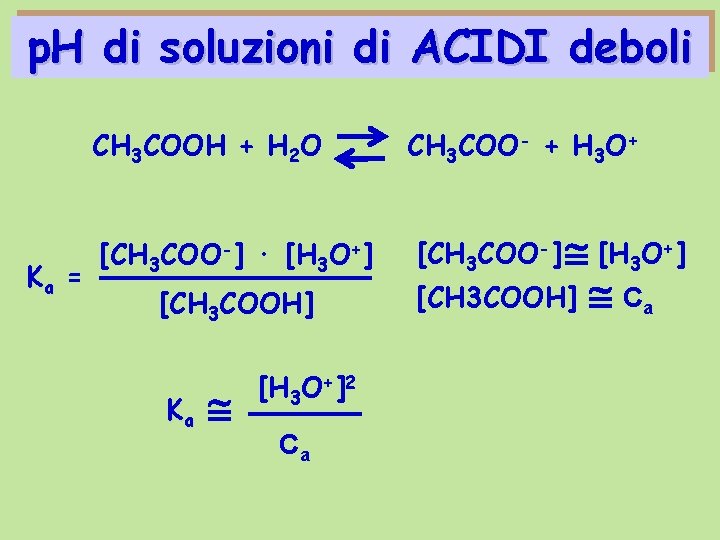
p. H di soluzioni di ACIDI deboli CH 3 COOH + H 2 O Ka = [CH 3 COO-] · [H 3 O+] [CH 3 COOH] Ka [H 3 O+]2 Ca CH 3 COO- + H 3 O+ [CH 3 COO-] [H 3 O+] [CH 3 COOH] Ca
![p H di soluzioni di ACIDI deboli Ka H 3 O2 Ca H 3 p. H di soluzioni di ACIDI deboli Ka [H 3 O+]2 Ca [H 3](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-9.jpg)
p. H di soluzioni di ACIDI deboli Ka [H 3 O+]2 Ca [H 3 O+] Ka Ca p. H = -log Ka Ca p. H = - log [H 3 O+] - ½ log Ka – ½ log Ca p. H = ½ p Ka – ½ log Ca

p. H di soluzioni di ACIDI deboli c) di CH 3 COOH 100 m. M [H 3 O+] Ka Ca [H 3 O+] 1, 8 · 10 -5 0. 1 = 1, 8 · 10 -6 = 0. 001341 p. H = 2. 87

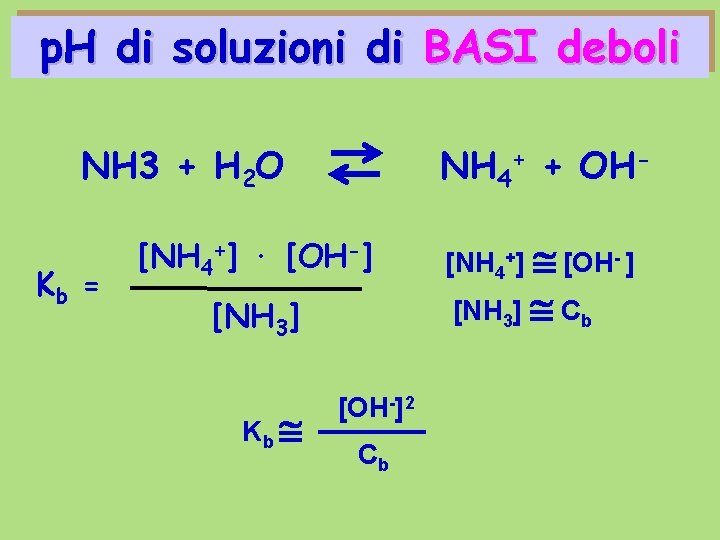
p. H di soluzioni di BASI deboli NH 3 + H 2 O Kb = NH 4+ + OH- [NH 4+] · [OH-] [NH 3] Kb [OH-]2 Cb [NH 4+] [OH- ] [NH 3] Cb
![p H di soluzioni di BASI deboli Kb OH2 Cb OH Kb Cb p p. H di soluzioni di BASI deboli Kb [OH-]2 Cb [OH-] Kb Cb p.](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-12.jpg)
p. H di soluzioni di BASI deboli Kb [OH-]2 Cb [OH-] Kb Cb p. OH = - log [OH-] - ½ log Kb – ½ log Cb p. OH = ½ p Kb – ½ log Cb p. H = 14 – p. OH
![p H di soluzioni di BASI deboli d di NH 3 1 M OH p. H di soluzioni di BASI deboli d) di NH 3 1 M [OH-]](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-13.jpg)
p. H di soluzioni di BASI deboli d) di NH 3 1 M [OH-] Kb Cb [OH-] 1, 8 · 10 -5 1 = 0. 0042 p. OH = -log (0. 0042) = 2. 38 p. H = 14 – 2. 38= 11. 62

Per la dissociazione di acidi e basi deboli è spesso conveniente esprimere la costante di equilibrio in funzione del grado di dissociazione

Il grado di dissociazione - a= N° di molecole dissociate N° di molecole totali 0 a 1

+ + CN H O HCN + H 2 O 3 moli iniziali moli all’equilibrio 1 - - 1 -a a a

HCN + H 2 O H 3 O+ + CN 1 -a a K a= a Moli all’equilibrio [H 3 O+] [CN- ] [HCN ] Per n moli in un volume V n (1 -a) [ HCN ] = V na + [H 3 O ] = V na [CN ] = V n a 2 Kc = (1 -a) V Legge di diluizione di Ostwald

Kc = n a 2 (1 -a) V Kc = a 2 C (1 -a) Da questa equazione appare evidente che aumentando il volume in cui è disciolto l’elettrolita (diluendo la soluzione) il grado di dissociazione aumenta. Per diluizione infinita, la dissociazione dell’elettrolita sarà completa Per elettroliti molto deboli (Kc 10 -4): (1 -a) 1 Kc a 2 C a K c /C


Sali I sali derivano dalla reazione di un acido con una base a) acido forte + base forte HCl + Na. OH Na. Cl + H 2 O b) acido debole + base forte HCN + KOH KCN + H 2 O c) acido forte + base debole HCl + NH 3 NH 4 Cl

Dalla dissociazione dei sali si possono formare delle specie, cationi ed anioni, che possono essere considerate acidi o basi, forti o deboli Na+Cl- Na+aq + Cl-aq K+CN- K+aq NH 4+Cl- NH 4+aq + CN-aq + Cl-aq

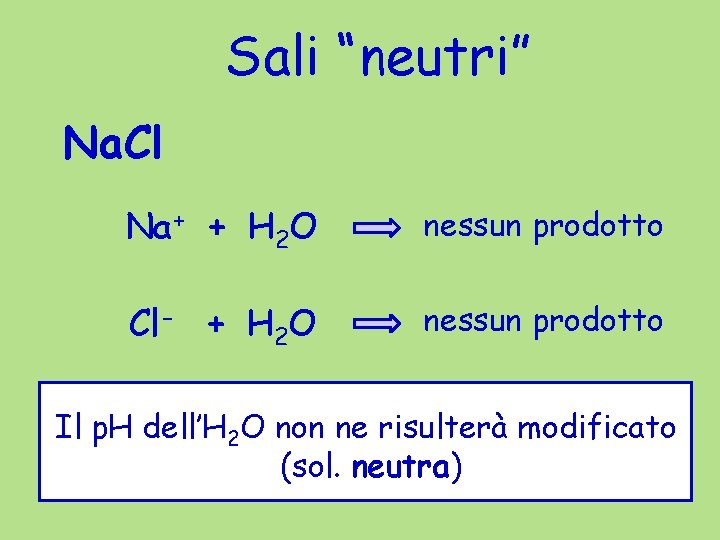
Sali “neutri” Na. Cl Na+ + H 2 O nessun prodotto Cl- + H 2 O nessun prodotto Il p. H dell’H 2 O non ne risulterà modificato (sol. neutra)

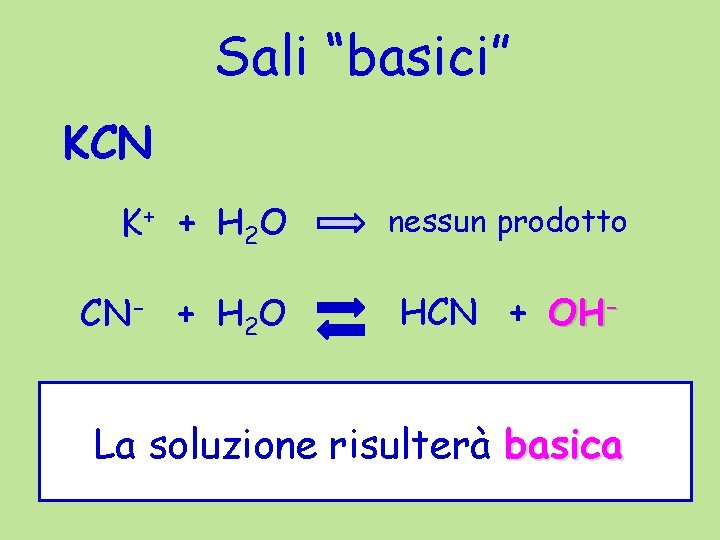
Sali “basici” KCN K + + H 2 O nessun prodotto CN- + H 2 O HCN + OH- La soluzione risulterà basica

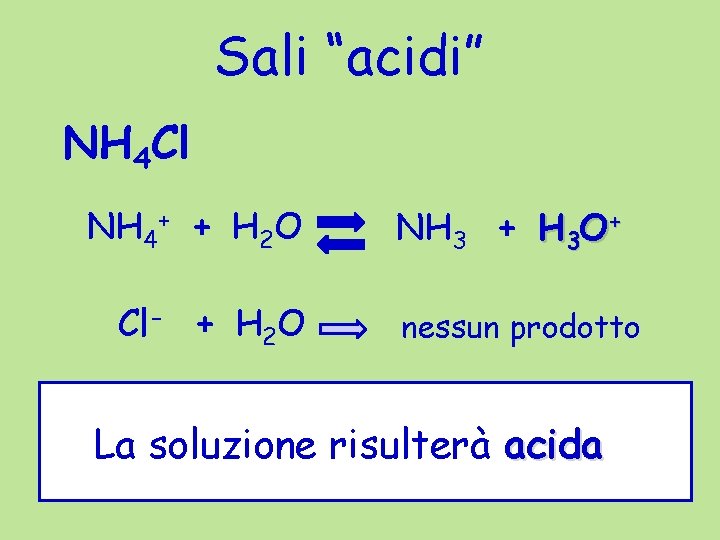
Sali “acidi” NH 4 Cl NH 4+ + H 2 O Cl- + H 2 O NH 3 + H 3 O+ nessun prodotto La soluzione risulterà acida

Il fenomeno per cui le soluzioni acquose di alcuni sali mostrano p. H acido o basico, va sotto il nome di idrolisi salina (scissione dell’acqua operata da sali)

Calcolo del p. H di soluzioni di sali idrolizzabili

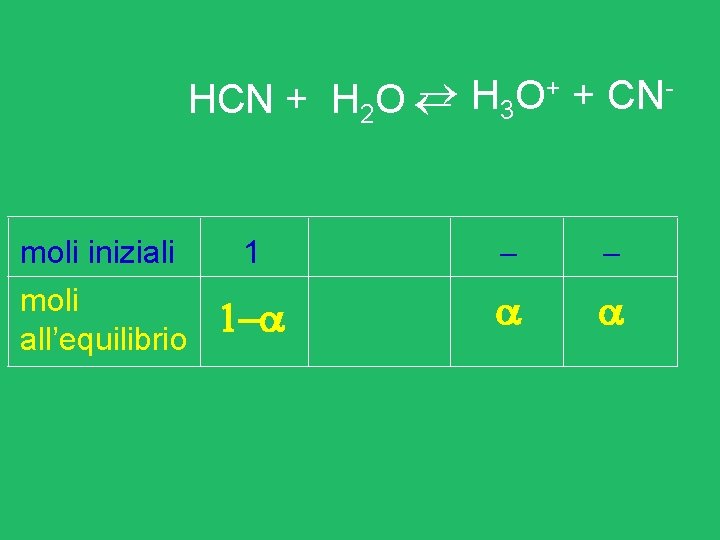
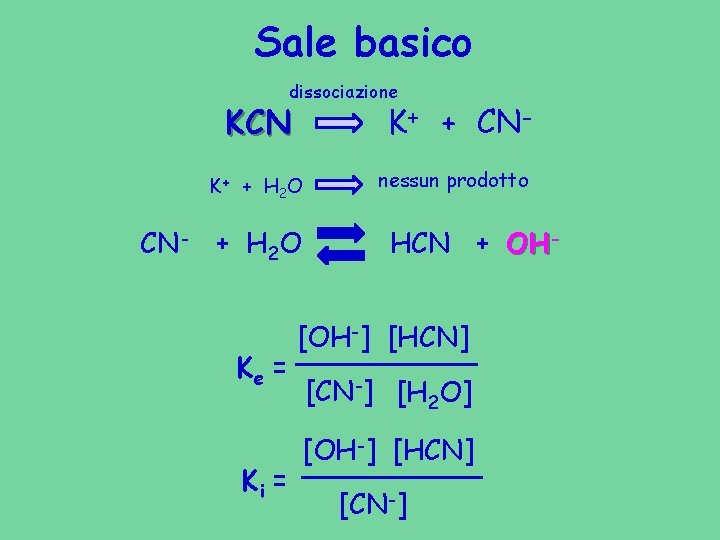
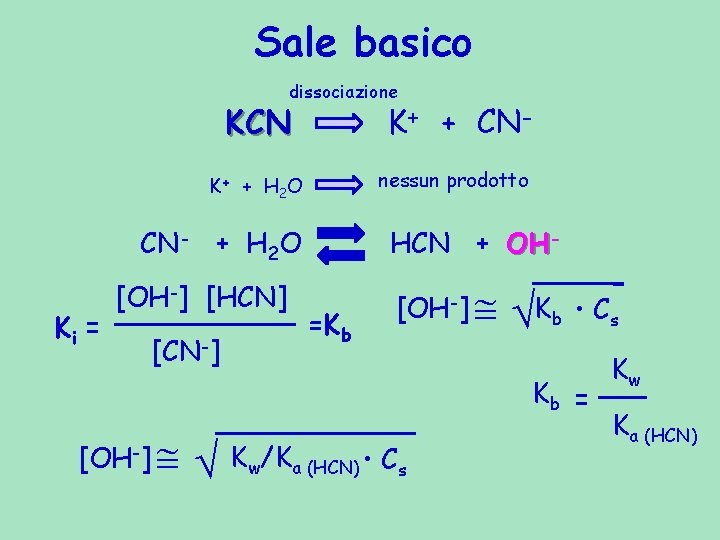
Sale basico dissociazione KCN K+ + CN- K+ + H 2 O CN- + H 2 O Ke = Ki = nessun prodotto HCN + OH- [OH-] [HCN] [CN-] [H 2 O] [OH-] [HCN] [CN-]

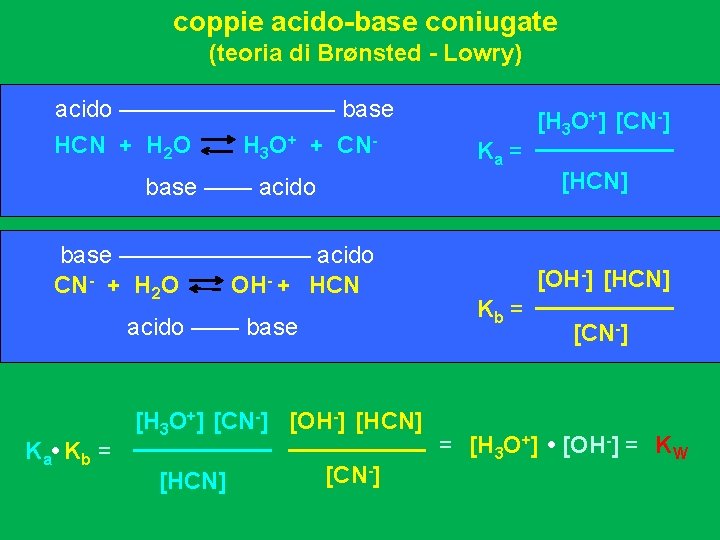
coppie acido-base coniugate (teoria di Brønsted - Lowry) acido ————— base HCN + H 2 O H 3 O+ + CN- Ka = base —— acido base ———— acido CN- + H 2 O OH- + HCN acido —— base K a • K b = [H 3 O+] [CN-] [OH-] [HCN] [CN-] [H 3 O+] [CN-] [HCN] [OH-] [HCN] Kb = [CN-] = [H 3 O+] • [OH-] = KW

Sale basico dissociazione KCN K+ + CN- nessun prodotto K+ + H 2 O CN- + H 2 O Ki = [OH-] [HCN] [CN-] HCN + OH=Kb [OH-] Kb • Cs Kb = [OH-] Kw/Ka (HCN) • Cs Kw Ka (HCN)
![Sale basico dissociazione KCN K CN p OH log OH log Sale basico dissociazione KCN K+ + CN- p. OH = - log [OH-] -log](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-30.jpg)
Sale basico dissociazione KCN K+ + CN- p. OH = - log [OH-] -log Kw/Ka • Cs p. OH - ½ log. Kb – ½log Cs p. OH ½ p. Kb – ½log Cs p. H = 14 - p. OH

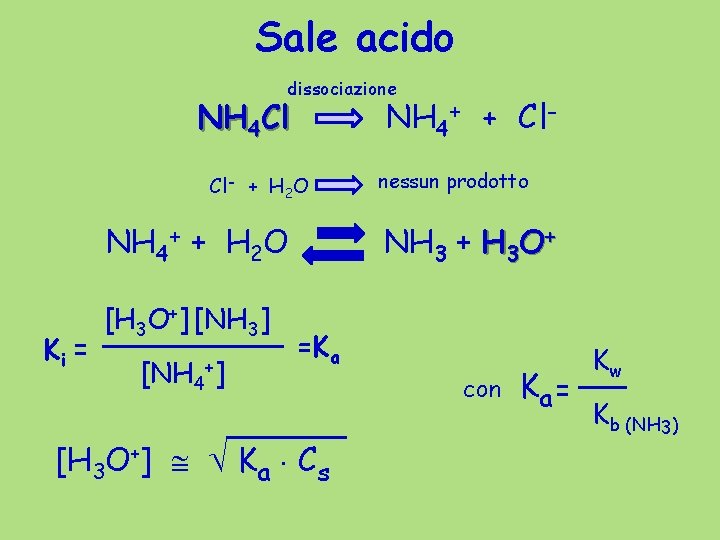
Sale acido dissociazione NH 4 Cl NH 4+ + Cl- + H 2 O NH 4+ + H 2 O Ki = [H 3 O+] [NH 3] [NH 4+] nessun prodotto NH 3 + H 3 O+ =Ka [H 3 O+] Ka Cs con Ka = Kw Kb (NH 3)
![Sale acido p H log H 3 O log KwKb NH Sale acido p. H = - log [H 3 O+] - log Kw/Kb (NH](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-32.jpg)
Sale acido p. H = - log [H 3 O+] - log Kw/Kb (NH 3) • Cs p. H = - log [H 3 O+] - ½ log Ka – ½ log Cs p. H ½ p. Ka – ½log Cs

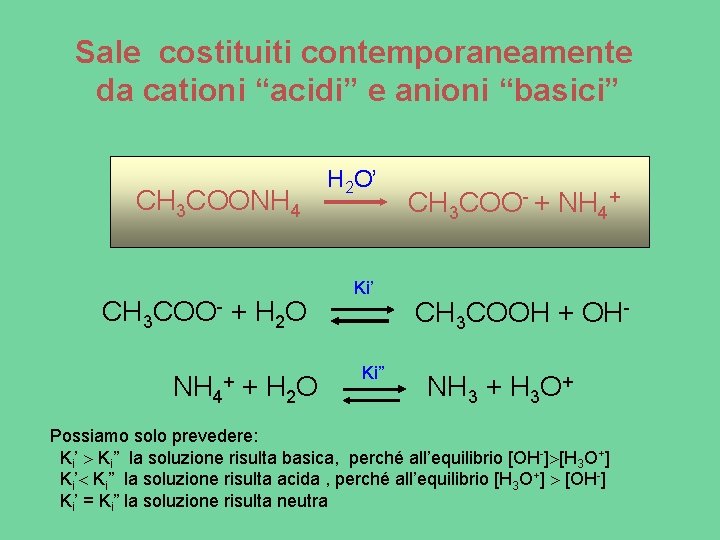
Sale costituiti contemporaneamente da cationi “acidi” e anioni “basici” CH 3 COONH 4 CH 3 COO- + H 2 O NH 4 + H 2 O’ Ki” CH 3 COO- + NH 4+ CH 3 COOH + OHNH 3 + H 3 O+ Possiamo solo prevedere: Ki’ Ki” la soluzione risulta basica, perché all’equilibrio [OH-] [H 3 O+] Ki’ Ki” la soluzione risulta acida , perché all’equilibrio [H 3 O+] [OH-] Ki’ = Ki” la soluzione risulta neutra

Soluzioni tampone

Soluzioni tampone Soluzioni che mantengono inalterato il loro p. H dopo aggiunta di piccole quantità di acidi o di basi.

a) un acido debole e dalla sua base coniugata (sale dell’acido) dell’acido CH 3 COOH / CH 3 COONa b) una base debole e dalla suo acido coniugato (sale della base) base NH 3 / NH 4+ NH 3 / NH 4 Cl

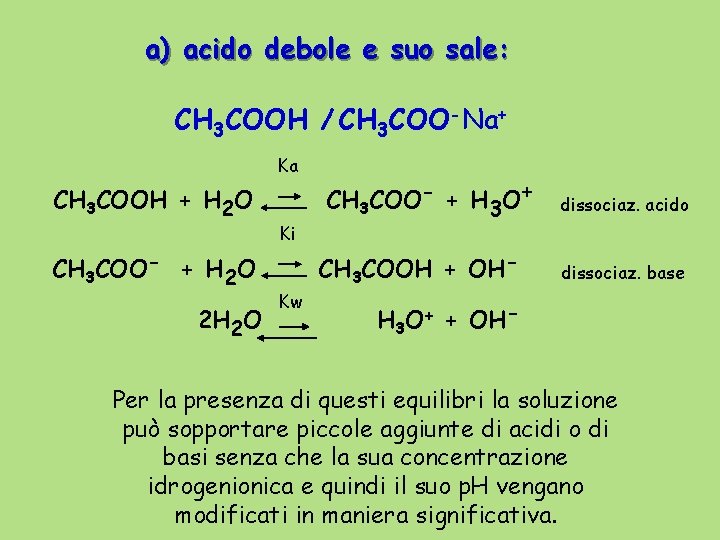
a) acido debole e suo sale: CH 3 COOH / CH 3 COO-Na+ Ka CH 3 COOH + H 2 O CH 3 COO- + H 2 O 2 H 2 O Ki Kw CH 3 COO- + H 3 O+ CH 3 COOH + OH- dissociaz. acido dissociaz. base H 3 O+ + OH- Per la presenza di questi equilibri la soluzione può sopportare piccole aggiunte di acidi o di basi senza che la sua concentrazione idrogenionica e quindi il suo p. H vengano modificati in maniera significativa.

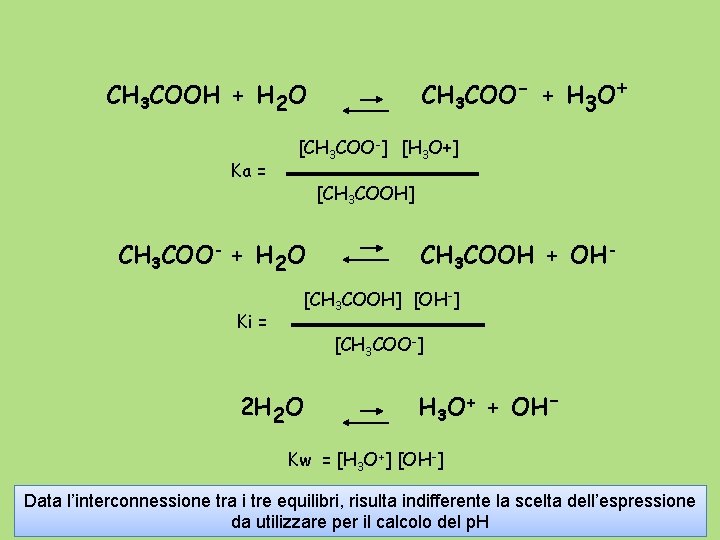
CH 3 COO- + H 3 O+ CH 3 COOH + H 2 O Ka = [CH 3 COO-] [H 3 O+] [CH 3 COOH] CH 3 COO- + H 2 O Ki = CH 3 COOH + OH- [CH 3 COOH] [OH-] [CH 3 COO-] 2 H 2 O H 3 O+ + OH- Kw = [H 3 O+] [OH-] Data l’interconnessione tra i tre equilibri, risulta indifferente la scelta dell’espressione da utilizzare per il calcolo del p. H
![K a H 3 O CH 3 COO H 3 O Ka K a= [H 3 O+] [CH 3 COO- ] [H 3 O+] = Ka](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-39.jpg)
K a= [H 3 O+] [CH 3 COO- ] [H 3 O+] = Ka [CH 3 COOH] [CH 3 COOH ] [CH 3 COO-]
![Ki CH 3 COOH OH CH 3 COO Kw OH Ka Ki = [CH 3 COOH ] [OH-] [CH 3 COO-] Kw [OH-] = Ka](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-40.jpg)
Ki = [CH 3 COOH ] [OH-] [CH 3 COO-] Kw [OH-] = Ka Kw Ka = Kw [H 3 O+] [CH 3 COOH ] Kw [CH 3 COO-] [H 3 O+] = Ka [CH 3 COOH ] [CH 3 COO-]
![Ca CH 3 COOH H 3 O Ka CH 3 COO ~ Ca CH 3 COOH = [H 3 O+] = Ka CH 3 COO-](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-41.jpg)
~ Ca CH 3 COOH = [H 3 O+] = Ka CH 3 COO- ~ = Cs [CH 3 COOH ] [CH 3 COO-] [H 3 O+] = Ka Ca Cs
![Equazione di Henderson Hasselbach H 3 O Ka Ca Cs log Equazione di Henderson - Hasselbach [H 3 O+] = Ka Ca Cs - log](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-42.jpg)
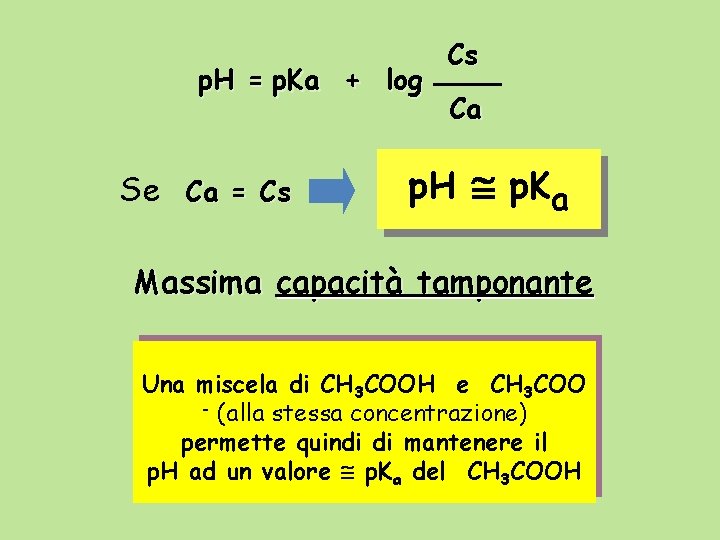
Equazione di Henderson - Hasselbach [H 3 O+] = Ka Ca Cs - log [H 3 O+] = - log Ka - log p. H = p. Ka + log Cs Ca Ca Cs

p. H = p. Ka + log Se Ca = Cs Cs Ca p. H p. Ka Massima capacità tamponante Una miscela di CH 3 COOH e CH 3 COO - (alla stessa concentrazione) permette quindi di mantenere il p. H ad un valore p. Ka del CH 3 COOH

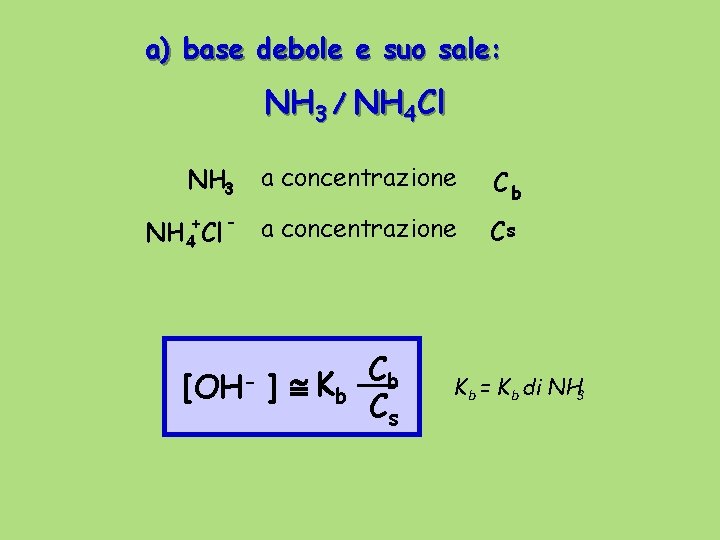
a) base debole e suo sale: NH 3 / NH 4 Cl NH 3 a concentrazione Cb + NH 4 Cl a concentrazione Cs [OH- ] Kb Cb Cs K b = K b di NH 3
![a base debole e suo sale OHKw H 3 O Kb Cb H 3 a) base debole e suo sale: [OHKw [H 3 O+] Kb Cb [H 3](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-45.jpg)
a) base debole e suo sale: [OHKw [H 3 O+] Kb Cb [H 3 Cs p. H = p. Ki + log Cb = C s Cb Cs O+] Cb Cs p. OH Kw Kb Kw Ki = Kb p. Kb Cs Cb
![Sperimentalmente si è verificato che un sistema tamponante risulta efficace quando H 3 O Sperimentalmente si è verificato che un sistema tamponante risulta efficace quando: [H 3 O+]](https://slidetodoc.com/presentation_image_h2/54c2e4cafb9f71d0d4920681f72052ae/image-46.jpg)
Sperimentalmente si è verificato che un sistema tamponante risulta efficace quando: [H 3 O+] Ka Ca Cs p. H p. Ka - log Ca Cs Ca / Cs = 10 p. H = p. Ka - 1 Ca / Cs = 1/10 p. H = p. Ka + 1 p. H p. Ka + - 1

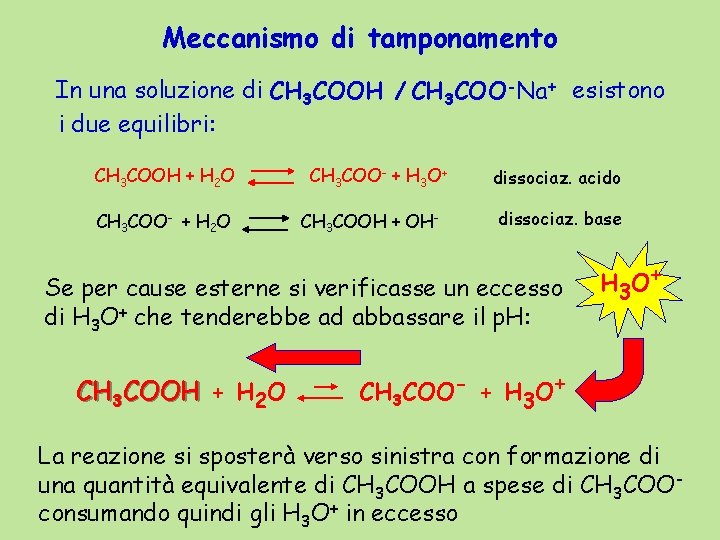
Meccanismo di tamponamento In una soluzione di CH 3 COOH / CH 3 COO-Na+ esistono i due equilibri: CH 3 COOH + H 2 O CH 3 COO- + H 3 O+ CH 3 COOH + OH- dissociaz. acido dissociaz. base Se per cause esterne si verificasse un eccesso di H 3 O+ che tenderebbe ad abbassare il p. H: CH 3 COOH + H 2 O H 3 O + CH 3 COO- + H 3 O+ La reazione si sposterà verso sinistra con formazione di una quantità equivalente di CH 3 COOH a spese di CH 3 COOconsumando quindi gli H 3 O+ in eccesso

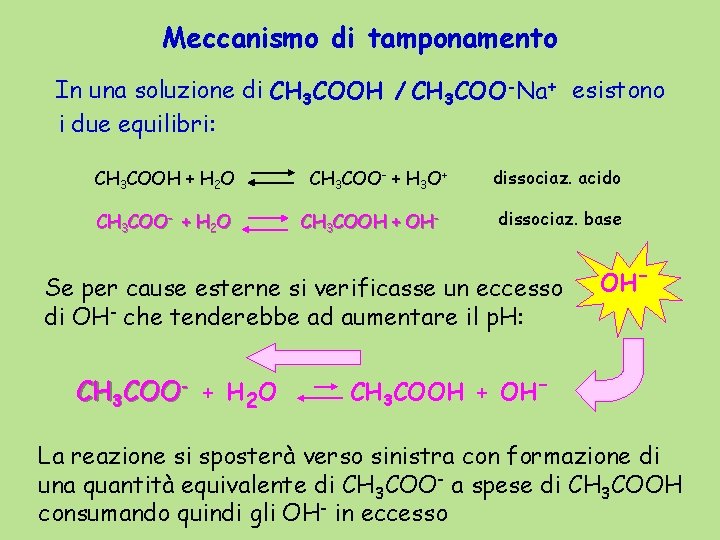
Meccanismo di tamponamento In una soluzione di CH 3 COOH / CH 3 COO-Na+ esistono i due equilibri: CH 3 COOH + H 2 O CH 3 COO- + H 3 O+ CH 3 COOH + OH- dissociaz. acido dissociaz. base Se per cause esterne si verificasse un eccesso di OH- che tenderebbe ad aumentare il p. H: CH 3 COO- + H 2 O OH- CH 3 COOH + OH- La reazione si sposterà verso sinistra con formazione di una quantità equivalente di CH 3 COO- a spese di CH 3 COOH consumando quindi gli OH- in eccesso

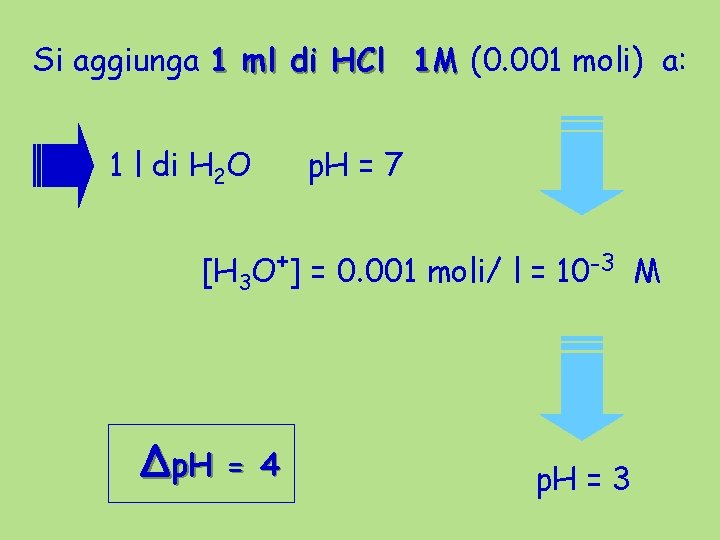
Potere Tamponante Si aggiunga 1 ml di HCl 1 M a: 1 l di H 2 O 1 l di Soluz. Tampone Ac. OH / Ac. O- 0, 1 M

Si aggiunga 1 ml di HCl 1 M (0. 001 moli) a: 1 l di H 2 O p. H = 7 [H 3 O+] = 0. 001 moli/ l = 10 -3 M Δp. H = 4 p. H = 3

1 l di Soluz. Tampone Ac. OH / Ac. O- 0, 1 M Cs p. H p. Ka + log Ca 5 + log 0, 1 5 Ka 10 -5 Si aggiunga 1 ml di HCl 1 M (0, 001 moli) Ac. O- + H 3 O+ Ac. OH + H 2 O [Ac. O-] = 0, 1 - 0, 001 = 0, 099 [Ac. OH] = 0, 1 + 0, 001 = 0, 101 Cs 5 + log 0, 099 4, 99 p. H p. Ka + log Ca 0, 101 Δp. H = 0, 01


Importanza biologica del tampone fosfato e del tampone bicarbonato omeostasi: capacità degli organismi viventi di mantenere costante la loro composizione di fronte a significative variazioni dell’ambiente esterno. Il p. H si mantiene costante in tutti i liquidi biologici, cellule e tessuti 7 < p. H sangue < 7, 9 Il p. H del sangue è mantenuto costante da due sistemi tamponi: - diidrogenofosfato / monoidrogenofosfato (H 2 PO 4 -/ HPO 42 -) - acido carbonico / bicarbonato (H 2 CO 3/ HCO 3 -)


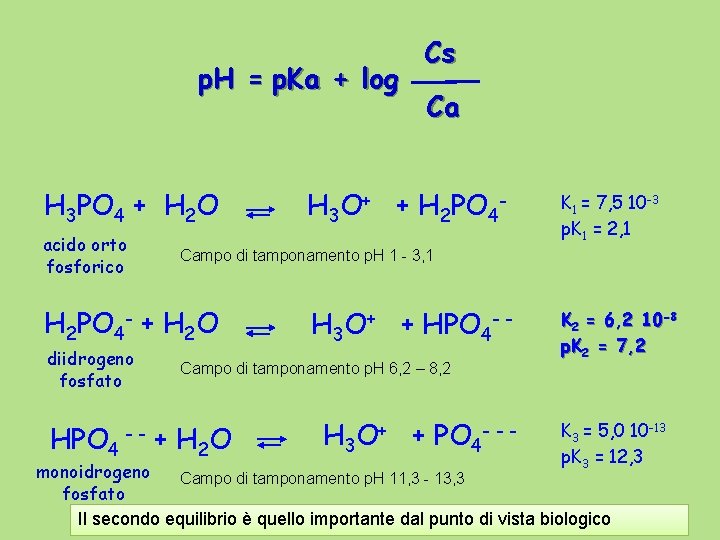
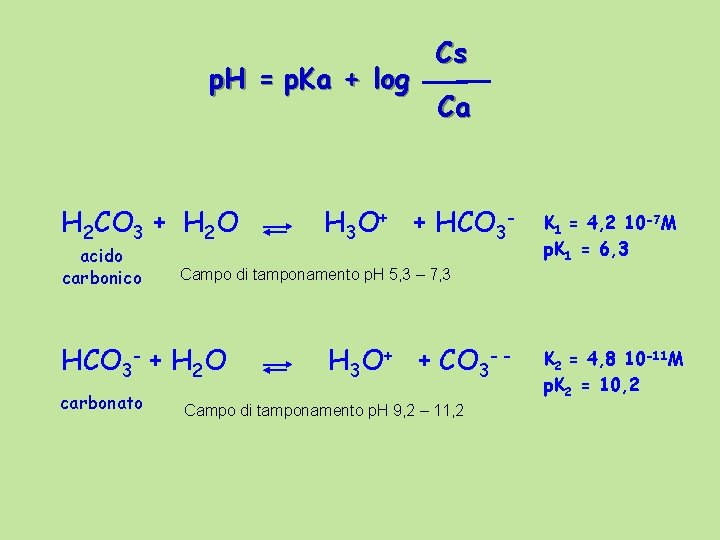
p. H = p. Ka + log H 3 PO 4 + H 2 O acido orto fosforico HPO 4 -- Ca H 3 O+ + H 2 PO 4 - K 1 = 7, 5 10 -3 p. K 1 = 2, 1 Campo di tamponamento p. H 1 - 3, 1 H 2 PO 4 - + H 2 O diidrogeno fosfato Cs H 3 O+ + HPO 4 - - Campo di tamponamento p. H 6, 2 – 8, 2 + H 2 O H 3 O+ + PO 4 --- K 2 = 6, 2 10 -8 p. K 2 = 7, 2 K 3 = 5, 0 10 -13 p. K 3 = 12, 3 monoidrogeno Campo di tamponamento p. H 11, 3 - 13, 3 fosfato Il secondo equilibrio è quello importante dal punto di vista biologico

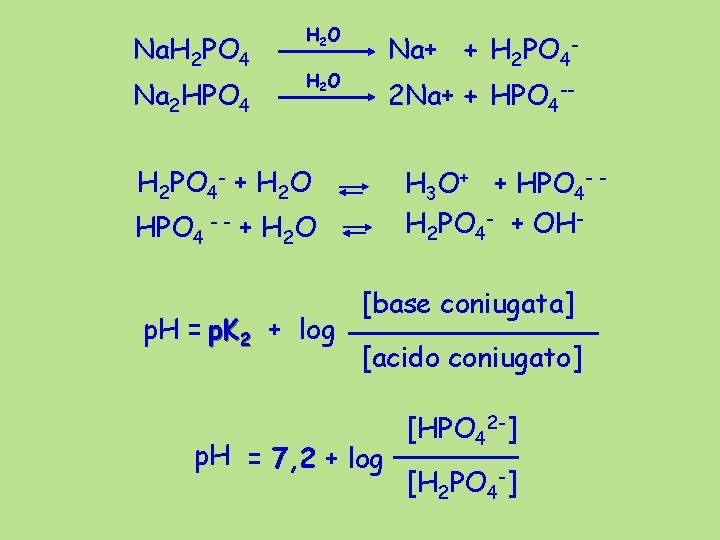
Na. H 2 PO 4 Na 2 HPO 4 H 2 O Na+ + H 2 PO 4 - H 2 O 2 Na+ + HPO 4 -- H 2 PO 4 - + H 2 O H 3 O+ + HPO 4 - H 2 PO 4 - + OH- HPO 4 - - + H 2 O p. H = p. K 2 + log [base coniugata] [acido coniugato] p. H = 7, 2 + log [HPO 42 -] [H 2 PO 4 -]


p. H = p. Ka + log H 2 CO 3 + H 2 O acido carbonico Ca H 3 O+ + HCO 3 - K 1 = 4, 2 10 -7 M p. K 1 = 6, 3 Campo di tamponamento p. H 5, 3 – 7, 3 HCO 3 - + H 2 O carbonato Cs H 3 O+ + CO 3 - - Campo di tamponamento p. H 9, 2 – 11, 2 K 2 = 4, 8 10 -11 M p. K 2 = 10, 2
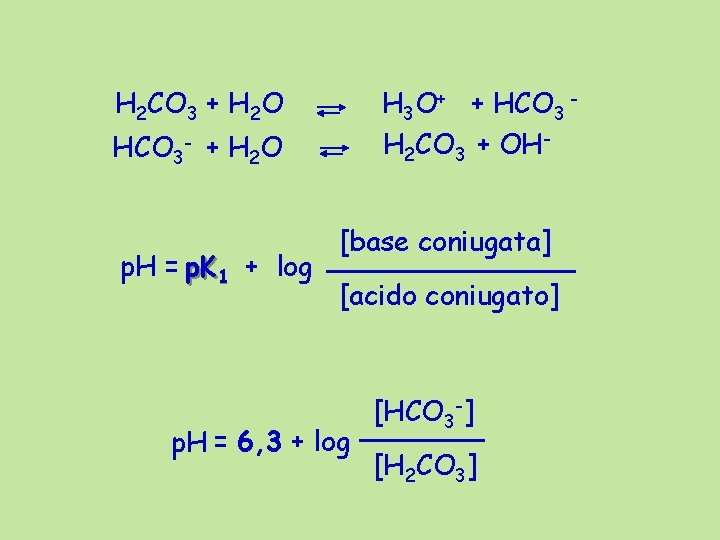
H 2 CO 3 + H 2 O H 3 O+ + HCO 3 H 2 CO 3 + OH- HCO 3 - + H 2 O p. H = p. K 1 + log [base coniugata] [acido coniugato] p. H = 6, 3 + log [HCO 3 -] [H 2 CO 3]