Proteo dos metais contra corroso A proteo contra




- Slides: 5

Proteção dos metais contra corrosão A proteção contra a corrosão do ferro e de outros metais pode ser feita por meio do revestimento da peça com tintas, esmaltes, óxidos e outros metais Parafusos revestidos de zinco para proteger da corrosão – processo denominado galvanização

Proteção catódica: Visto que a formação da ferrugem inicia-se em virtude da oxidação do ferro (Fe (s) → Fe 2+ + 2 e-) em contato com o ar úmido, uma das técnicas de proteção do ferro consiste em reverter essa oxidação. Para tal, um eletrodo de sacrifício ou metal de sacrifício é colocado em contato com o objeto feito de ferro ou de aço. Esse metal deve possuir um potencial de oxidação maior que o do ferro para, assim, oxidar-se no lugar dele (daí o nome “eletrodo de sacrifício”), fornecendo elétrons para quaisquer íons Fe 2+ que se formarem, voltando a ser ferro metálico. Para entender melhor, vejamos um exemplo: O magnésio possui potencial de redução maior que o do ferro, conforme mostra as suas semirreações de redução abaixo: Fe 2+ + 2 e- → Fe(s) E 0 = - 0, 44 V Mg 2+ + 2 e- → Mg(s) E 0 = - 2, 37 V Visto que seu potencial de redução é menor, a tendência do magnésio de oxidar-se é maior que a do ferro. Assim, liga-se uma peça de ferro a esse metal, formando uma pilha galvânica, em que o ferro é o cátodo e o magnésio funciona como ânodo. Isso significa que, em contato com o ar, o magnésio irá oxidar-se

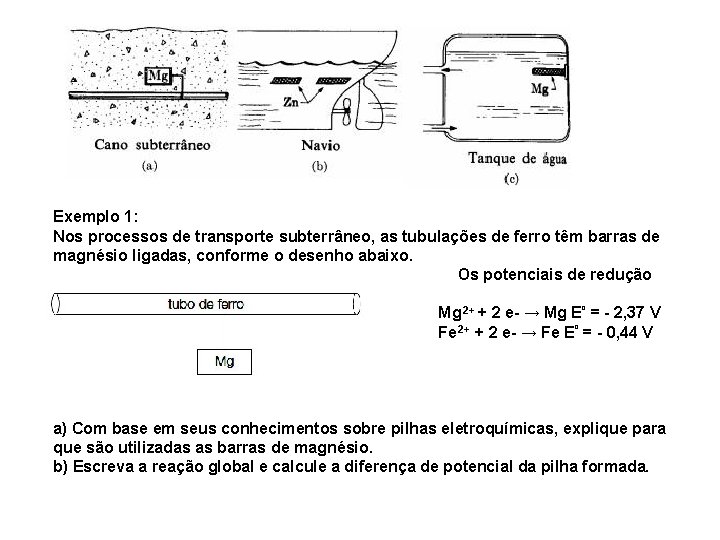
Geralmente, no caso dos navios, como mostrado abaixo, placas de zinco são colocadas diretamente em contato com o casco deles. Já no caso de tubulações, tanques de combustível e oleodutos, blocos de magnésio são conectados em vários pontos desses equipamentos.

O estanho é mais resistente à corrosão que o aço, ou seja, é menos reativo que o ferro, e ele ainda é revestido por outra camada de um óxido ou de um polímero, porque o ácido cítrico dos alimentos pode atacar o estanho. Mas se a lata for amassada, o ferro e o estanho ficarão em contato com o alimento, sendo que o ferro irá oxidar-se primeiro. Por isso, ao comprar alimentos enlatados, tome muito cuidado para que a lata não esteja amassada

Exemplo 1: Nos processos de transporte subterrâneo, as tubulações de ferro têm barras de magnésio ligadas, conforme o desenho abaixo. Os potenciais de redução são: Mg 2+ + 2 e- → Mg Eº = - 2, 37 V Fe 2+ + 2 e- → Fe Eº = - 0, 44 V a) Com base em seus conhecimentos sobre pilhas eletroquímicas, explique para que são utilizadas as barras de magnésio. b) Escreva a reação global e calcule a diferença de potencial da pilha formada.