PROTENAS CONJUGADAS 1 HEMOGLOBINA MIOGLOBINA CITOCROMOS 2 EVOLUO
PROTEÍNAS CONJUGADAS 1

HEMOGLOBINA MIOGLOBINA CITOCROMOS 2

EVOLUÇÃO Em organismos unicelulares ou multicelulares pequenos o O 2 pode ser absorvido diretamente pelo ar ou água circundante. Nos vertebrados: *Sistema circulatório *Proteínas de transporte e armazenamento

Lembrete 1 • O tempo médio de vida de uma hemácia é de 120 dias. Após esse período, ela é destruída no baço, onde aproximadamente dez milhões de hemácias são destruídas por segundo. Todos os componentes das hemácias são utilizados para fabricação de novas células.

PROTEÍNAS CONJUGADAS São aquelas que, através de hidrólise, liberam outro componente além dos aminoácidos. APOPROTEÍNA GRUPO PROSTÉTICO - Nucleoproteínas Ácidos Nucleicos - Lipoproteínas Lipídeos - Glicoproteínas Glicídica/ carboidrato - Metaloproteínas Metal - Fosfoproteínas Ácido Fosfórico - Porfirinoproteínas/ Hemoproteínas Porfirina
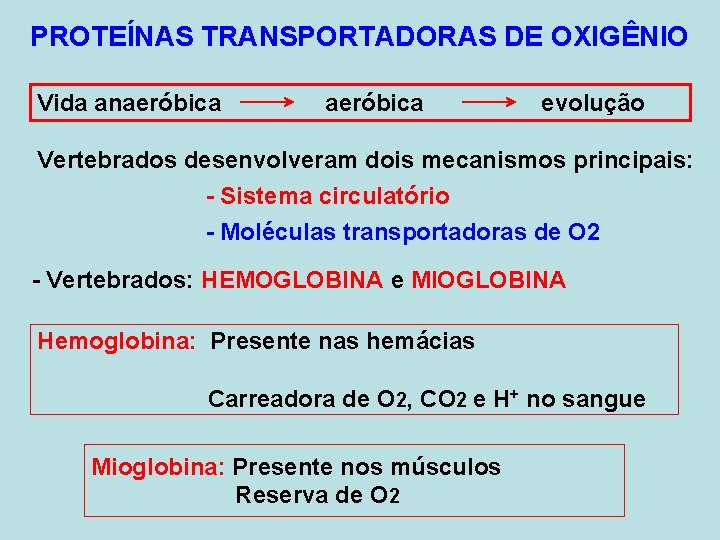
PROTEÍNAS TRANSPORTADORAS DE OXIGÊNIO Vida anaeróbica evolução Vertebrados desenvolveram dois mecanismos principais: - Sistema circulatório - Moléculas transportadoras de O 2 - Vertebrados: HEMOGLOBINA e MIOGLOBINA Hemoglobina: Presente nas hemácias Carreadora de O 2, CO 2 e H+ no sangue Mioglobina: Presente nos músculos Reserva de O 2

HEMÁCIAS Quase todo oxigênio transportado pelo sangue está ligado à Hemoglobina. Os eritrócitos ou hemácias são discos bicôncavos pequenos (6 -9 μm). São especializados no transporte de oxigênio. 600 litros de oxigênio dos pulmões aos tecidos por dia.

HEMÁCIAS No processo de maturação, perdem as organelas intracelulares e sintetizam grandes quantidades de Hemoglobina (Hb). A Hb que deixa os pulmões está 96% saturada com oxigênio.
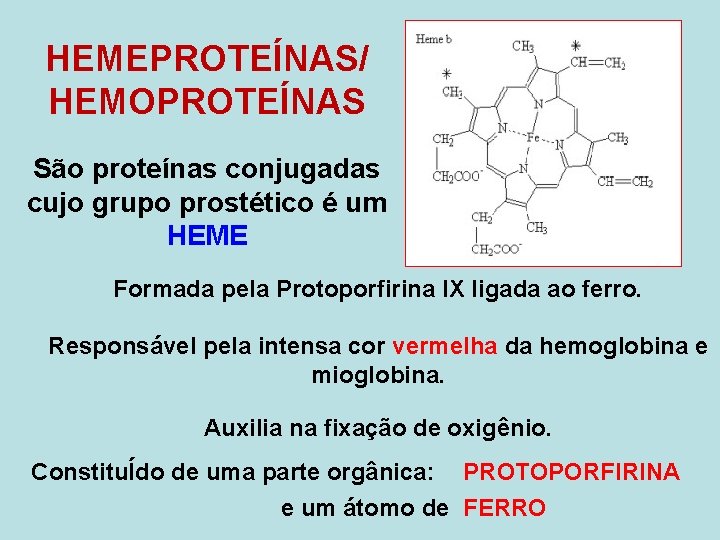
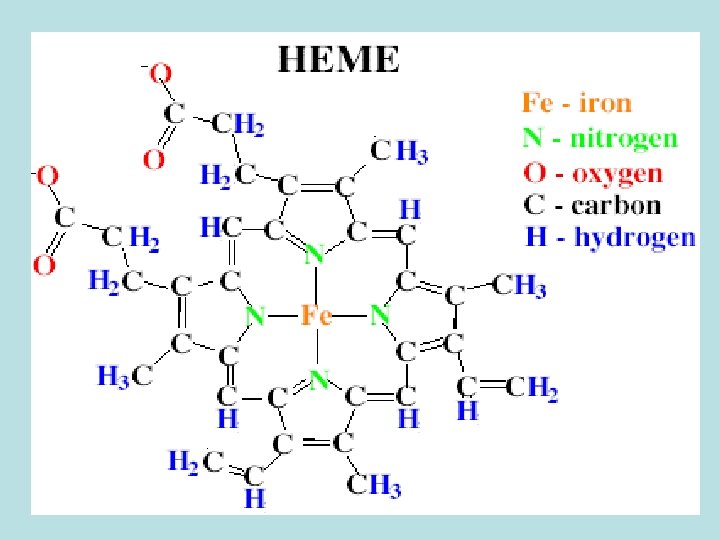
HEMEPROTEÍNAS/ HEMOPROTEÍNAS São proteínas conjugadas cujo grupo prostético é um HEME Formada pela Protoporfirina IX ligada ao ferro. Responsável pela intensa cor vermelha da hemoglobina e mioglobina. Auxilia na fixação de oxigênio. ConstituÍdo de uma parte orgânica: PROTOPORFIRINA e um átomo de FERRO
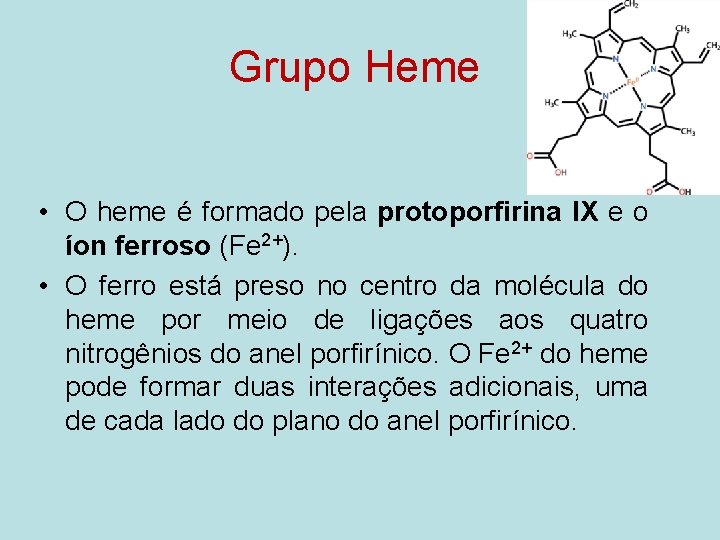
Grupo Heme • O heme é formado pela protoporfirina IX e o íon ferroso (Fe 2+). • O ferro está preso no centro da molécula do heme por meio de ligações aos quatro nitrogênios do anel porfirínico. O Fe 2+ do heme pode formar duas interações adicionais, uma de cada lado do plano do anel porfirínico.
11
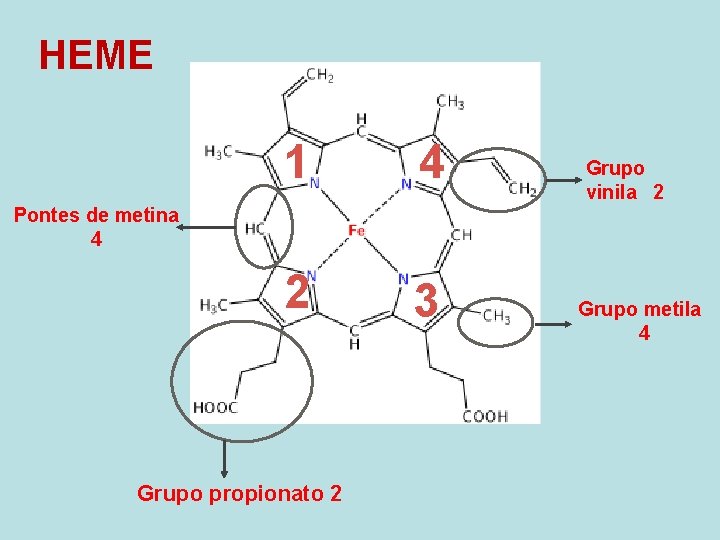
HEME 1 4 2 3 Grupo vinila 2 Pontes de metina 4 Grupo propionato 2 Grupo metila 4
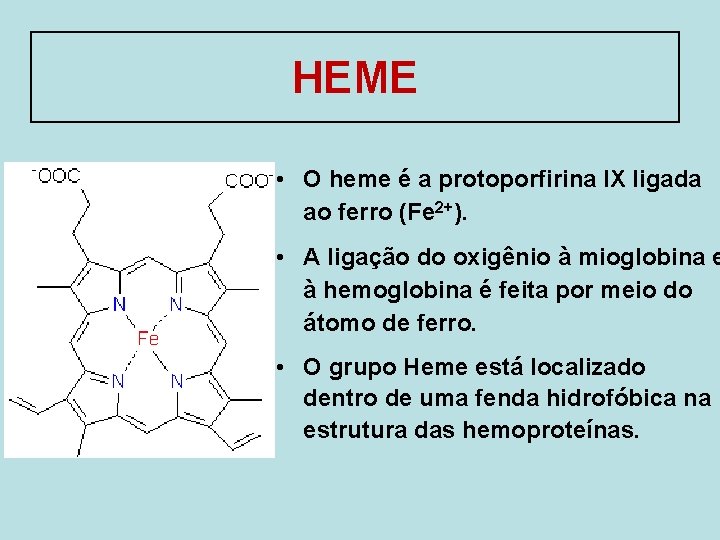
HEME • O heme é a protoporfirina IX ligada ao ferro (Fe 2+). • A ligação do oxigênio à mioglobina e à hemoglobina é feita por meio do átomo de ferro. • O grupo Heme está localizado dentro de uma fenda hidrofóbica na estrutura das hemoproteínas.
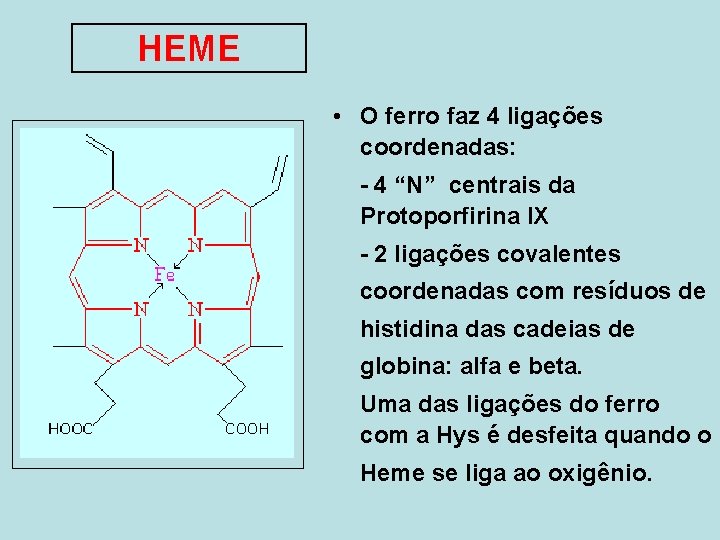
HEME • O ferro faz 4 ligações coordenadas: - 4 “N” centrais da Protoporfirina IX - 2 ligações covalentes coordenadas com resíduos de histidina das cadeias de globina: alfa e beta. Uma das ligações do ferro com a Hys é desfeita quando o Heme se liga ao oxigênio.
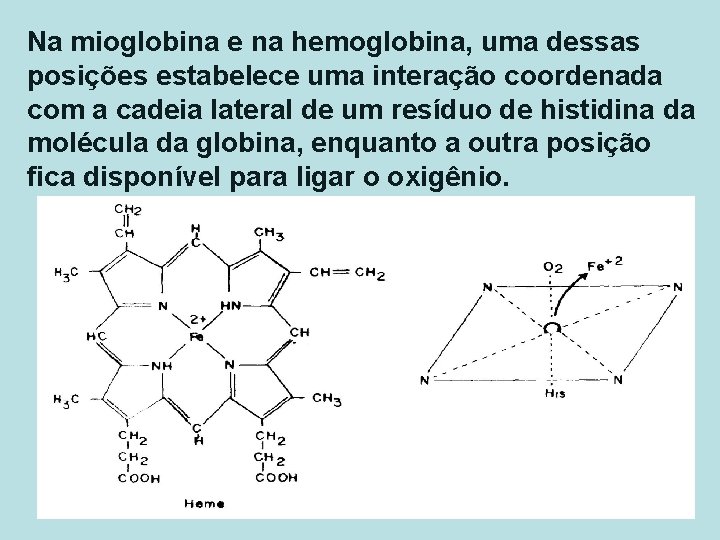
Na mioglobina e na hemoglobina, uma dessas posições estabelece uma interação coordenada com a cadeia lateral de um resíduo de histidina da molécula da globina, enquanto a outra posição fica disponível para ligar o oxigênio. 15
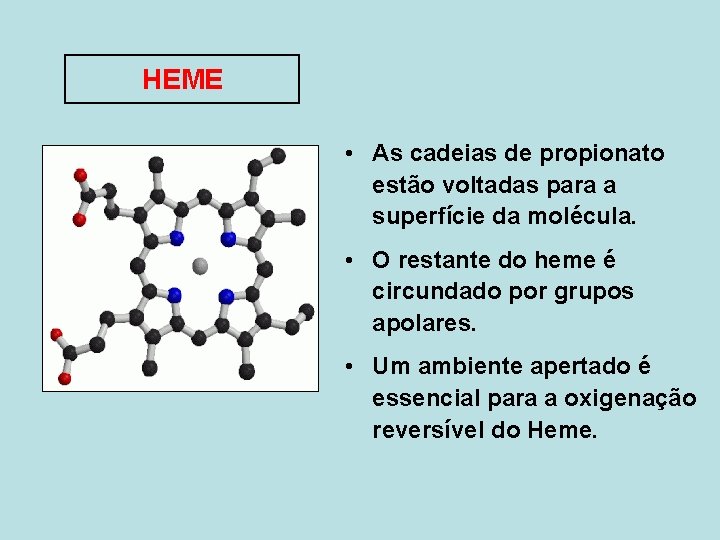
HEME • As cadeias de propionato estão voltadas para a superfície da molécula. • O restante do heme é circundado por grupos apolares. • Um ambiente apertado é essencial para a oxigenação reversível do Heme.

HEME • A presença da Hys distal na cavidade de encaixe do Heme é importante para diminuir a entrada do monóxido de carbono (CO). • A afinidade da Hb e mioglobina pelo CO é 200 X maior do que pelo O 2. • O Heme isolado fixa CO 25. 000 X mais fortemente que o O 2.

Função do Grupo Heme • O papel do grupo heme é determinado pelo ambiente criado pela estrutura tridimensional da proteína. • Na hemoglobina e na mioglobina, as duas hemeproteínas mais abundantes em humanos, o grupo heme serve para ligar, de forma reversível, o oxigênio. • O grupo heme de um citocromo funciona como um carreador de elétrons, sendo alternadamente oxidado e reduzido
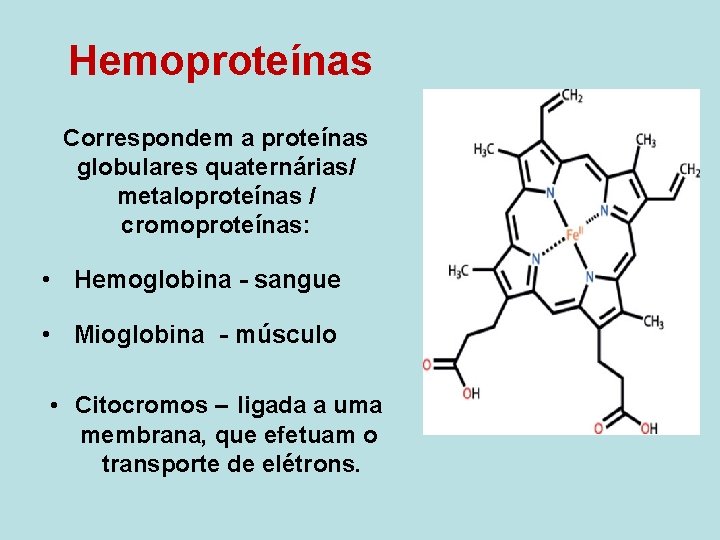
Hemoproteínas Correspondem a proteínas globulares quaternárias/ metaloproteínas / cromoproteínas: • Hemoglobina - sangue • Mioglobina - músculo • Citocromos – ligada a uma membrana, que efetuam o transporte de elétrons.
HEMEPROTEÍNAS HEMOGLOBINA MIOGLOBINA

Estrutura e função da Hemoglobina

HEMOGLOBINA Marx Perutz, 1962. Análises com difração de raios X. A molécula de Hb é esférica, com diâmetro aproximado de 5, 5 nm. Segmentos em α-hélice, separados por curvaturas. Grupos Heme localizados em uma fenda. Cada cadeia polipeptídica liga-se a um grupo Heme. Cada Heme liga-se à globina por meio de um resíduo de Hys.
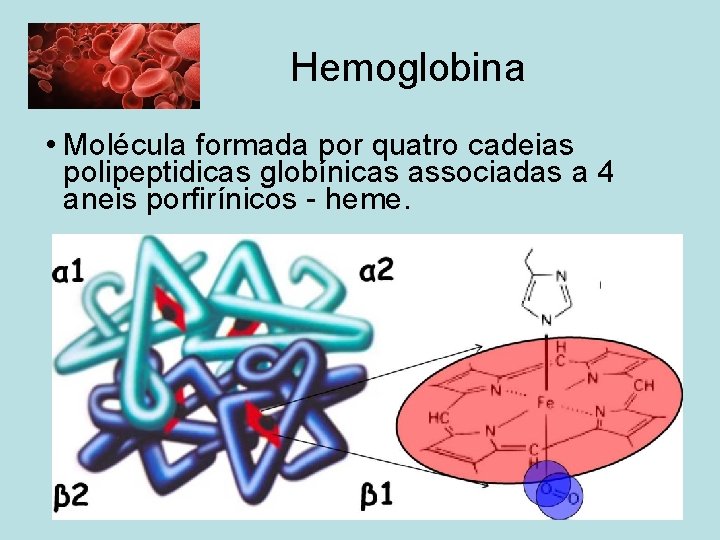
Hemoglobina • Molécula formada por quatro cadeias polipeptidicas globínicas associadas a 4 aneis porfirínicos - heme.

HEMOGLOBINA É uma molécula esférica com aproximadamente 55Å de diâmetro. PM = 64. 500 daltons É uma proteína oligomérica: Ø 4 cadeias polipeptidicas Ø 4 grupos heme
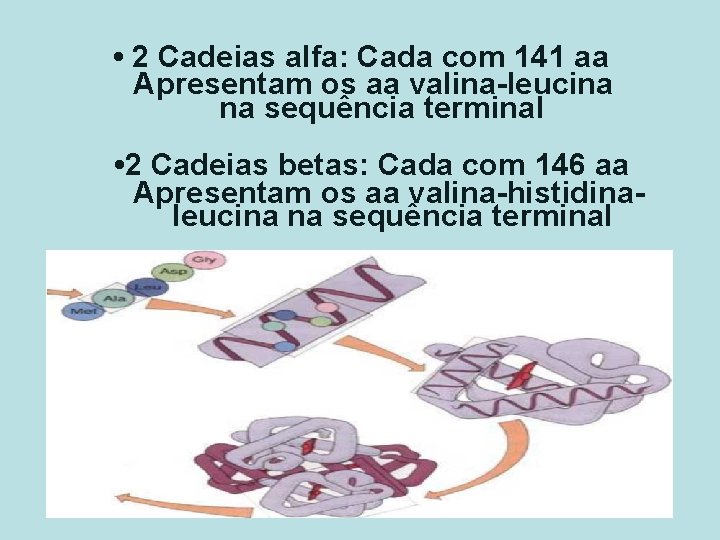
• 2 Cadeias alfa: Cada com 141 aa Apresentam os aa valina-leucina na sequência terminal • 2 Cadeias betas: Cada com 146 aa Apresentam os aa valina-histidinaleucina na sequência terminal

Hemoglobina As cadeias alfa e beta apresentam estruturas semelhantes. As cadeias da Hemoglobina são semelhantes à cadeia única da mioglobina. 70% das cadeias estão em α- hélice. Os dobramentos e ângulos de cada cadeia são semelhantes. Cadeias α e β estão enoveladas. Cada cadeia de globina se liga a um grupo Heme.
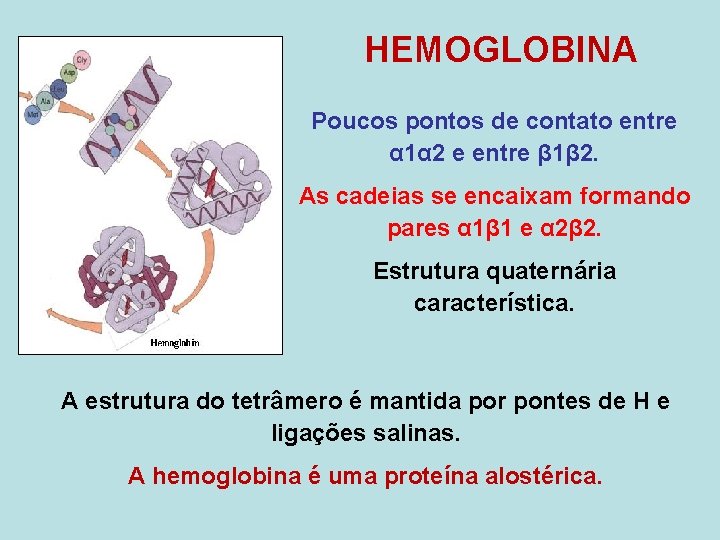
HEMOGLOBINA Poucos pontos de contato entre α 1α 2 e entre β 1β 2. As cadeias se encaixam formando pares α 1β 1 e α 2β 2. Estrutura quaternária característica. A estrutura do tetrâmero é mantida por pontes de H e ligações salinas. A hemoglobina é uma proteína alostérica.

HEMOGLOBINA • A hemoglobina é encontrada exclusivamente nos eritrócitos, onde sua principal função é transportar oxigênio dos pulmões até os capilares dos tecidos. • A hemoglobina A - A principal hemoglobina em adultos, é composta por quatro cadeias polipeptídicas (duas cadeias α e duas cadeias β – as globinas) mantidas unidas por meio de ligações não-covalentes. • Cada subunidade contém segmentos de estrutura em hélice α, além de uma fenda, onde se liga o grupo heme.

SÍNTESE DE HEMOGLOBINA • Inicia-se a partir do eritroblasto basófilo e termina nos reticulócitos que são os responsáveis por 35% da produção total de Hb. • Depende de suprimento de ferro, síntese de protoporfirinas e globinas. • Produção e degradação diária de 8 g Hb.
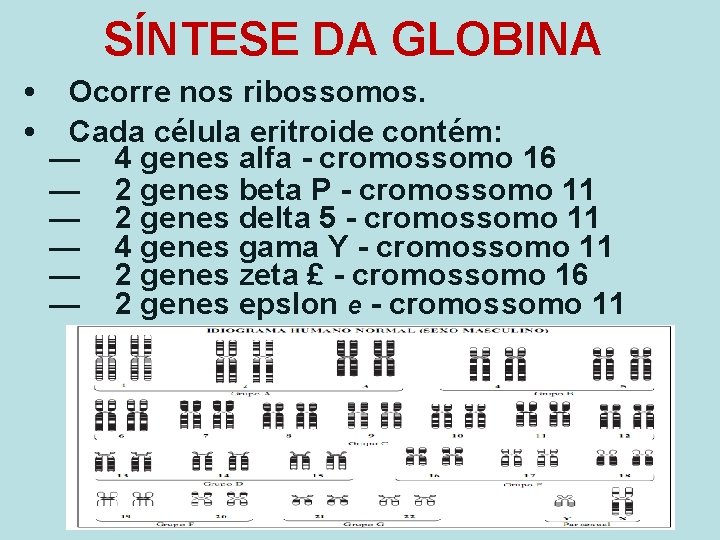
SÍNTESE DA GLOBINA • • Ocorre nos ribossomos. Cada célula eritroide contém: — 4 genes alfa - cromossomo 16 — 2 genes beta P - cromossomo 11 — 2 genes delta 5 - cromossomo 11 — 4 genes gama Y - cromossomo 11 — 2 genes zeta £ - cromossomo 16 — 2 genes epslon e - cromossomo 11
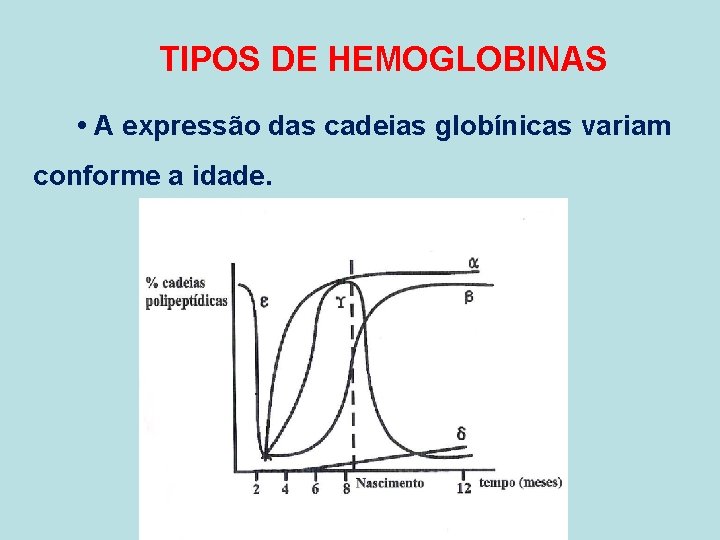
TIPOS DE HEMOGLOBINAS • A expressão das cadeias globínicas variam conforme a idade.

TIPOS DE HEMOGLOBINAS • Hemoglobina embrionária - Gower I (2 zeta e 2 epslon ) Portland (2 zeta e 2 gama) - Gower II ( 2 alfa e 2 epslon) • Hemoglobina fetal — Hb Fetal (2 alfa e 2 gama) – Presente no recém-nascido em grandes quantidades, sendo gr dualmente substituída pela Hb A – até os 6 meses de idade. Grande afinidade com O 2.
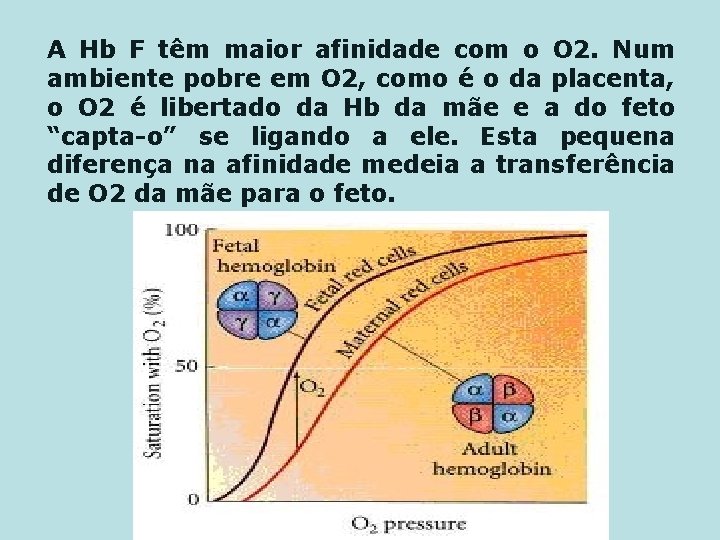
A Hb F têm maior afinidade com o O 2. Num ambiente pobre em O 2, como é o da placenta, o O 2 é libertado da Hb da mãe e a do feto “capta-o” se ligando a ele. Esta pequena diferença na afinidade medeia a transferência de O 2 da mãe para o feto.

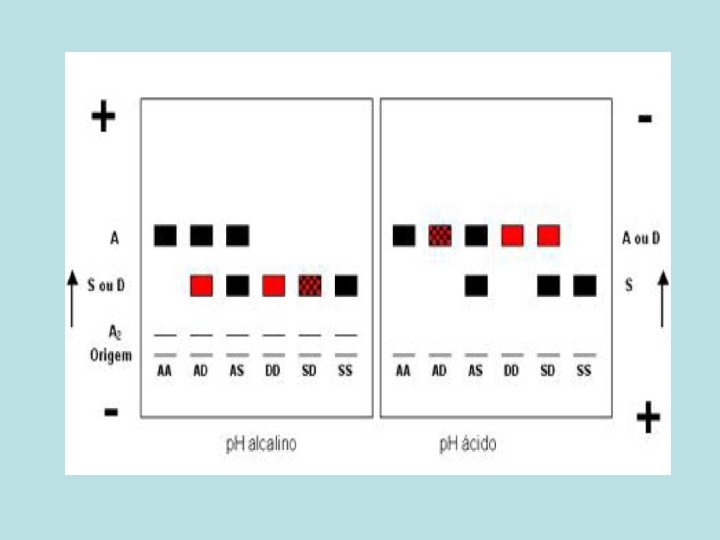
TIPOS DE HEMOGLOBINAS - Adulto - Hb. A 1 (2 alfa e 2 beta) - 95 a 98% - Hb. A 2 (2 alfa e 2 delta) - 2 a 4% - Hb. Fetal (2 alfa e 2 gama) - 0 a 2% • Devido a diferente distribuição dos aa nas cadeias globínicas, estas podem ser identificadas pela diferenga de carga elétrica através da técnica de eletroforese (fita de celulose)

HEMOGLOBINAS VARIANTES • Produzidas por alterações na expressão genética das cadeias globínicas Produção de hemoglobinopatias • Alterações na cadeia alfa: -Hb. M Substituição da histidina pela tirosina na posição 58 -Hb. O Substituição do ácido glutâmico pela lisina na posição 116 -Hb. G (Philadelphia): Substituição da asparagina pela lisina na posição 68
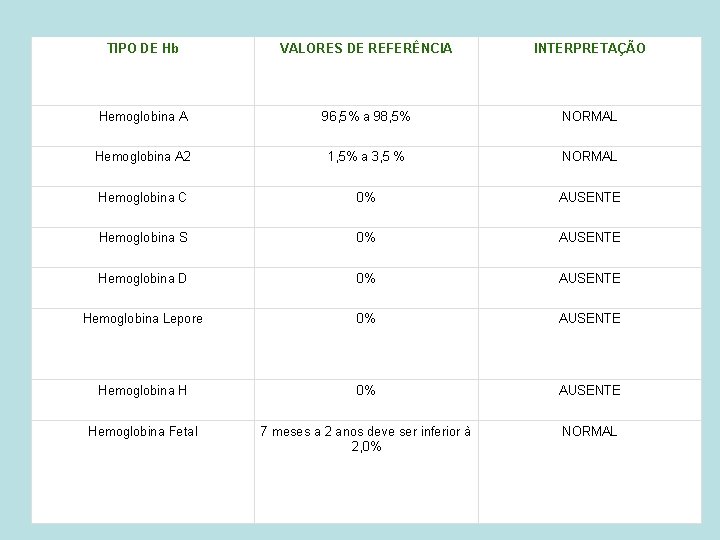
TIPO DE Hb VALORES DE REFERÊNCIA INTERPRETAÇÃO Hemoglobina A 96, 5% a 98, 5% NORMAL Hemoglobina A 2 1, 5% a 3, 5 % NORMAL Hemoglobina C 0% AUSENTE Hemoglobina S 0% AUSENTE Hemoglobina D 0% AUSENTE Hemoglobina Lepore 0% AUSENTE Hemoglobina H 0% AUSENTE Hemoglobina Fetal 7 meses a 2 anos deve ser inferior à 2, 0% NORMAL

HEMOGLOBINAS VARIANTES • Alterações na cadeia beta: Hb C: Substituição ácido glutâmico pela lisina na posição 6 Hb S: Substituição ácido glutâmico pela valina na posição 6 Hb D: Substituição do ácido glutâmico pela glutamina na posição 121 Hb E: Substituiçãodo ácido glutâmico pela lisina na posição 26

INTERPRETAÇÃO DE ELETROFORESE EM FITA DE CELULOSE
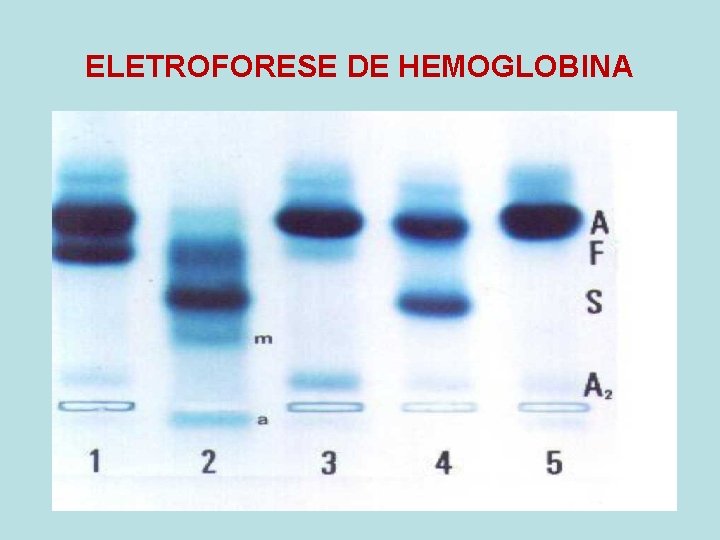
ELETROFORESE DE HEMOGLOBINA

Aparelhos de eletroforese

• Após 120 dias, a hemácia é retirada da circulação pelos macrófagos. • A porção globínica é metabolizada e os aminoácidos são reaproveitados. • • O heme é clivado, convertido a pigmentos biliares e excretado por via urinária e fecal. O ferro é reutilizado.

Estrutura e função da Mioglobina

MIOGLOBINA • A mioglobina é uma hemeproteína presente no coração e no músculo esquelético. • Funciona tanto como um reservatório de oxigênio quanto como um carreador de oxigênio, que aumenta a velocidade de transporte de oxigênio dentro da célula muscular. • A mioglobina consiste em uma única cadeia polipeptídica.

MIOGLOBINA • Apresenta uma cadeia de globina e um grupo heme. • 80% em alfa-hélice. • 8 segmentos separados por dobras e curvas. • PM : 16. 700 daltons. • 153 aa • É abundante nos músculos dos mamíferos marinhos como a baleia e o golfinho.

• Estrutura tridimensional: John Kendrew, 1957. • A estrutura da mioglobina é compacta. • Aa com grupos R apolares no interior da molécula e aa com grupos R polares na parte externa. • Quatro resíduos de Pro ocorrem nas curvas, além de Ser, Thr e Asn. MIOGLOBINA

MIOGLOBINA • O grupo Heme localiza-se numa fenda, cercado por aa apolares, exceto 2 resíduos de Hys. • Hys proximal liga-se diretamente ao ferro. • Hys distal estabiliza a ligação do Heme com o oxigênio. • Mioglobinas de diferentes espécies tem estruturas primárias homólogas e estrutura terciária semelhante. • A mioglobina apresenta alta afinidade pelo oxigênio.

MIOGLOBINA • Apresenta uma cadeia de globina e um grupo heme. • 80% em alfa-hélice. • 8 segmentos separados por dobras e curvas. • PM : 16. 700 daltons. • 153 aa • É abundante nos músculos dos mamíferos marinhos como a baleia e o golfinho.

MIOGLOBINA • Conteúdo de alfa hélice A mioglobina é uma molécula compacta, com aproximadamente 80% de sua cadeia polipeptídica dobrada em oito segmentos de hélice α. Essas regiões αhelicoidais, marcadas de A a H.

MIOGLOBINA • Localização dos resíduos aminoácidos polares e apolares. de • O interior da molécula da mioglobina é constituído quase que completamente por aminoácidos apolares. Eles estão compactados, formando uma estrutura estabilizada por interações hidrofóbicas. Em contraste, os aminoácidos polares carregados estão localizados quase exclusivamente na superfície da molécula, onde podem formar pontes de hidrogênio entre si e com a água.

MIOGLOBINA • Ligação do grupo heme. • O grupo heme da mioglobina se situa em uma fenda na molécula, a qual é revestida por aminoácidos não-polares. Exceções notáveis são dois resíduos de histidina.
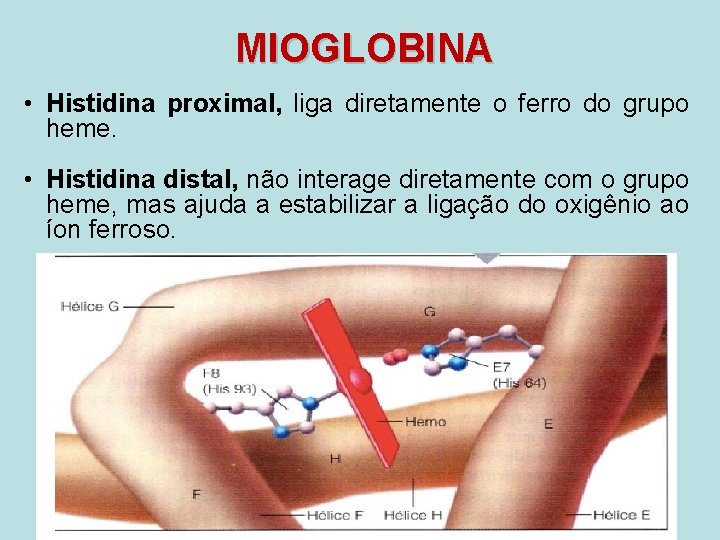
MIOGLOBINA • Histidina proximal, liga diretamente o ferro do grupo heme. • Histidina distal, não interage diretamente com o grupo heme, mas ajuda a estabilizar a ligação do oxigênio ao íon ferroso.
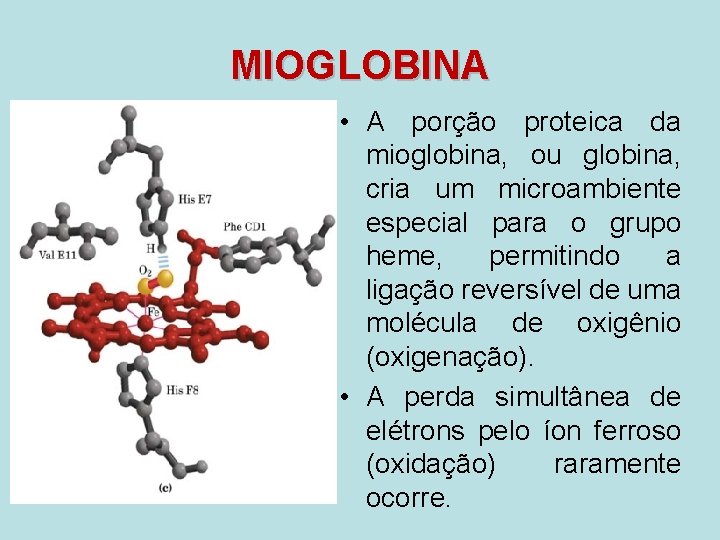
MIOGLOBINA • A porção proteica da mioglobina, ou globina, cria um microambiente especial para o grupo heme, permitindo a ligação reversível de uma molécula de oxigênio (oxigenação). • A perda simultânea de elétrons pelo íon ferroso (oxidação) raramente ocorre.

ESTRUTURA E FUNÇÃO DOS CITOCROMOS

CITOCROMOS • Citocromos são proteínas, geralmente ligadas a uma membrana, que contêm grupos heme e que efetuam o transporte de elétrons. • São encontradas sob a forma de proteínas monoméricas (citocromos c) ou como subunidades de complexos enzimáticos maiores catalisadores de reações redox.
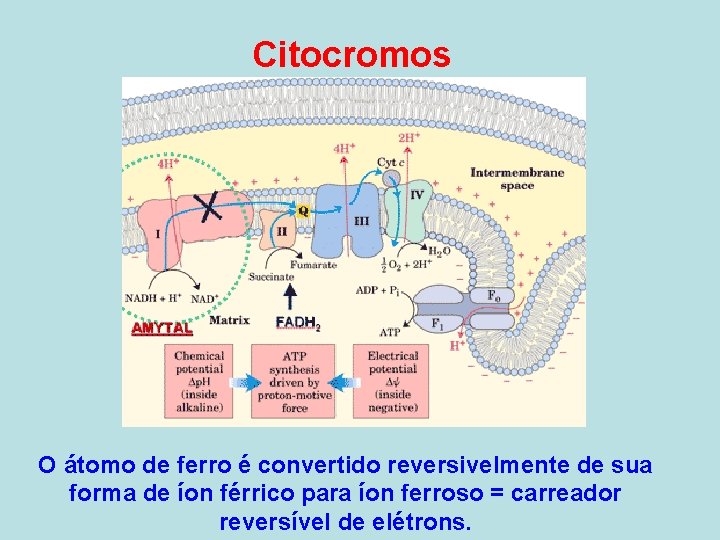
Citocromos O átomo de ferro é convertido reversivelmente de sua forma de íon férrico para íon ferroso = carreador reversível de elétrons.
CITOCROMOS • Podem ser encontrados na membrana interior das mitocôndrias e no retículo endoplasmático de eucariontes, nos cloroplastos de plantas e em bactérias.
- Slides: 58