Propriedades e transformaes da matria 2 3 Transformaes





















- Slides: 30

Propriedades e transformações da matéria 2. 3. Transformações químicas PROFESSORA PAULA MELO SILVA

QUÍMICA 10 REAÇÕES QUÍMICAS E ENERGIA DE LIGAÇÃO REAÇÃO QUÍMICA Corresponde a uma transformação química da qual resulta a formação de novas substâncias. As reações químicas podem ser representadas por equações químicas. 2

QUÍMICA 10 Representação da combustão do hidrogénio. Uma vez que a razão do número de moléculas é igual à razão da quantidade de matéria, a equação química pode ler-se: duas moles de moléculas de hidrogénio no estado gasoso reagem com uma mole de moléculas de oxigénio no estado gasoso dando origem a duas moles de moléculas de água no estado líquido. 3

QUÍMICA 10 Processo endoenergético Implica fornecimento de energia a um sistema para que ocorra uma transformação. Processo exoenergético Implica libertação de energia de um sistema quando ocorre uma transformação. Para que a reação ocorra em sistema isolado é necessário recorrer a um recipiente hermeticamente isolado. Reação química em sistema aberto. 4

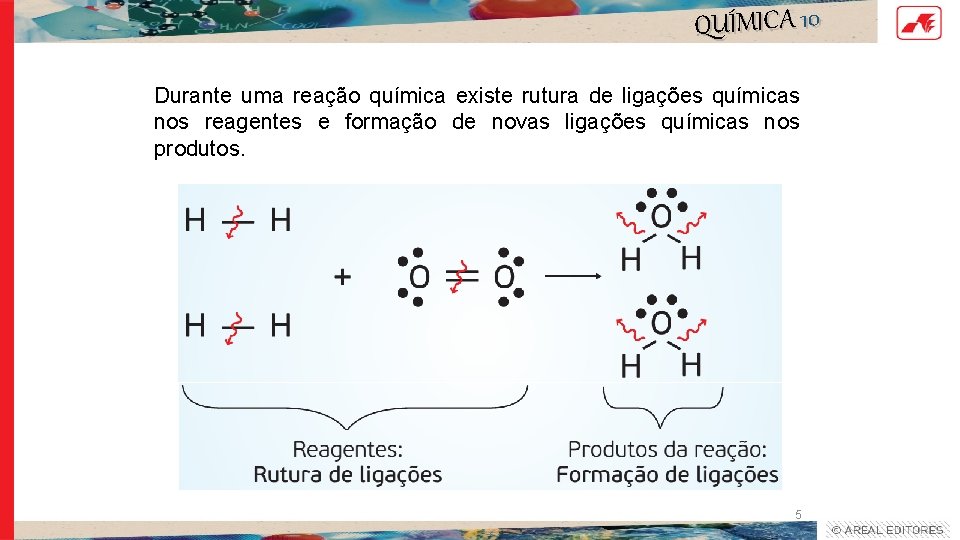
QUÍMICA 10 Durante uma reação química existe rutura de ligações químicas nos reagentes e formação de novas ligações químicas nos produtos. 5

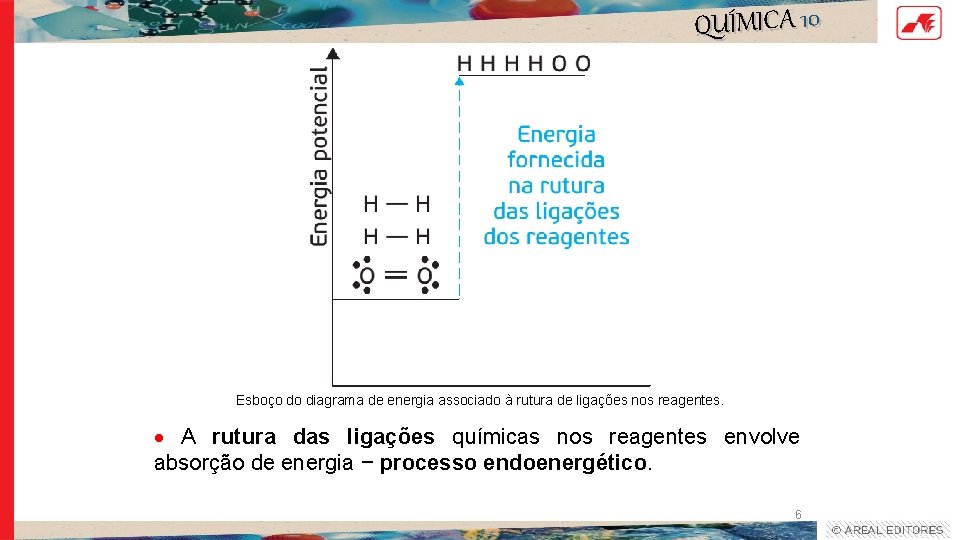
QUÍMICA 10 Esboço do diagrama de energia associado à rutura de ligações nos reagentes. A rutura das ligações químicas nos reagentes envolve absorção de energia − processo endoenergético. 6

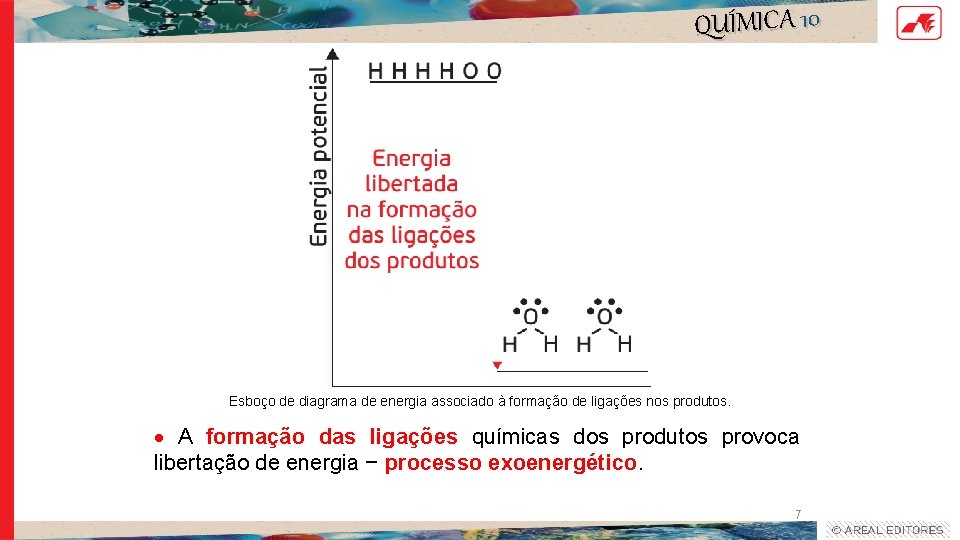
QUÍMICA 10 Esboço de diagrama de energia associado à formação de ligações nos produtos. A formação das ligações químicas dos produtos provoca libertação de energia − processo exoenergético. 7

QUÍMICA 10 REAÇÕES QUÍMICAS ENDOTÉRMICAS E EXOTÉRMICAS Utilizam-se os termos endotérmico e exotérmico para mencionar os processos de transformação química que ocorrem, respetivamente, com absorção e libertação de energia térmica. VARIAÇÃO DE ENTALPIA A variação de energia térmica resultante da troca de calor que se estabelece entre o sistema reacional e a vizinhança, em condições de pressão constante, tem a designação de variação de entalpia, H, de uma reação química. 8

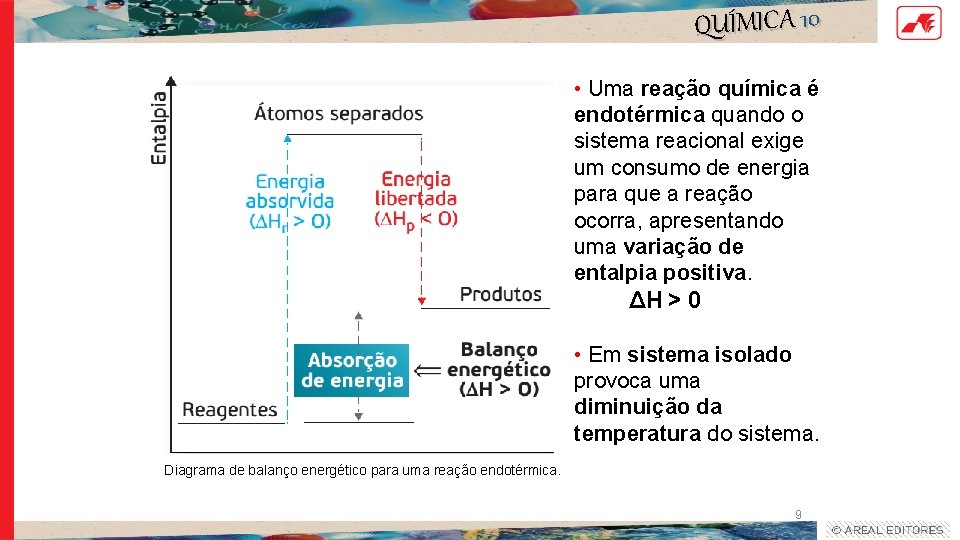
QUÍMICA 10 • Uma reação química é endotérmica quando o sistema reacional exige um consumo de energia para que a reação ocorra, apresentando uma variação de entalpia positiva. ΔH > 0 • Em sistema isolado provoca uma diminuição da temperatura do sistema. Diagrama de balanço energético para uma reação endotérmica. 9

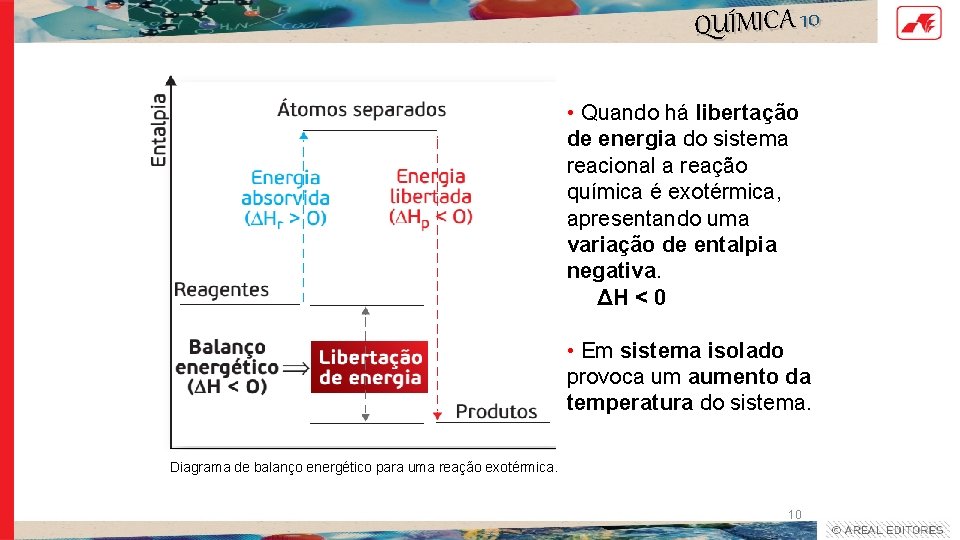
QUÍMICA 10 • Quando há libertação de energia do sistema reacional a reação química é exotérmica, apresentando uma variação de entalpia negativa. ΔH < 0 • Em sistema isolado provoca um aumento da temperatura do sistema. Diagrama de balanço energético para uma reação exotérmica. 10

QUÍMICA 10 EQUAÇÃO TERMOQUÍMICA Equação química que inclui a variação de entalpia da reação em causa. A variação de entalpia da reação é de – 571, 6 k. J, o que significa que há a libertação de 571, 6 k. J de energia quando 2 moles de H 2(g) reagem com 1 mole de O 2(g) para formar 2 moles de H 2 O(ℓ). Como a equação química indica a combustão de 2 moles de H 2(g) ou a formação de 2 moles de H 2 O(ℓ), a variação de entalpia pode também ser expressa por: ΔH = – 285, 8 k. J mol– 1. 11

QUÍMICA 10 ESTIMATIVA DA VARIAÇÃO DE ENTALPIA DE UMA REAÇÃO A variação da entalpia de uma reação química pode ser estimada pela diferença da soma das energias (entalpias) de ligação quebradas nos reagentes (Dreagentes) com a soma das energias (entalpias) de ligação formadas nos produtos (Dprodutos). TABELA I – ENERGIAS (ENTALPIAS) DE LIGAÇÃO EM KJ MOL -1 Ligação C≡O N≡N C≡C C=O C=N C=C S=O Energia de ligação 1072 946 891 837 799 615 611 523 Ligação O=O O–H C–F H–H H – Cℓ C–H N–H C–O Energia de ligação 498 463 439 436 431 414 389 351 Ligação C–C C – Cℓ C–N C ℓ– Cℓ N–O N–N F–F O–O Energia de ligação 348 328 293 242 201 163 159 146 12

QUÍMICA 10 A combustão do etano pode ser traduzida pela equação química: 13

QUÍMICA 10 A variação de entalpia será dada por: 14

QUÍMICA 10 A equação termoquímica para esta combustão será: Nesta reação libertam-se 2798 k. J de energia por cada 2 moles de etano e 7 moles de oxigénio consumidas e por cada 4 moles de dióxido de carbono e 6 moles de água formadas. 15

QUÍMICA 10 REAÇÕES FOTOQUÍMICAS NA ATMOSFERA REAÇÕES FOTOQUÍMICAS Reações químicas desencadeadas por ação da luz. FOTOIONIZAÇÃO Reação química desencadeada pela absorção de um fotão capaz de provocar a ejeção de um eletrão, ou seja, de ionizar a substância. FOTODISSOCIAÇÃO Reação química desencadeada pela absorção de um fotão capaz de provocar a quebra homolítica de uma ligação entre os átomos que constituem a substância. 16

QUÍMICA 10 RADICAL Átomo, molécula ou ião que apresenta um eletrão desemparelhado. É, normalmente, uma espécie química extremamente reativa. Os radicais apresentam as fórmulas ou símbolos químicos com um ponto que representa o eletrão desemparelhado. 17

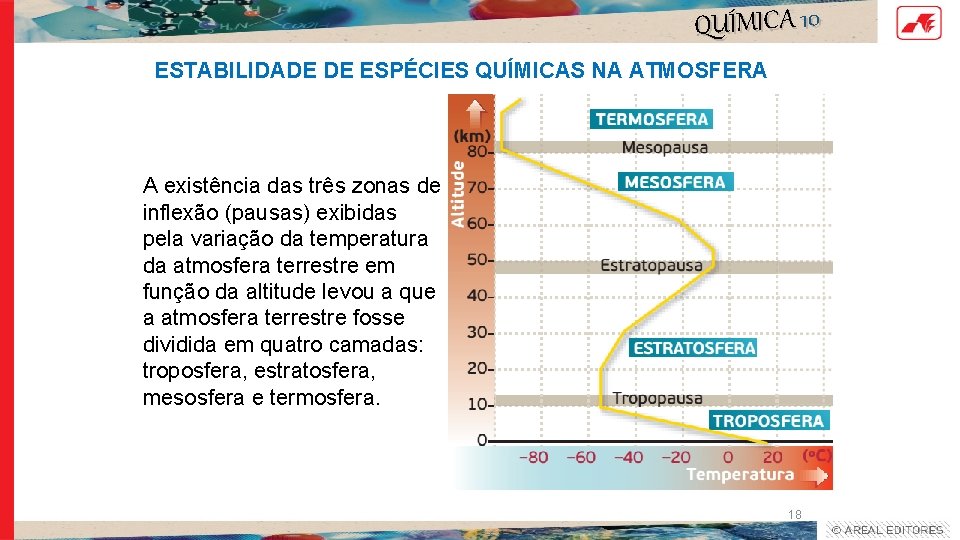
QUÍMICA 10 ESTABILIDADE DE ESPÉCIES QUÍMICAS NA ATMOSFERA A existência das três zonas de inflexão (pausas) exibidas pela variação da temperatura da atmosfera terrestre em função da altitude levou a que a atmosfera terrestre fosse dividida em quatro camadas: troposfera, estratosfera, mesosfera e termosfera. 18

QUÍMICA 10 Os dois principais constituintes da atmosfera são o nitrogénio (N 2) e o oxigénio (O 2). Sujeitas à radiação, estas moléculas podem sofrer fenómenos de: 19

QUÍMICA 10 De acordo com os valores das variações de entalpia de cada uma das reações: • todos os processos são endoenergéticos; • a energia requerida para a ionização das moléculas é consideravelmente superior à que é necessária para as dissociar; • para quebrar a ligação entre os átomos de nitrogénio na molécula de N 2, é envolvida quase o dobro da energia necessária à dissociação dos átomos de oxigénio na molécula de O 2. A ligação da molécula de nitrogénio é bastante mais forte do que a ligação da molécula de oxigénio. Quanto maior for a energia de dissociação de uma molécula diatómica mais forte é a ligação da molécula. 20

QUÍMICA 10 Não ocorre fotoionização nem fotodissociação. Ocorre fotoionização ou fotodissociação, sendo a energia excedente transformada em energia cinética do eletrão removido ou do gás, provocando um aumento da temperatura. 21

QUÍMICA 10 • Existindo radiações muito energéticas, na termosfera, a interação da radiação com a matéria desencadeia reações de fotoionização. • Requerendo, no geral, menos energia as reações de fotodissociação podem desencadear-se também em camadas inferiores da atmosfera. A fotoionização e a fotodissociação das moléculas de N 2 e O 2 são desencadeadas por radiações das gamas mais energéticas do espetro eletromagnético. 22

QUÍMICA 10 A molécula de ozono (O 3) apresenta um papel relevante no controlo da radiação que atinge a superfície da Terra. A fotodissociação da molécula O 3 é desencadeada por radiações ultravioleta. A ligação entre os átomos de oxigénio é mais forte na molécula de oxigénio, O 2, do que na molécula de ozono, O 3. 23

QUÍMICA 10 OZONO ESTRATOSFÉRICO Atendendo aos diferentes efeitos que provocam, é usual dividir a radiação UV em três zonas: 24

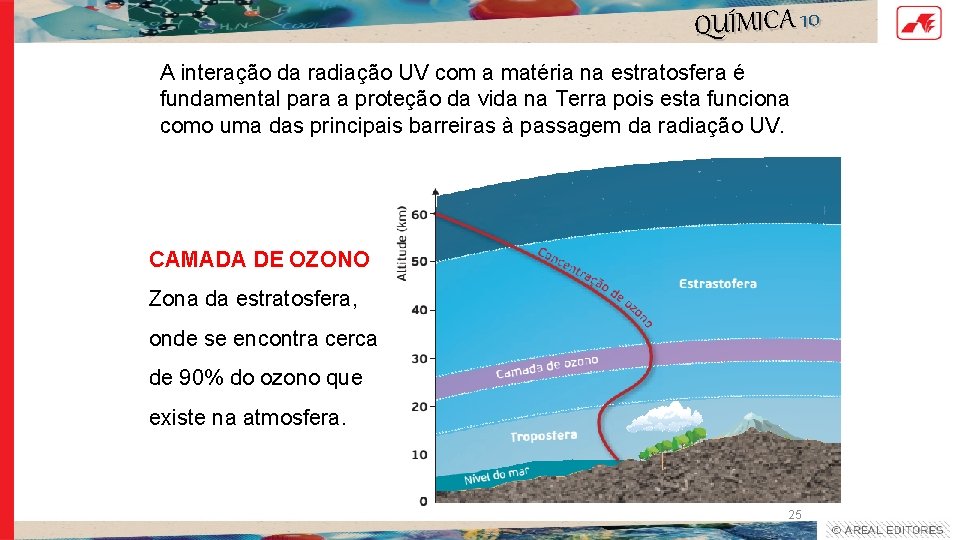
QUÍMICA 10 A interação da radiação UV com a matéria na estratosfera é fundamental para a proteção da vida na Terra pois esta funciona como uma das principais barreiras à passagem da radiação UV. CAMADA DE OZONO Zona da estratosfera, onde se encontra cerca de 90% do ozono que existe na atmosfera. 25

QUÍMICA 10 Foi Sydney Chapman que propôs, em 1930, um mecanismo de formação e decomposição do ozono que explica a existência da camada de ozono. 26

QUÍMICA 10 • As fotodissociações, das moléculas de O 2 e O 3 durante a formação e decomposição do ozono, são as reações fotoquímicas responsáveis pela absorção de uma parte importante da radiação ultravioleta. • A camada de ozono impede, assim, a passagem desta radiação para a superfície terrestre, funcionando como um filtro solar e protegendo a vida na Terra. 27

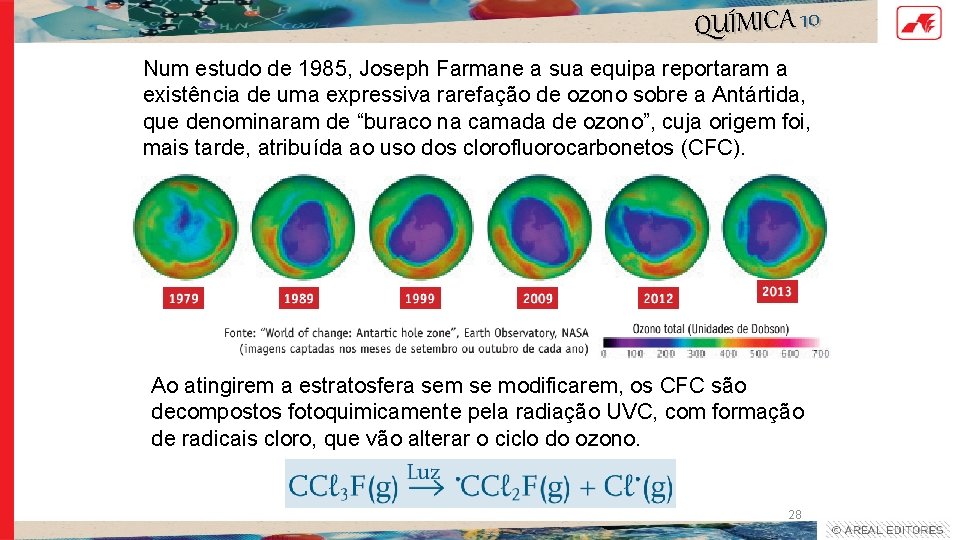
QUÍMICA 10 Num estudo de 1985, Joseph Farmane a sua equipa reportaram a existência de uma expressiva rarefação de ozono sobre a Antártida, que denominaram de “buraco na camada de ozono”, cuja origem foi, mais tarde, atribuída ao uso dos clorofluorocarbonetos (CFC). Ao atingirem a estratosfera sem se modificarem, os CFC são decompostos fotoquimicamente pela radiação UVC, com formação de radicais cloro, que vão alterar o ciclo do ozono. 28

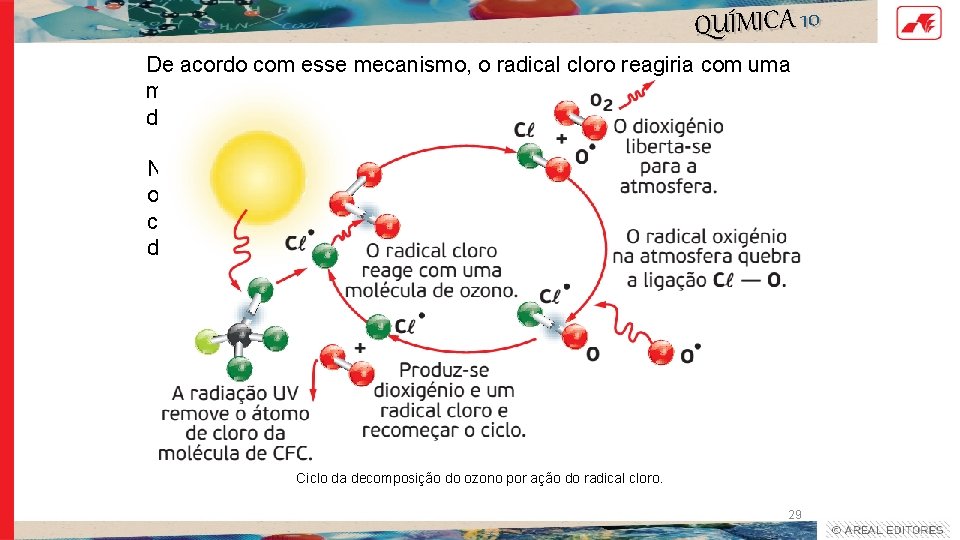
QUÍMICA 10 De acordo com esse mecanismo, o radical cloro reagiria com uma molécula de ozono para formar um radical monóxido de cloro e dioxigénio. Num último passo, o monóxido de cloro reagiria com um radical oxigénio para se estabilizar, formando-se de novo o dioxigénio e o cloro radical, que fica livre novamente para atacar outra molécula de ozono. Ciclo da decomposição do ozono por ação do radical cloro. 29

QUÍMICA 10 O ozono estratosférico é conhecido como “bom ozono”, uma vez que funciona como filtro das radiações UV, protegendo a superfície terrestre da sua ação danosa. O ozono troposférico é conhecido como “mau ozono” quando apresenta uma concentração acima do recomendável, podendo ser considerado um poluente. 30