Profesora Ana Mara Loyola M UNIDAD 1 Profesora




























- Slides: 35

« Profesora Ana María Loyola M.

UNIDAD 1 “ ” Profesora Ana María Loyola M.

¿Qué veremos hoy? 1. Solubilidad

- Reforzar unidades de concentración Físicas y químicas. Reconocer procedimiento para la determinación de la solubilidad.

Disoluciones Sistemas Homogéneos No se observan Menores a -7 10 Ejemplo: Agua salada cm

Disoluciones Formados por: Soluto Se halla en menor proporción. Solvente Se halla en mayor proporción. + Agua salada

Concentración Se refiere a la cantidad de soluto que hay en una determinada cantidad de solvente o solución. FÍSICAS Se expresa en unidades: QUÍMICAS

UNIDADES FÍSICAS UNIDADES QUÍMICAS PORCENTAJE PESO EN PESO %P/P PORCENTAJE PESO EN VOL. %P/V PORCENTAJE VOL. EN VOL. %V/V MOLALIDAD (m) MOLARIDAD (M) NORMALIDAD (N) FRACCIÓN MOLAR (X)

UNIDADES FÍSICAS PORCENTAJE PESO EN PESO %P/P “Masa en gramos de soluto por cada 100 gramos de solución. ” % P/P = Masa de soluto (g) 100 g de solución Por ejemplo: Na (OH) al 10% contendrá 10 gramos del hidróxido por cada 100 gramos de solución.

UNIDADES FÍSICAS PORCENTAJE PESO EN VOLUMEN %P/V “Masa en gramos de soluto por cada 100 m. L de solución. ” % P/V = Masa de soluto (g) 100 m. L de solución Por ejemplo: Ca. Cl 2 al 5% P/V contendrá 5 gramos de la sal por cada 100 m. L de solución.

UNIDADES FÍSICAS PORCENTAJE VOL EN VOL %V/V “Volumen de soluto por cada 100 m. L de solución. ” % V/V = Volumen de soluto (m. L) 100 m. L de solución Por ejemplo: Etanol al 25% V/V contendrá 25 m. L de etanol por cada 100 m. L de solución.

UNIDADES QUÍMICAS MOLALIDAD (m) “Número de moles de soluto por cada kilogramos de solvente. ” m = moles de soluto 1000 g de solvente

UNIDADES QUÍMICAS MOLARIDAD (M) “Número de moles de soluto por cada litro de solución. ” M = moles de soluto 1000 m. L de solución Por ejemplo: Na. Cl 2 M contendrá 2 moles de Na. Cl por litro de solución.

UNIDADES QUÍMICAS NORMALIDAD (N) “Número de equivalentes-gramo de soluto por cada litro de solución. ” N = nº eq-g de soluto 1000 m. L de solución Por ejemplo: HCl 2 N contendrá 2 equivalentes-gramo de HCl por litro de solución.

UNIDADES QUÍMICAS FRACCIÓN MOLAR (X) “Número de moles del componente A por la suma del número de moles total de la solución. ” X = moles de A moles totales

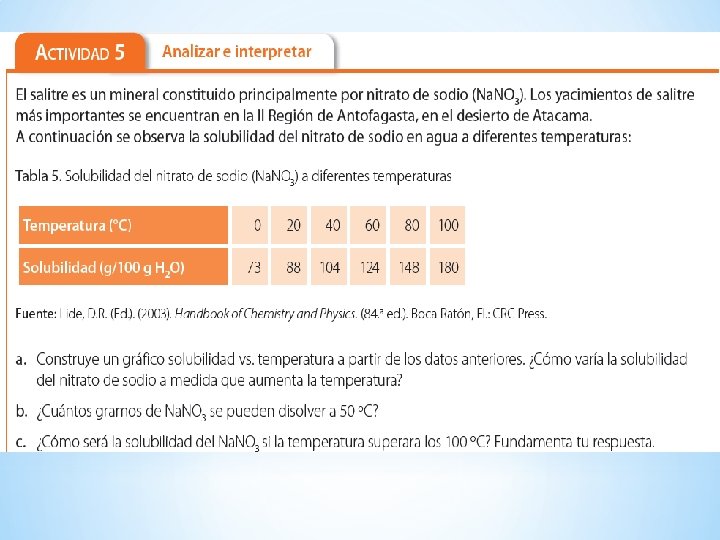
SOLUBILIDAD Es la cantidad máxima de soluto que puede disolverse en una cantidad de solvente, a una Temperatura determinada La solución que se obtiene en estas condiciones se denomina solución saturada La solubilidad se expresa en general en gramos de soluto por 100 gramos de disolvente. S = (m soluto / m solvente) x 100

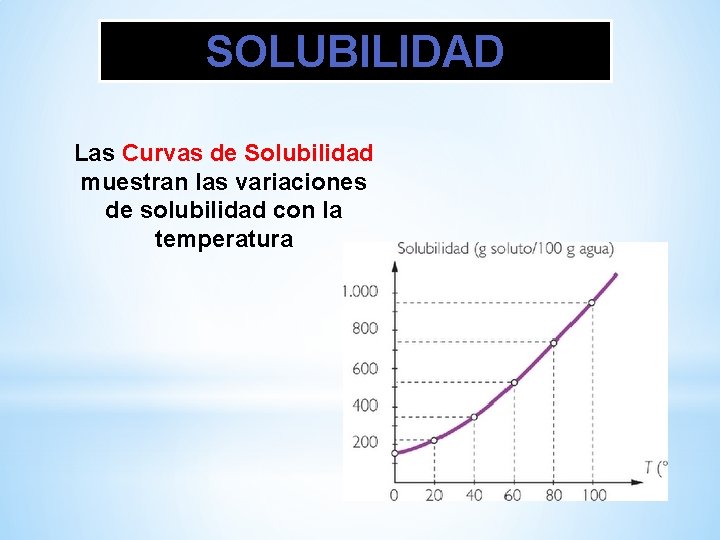
SOLUBILIDAD Las Curvas de Solubilidad muestran las variaciones de solubilidad con la temperatura

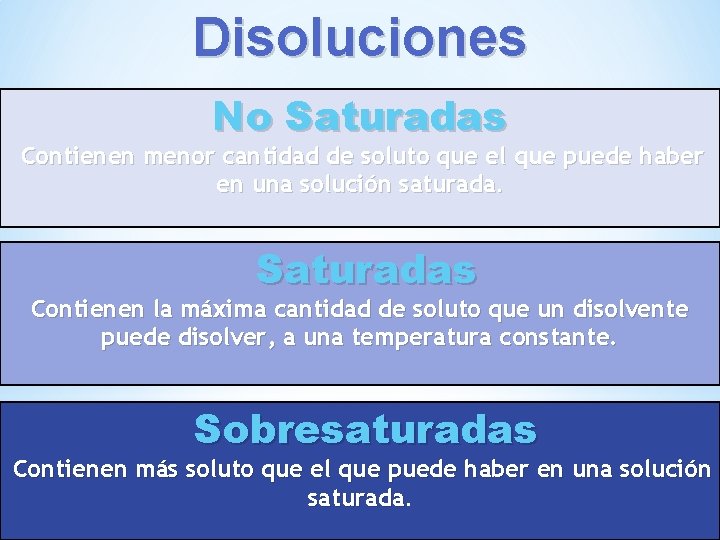
Disoluciones No Saturadas Contienen menor cantidad de soluto que el que puede haber en una solución saturada. Saturadas Contienen la máxima cantidad de soluto que un disolvente puede disolver, a una temperatura constante. Sobresaturadas Contienen más soluto que el que puede haber en una solución saturada.

SOLUBILIDAD Sólido en líquido Líquido en líquido Gas en líquido

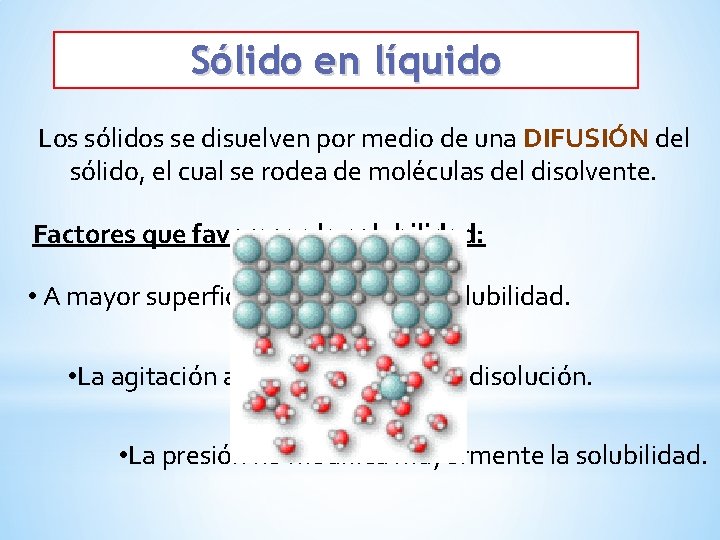
Sólido en líquido Los sólidos se disuelven por medio de una DIFUSIÓN del sólido, el cual se rodea de moléculas del disolvente. Factores que favorecen la solubilidad: • A mayor superficie del sólido la solubilidad. • La agitación acelera el proceso de disolución. • La presión no modifica mayormente la solubilidad.

Sólido en líquido Factores que favorecen la solubilidad: • Temperatura (coeficiente térmico de solubilidad). a) Si durante la disolución de un compuesto se absorbe calor Proceso endotérmico En estos sistemas al la temperatura la solubilidad.

Sólido en líquido Factores que favorecen la solubilidad: • Temperatura (coeficiente térmico de solubilidad). b) Si durante la disolución de un compuesto se desprende calor Proceso exotérmico En estos sistemas al la temperatura la solubilidad.

Líquido en líquido Pueden ocurrir tres casos: • Que sean completamente miscibles ( no existe punto de saturación). • Que sean parcialmente miscibles. (se disuelven hasta un cierto grado y ocurre la saturación). agua + éter etílico. • Que sean inmiscibles.

Líquido en líquido Factores que favorecen la solubilidad: • T : Al variar la T, varía la solubilidad en diferentes direcciones en líquidos parcialmente miscibles. • P : Al variar la P no se modifica la solubilidad.

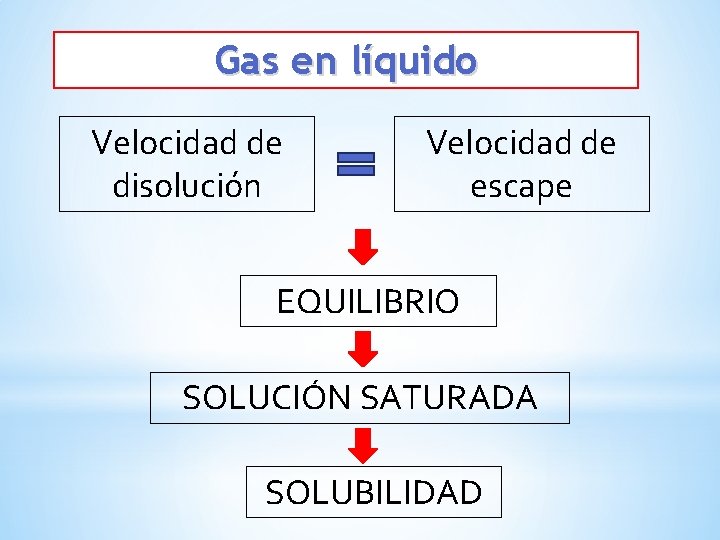
Gas en líquido Velocidad de disolución Velocidad de escape EQUILIBRIO SOLUCIÓN SATURADA SOLUBILIDAD

Gas en líquido Factores que favorecen la solubilidad: • T: Al la temperatura la solubilidad. “ Debido a que aumenta la energía cinética de las moléculas del gas disueltas y esto favorece que se escapen del líquido. ” • P: Al P la solubilidad. “ Debido a que aumenta el número de colisiones del gas con la superficie y aumenta la velocidad de captura. ”

Temperatura y efecto en la solubilidad en un gas. El gas escapa del liquido y disminuye la solubilidad

Presión y efecto en la solubilidad en un gas La solubilidad del soluto aumenta proporcionalmenteal incremento de la presión aplicada. Mayor presión, con tapa Menor presión, sin tapa

Gas en líquido LEY DE HENRY “LA SOLUBILIDAD DE UN GAS DISUELTO EN UN LÍQUIDO ES PROPORCIONAL A LA PRESIÓN PARCIAL DEL GAS SOBRE EL LÍQUIDO. ” Sg k P


ACTIVIDAD: 1. - ¿Qué es la solubilidad? 2. - ¿Qué es el punto se saturación? 3. - Nombra y explica los factores que afectan la solubilidad? 4. - ¿Qué dice la Ley de Henry?


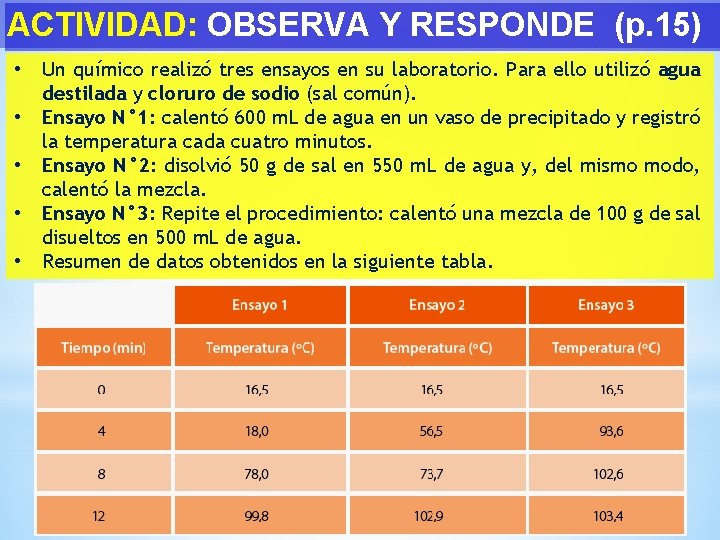
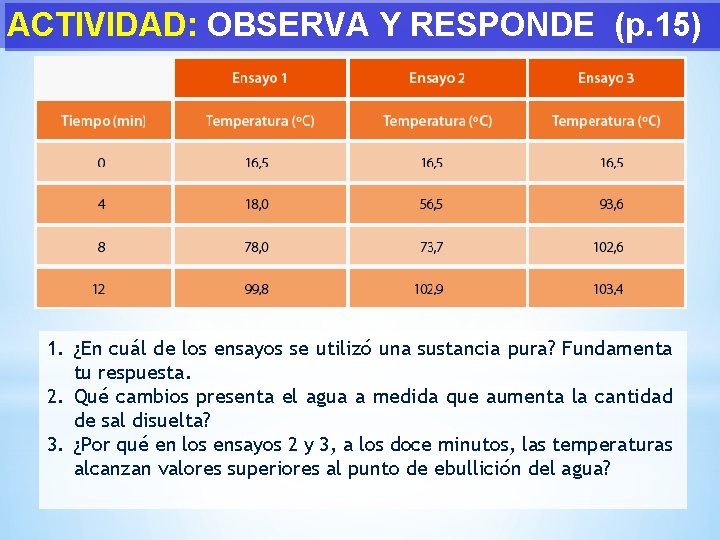
ACTIVIDAD: OBSERVA Y RESPONDE (p. 15) • • • Un químico realizó tres ensayos en su laboratorio. Para ello utilizó agua destilada y cloruro de sodio (sal común). Ensayo N° 1: calentó 600 m. L de agua en un vaso de precipitado y registró la temperatura cada cuatro minutos. Ensayo N° 2: disolvió 50 g de sal en 550 m. L de agua y, del mismo modo, calentó la mezcla. Ensayo N° 3: Repite el procedimiento: calentó una mezcla de 100 g de sal disueltos en 500 m. L de agua. Resumen de datos obtenidos en la siguiente tabla.

ACTIVIDAD: OBSERVA Y RESPONDE (p. 15) 1. ¿En cuál de los ensayos se utilizó una sustancia pura? Fundamenta tu respuesta. 2. Qué cambios presenta el agua a medida que aumenta la cantidad de sal disuelta? 3. ¿Por qué en los ensayos 2 y 3, a los doce minutos, las temperaturas alcanzan valores superiores al punto de ebullición del agua?

* ¿Qué vimos hoy?
 Ana mara pelada
Ana mara pelada Mara vergara
Mara vergara Unidad decena centena unidad de mil para niños
Unidad decena centena unidad de mil para niños Loyola maryland core curriculum
Loyola maryland core curriculum Iglesia san ignacio de loyola
Iglesia san ignacio de loyola Michael s kelly loyola
Michael s kelly loyola Webadvisor loyola
Webadvisor loyola My lumen loyola
My lumen loyola Loyola university chicago nursing
Loyola university chicago nursing Loyola maryland core curriculum
Loyola maryland core curriculum Loyola
Loyola Orden religiosa fundada por san ignacio de loyola
Orden religiosa fundada por san ignacio de loyola Poznati hrvatski isusovci
Poznati hrvatski isusovci Loyola catholic secondary school
Loyola catholic secondary school Loyola maryland aasc
Loyola maryland aasc Cecilia loyola
Cecilia loyola Loyola law symplicity
Loyola law symplicity Amar y servir san ignacio
Amar y servir san ignacio Loyola
Loyola Es el texto informativo por excelencia
Es el texto informativo por excelencia Listo profesora
Listo profesora Verbo de 9 letras
Verbo de 9 letras La profesora marta en el proceso de desarrollo
La profesora marta en el proceso de desarrollo Mary graham
Mary graham Oraciones con pereza
Oraciones con pereza Profesora ma
Profesora ma Profesora marlene
Profesora marlene La profesora patricia inicia las actividades
La profesora patricia inicia las actividades Profesora xn
Profesora xn Presente profesora
Presente profesora Silaba tonica en mariposa
Silaba tonica en mariposa Profesora de lenguaje animada
Profesora de lenguaje animada Presente profesora
Presente profesora Que son las ondas
Que son las ondas Mama elena como agua para chocolate
Mama elena como agua para chocolate Plurisignificativo
Plurisignificativo