Profesor Ienciu Monica coala Gimnazial Mihai Eminescu Arad












![Carbonati Malachitul : Cu 2[ CO 3 ] [ OH ]2 sau Cu. CO Carbonati Malachitul : Cu 2[ CO 3 ] [ OH ]2 sau Cu. CO](https://slidetodoc.com/presentation_image_h/8c0cddc4dad317cfc2b4cdc24bdd6635/image-13.jpg)









- Slides: 28

Profesor, Ienciu Monica Școala Gimnazială ”Mihai Eminescu„ Arad

STUDIUL CUPRULUI ÎN ÎNVĂȚĂM NTUL PREUNIVERSITAR

Considerațiile teoretice ale cuprului: 1. 2. 3. 4. 5. 6. 7. Scurt istoric Stare naturală Proprietățile fizice, mecanice și tehnologice ale cuprului Proprietățile chimice Compușii cuprului Obținerea și utilizările cuprului Întrebuințările cuprului

Tipuri de minerale și minereuri Cuprul nativ In stare nativa, cuprul este de regula aproape chimic pur. Poate contine pana la 2, 5% Fe, alteori argint nativ sub forma de incluziuni fine, mai rar aur, pana 2 – 3 % , cu care formeaza solutii solide(cupru aurifer), bismut, mercur, fier , arsen, etc. Cristalizeaza in sistem cubit clasa hexachisoctaedrica. Reteaua sa cristalina de cub cu fete centrate avand atomii dispusi in varfurile cubului si in mijlocul fiecarei fete elementare, reprezinta sistemul de cea mai compacta asezare a atomilor.

Sulfuri Denumirea deriva de la cuvantul grecesc , , chalcos’’care inseamna cupru. Contine teoretic 79, 8% Cu ; Cristalizeaza in sistem rombic insa este enantiotropa, la temperaturi mari de 91 o. C trece in modificatia cubica si invers. Apare rareori in stare cristalizata, sub forma de foite groase sau stalpi scurti. De regula constituie mase compacte fin granulare , mici incluziuni sau pseudomorfoze dupa bronit, calcopirita, uneori blenda , galena , covelina, pirita, s. a.

Calcopirita : Cu. Fe. S 2 Este mineralul de cupru cel mai comun. Denumirea sa provine din greceste, , , Chalcos’’ – cupru si , , piros’’ – foc . Contine teoretic : 34, 57% Cu ; 30, 54% Fe ; 34, 9% S si mici cantitati de argint, aur, etc. Cristalizeaza in sistem tetragonal, clasa tetragonal – scalenoedrica.

Bornitul : Cu 5 Fe. S 4 sau Cu 2 S ∙ (Fe, Cu) ∙ S Formeaza solutii solide limitate cu calcopirita , de care se separa prin racire. Teoretic , are 63, 3 % Cu ; 11, 2% Fe si 25, 5% S; insa compozitia sa variaza in limite foarte largi , deoarece contine sub forma de solutii calcozina , calcoprita si uneori incluziuni de argint. Cristalizeaza in sistemul cubic , clasa hexachisoctaedrica.

Covelina : Cu. S sau Cu 2 S∙Cu 2+S 2 Denumirea ei provine de la numele mineralogului italian Covelli. Contine teoretic 66, 5% Cu si 33, 5% S , insa in mod practic in constitutia covelinei mai apar fierul, rareori seleniul , argintul si plumbul ; Cristalizeaza in sistem hexagonal, clasa dihexagonal – bipiramidala (prezentata in fig. 5. de mai jos ). In stare cristalina nu apare decat rareori sub forma unor lamele mici si subtiri. Are o retea cristalina hexagonala stratificata care potrivit unor studii röentgenografice recente, este mult mai complicata decat s a presupus.

Sulfosaruri Tetraendritul , Cu 12 Sb 4 S 13 sau 3 Cu 2 S : Sb 2 S 3 Tennatitul , Cu 12 As 4 S 13 sau 3 Cu 2 S: As 2 S 3 Aceste minerale au numeroase proprietati fizce comune. In alcatuirea lor chimica apar si : Cu. . 22 – 53% Hg. . 0 – 17, 0% As. . . . 0 – 20, 0% Ag. . . 0 – 18% Ni. . 0 – 3, 5 % Sb. . . . 0 – 29, 2% Zn. . . 0 – 12% Co. . 0 – 4, 2% Be. . . . 0 – 4, 5% Fe. . . 0 – 13% Mn. . . 0 – 1, 5% S. . . 20, 6 – 29, 1%

Enargitul : Cu 3 As. S 4 Compozitia sa chimica teoretica este : 48, 3% Cu ; 19, 1 % As ; 32, 6% S. Mai contine stibiu(pana la 6, 5 %) fier (pana la 5, 7%) si cantitati mici de plumb, zinc si argint sub forma de incluziuni. Cristalizeaza in sistem rombic, clasa rombo – bipiramidala.

Bournonitul : Cu. Pb. S 3 sau 2 Pb. S ∙ Cu. S ∙ Sb 2 S 3 Contine teoretic 13% Cu ; 42, 5% Pb ; 24, 7% Sb ; 19, 8 % S, alaturi de care mai apar fierul (pana la 5%) , argintul (pana la 3%) , urme de zinc si mangan. Este asemanator tetraedritului insa are un luciu mult mai puternic ; Cristalizeaza in sistemul rombic , clasa rombo bipiramidala.

Oxizi Cupritul : Cu 2 O Denumirea acestui mineral deriva din latinescul , , cuprum’’ – cupru. Compozitia chimica teoretica : 88, 8% Cu si 11, 2 % O insa contine sub forma de impuritati cupru nativ si uneori Fe 2 O 3 , Si. O 2 si H 2 O in special in varietatile criptocristaline. Cristalizeaza in sistem cubic , clasa pentagon – trioctaedrica.
![Carbonati Malachitul Cu 2 CO 3 OH 2 sau Cu CO Carbonati Malachitul : Cu 2[ CO 3 ] [ OH ]2 sau Cu. CO](https://slidetodoc.com/presentation_image_h/8c0cddc4dad317cfc2b4cdc24bdd6635/image-13.jpg)
Carbonati Malachitul : Cu 2[ CO 3 ] [ OH ]2 sau Cu. CO 3 ∙ Cu(OH)2 Se pare ca numele acestui mineral deriva din cuvantul grecesc , , mahale ’’ care inseamna nalba , probabil datorita asemanarii dintre culoarea sa si cea a plantei respective. Conpozitia chimica , teoretica : 71, 99% Cu. O ; 19, 9 % CO 2 si 8, 2% H 2 O ; Mai poate contine cantitati mici de Ca. O , Fe 2 O 3 , Si. O 2 sub forma de incluziuni mecanice sau adsorbtii. Malachitul cristalizeaza in sistemul monoclin , clasa prismatica (vezi fig. 10. de mai jos), insa cristalele cu habitus prismatic sunt foarte rare. De regula apare sub forma de mase stalactitice , cu structura fibroasa , radiara mase reniforme , cu structura concentrica zonara si mase pamantoase.

Azuritul : Cu 3 (CO 3)2 (OH)2 sau 2 Cu. CO 3 ∙ Cu(OH)2 Denumirea acestui mineral este legata de culoarea sa albastra. Contine teoretic 69, 2 % Cu. O , 25, 6 % CO 2 si 5, 2% H 2 O. Mineralul este de regula curat, rareori contine impuritati , cristale fine de aur nativ. Cristalizeaza in sistemul monoclin clasa prismatica ( fig. 11. de mai jos ). Cristalele au forme aciculare , prismatice , scurte sau tabulare.

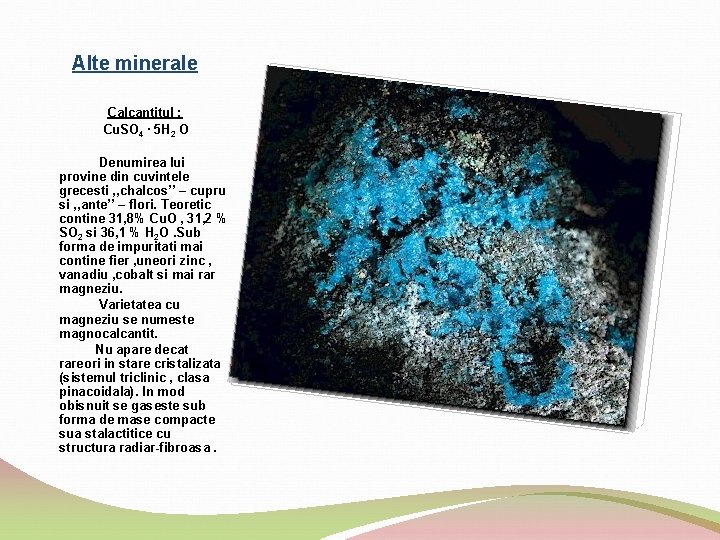
Alte minerale Calcantitul : Cu. SO 4 ∙ 5 H 2 O Denumirea lui provine din cuvintele grecesti , , chalcos’’ – cupru si , , ante’’ – flori. Teoretic contine 31, 8% Cu. O , 31, 2 % SO 2 si 36, 1 % H 2 O. Sub forma de impuritati mai contine fier , uneori zinc , vanadiu , cobalt si mai rar magneziu. Varietatea cu magneziu se numeste magnocalcantit. Nu apare decat rareori in stare cristalizata (sistemul triclinic , clasa pinacoidala). In mod obisnuit se gaseste sub forma de mase compacte sua stalactitice cu structura radiar fibroasa.

Brochantitul : Cu. SO 4 ∙ 3 Cu(OH)2 ; Contine teoretic 70, 3% Cu. O ; 17, 7% SO 3 ; 12, 0% H 2 O ; Se formeaza de regula in zona de oxidare a zacamintelor de cupru . in conditii aride. , deseori in concrestere cu malachitul si antleritul Cristalizeaza in sistem ortorombic.

Turcoaza : Cu. Al 6(PO 4)4 (OH)8 5 H 2 O Sinonim cu o denumire mai veche kallait si cu o varietate cu continut de fier denumita rashleighit. Continuturi teoretice : 9, 5% Cu ; 38, 8 % Al 2 O 3 ; 34, 12% P 2 O 3 ; 19, 47 % H 2 O ; Cristalizeaza in sistemul triclinic ; clasa pinacoidala , insa cel mai frecvent apare ca mase criptocristaline , reniforme sau sub forme de cruste, vinisoare si concentratii de forme neregulate.

PROPRIETĂŢILE FIZICE, MECANICE ŞI TEHNOLOGICE ALE CUPRULUI Proprietatile fizice : Numarul atomic : 29 Structura electronica : electroni 1 s 2 2 s 2 p 6 3 s 2 p 6 d 10 4 s 1 total 29ē stratul K L M N Greutatea atomica: 63, 54 Izotopi stabili : 2 , cu masa atomica 63 sau 65 Izotopi radioactivi : 9 , cu masele 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68 Volumul atomic : 7, 10 cm 3/atom gram ; Greutatea specifica( la 20 o. C): 8, 9592 g/cm 3 Duritatea(pe scara Mohs) : 3, 0 Temperatura de topire (la ρ= 1 atm) : 1083 + 0, 1 o. C Temperatura de fierbere (la ρ=1 atm) : 2595 o. C Coeficientul de dilatare liniara : Intre 20 si 100 o. C. . (16, 47 ∙ 10 6/grd) Intre 0 si 300 o. C. . : L T = L 0 [(1+ 16, 25 T + 0, 00483 T 2 ) X 10 6] Contractia volumetrica la solidificare : 4, 92% precum cuprul lipsit de oxigen si cuprul dezoxidat ;

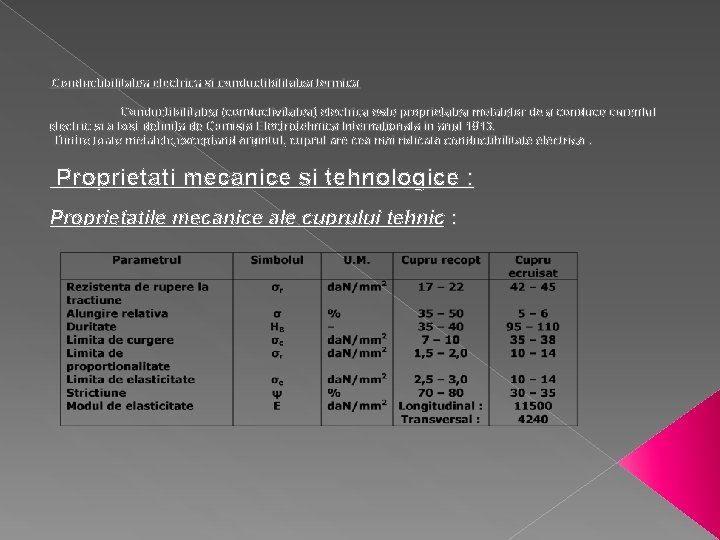
Conductibilitatea electrica si conductibilitatea termica Conductibilitatea (conductivitatea) electrica este proprietatea metalelor de a conduce curentul electric si a fost definita de Comisia Electrotehnica Internationala in anul 1913. Dintre toate metalele, exceptand argintul, cuprul are cea mai ridicata conductibilitate electrica. Proprietati mecanice si tehnologice : Proprietatile mecanice ale cuprului tehnic :

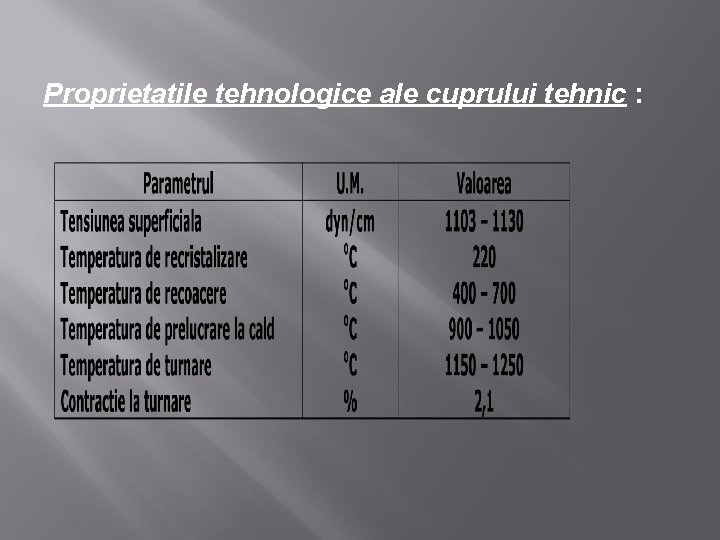
Proprietatile tehnologice ale cuprului tehnic :

4) PROPRIETATILE CHIMICE ALE CUPRULUI 4. 1) Rezistenta la coroziune Comportarea cuprului, metal din grupa IB fata de agentii atmosferici : in aer uscat , la temperatura camerei Cu nu se combina cu oxigenul din aer fiind stabil; in aer umed , la temperatura camerei Cu se acopera cu un strat de Cu 2 O care il apara de oxidiare in profunzime ; in aer umed, la temperatura camerei in prezenta de CO 2 sau SO 2 Cu se acopera cu o pelicula verzuie de , , cocleala’’ de fapt un carbonat bazic : Cu. CO 3 ∙ Cu(OH)2 sau un sulfat bazic : Cu. SO 4 ∙ 3 Cu(OH)2 ; incalzite in aer Cu se oxideaza relativ usor la Cu. O negru, la temp. cuprinse intre 200 – 375 o. C, iar la temp. mai mari de 900 o. C, la Cu 2 O rosu ; cu vaporii de apa Cu nu descompune apa nici la temperaturi ridicate; 4. 2) Reactia cu elementele nemetalice Comportarea Cu, metal in grupa I B in reactia cu nemetalele: Ø Cu hidrogenul nu reactioneaza direct si nici la cald ! Ø Cu oxigenul reactioneaza si formeaza : la temp. mai mici: Cu + ½ O 2 →Cu. O la temp. mai mari: 4 Cu + O 2 → 2 Cu 2 O Ø Cu halogenii reactioneaza cu usurinta, chiar la rece = > Cu X 2 Ø Cu fluorul nu reactioneaza numai la suprafata formand un strat protector de Cu. F 2 ; cu iodul se combina mai greu generand indeosebi Cu. I ; cu clorul deasemeni formeaza Cu. Cl 2 ; Ø Cu carbonul, siliciul, azotul si borul nu reactioneaza direct si nici la cald Ø Cu sulful , seleniul si cu telurul Reactioneaza usor, direct , la incalzire : => Cu. S, Cu. Se, Cu. Te ;

4. 3) Reactia cuprului cu acizii 3 Cuo + 8 HNO 3 (dil) → 3 Cu. II ( NO 3)2 + 2 NO + 4 H 2 O …………Acidul azotic(concentrat) pasiveaza cuprul Cuo + 2 H 2 SO 4 (conc. ) → Cu. II SO 4 + SO 2 + 2 H 2 O ……………. . Acidul sulfuric conc. ataca incet Cu la rece, mult mai repede la cald ! 2 Cuo + 4 HCl(conc) + ½ O 2 → 2 H[Cu. ICl 2] + H 2 O Cuo + 2 HCl(conc) + ½ O 2 → Cu. II Cl 2 + H 2 O ……………. Acidul clorhidric conc. reactioneaza cu Cu in prezenta oxigenului din aer care oxideaza Cu(I)sau Cu(II), formandu-se halogenocomplex la oxidarea metalului monovalent , solubil spre deosebire de halogenuri; Cuo + 2 HCl (conc. ) → H[Cu. ICl 2 ] + ½ H 2 ↑ Cand concentratia ionilor cuprosi scade semnificativ prin formarea anionului complex stabil, potentialul Cu devine negativ fata de cel al H 2 si reactia are loc cu degajare de hidrogen molecular; 2 Cuo + 2 CH 3 COOH(conc. ) + O 2 → Cu. II(CH 3 COO)2∙ Cu. II(OH)2 ………. . Acidul acetic conc. ataca cuprul in prezenta oxigenului, formad un acetat bazic de Cu(II) solubil; 4. 4) Reactia cuprului cu bazele : Cuprul , argintul si aurul nu sunt atacate de baze tari , nici in solutie concentrata nici in topitura. 5) COMPUSII CUPRULUI : 5. 1) Compusii cuprului la S. O. = +1 5. 1. 1) Oxidul cupros : ( Cu 2 O ) 5. 1. 2) Halogenuri cuproase (I) : Cu. X 5. 1. 3) Saruri cuproase (I) : cu oxoacizii: 5. 2) Compusii cuprului cu S. O. = +2 5. 2. 1) Oxidul cupric : Cu. IIO 5. 2. 2) Hidroxidul cupric, Cu. II(OH)2 5. 2. 3) Dihalogenurile cuprice anhidre si hidratate , Cun. X 2 cu X=F, Cl, Br, I, atat in formula anhidra cat si hidratata ; 5. 2. 4) Sarurile anhidre si hidratate ale cuprului(II ) cu oxiacizii

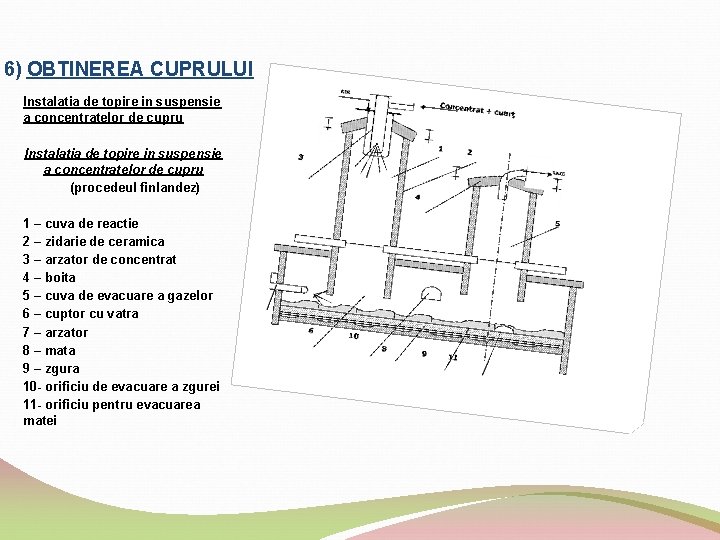
6) OBTINEREA CUPRULUI Instalatia de topire in suspensie a concentratelor de cupru (procedeul finlandez) 1 – cuva de reactie 2 – zidarie de ceramica 3 – arzator de concentrat 4 – boita 5 – cuva de evacuare a gazelor 6 – cuptor cu vatra 7 – arzator 8 – mata 9 – zgura 10 orificiu de evacuare a zgurei 11 orificiu pentru evacuarea matei

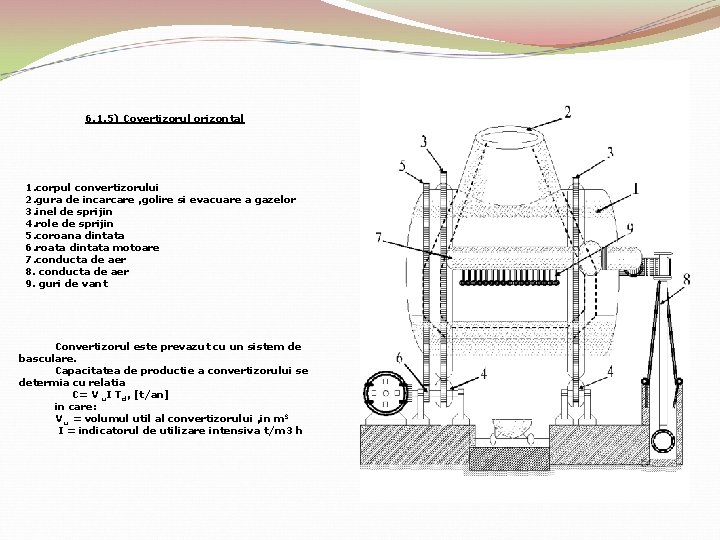
6. 1. 5) Covertizorul orizontal 1. corpul convertizorului 2. gura de incarcare , golire si evacuare a gazelor 3. inel de sprijin 4. role de sprijin 5. coroana dintata 6. roata dintata motoare 7. conducta de aer 8. conducta de aer 9. guri de vant Convertizorul este prevazut cu un sistem de basculare. Capacitatea de productie a convertizorului se determia cu relatia C= V u. I Td, [t/an] in care: V u = volumul util al convertizorului , in m 3 I = indicatorul de utilizare intensiva t/m 3 h

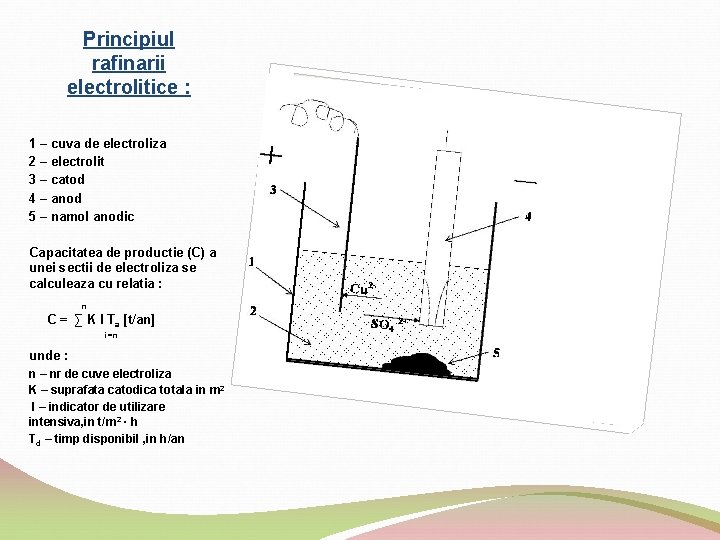
Principiul rafinarii electrolitice : 1 – cuva de electroliza 2 – electrolit 3 – catod 4 – anod 5 – namol anodic Capacitatea de productie (C) a unei sectii de electroliza se calculeaza cu relatia : n C = ∑ K I Ta [t/an] i=n unde : n – nr de cuve electroliza K – suprafata catodica totala in m 2 I – indicator de utilizare intensiva, in t/m 2 ∙ h Td – timp disponibil , in h/an

7. ) UTILIZARILE CUPRULUI 7. 1. ) Cupul industrial Cuprul brut (cupru de convertizor ) - se produce in lingouri de 20. . . 80 kg destinate rafinarii termice sau in anozi care se supun rafinarii electrolitice. Cuprul rafinat termic – are o gama larga de intrebuintari , exceptand fabricareaconductorilor electrici. Cuprul rafinat electrolitic - in electrotehnica, Cuprul de mare puritate chimica si spectrala implica procedee de obtinere cu totul speciale , folosindu se aproape exclusiv in scopuri stiintifice. 7. 2. ) Domeniile de intrebuintare ale cuprului si a aliajelor sale. 7. 2. 1. ) Cuprul industrial , cuprul slab aliat si aliajele cu continuturi de cupru ridicate. Cablurile si sarmele de cupru sunt solicitate pentru realizarea liniilor electrice de inalta tensiune , precum si in domeniul comunicatiilor in constructia de vehicole si a liniilor pentru exploatarea acestora, in constructia de locuinte, in electrotehnica (bobine , electromagneteti). 7. 2. 2. ) Intrebuintarile alamelor Alamele se prelucreaza in sarma ( 3. . 9%) vergele si bare * 39. . . 62%) table , benzi si placi (24. . . 46%) tevi (5. . 21%). 7. 2. 3) Intrebuintarile bronzului : Bronzul cu fosfor se folosesc in special sub forma laminata, in timp ce bronzurile cu aluminiu si cele cu mangan se pot prelucra atat prin laminare cat si prin turnare.

BIBILIOGRAFIE : 1. ) Sever Banciu , „ Din istoria descoperirii elementelor chimice ", Ed. Albatros , Bucuresti , 1981 11. ) A. Chiriac , Delia Isac , Rodica Iagher , Mia Isacu, Laura Pitulice , „Chimie – Formare initiala si continua " , Ed. Universitatii de Vest , Timisoara , 2002 12. ) Petre Danila , Maria Danila , „ Seria substantelor minerale utile – Cuprul – “ , Ed. Tehnica , Bucuresti , 1982 13. ) I. Fetita si Al. Fetita , „ Manual pentru clasa a IX- a , licee industriale si scoli profesionale “ , Ed. Didactica si Pedagogica , R. A. Bucuresti , 1992 2. ) Otilia Spiridon Bizerea , „ Introducere in chimia metalelor. Metale reprezentative " , Ed. Mirton , 2001 3. ) Otilia Spiridon Bizerea , „ Metale tranzitionale de tip d si compusii lor " , Ed. Politehnica , 2005 4. ) Otilia Spiridon Bizerea , „ Elemente de chimia metalelor . Lucrari practice" , Ed. Mirton , 2005 5. ) Maria Brezeanu , E. Cristurean , A. Antoniu , D. Marinescu , M. Andruh , „ Chimia metalelor " , Editura Academiei Romane , Bucuresti, 1990 14. ) I. Ganescu , C. Patrosescu , M. Raileanu , S. Florea, A. Ciocioc , Gh. Brinz , „ Chimie pentru definitivat “, Ed. Didactica si Pedagogica , Bucuresti , 1989 6. ) A. Chiriac , C. Radovan , Daniela Dascalu , V. Chiriac, „ Compendiu de chimie generala pentru licenta " , Ed. Universitatii de Vest , Timisoara , 2006 7. ) V. Chiriac , Veronica Chiriac , A. Chiriac , Daniela Dascalu , „ Consultatii la chimie in pagini de ziar “ , Ed. Mirton , 2006 15. ) G. Marcu , Maria Brezeanu. Cornelia Bejan , Cornelia Batca , Rodica Catineanu , „ Chimie anorganica “ , Ed. Didactica si Pedagogica , Bucuresti , 1992 16. ) C. D. Nenitescu , „ Chimie generala “ , Ed. Didactica si Pedagogica , Bucuresti , 1979 17. ) C. Pumnea , N. Ionita , S. Sontea , „ Tehnologii din industria metalurgica si prelucratoare “ , Ed. Didactica si Pedagogica , Bucuresti , 1989 9. ) Veronica Chiriac , A. Chiriac , V. Chiriac , „ Teste de chimie anorganica “ , Ed. Mirton , Timisoara , 2003 18. ) I. Risavi , I. Ionescu , „ Chimie si probleme de chimie pentru concursurile de admitere in invatamantul superior “ , Ed. Tehnica , Bucuresti , 1974 10. ) Veronica Chiriac , V. Chiriac , Codruta Cofan , „ Intrebari , exercitii si probleme de chimie generala , Ed. Mirton , Timisoara , 2002 19. ) S. Sontea , M. Vladoi , N. Zaharia , „Metale si aliaje neferoase de turnatorie “ , Ed. Didactica si Pedagogica, Bucuresti , 1989 8. ) Veronica Chiriac , V. Chiriac , Daniela Dascalu , Delia Isac , „Curs de chimie generala “ , Ed. Mirton , Timisoara , 2003

 Gimnazial
Gimnazial Eminescu viata si opera
Eminescu viata si opera De ce mihai eminescu este o personalitate
De ce mihai eminescu este o personalitate Ale tale doruri toate
Ale tale doruri toate Motivul genezei
Motivul genezei Cei 5 mari clasici
Cei 5 mari clasici Viata si opera lui mihai eminescu
Viata si opera lui mihai eminescu Mitul transhumantei
Mitul transhumantei Opera si viata lui mihai eminescu
Opera si viata lui mihai eminescu Si te-ai dus dulce minune
Si te-ai dus dulce minune Floare albastra wikipedia
Floare albastra wikipedia Fiind băiet păduri cutreieram de mihai eminescu
Fiind băiet păduri cutreieram de mihai eminescu Mihai eminescu lucruri interesante
Mihai eminescu lucruri interesante Peste varfuri versuri
Peste varfuri versuri O vino iar in al meu brat
O vino iar in al meu brat Floare albastra mihai eminescu
Floare albastra mihai eminescu Cel mai mare poet
Cel mai mare poet Eminescu noapte buna
Eminescu noapte buna Mihai eminescu nu credeam sa-nvat a muri vreodata
Mihai eminescu nu credeam sa-nvat a muri vreodata Viata si opera lui mihai eminescu ppt
Viata si opera lui mihai eminescu ppt Trasaturile junimismului
Trasaturile junimismului Plural coala
Plural coala Coala de autor
Coala de autor Coala
Coala Substantivul clasa 3
Substantivul clasa 3 Coala de autor
Coala de autor Real investment arad
Real investment arad Satu mare arad km
Satu mare arad km Apm arad
Apm arad
















































