Prof Valmir F Juliano QUI 221 INTRODUO AOS
























- Slides: 40

Prof. Valmir F. Juliano QUI 221 INTRODUÇÃO AOS MÉTODOS ESPECTROANALÍTICOS - II

Luminescência Molecular • Três tipos de métodos ópticos relacionados entre si são conhecidos coletivamente como métodos de luminescência molecular: Fluorescência molecular; molecular fosforescência e quimiluminescência • A fluorescência e a fosforescência são similares, no tocante ao processo de excitação, que é feita por absorção de fótons Por esse motivo são frequentemente mencionados pelo termo mais genérico fotoluminescência • A quimiluminescência está baseada no espectro de emissão de uma espécie excitada que é formada no decorrer de uma reação química

Luminescência Molecular • A medida da intensidade de fotoluminescência ou quimiluminescência permite a determinação quantitativa de uma variedade de espécies orgânicas e inorgânicas importantes em concentrações muito baixas (traços). • Atualmente, o número de métodos fluorimétricos é significativamente maior que o número de aplicações de procedimento de fosforescência e quimiluminescência. • Um dos aspectos mais atraentes dos métodos de luminescência é a sua sensibilidade intrínseca, com limites de detecção frequentemente de uma a três ordens de grandeza menores de a absorção (ppb).

Luminescência Molecular • Outra vantagem dos métodos fotoluminescentes é a sua extensa faixa de concentração linear, que, com frequencia, é significativamente maior que as encontradas em métodos de absorção. • Devido à sua alta sensibilidade , os métodos de luminescência quantitativos estão sujeitos a efeitos de interferência sérios das matrizes das amostras. Por essa razão, normalmente, as medições de luminescência estão associadas com técnicas de separação da cromatografia e da eletroforese. • Geralmente os métodos de luminescência apresentam uma aplicação menos ampla. Muito mais espécies absorvem radiação UV/Vis do que emitem.

Luminescência Molecular Teoria da fluorescência e fosforescência • Ocorrem em sistemas químicos gasosos, líquidos e sólidos simples, bem como em sistemas complexos. • Fluorescência de ressonância: ressonância lemis = labs. Observada mais para espécies atômicas que moleculares. • Fluorescência com deslocamento Stokes: Stokes lemis > labs. O físico Irlandês George Gabriel Stokes, verificou que o fóton absorvido perdia energia por inúmeras vibrações microscópicas. • A absorção de fótons ocorre instantaneamente (10 -14 a 10 -15 s). • A emissão de fluorescência ocorre em um tempo significativamente maior (10 -9 a 10 -7 s, quando e tem valores 103 a 105, e 10 -6 a 10 -5 s para e bem menores). • A emissão de fosforescência, por sua vez, ocorre em tempos muito maiores (10 -4 a 10 s ou mais) em virtude da transição de spin singlete-triplete diferente da transição singlete-singlete da fluorescência.

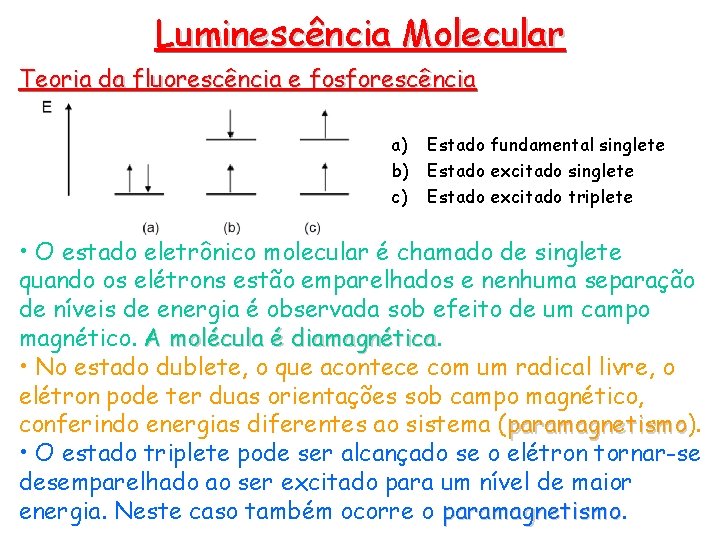
Luminescência Molecular Teoria da fluorescência e fosforescência a) Estado fundamental singlete b) Estado excitado singlete c) Estado excitado triplete • O estado eletrônico molecular é chamado de singlete quando os elétrons estão emparelhados e nenhuma separação de níveis de energia é observada sob efeito de um campo magnético. A molécula é diamagnética • No estado dublete, o que acontece com um radical livre, o elétron pode ter duas orientações sob campo magnético, conferindo energias diferentes ao sistema (paramagnetismo). paramagnetismo • O estado triplete pode ser alcançado se o elétron tornar-se desemparelhado ao ser excitado para um nível de maior energia. Neste caso também ocorre o paramagnetismo

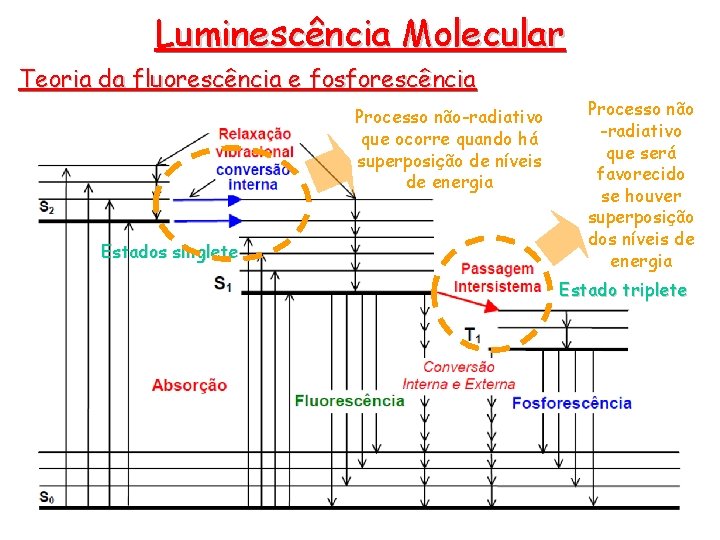
Luminescência Molecular Teoria da fluorescência e fosforescência • A molécula pode voltar ao seu estado fundamental por uma combinação de várias etapas mecanísticas, denominados de processos de desativação: desativação • Processos radiativos • Fluorescência. • Fosforescência. Sempre ocorrem do menor nível energético vibracional • Processo não-radiativos • Relaxação vibracional (10 -12 s) • Colisões entre as moléculas excitadas e as moléculas do solvente eliminam excesso de energia, atingindo o menor nível vibracional. • Conversão interna • Processos intermoleculares pelos quais a molécula passa para um estado eletrônico de menor energia sem emissão de radiação. • Conversão externa (extinção por colisão) • A desativação de um estado eletrônico excitado envolve a transferência de energia entre a molécula excitada e o solvente ou outros solutos. Condições que reduzem o número de colisões (baixa temperatura e alta viscosidade) aumentam a emissão

Luminescência Molecular Teoria da fluorescência e fosforescência Processo não-radiativo que ocorre quando há superposição de níveis de energia Estados singlete Processo não -radiativo que será favorecido se houver superposição dos níveis de energia Estado triplete

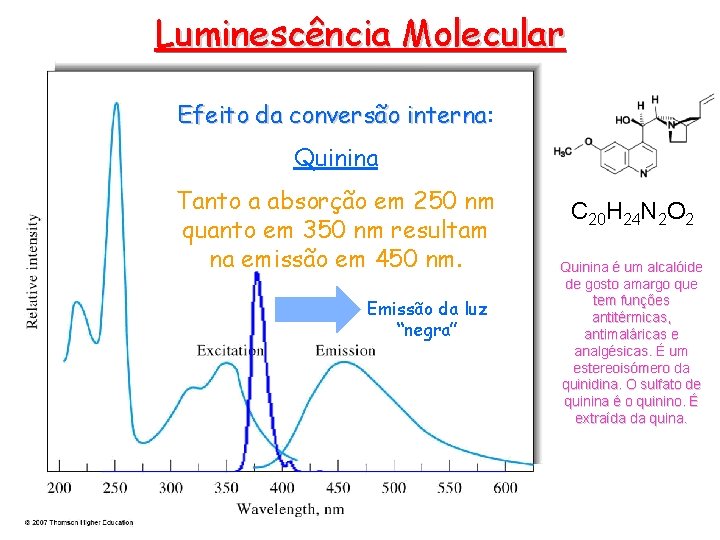
Luminescência Molecular Efeito da conversão interna: interna Quinina Tanto a absorção em 250 nm quanto em 350 nm resultam na emissão em 450 nm. Emissão da luz “negra” C 20 H 24 N 2 O 2 Quinina é um alcalóide de gosto amargo que tem funções antitérmicas, antimaláricas e analgésicas. É um estereoisómero da quinidina. O sulfato de quinina é o quinino. É extraída da quina.

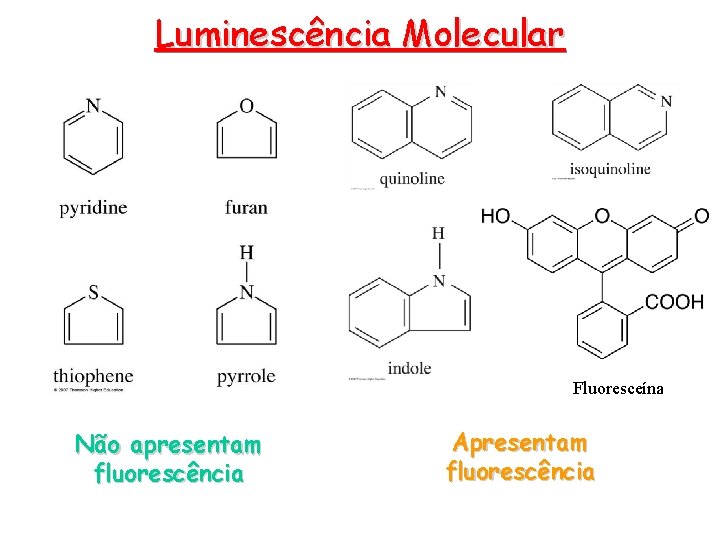
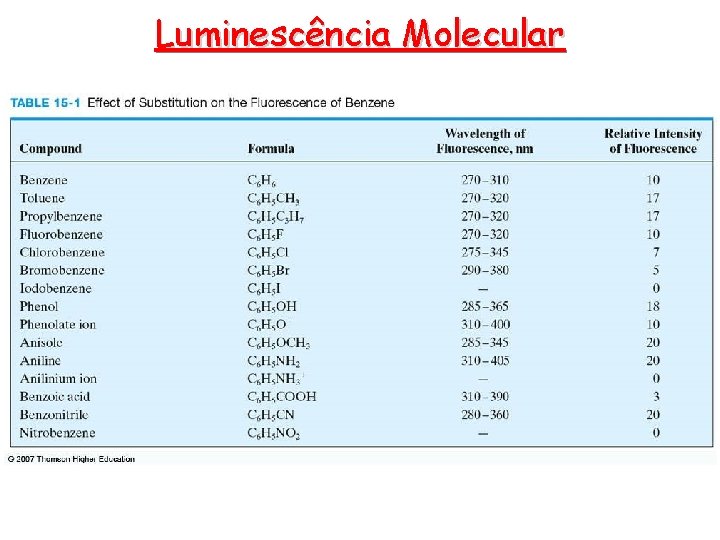
Luminescência Molecular Teoria da fluorescência e fosforescência • A estrutura molecular, assim como o ambiente químico, influenciam a ocorrência ou não da luminescência de uma molécula. Estes fatores também determinam a intensidade de emissão, quando esta ocorre. • Rendimento quântico ou eficiência quântica F: • É simplesmente a razão do número de moléculas que luminescem pelo número de moléculas excitadas. A fluoresceína possui uma eficiência quântica próxima da unidade. • Tipos de transição • Dificilmente a fluorescência resulta de absorção de radiação com l menor que 250 nm, porque tal radiação é suficientemente energética para promover a desativação dos estados excitados por prédissociação ou dissociação. A emissão fica restrita a transições p* p (maior eficiência quântica) quântica e p* n. • Estrutura • Ainda que alguns compostos carbonílicos e alguns com estruturas de duplas ligações altamente conjugadas fluoresçam, a fluorescência mais intensa e mais útil é encontrada em compostos com grupos aromáticos com transições p p* de baixa energia.

Luminescência Molecular Fluoresceína Não apresentam fluorescência Apresentam fluorescência

Luminescência Molecular

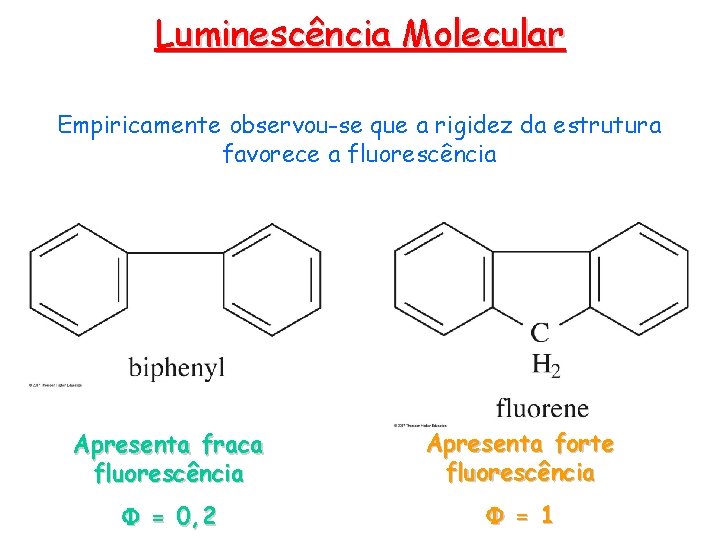
Luminescência Molecular Empiricamente observou-se que a rigidez da estrutura favorece a fluorescência Apresenta fraca fluorescência Apresenta forte fluorescência F = 0, 2 F = 1

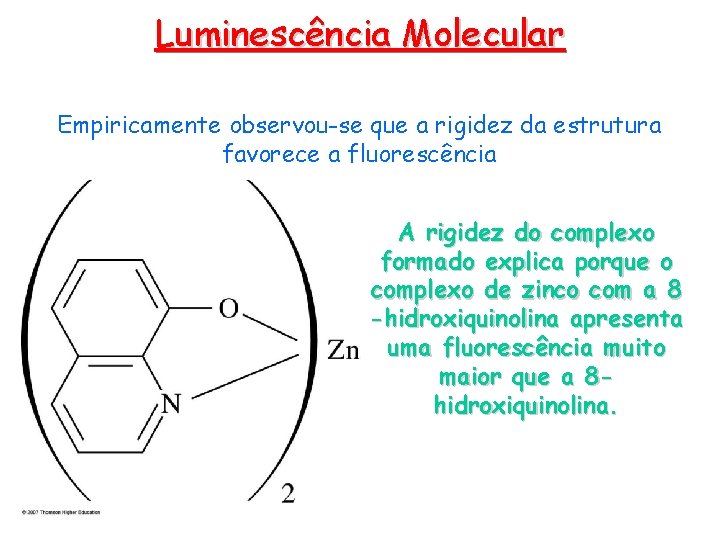
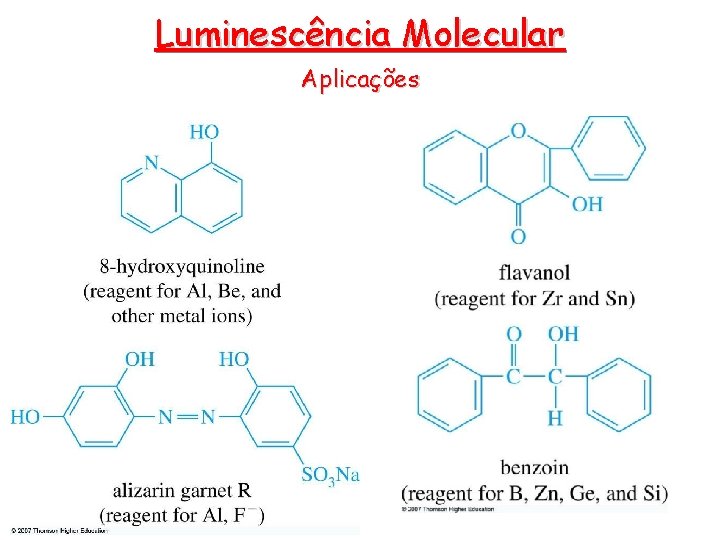
Luminescência Molecular Empiricamente observou-se que a rigidez da estrutura favorece a fluorescência A rigidez do complexo formado explica porque o complexo de zinco com a 8 -hidroxiquinolina apresenta uma fluorescência muito maior que a 8 hidroxiquinolina.

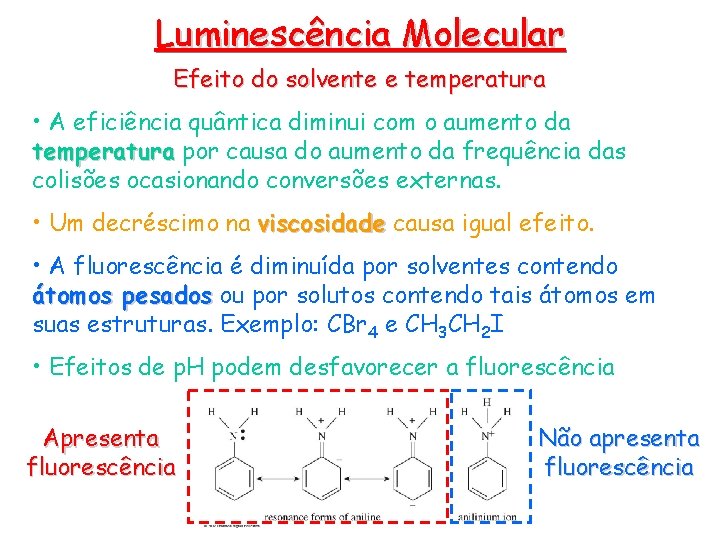
Luminescência Molecular Efeito do solvente e temperatura • A eficiência quântica diminui com o aumento da temperatura por causa do aumento da frequência das colisões ocasionando conversões externas. • Um decréscimo na viscosidade causa igual efeito. • A fluorescência é diminuída por solventes contendo átomos pesados ou por solutos contendo tais átomos em suas estruturas. Exemplo: CBr 4 e CH 3 CH 2 I • Efeitos de p. H podem desfavorecer a fluorescência Apresenta fluorescência Não apresenta fluorescência

Luminescência Molecular Efeito da concentração na intensidade de fluorescência • A potência de emissão de fluorescência F é proporcional à potência radiante do feixe de excitação que é absorvido. F = K´(Po – P) • Escrevendo a lei de Beer, P / Po = 10 -ebc, onde e é absortividade molar das moléculas fluorescentes F = K´(Po - Po 10 -ebc) = K´Po(1 - 10 -ebc) • O termo exponencial pode ser expandido e posteriormente simplificado. Considerando A < 0, 05, o resultado passa a ser F = 2, 303 K´ebc. Po. • Como eb é constante e é possível manter Po também constante, o resultado final passa a ser: F = Kc

Luminescência Molecular Desvios da linearidade • Quando a concentração da espécie emissora é grande o suficiente para que a absorbância seja maior que 0, 05, a simplificação do termo exponencial se torna inválida e a linearidade é perdida. (absorção primária) primária • Dois outros fatores também causam desvios negativos da linearidade: • Auto-supressão • Colisões entre moléculas excitadas provocam a transferência de energia não-radiativa de um modo semelhante à transferência para moléculas do solvente na conversão externa. • Absorção secundária (inclui a auto-absorção) • Ocorre quando lemissão coincide com algum labsorção. O resultado é a reabsorção da radiação por quaisquer moléculas na solução.

Luminescência Molecular Fatores que reduzem a intensidade de fluorescência • Supressão dinâmica • Também chamada de supressão colisional, necessita do contato entre as espécies excitadas e o agente supressor. O mecanismo não é muito bem compreendido. • A concentração do agente supressor deve ser suficientemente alta para que haja uma alta probabilidade de colisão entre as espécies excitada e supressor durante o tempo de vida do estado excitado. • A presença de O 2 dissolvido, que é paramagnético, geralmente reduz a intensidade da fluorescência por promover o cruzamento intersistema. Entretanto, também pode promover a supressão do estado triplete, reduzindo também a fosforescência. • A fluorescência do sulfato de quinino é suprimida por altas concentrações de íons cloreto.

Luminescência Molecular Fatores que reduzem a intensidade de fluorescência • Supressão estática • Neste caso, o supressor forma com o analito fluoróforo um complexo chamado de complexo escuro. M supressor + L Molécula fluorescente ⇌ ML Complexo nãofluorescente • Supressão de longo alcance • Neste tipo de supressão a transferência de energia ocorre com colisões entre as moléculas. O acoplamento dipolo-dipolo entre o fluoróforo excitado e o supressor é responsável pela transferência.

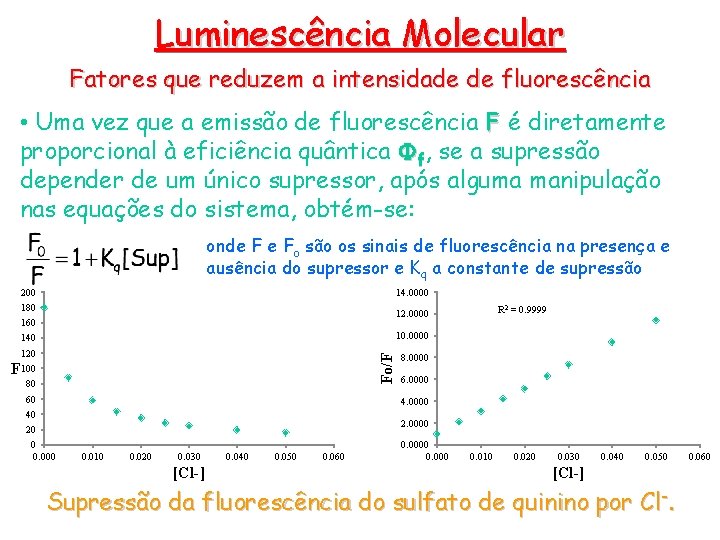
Luminescência Molecular Fatores que reduzem a intensidade de fluorescência • Uma vez que a emissão de fluorescência F é diretamente proporcional à eficiência quântica Ff, se a supressão depender de um único supressor, após alguma manipulação nas equações do sistema, obtém-se: onde F e Fo são os sinais de fluorescência na presença e ausência do supressor e Kq a constante de supressão 200 14. 0000 180 R 2 = 0. 9999 12. 0000 160 10. 0000 120 8. 0000 Fo/F 140 F 100 80 60 6. 0000 40 2. 0000 20 0 0. 000 0. 010 0. 020 0. 030 [Cl-] 0. 040 0. 050 0. 060 0. 000 0. 010 0. 020 0. 030 0. 040 0. 050 [Cl-] Supressão da fluorescência do sulfato de quinino por Cl -. 0. 060

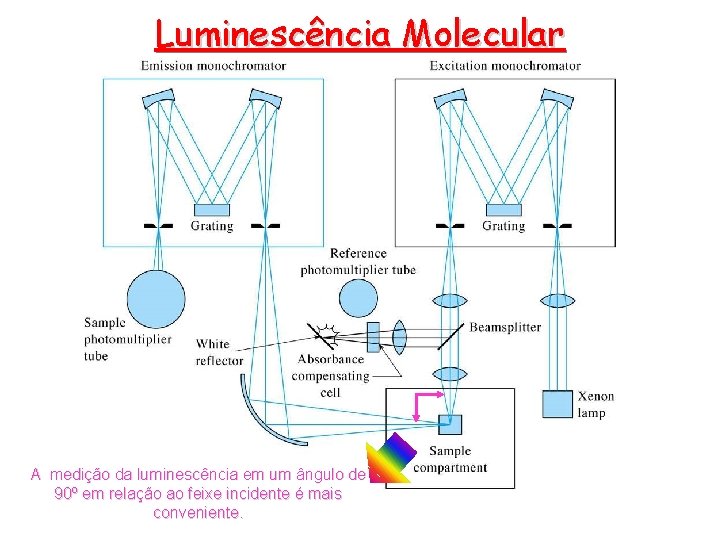
Luminescência Molecular Instrumentos para medir fluorescência e fosforescência • Os componentes dos instrumentos para medir a fotoluminescência são similares àqueles encontrados nos fotômetros e espectrofotômetros UV/Vis. • A fonte de radiação necessita ser mais intensa que aquelas utilizadas na absorção molecular. • A maioria dos equipamentos emprega a ótica de duplo feixe para compensar flutuações na potência da fonte • A fluorescência emitida pela amostra se propaga em todas as direções, mas o ângulo reto em relação ao feixe incidente é mais conveniente para evitar perdas por espalhamento na solução e, principalmente, nas paredes da cubeta. F = Kc

Luminescência Molecular A medição da luminescência em um ângulo de 90º em relação ao feixe incidente é mais conveniente.

Luminescência Molecular Para refletir e responder: Seria possível realizar uma medida de fluorescência em um espectrofotômetro convencional após alguma pequena modificação?

Luminescência Molecular Aplicações • Os métodos de fluorescência e fosforescência são intrinsecamente aplicáveis a faixas de concentrações mais baixas que as medidas espectrofotométricas baseadas em absorbâncias e estão entre as técnicas analíticas mais sensíveis facilmente disponíveis. • Essa sensibilidade elevada vem do fato que F aumenta se a potência da fonte Po aumentar, ou então, pelo fato do sinal poder ser amplificado posteriormente. A absorbância, por estar relacionada com Po/P, não se altera com o aumento de Po, pois o aumento deste causa um aumento proporcional em P. • Em contraste a alta sensibilidade, os métodos fotoluminescentes são menos precisos e exatos que os métodos espectrofotométricos por um fator de 2 a 5.

Luminescência Molecular Aplicações • Muitos íons de metais de transição são paramagnéticos, o que favorece o cruzamento intersistema ao estado triplete, desfavorecendo a fluorescência, embora a fosforescência possa ser observada. • Os complexos dos metais de transição possuem muitos níveis de energia pouco espaçados, favorecendo a desativação por conversão interna e não por fluorescência. • Complexos de metais que não são de transição, transição geralmente incolores e que formam complexos também incolores, são menos suscetíveis a esses processos de desativação. Estes não poderiam ser determinados por absorção molecular no visível. Assim a fluorimetria é complementar à absorção molecular.

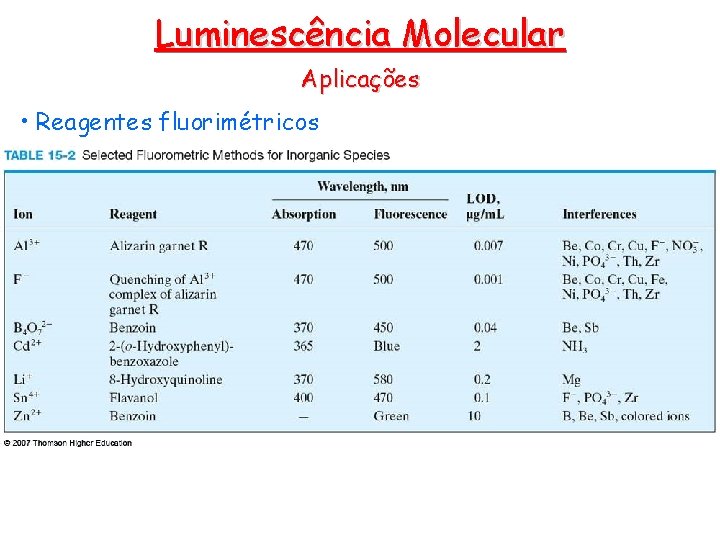
Luminescência Molecular Aplicações • Reagentes fluorimétricos

Luminescência Molecular Aplicações

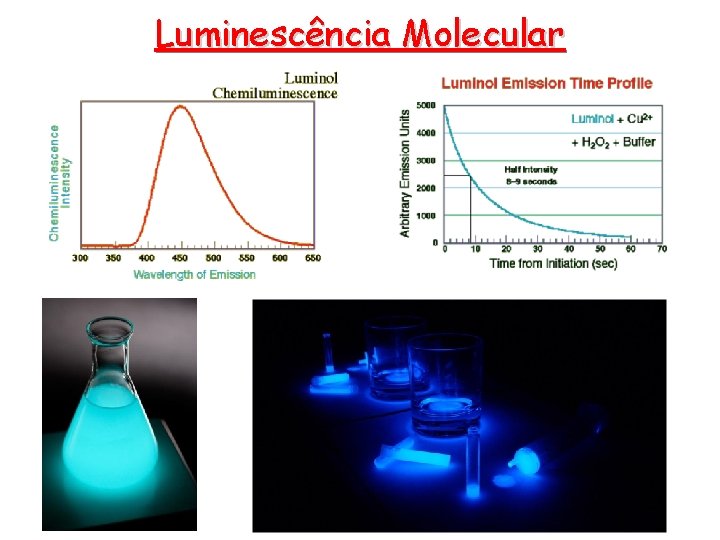
Luminescência Molecular Quimiluminescência A aplicação da quimiluminescência à química analítica é relativamente recente. O número de reações químicas que produz quimiluminescência é pequeno, limitando assim o método • A quimiluminescência é produzida quando uma reação química fornece uma espécie excitada eletronicamente que emite luz quando retorna ao estado fundamental. • A bioluminescência é a quimiluminescência que ocorre em sistemas biológicos. Os exemplos mais conhecido são os vaga-lumes e as águas-vivas. • A instrumentação para medidas de quimiluminescência é notavelmente simples. É necessário um sistema fechado com apenas um tubo fotomultiplicador.

Luminescência Molecular Quimiluminescência • Os métodos de quimiluminescência em geral são altamente sensíveis porque níveis baixos de luz podem ser detectados na ausência de ruído. • Não há atenuação da radiação em monocromadores ou filtros. Com isso limites de detecção na faixa de partes por bilhão (ppb) ppb ou partes por trilhão (ppt) ppt podem ser alcançados.

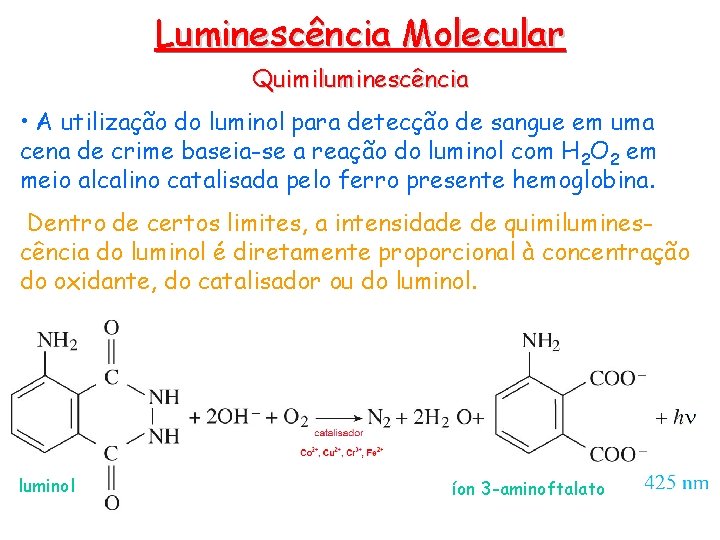
Luminescência Molecular Quimiluminescência • A utilização do luminol para detecção de sangue em uma cena de crime baseia-se a reação do luminol com H 2 O 2 em meio alcalino catalisada pelo ferro presente hemoglobina. Dentro de certos limites, a intensidade de quimiluminescência do luminol é diretamente proporcional à concentração do oxidante, do catalisador ou do luminol íon 3 -aminoftalato

Luminescência Molecular

Luminescência Molecular Quimiluminescência Cenas muito fortes. . . Se você é fraco, feche os olhos. . .

Luminescência Molecular Vantagens (em comparação à absorção molecular) • Muito mais sensível. Alcança facilmente limites de detecção de ppb. A quimiluminescência pode fornecer limites de detecção da ordem de ppt. • Mais seletiva. O fato de absorver um determinado l e emitir em outro, diminui em muito a probabilidade de existir na mesma solução outra espécie que faça o mesmo. • Serve para a determinação de metais que não são de transição que, em geral, são incolores e tendem a formar quelatos também incolores e que não poderiam ser determinados por absorção molecular na região do visível.

Luminescência Molecular Desvantagens (em comparação à absorção molecular) • Limitada a um número muito menor de sistemas que incorporam características estruturais e ambientais que provocam uma desaceleração dos processos de relaxação ou desativação não-radiativos. Apesar disso, existem mais de 200 substâncias que podem ser analisadas por esta técnica. • Espécies orgânicas e bioquímicas – produtos alimentícios, fármacos, produtos naturais e amostras clínicas: • Enzimas e coenzimas, esteróides, vitaminas, etc. • Pior exatidão e precisão por um fator de 2 a 5. • Custo maior do equipamento. • Ao contrário da absorção molecular, é muito limitada para a determinação de complexos de metais de transição.

Luminescência Molecular Para refletir e responder: Seria possível analisar um analito orgânico aromático com anéis condensados em uma mistura de compostos orgânicos através da espectrometria de luminescência molecular? Em caso positivo, quais seriam as limitações da análise?

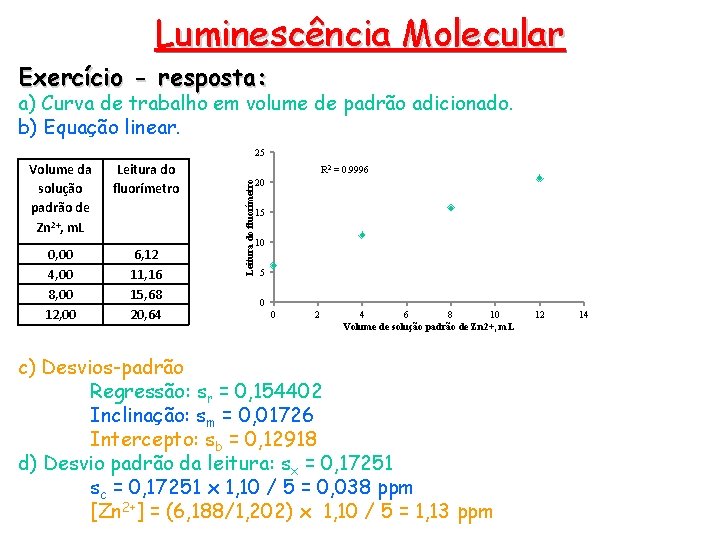
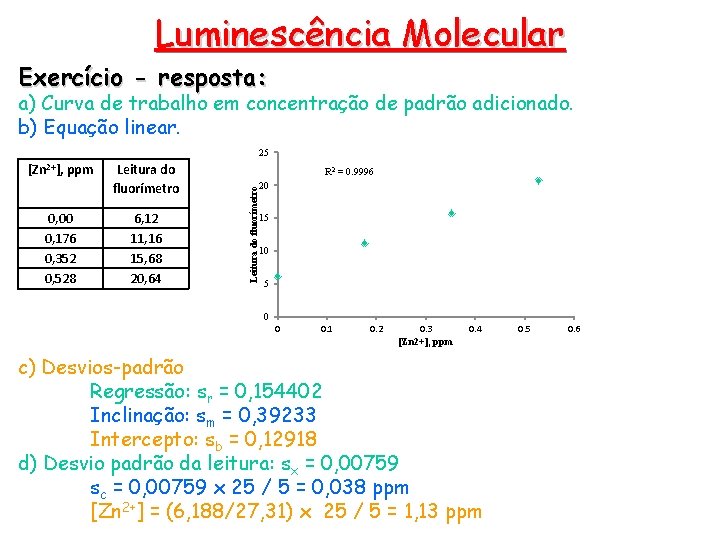
Luminescência Molecular Exercício: Os volumes de uma solução padrão contendo 1, 10 ppm de Zn 2+, mostrados na tabela, foram pipetados para frascos separados, cada um contendo 5, 00 m. L de uma solução de concentração desconhecida de zinco. Cada uma foi extraída com 3 alíquotas de 5 m. L de CCl 4 contendo excesso de 8 hidroxiquinolina. Os extratos foram então diluídos a 25, 00 m. L e a fluorescência foi medida com um fluorímetro. a) Construa a curva de trabalho. b) Determine a equação linear. c) Calcule o desvio padrão da inclinação, do intercepto e da regressão. d) Determine a concentração de zinco na amostra com o respectivo desvio padrão Volume da solução padrão de Zn 2+, m. L Leitura do fluorímetro 0, 00 4, 00 8, 00 12, 00 6, 12 11, 16 15, 68 20, 64

Luminescência Molecular Exercício - resposta: a) Curva de trabalho em volume de padrão adicionado. b) Equação linear. 25 Leitura do fluorímetro 0, 00 4, 00 8, 00 12, 00 6, 12 11, 16 15, 68 20, 64 R 2 = 0. 9996 Leitura do fluorímetro Volume da solução padrão de Zn 2+, m. L 20 15 10 5 0 0 2 4 6 8 10 Volume de solução padrão de Zn 2+, m. L c) Desvios-padrão Regressão: sr = 0, 154402 Inclinação: sm = 0, 01726 Intercepto: sb = 0, 12918 d) Desvio padrão da leitura: sx = 0, 17251 sc = 0, 17251 x 1, 10 / 5 = 0, 038 ppm [Zn 2+] = (6, 188/1, 202) x 1, 10 / 5 = 1, 13 ppm 12 14

Luminescência Molecular Exercício - resposta: a) Curva de trabalho em concentração de padrão adicionado. b) Equação linear. 25 0, 00 0, 176 0, 352 0, 528 Leitura do fluorímetro 6, 12 11, 16 15, 68 20, 64 R 2 = 0. 9996 Leitura do fluorímetro [Zn 2+], ppm 20 15 10 5 0 0 0. 1 0. 2 0. 3 [Zn 2+], ppm 0. 4 c) Desvios-padrão Regressão: sr = 0, 154402 Inclinação: sm = 0, 39233 Intercepto: sb = 0, 12918 d) Desvio padrão da leitura: sx = 0, 00759 sc = 0, 00759 x 25 / 5 = 0, 038 ppm [Zn 2+] = (6, 188/27, 31) x 25 / 5 = 1, 13 ppm 0. 5 0. 6

Luminescência Molecular Exercício: Compare a luminescência molecular com a absorção molecular no UV/Vis. Porque o aumento da potência da fonte luminosa não aumenta a sensibilidade de detecção na absorção molecular, mas aumenta a emissão? A = log (P 0/P) F = K´ (P 0 – P) F = K´(Po - Po 10 -ebc) F = K´Po(1 - 10 -ebc) ≈ 2, 303 K´ebc. P 0

Fim da Luminescência Molecular. O que será que vem a seguir?
 Rávena
Rávena Ian juliano
Ian juliano Juliano trevisan psiquiatra
Juliano trevisan psiquiatra Toi qui aimes
Toi qui aimes Toi qui plies, toi qui pleures
Toi qui plies, toi qui pleures Cs 221
Cs 221 Csce 221
Csce 221 If 221
If 221 Aoi 221 gate
Aoi 221 gate Rotational statics
Rotational statics Aca 221
Aca 221 Ee 221
Ee 221 Emmett bond results
Emmett bond results Bio 221
Bio 221 Ee 221
Ee 221 Cpsc 221
Cpsc 221 221 bce
221 bce Cpit 221
Cpit 221 866-221-0269
866-221-0269 Edu-221
Edu-221 866-221-0269
866-221-0269 Fin 221
Fin 221 133 221
133 221 Epsc 221
Epsc 221 Einstein flow cytometry
Einstein flow cytometry Lagr 221
Lagr 221 Cpit 221
Cpit 221 Cps 221
Cps 221 Ancient chinese religion
Ancient chinese religion Gs-221
Gs-221 Difference between arithmetic shift and logical shift
Difference between arithmetic shift and logical shift Cse 221
Cse 221 Geoffrey tien
Geoffrey tien 221 bc
221 bc Apa perbedaan kapasitor polar dan nonpolar
Apa perbedaan kapasitor polar dan nonpolar Csce 221 tamu syllabus
Csce 221 tamu syllabus 2 enteros 132 diezmilésimos
2 enteros 132 diezmilésimos Csce 221
Csce 221 Sp 221
Sp 221 Gs-221
Gs-221 Cse 221
Cse 221