Prof Ms Leonardo Eduardo Ferreira Foz do Iguau


























- Slides: 56

Profº Ms. Leonardo Eduardo Ferreira Foz do Iguaçu, 09 de Maio, 2018. Bioquímica Geral. Proteínas, Enzimas, classificação, tipos de reações.

2 ENZIMAS - HISTÓRICO ûCatálise biológica início séc. XIX û digestão da carne: estômago û digestão do amido: saliva ûDécada de 50 û Louis Pasteur - concluiu que a fermentação do açúcar em álcool pela levedura era catalisada por “fermentos” = enzimas. ûEduard Buchner (1897) û extratos de levedo podiam fermentar o açúcar até álcool; û enzimas funcionavam mesmo quando removidas da célula viva.

3 ENZIMAS - HISTÓRICO ûJames Sumner (1926) û Isolou e cristalizou a urease; û Cristais eram de proteínas; û Postulou que “todas as enzimas são proteínas”. ûJohn Northrop (década 30) û Cristalizou a pepsina e a tripsina bovinas; ûDécada de 50 – séc. XX û 75 enzimas isoladas e cristalizadas; û Ficou evidenciado caráter proteico. û Atualmente - Mais de 2000 enzimas são conhecidas.

4 ENZIMAS Aminoácidos: H R C* û Definição: NH 2 û Catalisadores biológicos; û Longas cadeias de pequenas moléculas COOH chamadas aminoácidos. û Função: û Viabilizar a atividade das células, quebrando moléculas ou juntando-as para formar novos compostos. û Com exceção de um pequeno grupo de moléculas de RNA com propriedades catalíticas, chamadas de RIBOZIMAS, todas as enzimas são PROTEÍNAS.

Enzimas Ribozima Molécula de RNA com atividade catalítica

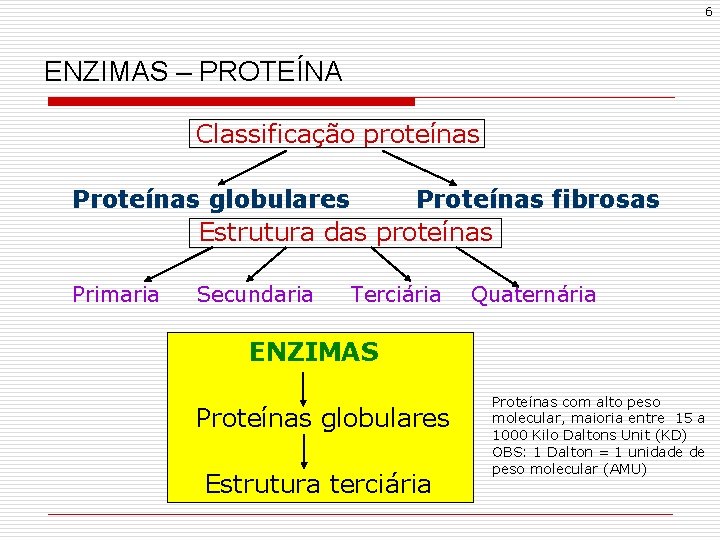
6 ENZIMAS – PROTEÍNA Classificação proteínas Proteínas globulares Proteínas fibrosas Estrutura das proteínas Primaria Secundaria Terciária Quaternária ENZIMAS Proteínas globulares Estrutura terciária Proteínas com alto peso molecular, maioria entre 15 a 1000 Kilo Daltons Unit (KD) OBS: 1 Dalton = 1 unidade de peso molecular (AMU)

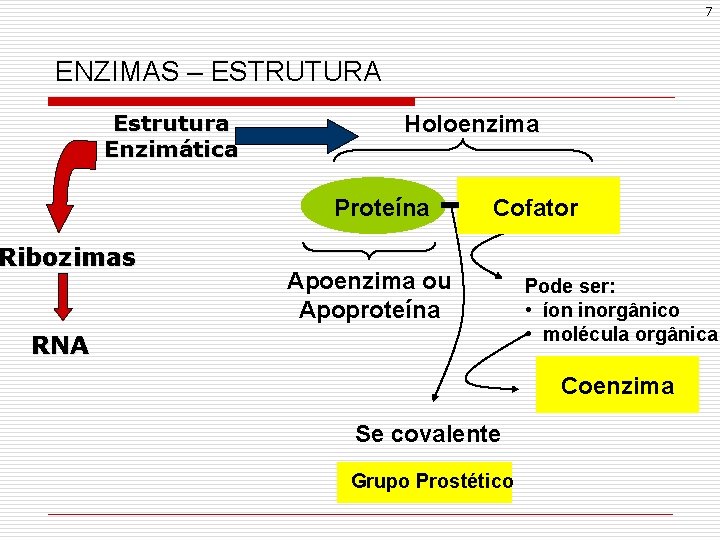
7 ENZIMAS – ESTRUTURA Estrutura Enzimática Holoenzima Proteína Ribozimas Cofator Apoenzima ou Apoproteína RNA Pode ser: • íon inorgânico • molécula orgânica Coenzima Se covalente Grupo Prostético

8 ENZIMAS – CARACTERÍSTICAS GERAIS ûApresentam alto grau de especificidade; ûSão produtos naturais biológicos; ûReações baratas e seguras; ûSão altamente eficientes, acelerando a velocidade das reações; ûSão econômicas, reduzindo a energia de ativação; ûNão são tóxicas; ûCondições favoráveis de p. H, temperatura, polaridade do solvente e força iônica.

9 ENZIMAS – NOMENCLATURA ûSéculo XIX - poucas enzimas identificadas - Adição do sufixo ”ASE” ao nome do substrato: * gorduras (lipo - grego) – LIPASE * amido (amylon - grego) – AMILASE - Nomes arbitrários: * Tripsina e pepsina – proteases

Enzimas – nomenclatura Existem 3 métodos para nomenclatura enzimática: û Nome Recomendado: Mais curto e utilizado no dia a dia de quem trabalha com enzimas. Usa o sufixo "ase" para caracterizar a enzima. Ex: Urease, Hexoquinase, Peptidase, etc. û Nome Sistemático: Mais complexo, dá informações precisas sobre a função metabólica da enzima. Ex: ATP-Glicose-Fosfo-Transferase û Nome Usual : Consagrado pelo uso. Ex: Tripsina, Pepsina, Ptialina.

Classificação das Enzimas

Classificação das Enzimas

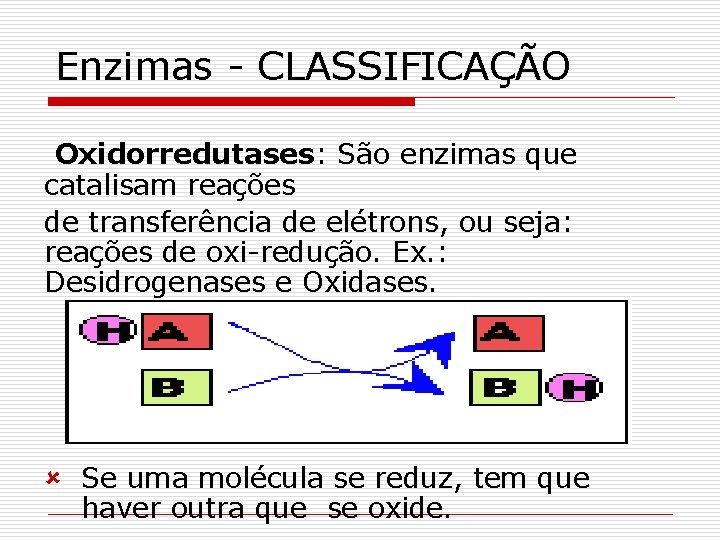
Enzimas - CLASSIFICAÇÃO Oxidorredutases: São enzimas que catalisam reações de transferência de elétrons, ou seja: reações de oxi-redução. Ex. : Desidrogenases e Oxidases. û Se uma molécula se reduz, tem que haver outra que se oxide.

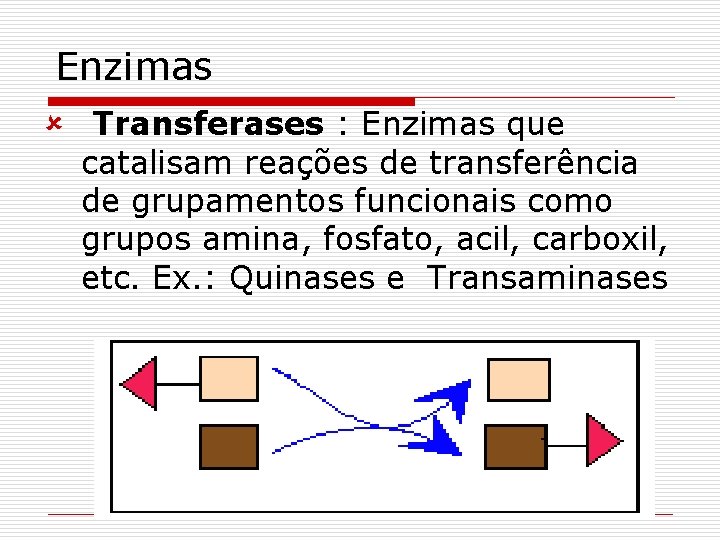
Enzimas û Transferases : Enzimas que catalisam reações de transferência de grupamentos funcionais como grupos amina, fosfato, acil, carboxil, etc. Ex. : Quinases e Transaminases

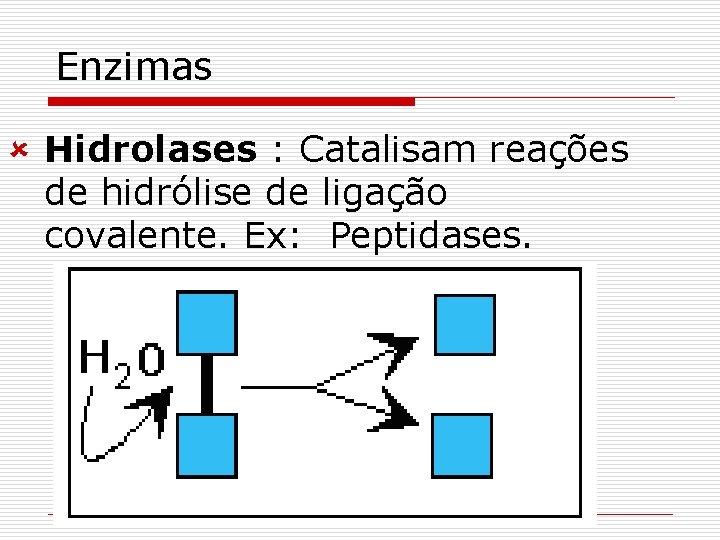
Enzimas û Hidrolases : Catalisam reações de hidrólise de ligação covalente. Ex: Peptidases.

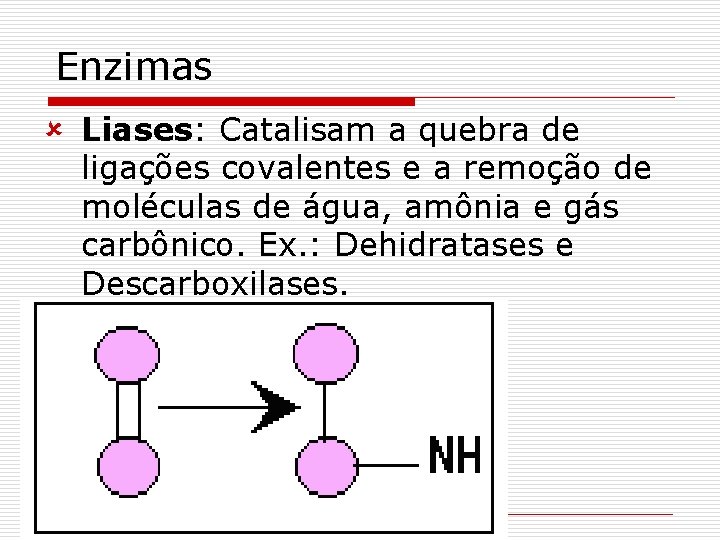
Enzimas û Liases: Catalisam a quebra de ligações covalentes e a remoção de moléculas de água, amônia e gás carbônico. Ex. : Dehidratases e Descarboxilases.

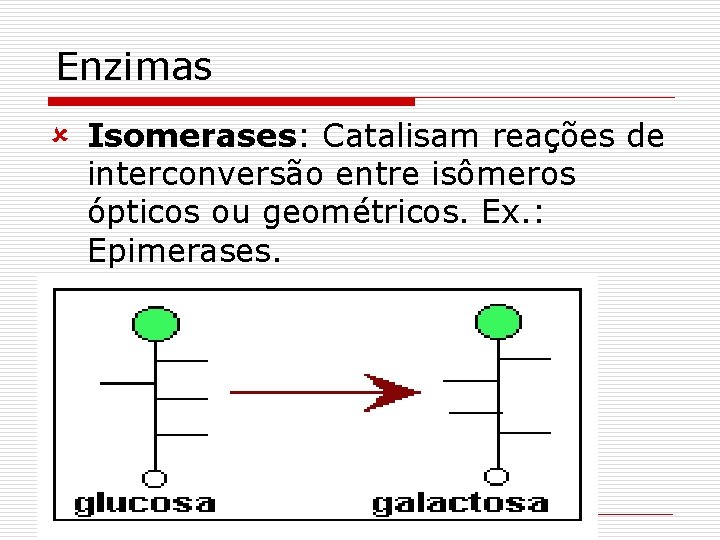
Enzimas û Isomerases: Catalisam reações de interconversão entre isômeros ópticos ou geométricos. Ex. : Epimerases.

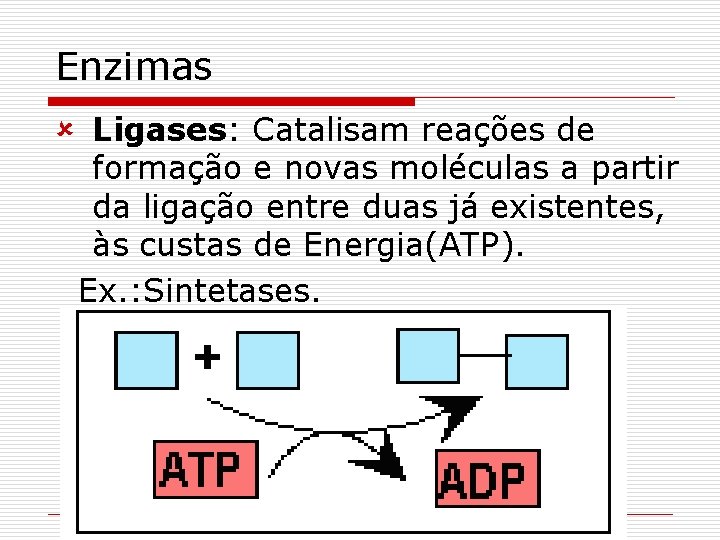
Enzimas û Ligases: Catalisam reações de formação e novas moléculas a partir da ligação entre duas já existentes, às custas de Energia(ATP). Ex. : Sintetases.

Isozimas - enzimas que catalisam a mesma reação mas apresentam estruturas diferentes (primária e/ou quaternária). Podem ser : - constituem diferentes enzimas produzidas por diferentes genes; Desidrogenase lática

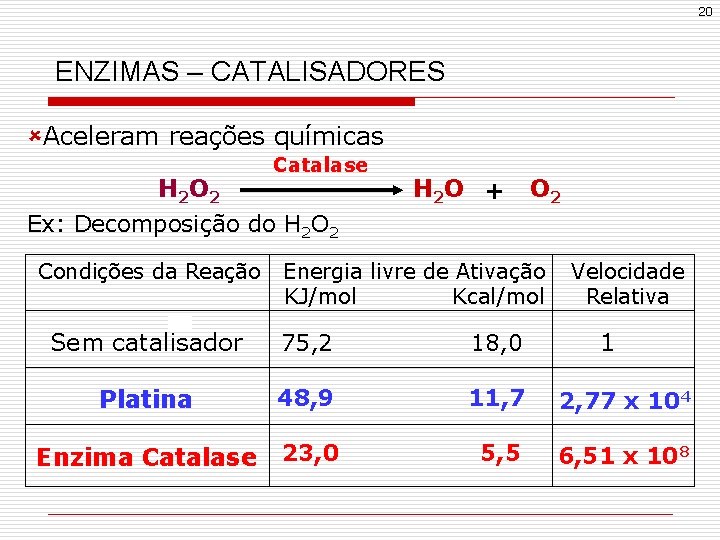
20 ENZIMAS – CATALISADORES ûAceleram reações químicas Catalase H 2 O 2 Ex: Decomposição do H 2 O 2 Condições da Reação H 2 O + O 2 Energia livre de Ativação KJ/mol Kcal/mol Velocidade Relativa Sem catalisador 75, 2 18, 0 Platina 48, 9 11, 7 2, 77 x 104 Enzima Catalase 23, 0 5, 5 6, 51 x 108 1

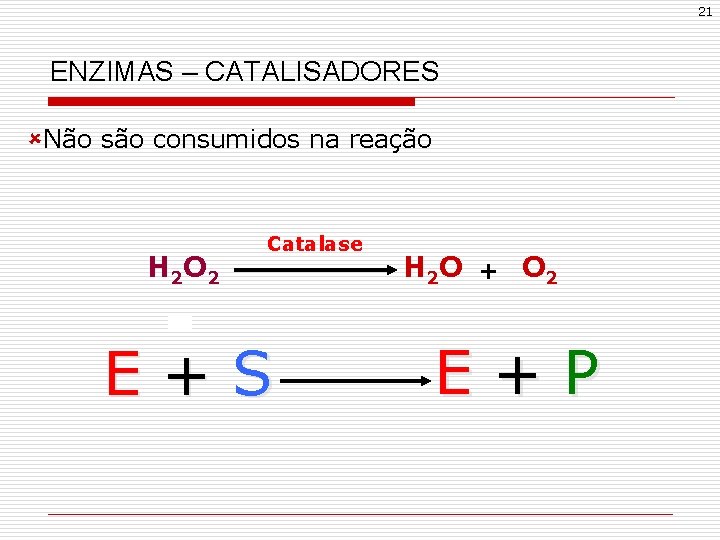
21 ENZIMAS – CATALISADORES ûNão são consumidos na reação H 2 O 2 Catalase E+S H 2 O + O 2 E+P

22 ENZIMAS – CATALISADORES Energia ûNão alteram o estado de equilíbrio • Abaixam a energia de ativação; • Keq não é afetado pela enzima. ûNão apresenta efeito termodinâmico global • G não é afetada pela enzima. Diferença entre a energia livre de S e P Energia de ativação sem enzima S P Energia de ativação com enzima Caminho da Reação

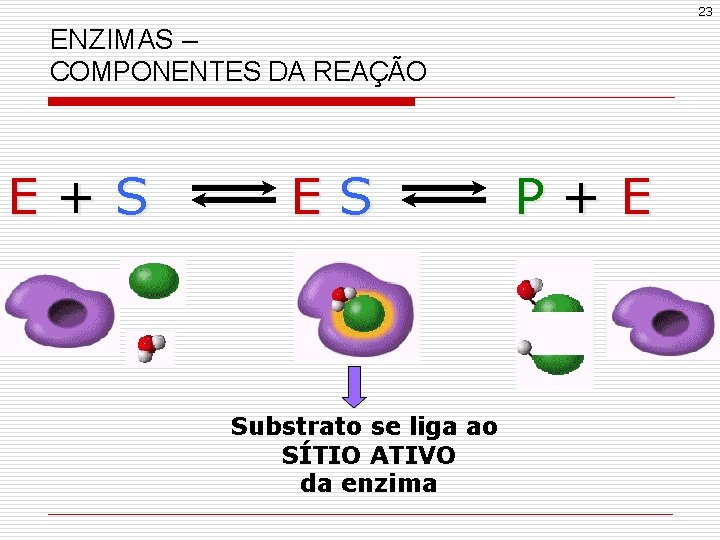
23 ENZIMAS – COMPONENTES DA REAÇÃO E+S ES Substrato se liga ao SÍTIO ATIVO da enzima P+E

24 ENZIMAS – SÍTIO ATIVO ûRegião da molécula enzimática da reação com o substrato. que participa ûPode possuir componentes não protéicos: cofatores. ûPossui aminoácidos auxiliares e de contato. Porção protéica Cofator APOENZIMA Ativador: Íons inorgânicos que condicionam a ação catalítica das enzimas. Fe²+ Coenzima: molécula orgânica complexa. NAD+ HOLOENZIMA Grupamento prostético

25 ENZIMAS – COFATOR û Algumas enzimas que contêm ou necessitam de elementos inorgânicos como cofatores ENZIMA COFATOR PEROXIDASE Fe+2 ou Fe+3 CATALASE CITOCROMO OXIDASE Cu+2 ÁLCOOL DESIDROGENASE Zn+2 HEXOQUINASE Mg+2 UREASE Ni+2

PROPRIEDADES DAS ENZIMAS Cofator (inorgânico) Algumas enzimas requerem a presença de íons metálicos para que a reação catalítica ocorra (Mg, Zn, Fe, Ca, Cu, Mn). Anidrase carbônica é uma enzima que tem um papel importante no transporte do CO 2 e no controle do p. H do sangue. Zinco

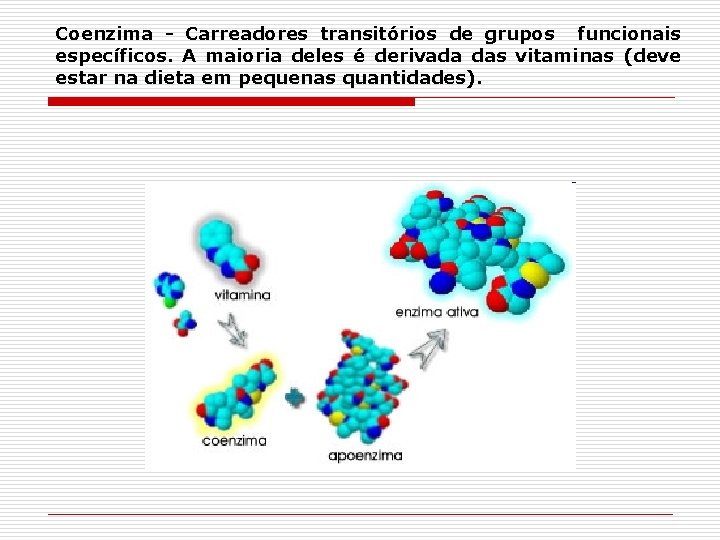
Coenzima - Carreadores transitórios de grupos funcionais específicos. A maioria deles é derivada das vitaminas (deve estar na dieta em pequenas quantidades).

Coenzima Grupo prostético (coenzima) As enzimas quando ligadas covalentemente ou nãocovalentemente às coenzimas, são chamadas de holoenzimas Apoenzima Holoenzima

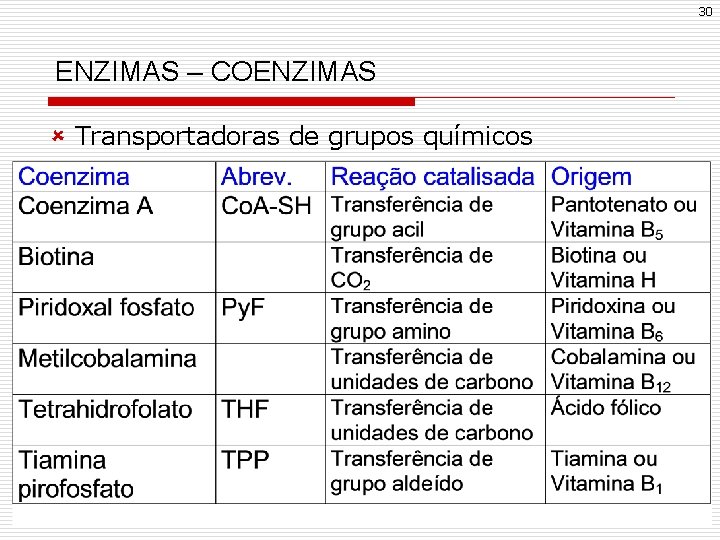
29 ENZIMAS – COENZIMAS û Maioria deriva de vitaminas hidrossolúveis û Classificam-se em: - transportadoras de hidrogênio - transportadoras de grupos químicos û Transportadoras de hidrogênio

30 ENZIMAS – COENZIMAS û Transportadoras de grupos químicos

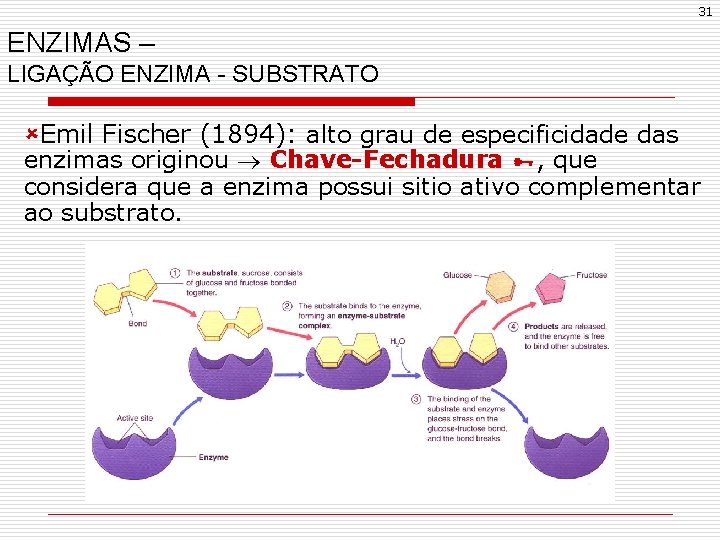
31 ENZIMAS – LIGAÇÃO ENZIMA - SUBSTRATO ûEmil Fischer (1894): alto grau de especificidade das enzimas originou Chave-Fechadura , que considera que a enzima possui sitio ativo complementar ao substrato.

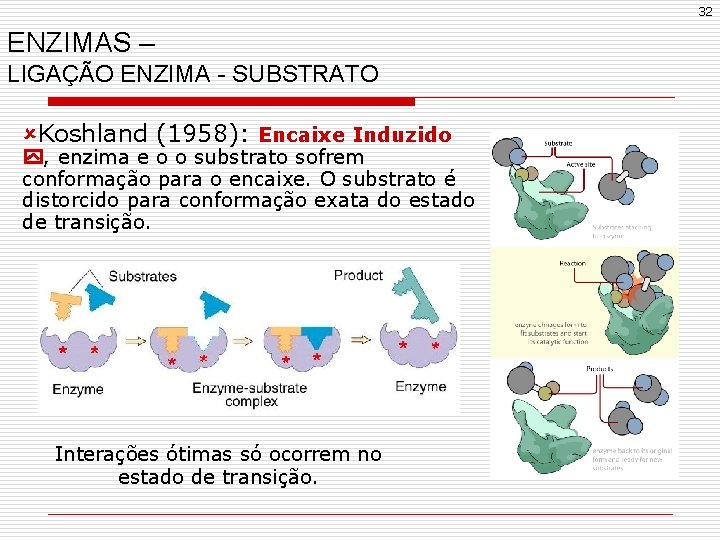
32 ENZIMAS – LIGAÇÃO ENZIMA - SUBSTRATO ûKoshland (1958): Encaixe Induzido , enzima e o o substrato sofrem conformação para o encaixe. O substrato é distorcido para conformação exata do estado de transição. Interações ótimas só ocorrem no estado de transição.


34 ENZIMAS – ATIVIDADE ENZIMÁTICA ûFatores que alteram a velocidade de reações enzimáticas: - p. H; - temperatura; - concentração das enzimas; - concentração dos substratos; - presença de inibidores.

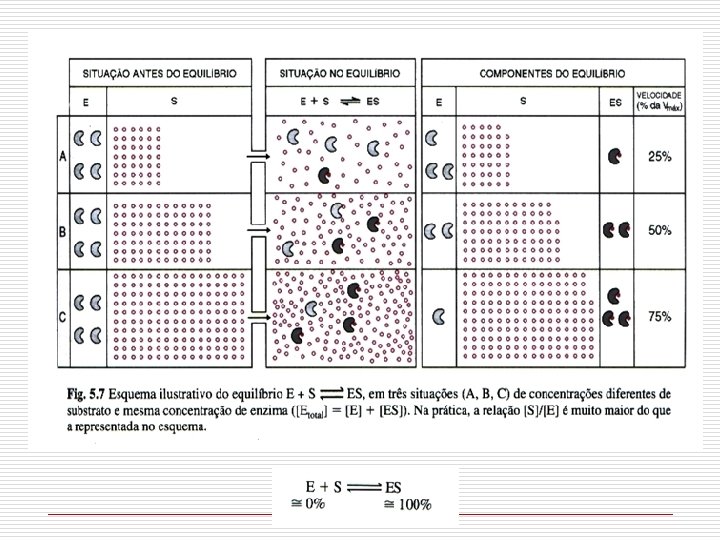
FATORES QUE AFETAM A VELOCIDADE DA REAÇÃO CONCENTRAÇÃO DO SUBSTRATO Unidade de enzima (U) - quantidade de enzima que catalisa a transformação de 1 µmol de substrato por min [ES] SÍTIOS DE LIGAÇÃO OCUPADOS

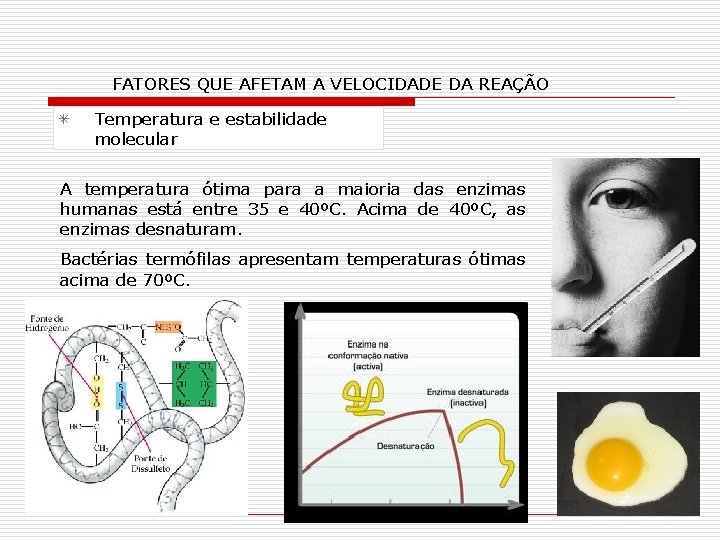
FATORES QUE AFETAM A VELOCIDADE DA REAÇÃO Temperatura e estabilidade molecular A temperatura ótima para a maioria das enzimas humanas está entre 35 e 40ºC. Acima de 40ºC, as enzimas desnaturam. Bactérias termófilas apresentam temperaturas ótimas acima de 70ºC.

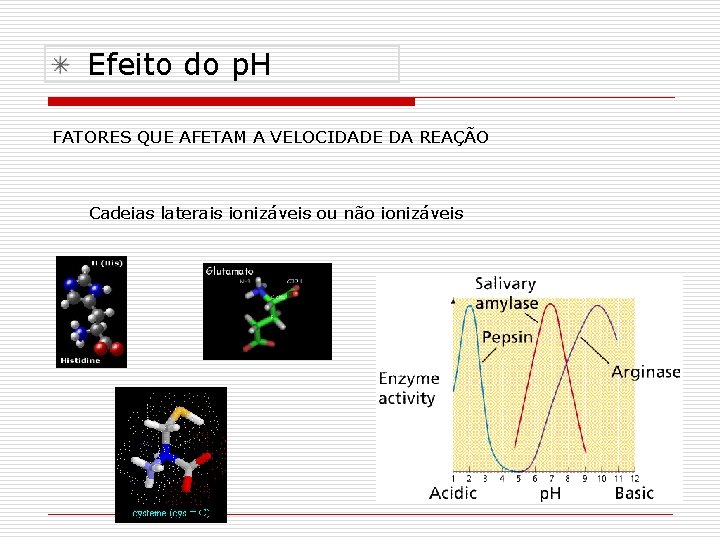
Efeito do p. H FATORES QUE AFETAM A VELOCIDADE DA REAÇÃO Cadeias laterais ionizáveis ou não ionizáveis

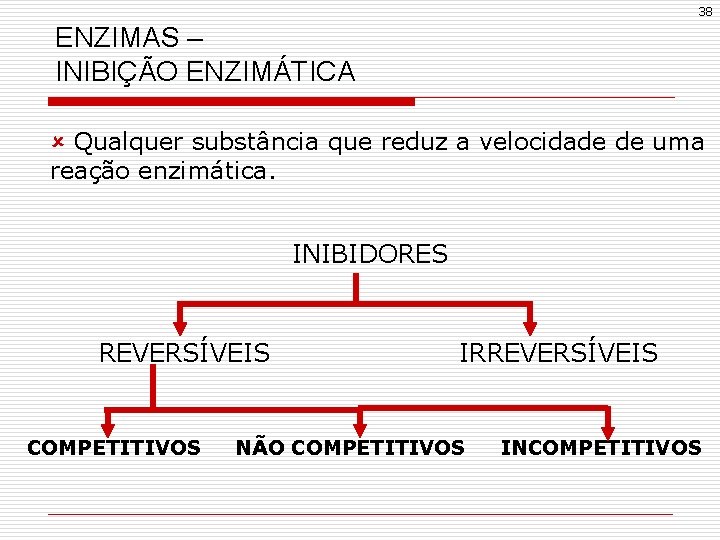
38 ENZIMAS – INIBIÇÃO ENZIMÁTICA û Qualquer substância que reduz a velocidade de uma reação enzimática. INIBIDORES REVERSÍVEIS COMPETITIVOS IRREVERSÍVEIS NÃO COMPETITIVOS INCOMPETITIVOS

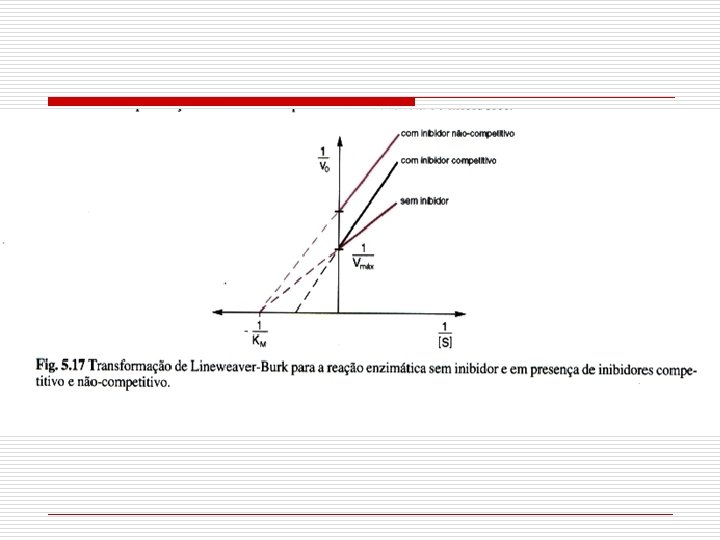
39 ENZIMAS – INIBIÇÃO COMPETITIVA û Inibidor competitivo concorre com o S pelo sitio ativo da E livre. û I análogo não metabolizável, derivado de um S verdadeiro, S substituto da E ou um P da reação. I compostos com estrutura molecular lembra S afinidade da enzima pelo substrato [substrato] necessária para obter a mesma [ES] Km aparente da enzima

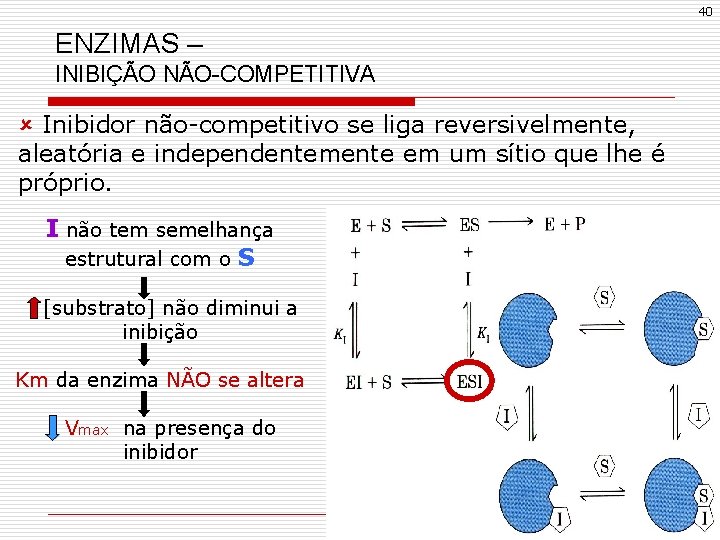
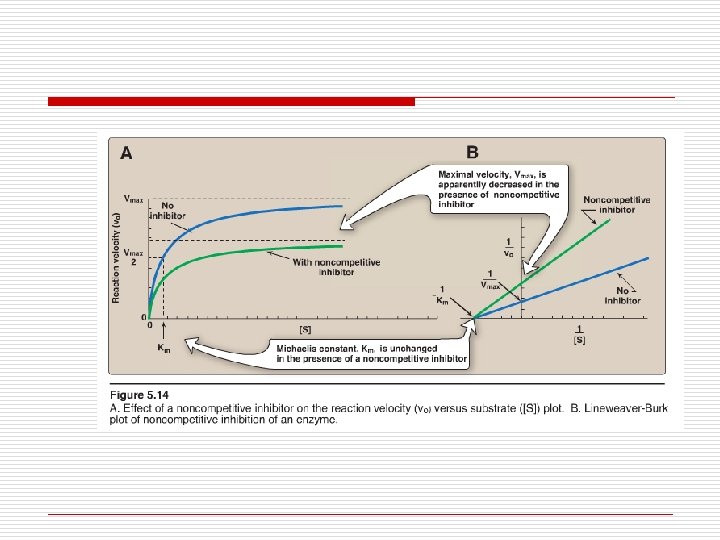
40 ENZIMAS – INIBIÇÃO NÃO-COMPETITIVA û Inibidor não-competitivo se liga reversivelmente, aleatória e independentemente em um sítio que lhe é próprio. I não tem semelhança estrutural com o S [substrato] não diminui a inibição Km da enzima NÃO se altera Vmax na presença do inibidor

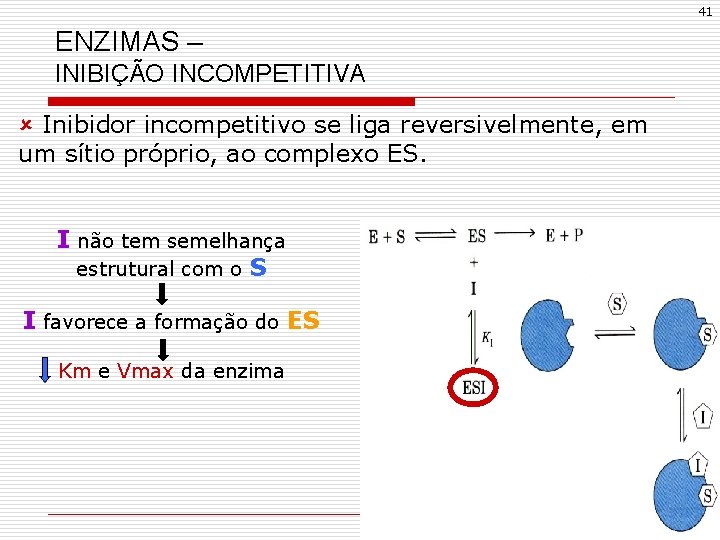
41 ENZIMAS – INIBIÇÃO INCOMPETITIVA û Inibidor incompetitivo se liga reversivelmente, em um sítio próprio, ao complexo ES. I não tem semelhança estrutural com o S I favorece a formação do ES Km e Vmax da enzima

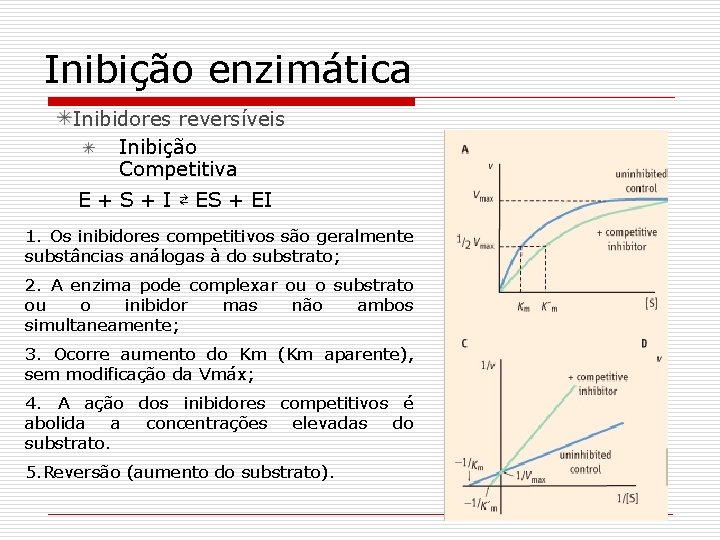
Inibição enzimática Inibidores reversíveis Inibição Competitiva E + S + I ⇄ ES + EI 1. Os inibidores competitivos são geralmente substâncias análogas à do substrato; 2. A enzima pode complexar ou o substrato ou o inibidor mas não ambos simultaneamente; 3. Ocorre aumento do Km (Km aparente), sem modificação da Vmáx; 4. A ação dos inibidores competitivos é abolida a concentrações elevadas do substrato. 5. Reversão (aumento do substrato).

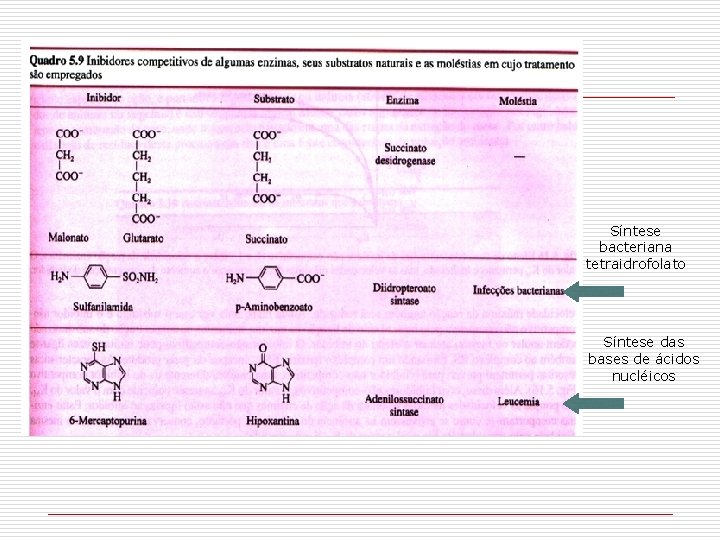
Síntese bacteriana tetraidrofolato Síntese das bases de ácidos nucléicos

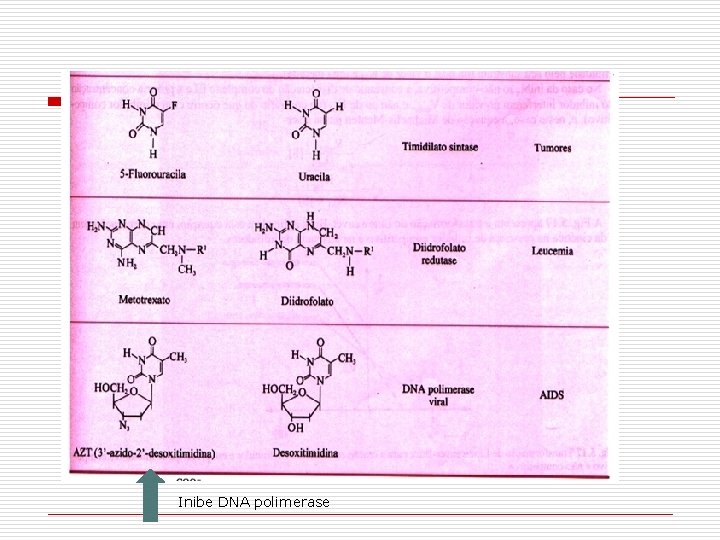
Inibe DNA polimerase

Inibição enzimática Inibição Nãocompetitiva E + S + I ⇄ ES + EIS 1. O inibidor se liga à enzima num local diferente do sítio ativo; 2. A enzima pode combinar-se simultaneamente com o substrato e o inibidor; 3. Ocorre diminuição aparente do Vmáx (menos enzimas); 4. O inibidor afeta apropriada à catálise. a configuração Ex: metais pesados SH proteínas mais



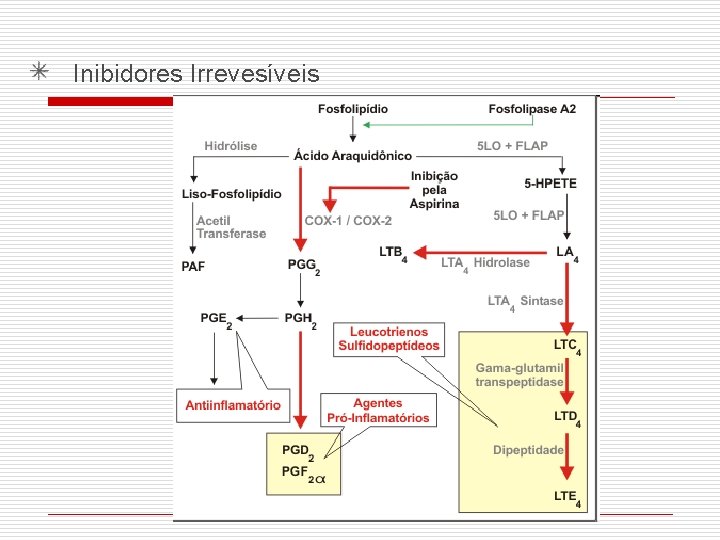
48 ENZIMAS – INIBIÇÃO IRREVERSÍVEL û I se combina com um grupo funcional, na molécula da E, que é essencial para sua atividade. û Podem promover a destruição do grupo funcional û Forma-se uma ligação COVALENTE entre o I e a E. û Vmax parte da E é completamente removida do sistema e Km permanece a mesma. E+S + I EI K 1 ES K 2 E+P

Inibição enzimática Inibidores Irrevesíveis Gases tóxicos derivados de Ácidos fluorfosfórico (HPO 2 F 2, H 2 PO 3 F) organofosforados carbamatos Sítio ativo da colinesterase

Inibidores Irrevesíveis

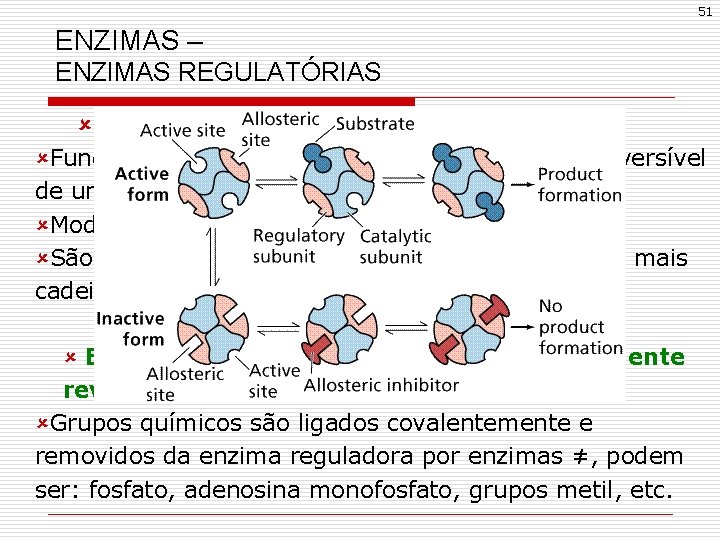
51 ENZIMAS – ENZIMAS REGULATÓRIAS û Enzimas alostéricas ûFuncionam através da ligação não-covalente e reversível de um metabólito regulador chamado modulador; ûModuladores podem ser inibidores ou ativadores; ûSão maiores e mais complexas, possuem duas ou mais cadeias polipeptídicas. û Enzimas reguladas pela modificação covalente reversível ûGrupos químicos são ligados covalentemente e removidos da enzima reguladora por enzimas ≠, podem ser: fosfato, adenosina monofosfato, grupos metil, etc.

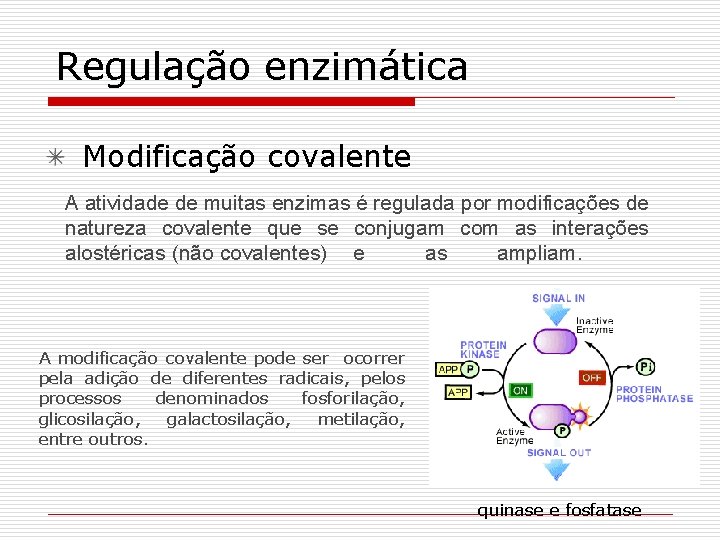
Regulação enzimática Modificação covalente A atividade de muitas enzimas é regulada por modificações de natureza covalente que se conjugam com as interações alostéricas (não covalentes) e as ampliam. A modificação covalente pode ser ocorrer pela adição de diferentes radicais, pelos processos denominados fosforilação, glicosilação, galactosilação, metilação, entre outros. quinase e fosfatase

Cinética enzimática Equação de Michaelis. Menten reversível É baseado nos seguintes pressupostos: • E, S e ES estão em equilíbrio; • a conversão de ES em E + P é uma etapa irreversível e limitante da velocidade. • Velocidade inicial é calculada quando a enzima é misturada ao substrato, sendo nesse momento o produto muito pequeno. Km= K 2 + K 3/K 1



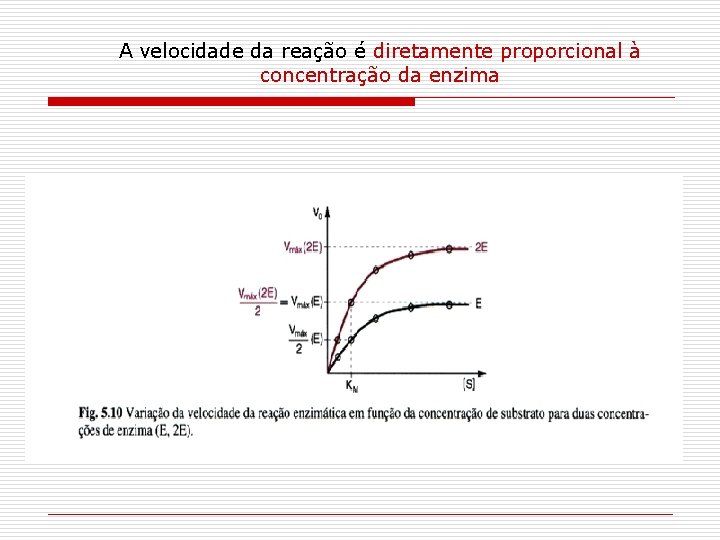
A velocidade da reação é diretamente proporcional à concentração da enzima
 Alternancia de geração
Alternancia de geração Parasitas
Parasitas Bacia hidrográfica do rio lima
Bacia hidrográfica do rio lima Nascente leito margens
Nascente leito margens Foz endorreica
Foz endorreica Tipos de foz de um rio
Tipos de foz de um rio Leonardo fibonacci leonardo pisano (fibonacci)
Leonardo fibonacci leonardo pisano (fibonacci) Equipamentos ativos de rede
Equipamentos ativos de rede Washington luiz ferreira rios
Washington luiz ferreira rios Rui seabra ferreira junior
Rui seabra ferreira junior Bruno ferreira cypriano
Bruno ferreira cypriano Ostracodermes
Ostracodermes Tiago toledo ferreira
Tiago toledo ferreira Exsudato e transudato
Exsudato e transudato Muriel ferreira
Muriel ferreira Econofísica livros
Econofísica livros Rafael de vasconcelos xavier ferreira
Rafael de vasconcelos xavier ferreira Tipos de isometrias
Tipos de isometrias Thatiana ferreira vieira nutricionista
Thatiana ferreira vieira nutricionista Annabel ferreira
Annabel ferreira Maria de jesus quental ferreira
Maria de jesus quental ferreira Nivan ferreira
Nivan ferreira Juvinal ferreira
Juvinal ferreira Rosana louro ferreira silva
Rosana louro ferreira silva Joseph ferreira mit
Joseph ferreira mit Tipos de libros de contabilidad
Tipos de libros de contabilidad Gina ferreira
Gina ferreira Antonio alfredo ferreira loureiro
Antonio alfredo ferreira loureiro Metade de mim ferreira gullar
Metade de mim ferreira gullar Alysson ferreira
Alysson ferreira Dr miguel morayta rizal
Dr miguel morayta rizal Eduardo pilonieta pinilla
Eduardo pilonieta pinilla Eduardo ronchetti
Eduardo ronchetti Andrés eduardo cusi arredondo
Andrés eduardo cusi arredondo Eduardo nunca (entrenarse) tanto en invierno
Eduardo nunca (entrenarse) tanto en invierno Sharing
Sharing Eduardo salaz
Eduardo salaz Eduardo lima artista
Eduardo lima artista Obras de eduardo kingman
Obras de eduardo kingman Eduardo garcia el gitano
Eduardo garcia el gitano Carlos eduardo carvalho lima
Carlos eduardo carvalho lima Bolsa eduardo panadés
Bolsa eduardo panadés Perfil maternal eduardo kingman
Perfil maternal eduardo kingman Organigrama del municipio de acapulco
Organigrama del municipio de acapulco Eduardo novoa
Eduardo novoa Eduardo en letra cursiva para copiar y pegar
Eduardo en letra cursiva para copiar y pegar Eduardo manzano
Eduardo manzano Armas mendez, hugo eduardo
Armas mendez, hugo eduardo Eduardo mazza
Eduardo mazza Principios logicos
Principios logicos Eduardo platero
Eduardo platero Argumento de no oyes ladrar los perros
Argumento de no oyes ladrar los perros Bleeding diathesis
Bleeding diathesis Triangle of doom and pain
Triangle of doom and pain Placa de ateroma
Placa de ateroma Escala de patterson
Escala de patterson Eduardo daverin
Eduardo daverin