Prof Agamenon Roberto Prof Agamenon Roberto H H

Prof. Agamenon Roberto

Prof. Agamenon Roberto
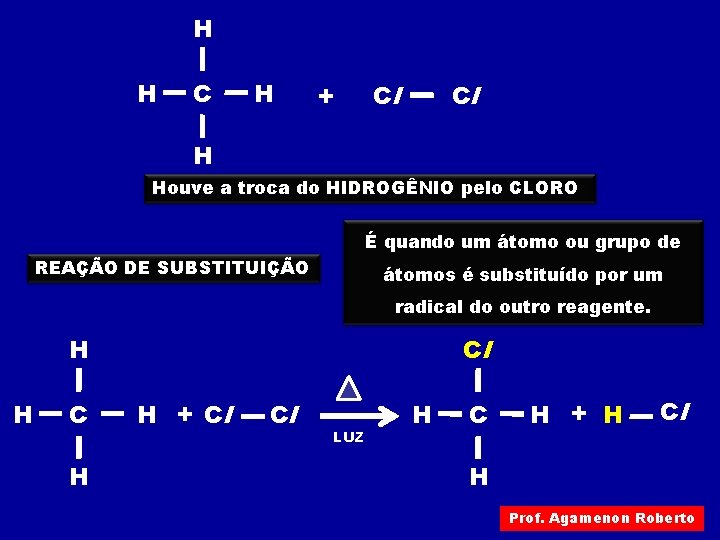
H H C H + Cl Cl H Houve a troca do HIDROGÊNIO pelo CLORO É quando um átomo ou grupo de REAÇÃO DE SUBSTITUIÇÃO átomos é substituído por um radical do outro reagente. Cl H H C H H + Cl Cl LUZ H C H + H Cl H Prof. Agamenon Roberto
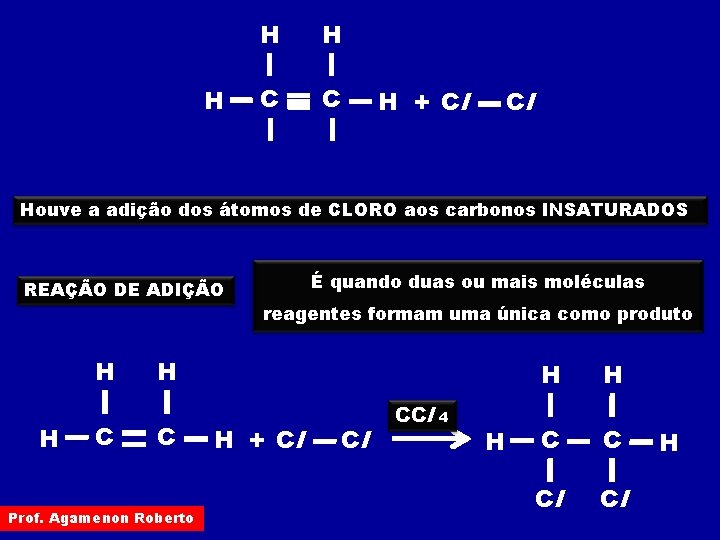
H H H C C H + Cl Cl Houve a adição dos átomos de CLORO aos carbonos INSATURADOS REAÇÃO DE ADIÇÃO H H C É quando duas ou mais moléculas reagentes formam uma única como produto H C Prof. Agamenon Roberto H + Cl Cl CCl 4 H H H C C Cl Cl H

H H OH C C H H H + H 2 O Ocorreu a saída de ÁGUA do etanol É quando de uma molécula são retirados REAÇÃO DE ELIMINAÇÃO dois átomos ou dois grupos de átomos sem que sejam substituídos por outros H H OH C C H H+ H C C H H H + H 2 O Prof. Agamenon Roberto

Entre os compostos orgânicos que sofrem reações de substituição destacam-se v Os alcanos. v O benzeno e seus derivados. v Os haletos de alquila. v Os alcoóis. v Os ácidos carboxílicos. Prof. Agamenon Roberto

É quando substituímos um ou mais átomos de hidrogênio de um alcano por átomos dos halogênios H H LUZ H C H H + Cl Cl H C Cl + H Cl H Prof. Agamenon Roberto

Podemos realizar a substituição dos demais átomos de hidrogênio sucessivamente, resultando nos compostos CH 4 Cl 2 HCl H 3 CCl Cl 2 HCl H 2 CCl 2 HCl HCCl 3 Cl 2 CCl 4 HCl Prof. Agamenon Roberto

A halogenação de alcanos é uma reação por radicais livres, ou seja, uma reação RADICALAR Para iniciar esse tipo de reação, temos que produzir alguns radicais livres, e as condições para isso são luz de frequência adequada ou aquecimento Prof. Agamenon Roberto
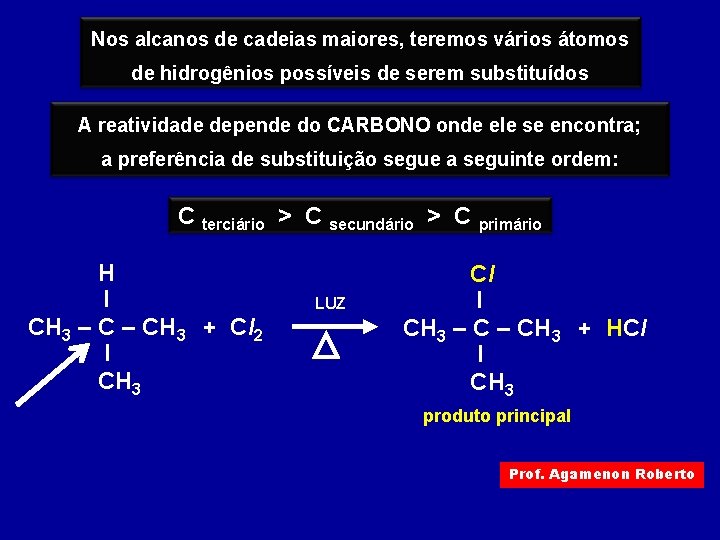
Nos alcanos de cadeias maiores, teremos vários átomos de hidrogênios possíveis de serem substituídos A reatividade depende do CARBONO onde ele se encontra; a preferência de substituição segue a seguinte ordem: C terciário > C secundário > C primário H I CH 3 – CH 3 + Cl 2 I CH 3 LUZ Cl I CH 3 – CH 3 + HCl I CH 3 produto principal Prof. Agamenon Roberto
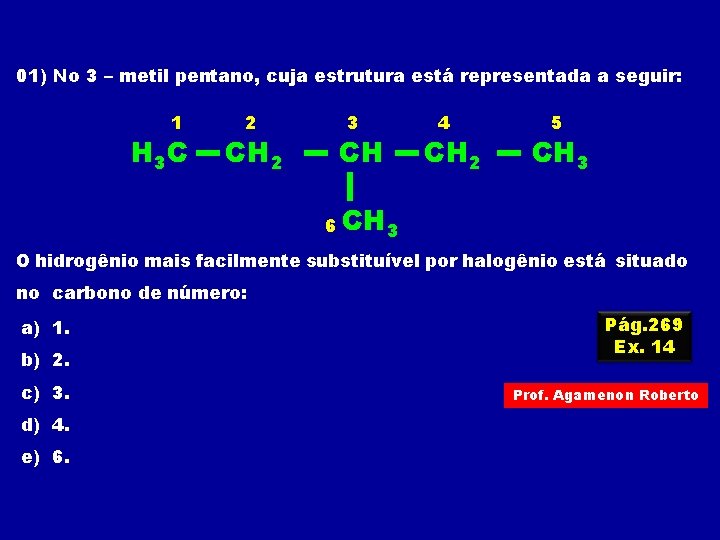
01) No 3 – metil pentano, cuja estrutura está representada a seguir: 1 H 3 C 2 CH 2 3 CH 4 CH 2 5 CH 3 6 CH 3 O hidrogênio mais facilmente substituível por halogênio está situado no carbono de número: a) 1. b) 2. c) 3. d) 4. e) 6. Pág. 269 Ex. 14 Prof. Agamenon Roberto
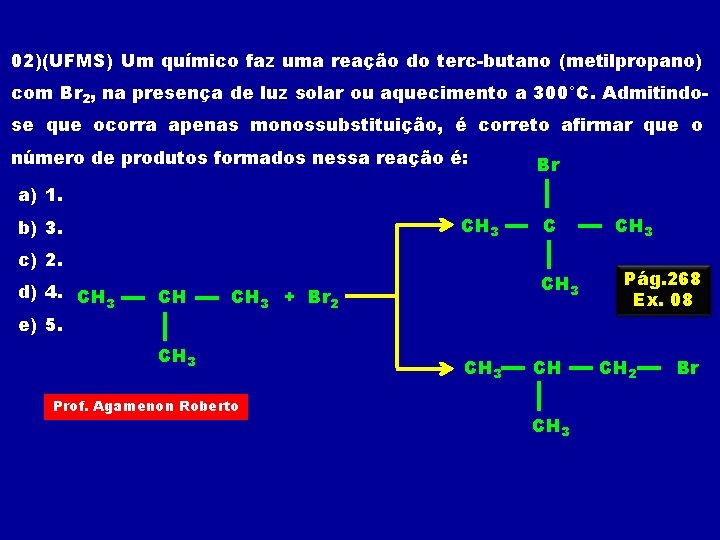
02)(UFMS) Um químico faz uma reação do terc-butano (metilpropano) com Br 2, na presença de luz solar ou aquecimento a 300°C. Admitindose que ocorra apenas monossubstituição, é correto afirmar que o número de produtos formados nessa reação é: Br a) 1. CH 3 b) 3. c) 2. d) 4. CH 3 e) 5. CH CH 3 + Br 2 CH 3 Prof. Agamenon Roberto C CH 3 Pág. 268 Ex. 08 CH 2 Br

03)(Mackenzie-SP) (a) CH 4 + (b) Cl 2 λ CHCl 3 + (c) HCl Da halogenação acima equacionada, considere as afirmações I, III e IV. I. Representa uma reação de adição. II. Se o coeficiente do balanceamento (a) é igual a 1, então (b) e (c) são iguais a 3. III. O produto X tem fórmula molecular HCl. IV. Um dos reagentes é o metano. Das afirmações feitas, estão corretas: a) I, III e IV. b) I e IV, somente. c) II, III e IV, somente. d) II e III, somente. e) I, II e III, somente. Pág. 268 Ex. 02 Prof. Agamenon Roberto
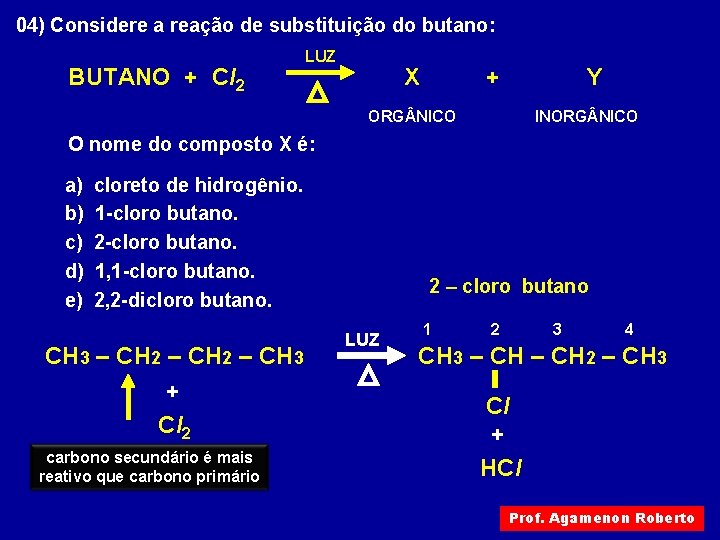
04) Considere a reação de substituição do butano: BUTANO + Cl 2 LUZ X + Y ORG NICO INORG NICO O nome do composto X é: a) b) c) d) e) cloreto de hidrogênio. 1 -cloro butano. 2 -cloro butano. 1, 1 -cloro butano. 2, 2 -dicloro butano. CH 3 – CH 2 – CH 3 + Cl 2 carbono secundário é mais reativo que carbono primário 2 – cloro butano LUZ 1 2 3 4 CH 3 – CH 2 – CH 3 Cl + HCl Prof. Agamenon Roberto
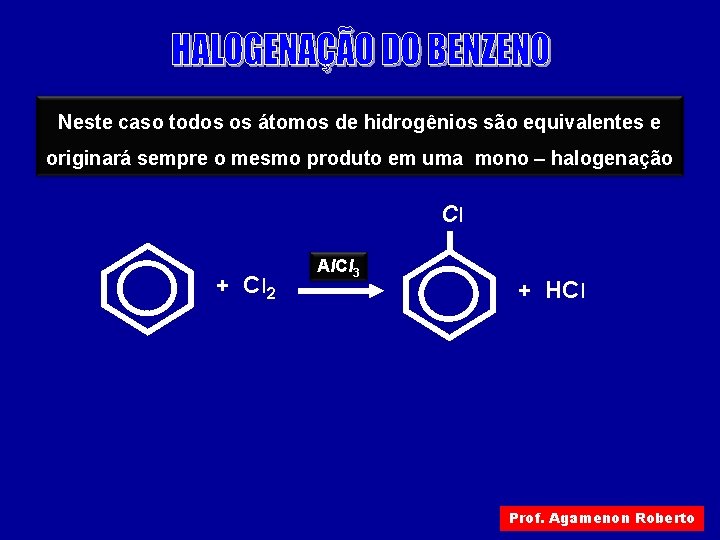
Neste caso todos os átomos de hidrogênios são equivalentes e originará sempre o mesmo produto em uma mono – halogenação Cl + Cl 2 Al. Cl 3 + HCl Prof. Agamenon Roberto
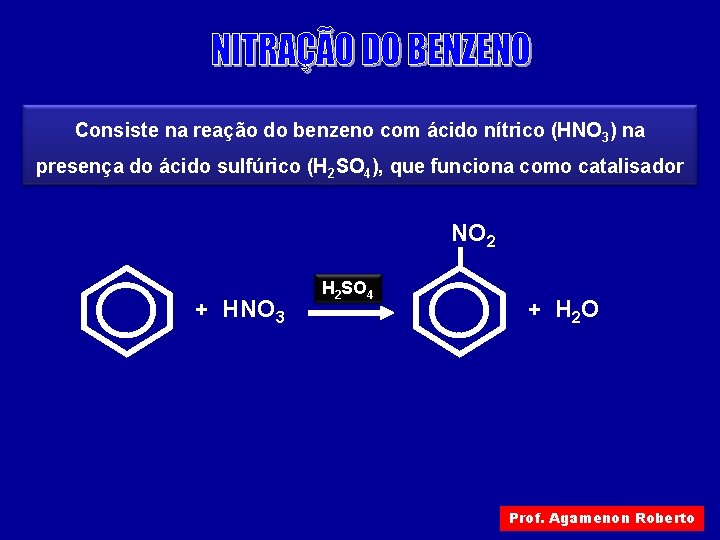
Consiste na reação do benzeno com ácido nítrico (HNO 3) na presença do ácido sulfúrico (H 2 SO 4), que funciona como catalisador NO 2 + HNO 3 H 2 SO 4 + H 2 O Prof. Agamenon Roberto
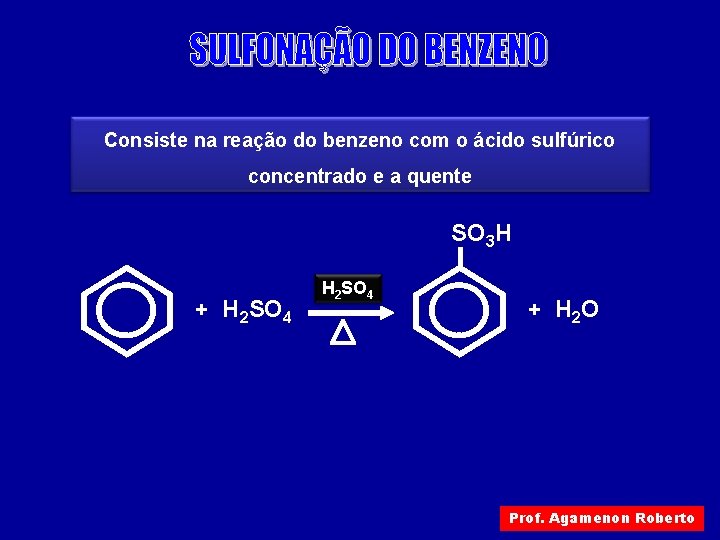
Consiste na reação do benzeno com o ácido sulfúrico concentrado e a quente SO 3 H + H 2 SO 4 + H 2 O Prof. Agamenon Roberto
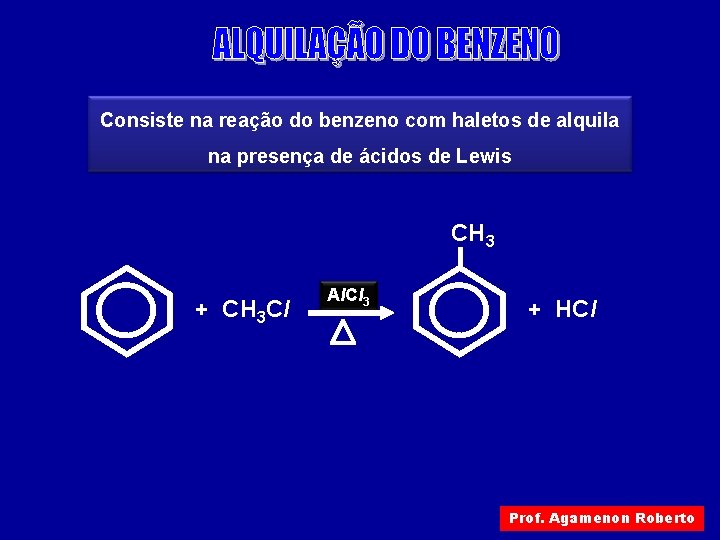
Consiste na reação do benzeno com haletos de alquila na presença de ácidos de Lewis CH 3 + CH 3 Cl Al. Cl 3 + HCl Prof. Agamenon Roberto
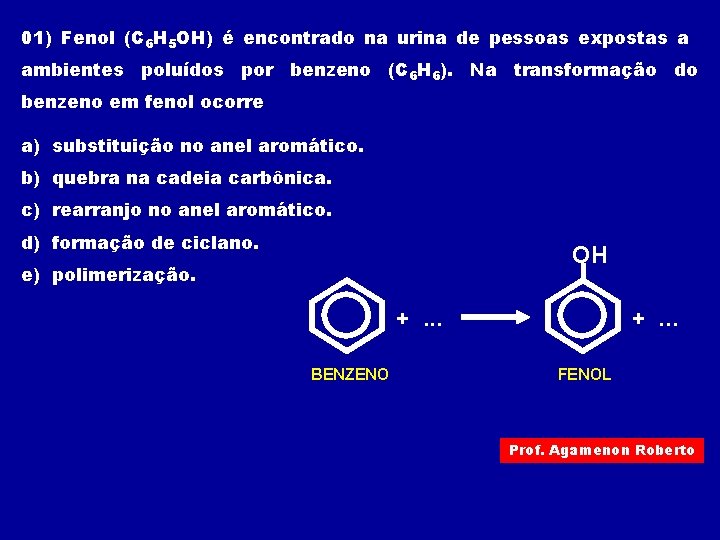
01) Fenol (C 6 H 5 OH) é encontrado na urina de pessoas expostas a ambientes poluídos por benzeno (C 6 H 6). Na transformação do benzeno em fenol ocorre a) substituição no anel aromático. b) quebra na cadeia carbônica. c) rearranjo no anel aromático. d) formação de ciclano. OH e) polimerização. +. . . BENZENO FENOL Prof. Agamenon Roberto
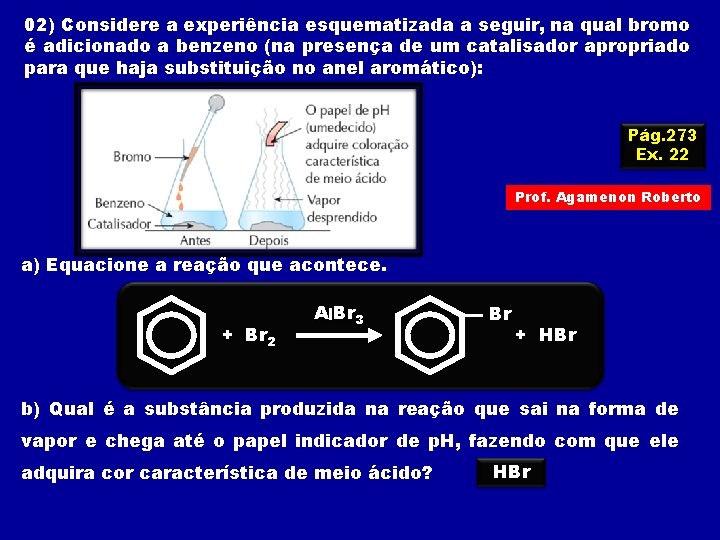
02) Considere a experiência esquematizada a seguir, na qual bromo é adicionado a benzeno (na presença de um catalisador apropriado para que haja substituição no anel aromático): Pág. 273 Ex. 22 Prof. Agamenon Roberto a) Equacione a reação que acontece. + Br 2 Al. Br 3 Br + HBr b) Qual é a substância produzida na reação que sai na forma de vapor e chega até o papel indicador de p. H, fazendo com que ele adquira cor característica de meio ácido? HBr
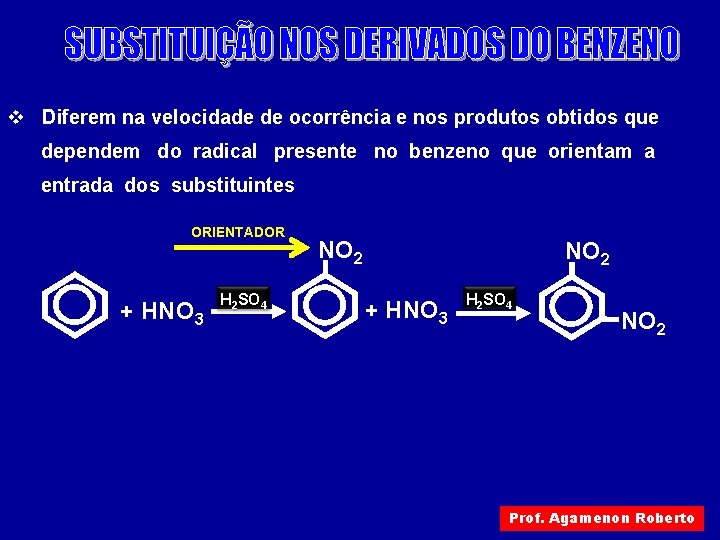
v Diferem na velocidade de ocorrência e nos produtos obtidos que dependem do radical presente no benzeno que orientam a entrada dos substituintes ORIENTADOR + HNO 3 H 2 SO 4 NO 2 Prof. Agamenon Roberto

Assim teremos: ORIENTADORES ORTO – PARA ( ATIVANTES ) – Cl ORIENTADORES META ( DESATIVANTES ) – OH – NO 2 – NH 2 – SO 3 H – CH 3 – CN – Br –I – COOH ( DESATIVANTES ) Os orientadores META possuem um átomo com ligação dupla ou tripla ligado ao benzeno Prof. Agamenon Roberto
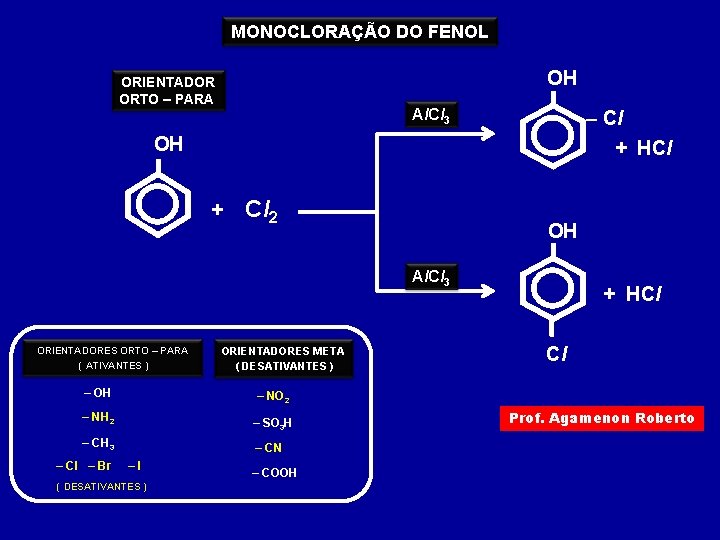
MONOCLORAÇÃO DO FENOL OH ORIENTADOR ORTO – PARA Al. Cl 3 – Cl + HCl OH + Cl 2 OH Al. Cl 3 ORIENTADORES ORTO – PARA ( ATIVANTES ) – OH Cl – NO 2 – NH 2 – SO 3 H – CH 3 – Cl – Br ORIENTADORES META ( DESATIVANTES ) + HCl – CN –I ( DESATIVANTES ) – COOH Prof. Agamenon Roberto
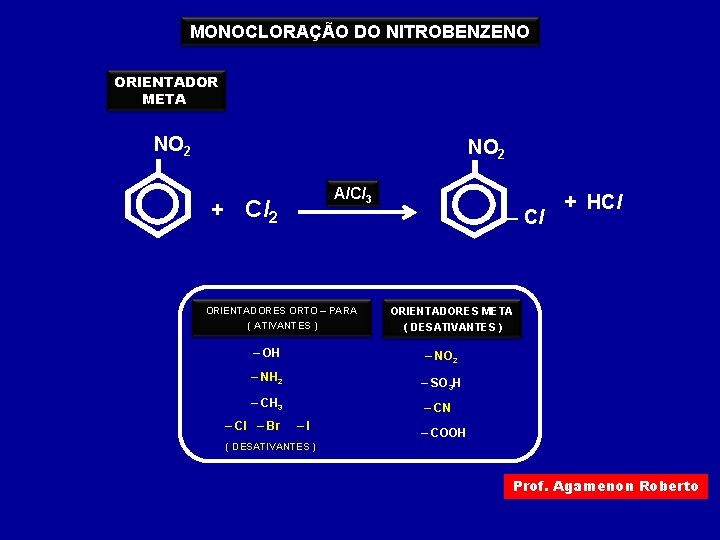
MONOCLORAÇÃO DO NITROBENZENO ORIENTADOR META NO 2 Al. Cl 3 + Cl 2 – Cl ORIENTADORES ORTO – PARA ( ATIVANTES ) – OH ORIENTADORES META ( DESATIVANTES ) – NO 2 – NH 2 – SO 3 H – CH 3 – Cl – Br + HCl – CN –I – COOH ( DESATIVANTES ) Prof. Agamenon Roberto
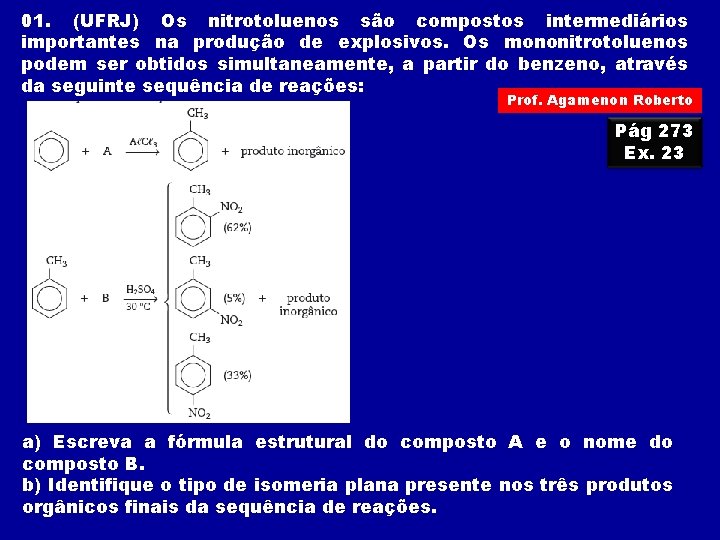
01. (UFRJ) Os nitrotoluenos são compostos intermediários importantes na produção de explosivos. Os mononitrotoluenos podem ser obtidos simultaneamente, a partir do benzeno, através da seguinte sequência de reações: Prof. Agamenon Roberto Pág 273 Ex. 23 a) Escreva a fórmula estrutural do composto A e o nome do composto B. b) Identifique o tipo de isomeria plana presente nos três produtos orgânicos finais da sequência de reações.
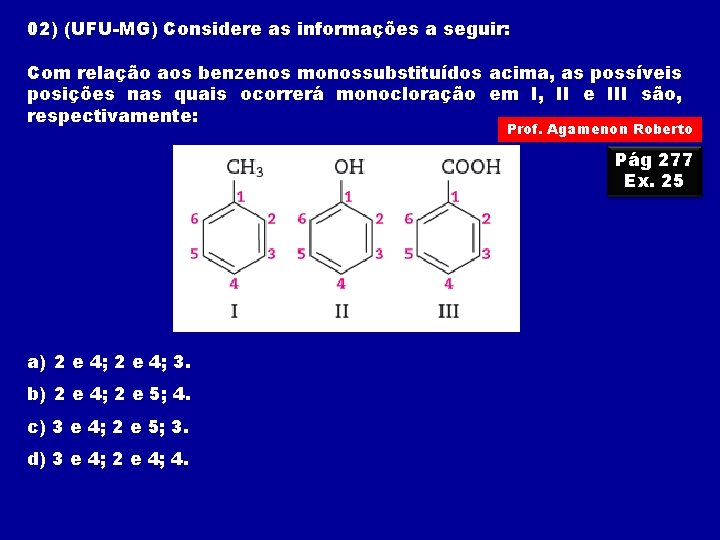
02) (UFU-MG) Considere as informações a seguir: Com relação aos benzenos monossubstituídos acima, as possíveis posições nas quais ocorrerá monocloração em I, II e III são, respectivamente: Prof. Agamenon Roberto Pág 277 Ex. 25 a) 2 e 4; 3. b) 2 e 4; 2 e 5; 4. c) 3 e 4; 2 e 5; 3. d) 3 e 4; 2 e 4; 4.

03. (PUC-PR) A monocloração do nitro-benzeno produz: a) o – cloro – nitro – benzeno. Prof. Agamenon Roberto b) m – cloro – nitro – benzeno. c) p – cloro – nitro – benzeno. d) uma mistura equimolecular de o – cloro – nitro - benzeno e p - cloro – nitro – benzeno. e) cloro – benzeno. Pág 278 Ex. 31

04. (Unifor-CE) A fórmula CH 3 CH 2 OH representa um composto: I. combustível Pág 287 Ex. 13 II. pouco solúvel em água III. que pode ser obtido pela hidratação do eteno É correto afirmar: a) I, somente. b) II e III, somente. c) II, somente. d) I, II e III. e) I e III, somente. Prof. Agamenon Roberto

05) (UNICAP-98) O clorobenzeno, ao reagir por substituição eletrofílica com: V 0 0 HNO 3, em presença de H 2 SO 4, produz 2 -nitroclorobenzeno. F 1 1 Cl 2, em presença de Fe. Cl 3, produz preferencialmente metadiclorobenzeno V 2 2 CH 3 Cl, em presença de Al. Cl 3, produz 4 -metilclorobenzeno. V 3 3 H 2 SO 4, em presença de SO 3, produz 2 -hidrogenosulfato de clorobenzeno. F 4 4 Br 2, produz preferencialmente, em presença de Fe. Cl 3 3 -bromo, cloro benzeno. Cl 1 6 2 o “cloro” é orientador orto-para e desativante 3 5 4 Prof. Agamenon Roberto
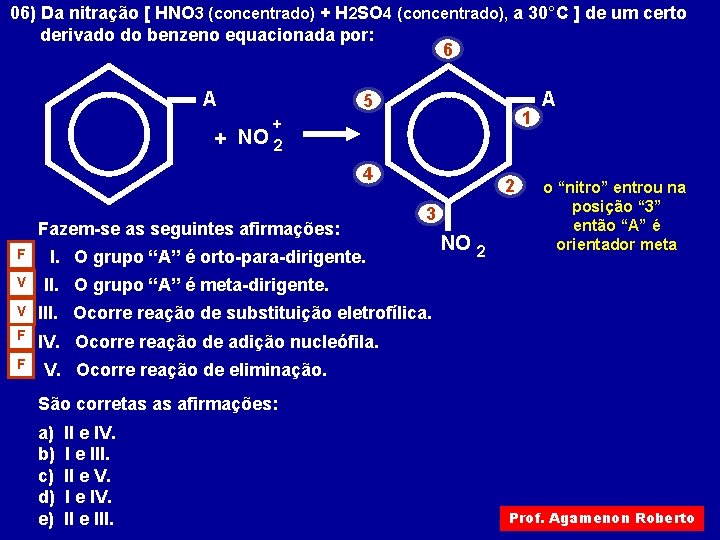
06) Da nitração [ HNO 3 (concentrado) + H 2 SO 4 (concentrado), a 30°C ] de um certo derivado do benzeno equacionada por: 6 A + NO 5 1 + 2 4 Fazem-se as seguintes afirmações: F V 2 3 I. O grupo “A” é orto-para-dirigente. 2 o “nitro” entrou na posição “ 3” então “A” é orientador meta II. O grupo “A” é meta-dirigente. V III. Ocorre reação de substituição eletrofílica. F IV. Ocorre reação de adição nucleófila. F NO A V. Ocorre reação de eliminação. São corretas as afirmações: a) b) c) d) e) II e IV. I e III. II e V. I e IV. II e III. Prof. Agamenon Roberto

REAÇÕES DE ADIÇÃO As reações de adição mais importantes ocorrem nos. . . v alcenos v alcinos v aldeídos v cetonas Prof. Agamenon Roberto
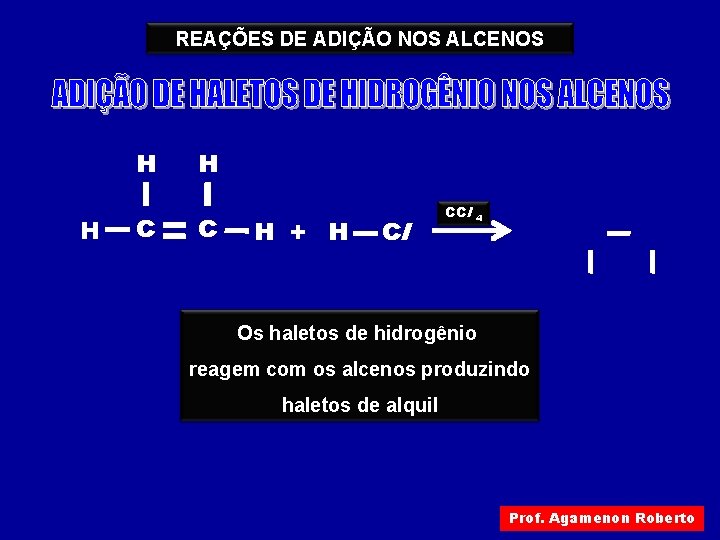
REAÇÕES DE ADIÇÃO NOS ALCENOS H H C H + H Cl CCl 4 Os haletos de hidrogênio reagem com os alcenos produzindo haletos de alquil Prof. Agamenon Roberto
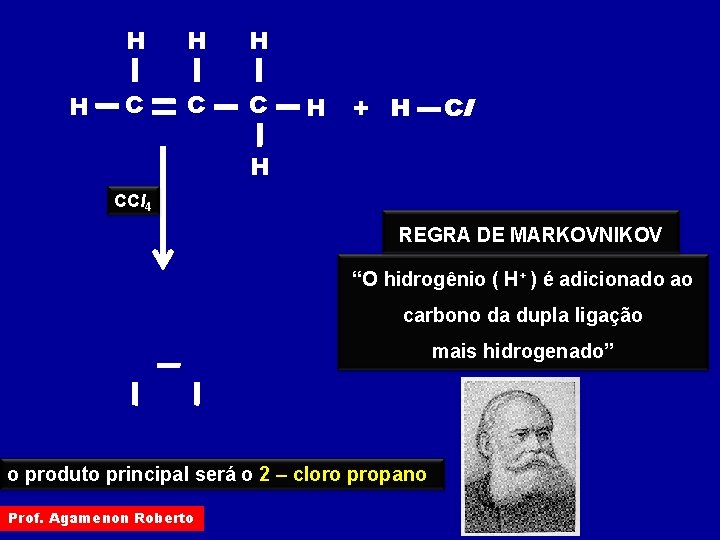
H H C C C H + H Cl H CCl 4 REGRA DE MARKOVNIKOV “O hidrogênio ( H+ ) é adicionado ao carbono da dupla ligação mais hidrogenado” o produto principal será o 2 – cloro propano Prof. Agamenon Roberto
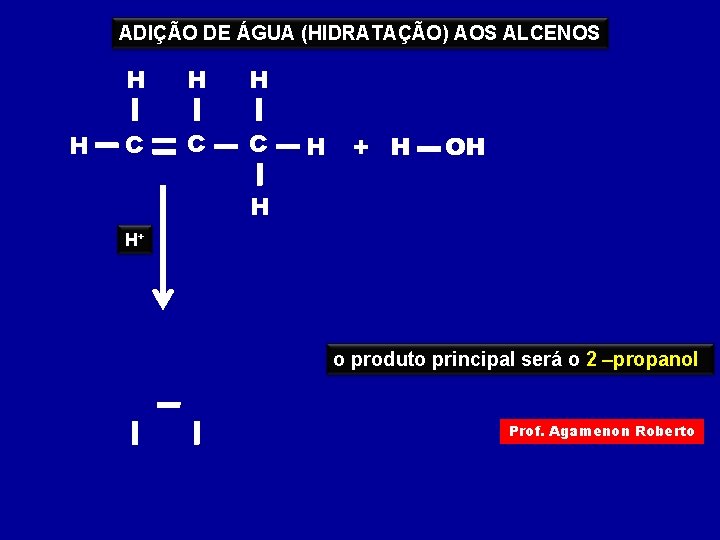
ADIÇÃO DE ÁGUA (HIDRATAÇÃO) AOS ALCENOS H H C C C H + H OH H H+ o produto principal será o 2 –propanol Prof. Agamenon Roberto
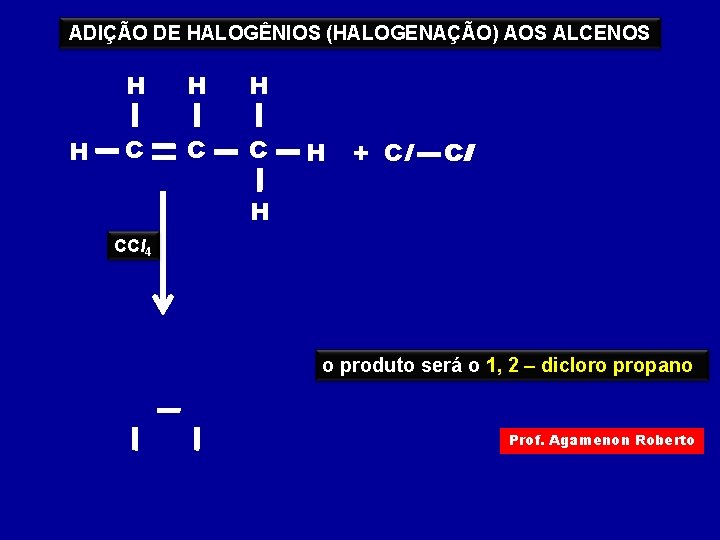
ADIÇÃO DE HALOGÊNIOS (HALOGENAÇÃO) AOS ALCENOS H H C C C H + Cl Cl H CCl 4 o produto será o 1, 2 – dicloro propano Prof. Agamenon Roberto
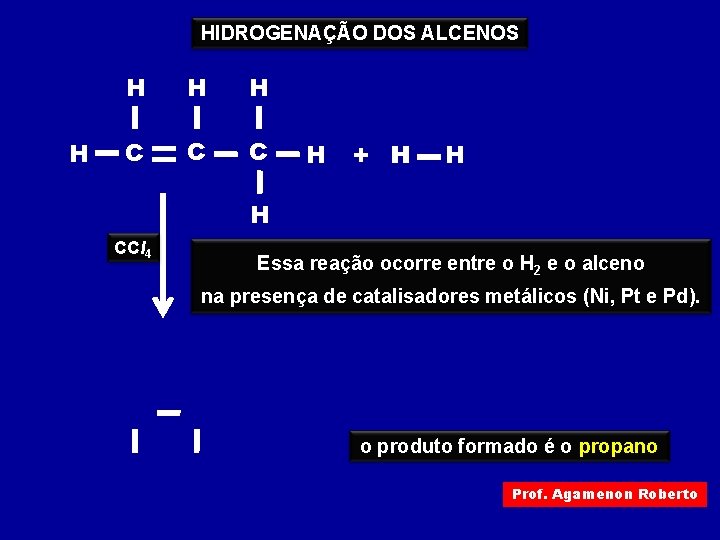
HIDROGENAÇÃO DOS ALCENOS H H C C C H + H H H CCl 4 Essa reação ocorre entre o H 2 e o alceno na presença de catalisadores metálicos (Ni, Pt e Pd). o produto formado é o propano Prof. Agamenon Roberto

01. (Fuvest-SP) Dois hidrocarbonetos insaturados, que são isômeros, foram submetidos, separadamente, à hidrogenação catalítica. Cada um deles reagiu com H 2 na proporção, em mols, de 1: 1, obtendo-se, em cada caso, um hidrocarboneto de fórmula C 4 H 10. Os hidrocarbonetos que foram hidrogenados poderiam ser: Prof. Agamenon Roberto a) 1 -butino e 1 -buteno. b) 1, 3 -butadieno e ciclobutano. Pág 285 Ex. 04 c) 2 -buteno e 2 -metilpropeno. d) 2 -butino e 1 -buteno. e) 2 -buteno e 2 -metilpropano. Prof. Agamenon Roberto

02) (UFRN) Observe o esquema reacional abaixo: Pág 287 Ex. 09 Sobre esses compostos, é correto afirmar que todas as reações são de: a) adição, sendo os produtos respectivamente: A = 1 -propanol; B = 1 cloro-propano e C = propano. b) substituição, sendo os produtos respectivamente: A = 1 -butanol; B = 2 -cloro-propano e C = propano. c) substituição; sendo os produtos respectivamente: A = 1 -hidróxi-2 propeno; B = 2 -cloro-1 -propeno e C = propeno. d) adição, sendo os produtos respectivamente: A = 1, 2 -propanodiol; B = 1, 2 -dicloropropano e C = propano. e) adição, sendo os produtos respectivamente: A = 2 -propanol; B = 2 cloro-propano e C = propano. Prof. Agamenon Roberto

03) Com respeito à equação: X + HBr C 6 H 13 Br Pode-se afirmar que X é um: a) b) c) d) e) alcano e a reação é de adição. alceno e a reação de substituição. alceno e a reação é de adição eletrofílica. alcano e a reação é de substituição eletrofílica. alcino e a reação é de substituição. Prof. Agamenon Roberto
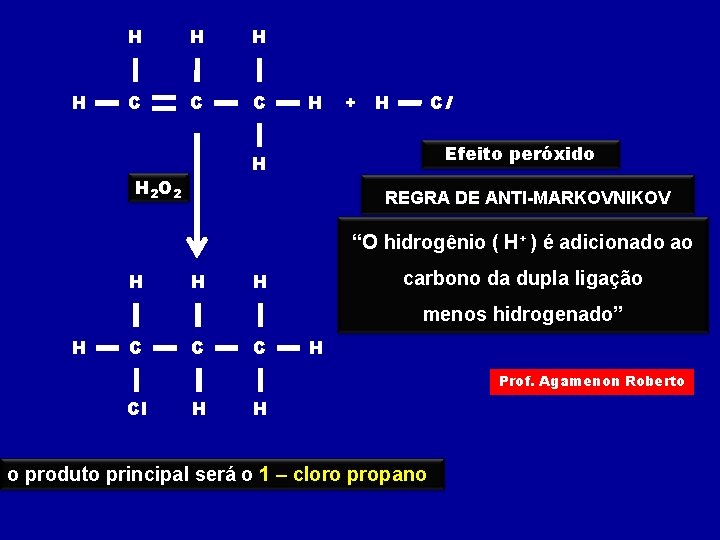
H H C C C H + Cl H Efeito peróxido H H 2 O 2 REGRA DE ANTI-MARKOVNIKOV “O hidrogênio ( H+ ) é adicionado ao H H carbono da dupla ligação H menos hidrogenado” H C C C H Prof. Agamenon Roberto Cl H H o produto principal será o 1 – cloro propano

ADIÇÃO DE HALETOS DE HIDROGÊNIO AOS ALCINOS Ocorre a adição de 1 mol do haleto de hidrogênio para, em seguida, ocorrer a adição de outro mol do haleto de hidrogênio H–C H C – CH 3 + H – Cl C – CH 3 Cl + H – Cl H–C C – CH 3 H Cl H–C H C – CH 3 Cl Prof. Agamenon Roberto
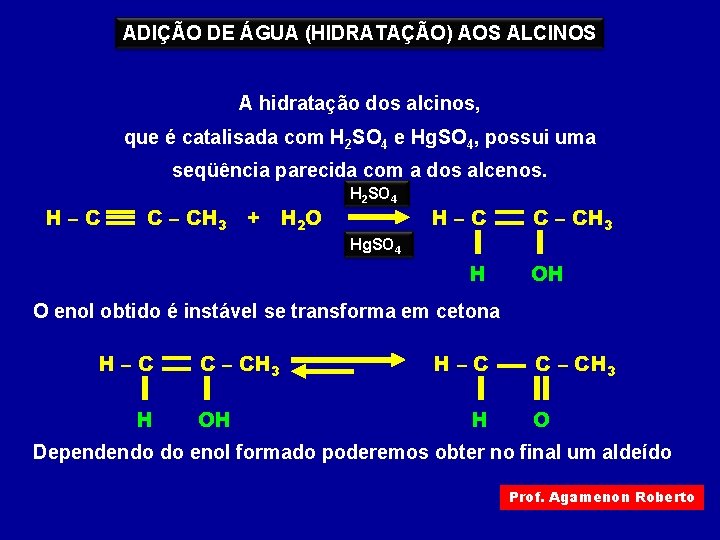
ADIÇÃO DE ÁGUA (HIDRATAÇÃO) AOS ALCINOS A hidratação dos alcinos, que é catalisada com H 2 SO 4 e Hg. SO 4, possui uma seqüência parecida com a dos alcenos. H–C C – CH 3 + H 2 O H 2 SO 4 H–C C – CH 3 Hg. SO 4 H OH O enol obtido é instável se transforma em cetona H–C H C – CH 3 OH H–C H C – CH 3 O Dependendo do enol formado poderemos obter no final um aldeído Prof. Agamenon Roberto
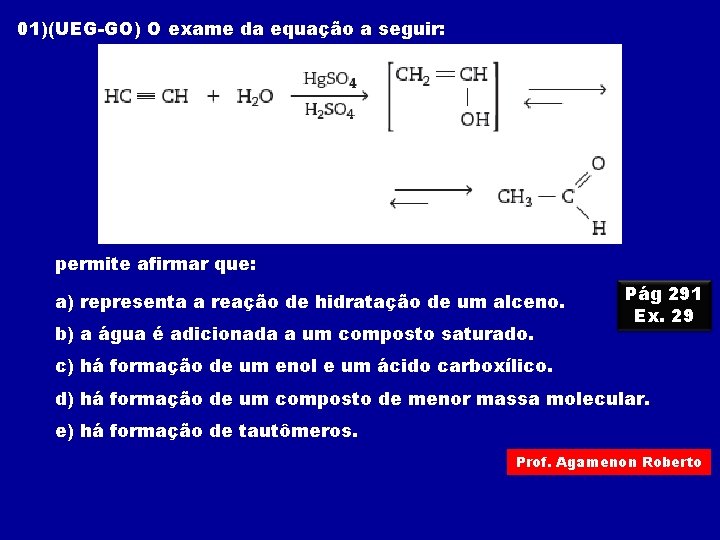
01)(UEG-GO) O exame da equação a seguir: permite afirmar que: a) representa a reação de hidratação de um alceno. b) a água é adicionada a um composto saturado. Pág 291 Ex. 29 c) há formação de um enol e um ácido carboxílico. d) há formação de um composto de menor massa molecular. e) há formação de tautômeros. Prof. Agamenon Roberto

REAÇÕES DE ADIÇÃO A “ DIENOS ” Os dienos (ou alcadienos) são hidrocarbonetos de cadeia aberta contendo duas ligações duplas São divididos pelos químicos em três grupos: Dienos acumulados: H 2 C = CH – CH 3 Possuem ligações duplas vizinhas Dienos conjugados: H 2 C = CH – CH = CH 2 Possuem duplas separadas por apenas uma ligação Dienos isolados: H 2 C = CH – CH 2 – CH = CH 2 Possuem duplas separadas por mais de uma ligação Prof. Agamenon Roberto

Os DIENOS ACUMULADOS comportam-se como se fossem “um alceno em dobro” nas reações de adição Prof. Agamenon Roberto Cl H 2 C = CH – CH 3 + 2 Cl H 2 C – CH 3 Cl Cl Os DIENOS ISOLADOS seguem o mesmo padrão, também se comportando como se fossem “um alceno em dobro”

Os DIENOS CONJUGADOS, por sua vez, exibem um comportamento muito especial Quando 1 mol de dieno conjugado reage com 1 mol da substância a ser adicionada (HCl, HBr etc. ), dois caminhos são possíveis Um deles é a adição normal (ou adição 1, 2) H 2 C = CH – CH = CH 2 + HCl H 2 C – C = CH – CH 3 H Cl Prof. Agamenon Roberto
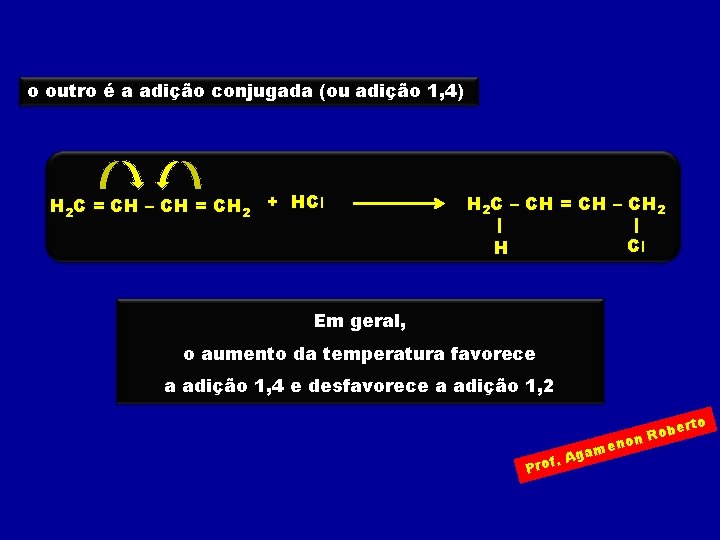
o outro é a adição conjugada (ou adição 1, 4) H 2 C = CH – CH = CH 2 + HCl H 2 C – CH = CH – CH 2 Cl H Em geral, o aumento da temperatura favorece a adição 1, 4 e desfavorece a adição 1, 2 rto e Rob n o n ame g A. Prof
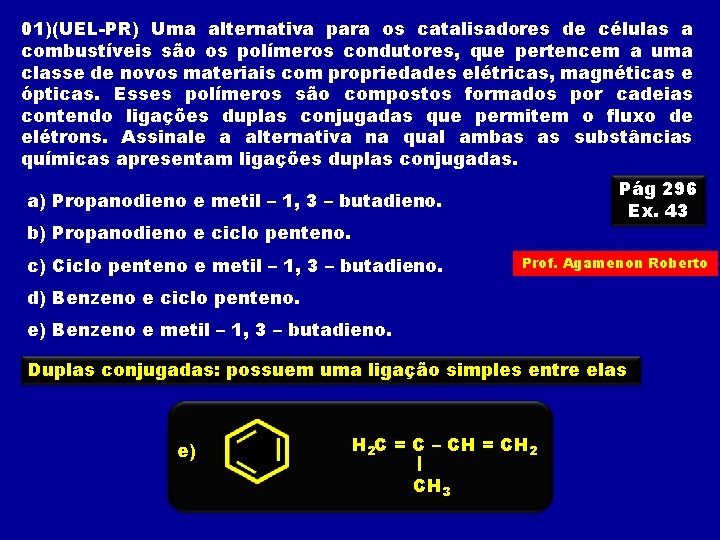
01)(UEL-PR) Uma alternativa para os catalisadores de células a combustíveis são os polímeros condutores, que pertencem a uma classe de novos materiais com propriedades elétricas, magnéticas e ópticas. Esses polímeros são compostos formados por cadeias contendo ligações duplas conjugadas que permitem o fluxo de elétrons. Assinale a alternativa na qual ambas as substâncias químicas apresentam ligações duplas conjugadas. Pág 296 Ex. 43 a) Propanodieno e metil – 1, 3 – butadieno. b) Propanodieno e ciclo penteno. c) Ciclo penteno e metil – 1, 3 – butadieno. Prof. Agamenon Roberto d) Benzeno e ciclo penteno. e) Benzeno e metil – 1, 3 – butadieno. Duplas conjugadas: possuem uma ligação simples entre elas e) H 2 C = C – CH = CH 2 CH 3

02) O manjericão é umaasplanta cujas folhas são utilizadas em c) adição de HCl, a todas ligações duplas. culinária para elaborar deliciosos molhos, como é o caso do exótico pesto genovês responsáveis pelo aroma Br. HUma das Hsubstâncias Br Br H característico do manjericão é o ocimeno, cuja fórmula estrutural é H 3 Ca –seguir. C – CH 2 – CH 2 mostrada Prof. Agamenon Roberto CH 3 Pág 296 Ex. 45 Represente a fórmula estrutural do produto obtido quando o ocimeno sofre: a) hidrogenação catalítica completa; H 3 C – CH 2 – CH 2 – CH 3 b) adição de bromo a todas as ligações duplas; Br Br Br H 3 C – CH – CH 2 CH 3
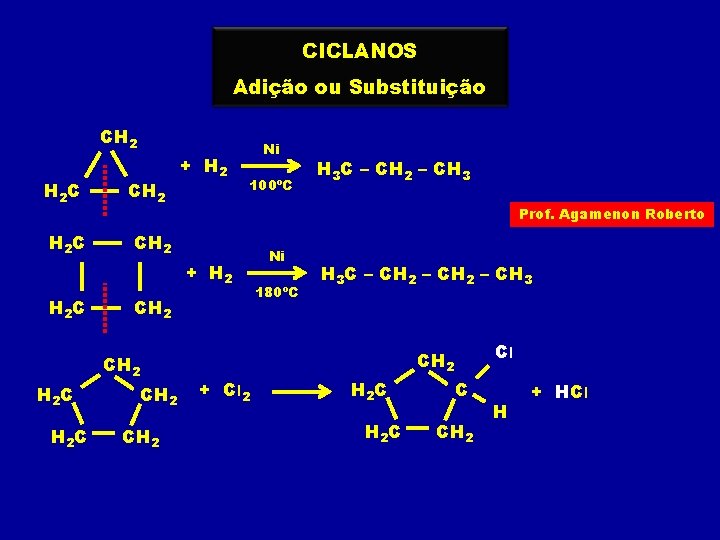
CICLANOS Adição ou Substituição CH 2 H 2 C CH 2 + H 2 Ni 100ºC Prof. Agamenon Roberto CH 2 + H 2 C CH 2 H 3 C – CH 2 – CH 3 Ni 180ºC H 3 C – CH 2 – CH 3 Cl CH 2 + Cl 2 H 2 C C CH 2 H + HCl
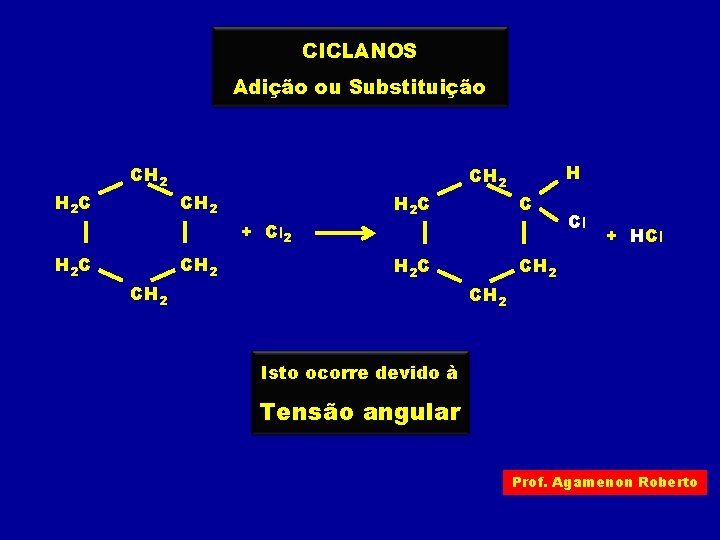
CICLANOS Adição ou Substituição H 2 C CH 2 H C + Cl 2 H 2 C CH 2 Cl + HCl CH 2 Isto ocorre devido à Tensão angular Prof. Agamenon Roberto

Teoria das tensões de Baeyer ngulos distantes de 109° 28’ 90º ngulos próximos de 109° 28’ 108º 60º Há tendência ao rompimento do anel Não há tendência ao rompimento do anel. Prof. Agamenon Roberto

Ciclo – hexano as moléculas de ciclo-hexano não são planares, existindo em duas conformações diferentes, chamadas de CADEIRA e BARCO 109º 28’ CADEIRA BARCO sofrem reações de substituição. Prof. Agamenon Roberto
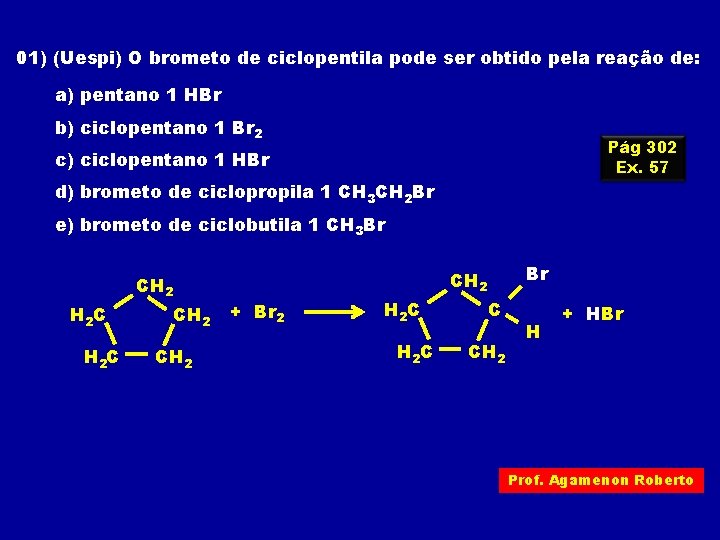
01) (Uespi) O brometo de ciclopentila pode ser obtido pela reação de: a) pentano 1 HBr b) ciclopentano 1 Br 2 Pág 302 Ex. 57 c) ciclopentano 1 HBr d) brometo de ciclopropila 1 CH 3 CH 2 Br e) brometo de ciclobutila 1 CH 3 Br CH 2 H 2 C CH 2 Br CH 2 + Br 2 H 2 C C CH 2 H + HBr Prof. Agamenon Roberto

ADIÇÃO DE REAGENTE DE GRIGNARD A ALDEÍDOS E CETONAS A adição de reagentes de Grignard (RMg. X), seguida de hidrólise, a aldeídos ou cetonas é um dos melhores processos para a PREPARAÇÃO DE ALCOÓIS O esquema geral do processo é: metanal + RMg. X aldeído + RMg. X cetona + RMg. X H 2 O álcool primário álcool secundário álcool terciário Prof. Agamenon Roberto
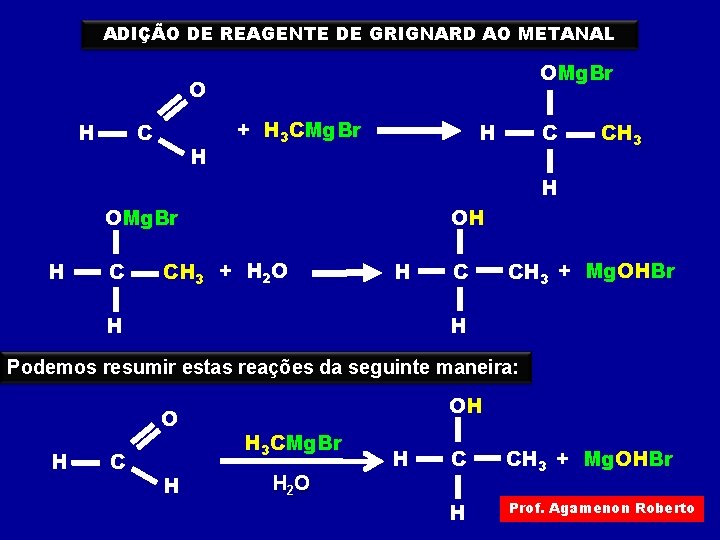
ADIÇÃO DE REAGENTE DE GRIGNARD AO METANAL OMg. Br O H C H + H 3 CMg. Br H C CH 3 H OMg. Br H C OH CH 3 + H 2 O H C CH 3 + Mg. OHBr H H Podemos resumir estas reações da seguinte maneira: O H C H OH H 3 CMg. Br H 2 O H C CH 3 + Mg. OHBr H Prof. Agamenon Roberto
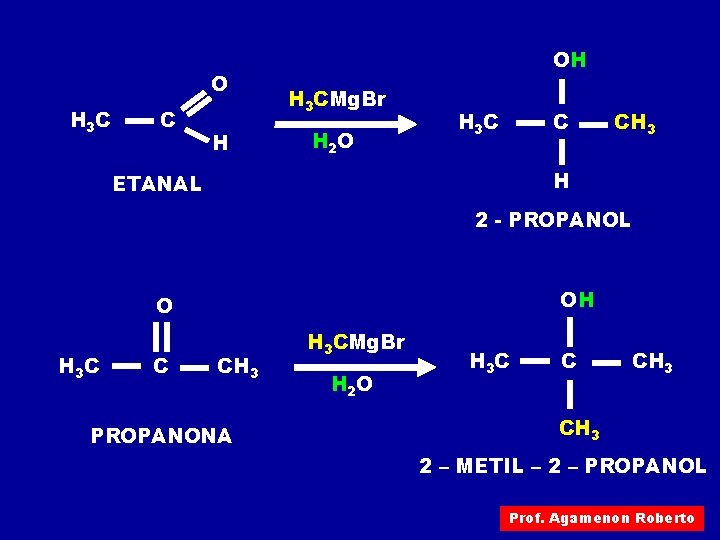
O H 3 C C H OH H 3 CMg. Br H 2 O H 3 C C CH 3 H ETANAL 2 - PROPANOL OH O H 3 C C CH 3 PROPANONA H 3 CMg. Br H 2 O H 3 C C CH 3 2 – METIL – 2 – PROPANOL Prof. Agamenon Roberto
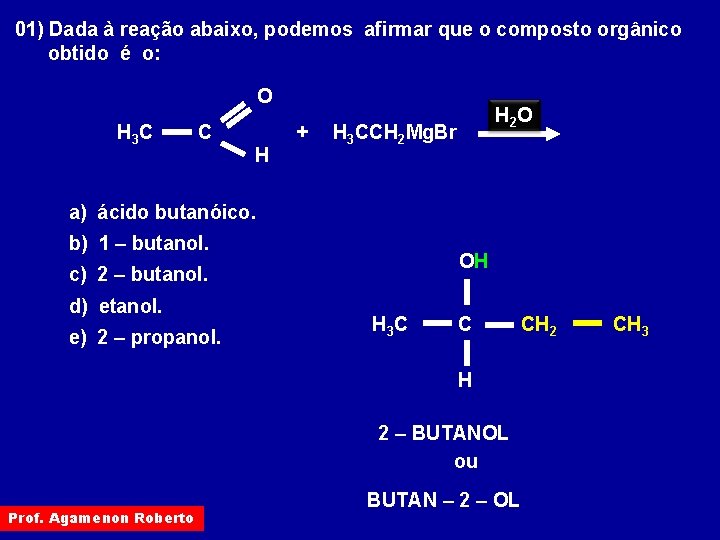
01) Dada à reação abaixo, podemos afirmar que o composto orgânico obtido é o: O H 3 C C + H H 2 O H 3 CCH 2 Mg. Br a) ácido butanóico. b) 1 – butanol. OH c) 2 – butanol. d) etanol. e) 2 – propanol. H 3 C C H 2 – BUTANOL ou Prof. Agamenon Roberto BUTAN – 2 – OL CH 2 CH 3
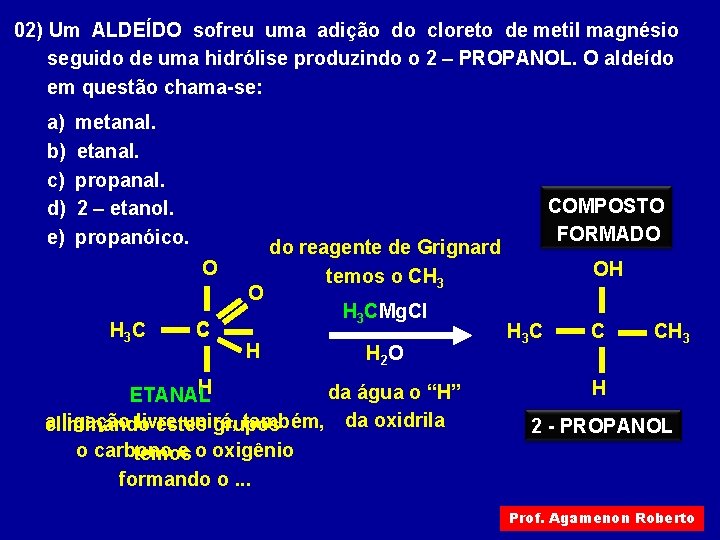
02) Um ALDEÍDO sofreu uma adição do cloreto de metil magnésio seguido de uma hidrólise produzindo o 2 – PROPANOL. O aldeído em questão chama-se: a) b) c) d) e) metanal. propanal. 2 – etanol. propanóico. O O H 3 C C H COMPOSTO FORMADO do reagente de Grignard temos o CH 3 H 3 CMg. Cl H 2 O H da água o “H” ETANAL a ligação livre unirá, também, da oxidrila eliminando estes grupos o carbono e o oxigênio temos formando o. . . OH H 3 C C CH 3 H 2 - PROPANOL Prof. Agamenon Roberto

REAÇÕES DE ELIMINAÇÃO As reações de eliminação são processos, em geral, inversos aos descritos para as reações de adição e, constituem métodos de obtenção de alcenos e alcinos Prof. Agamenon Roberto
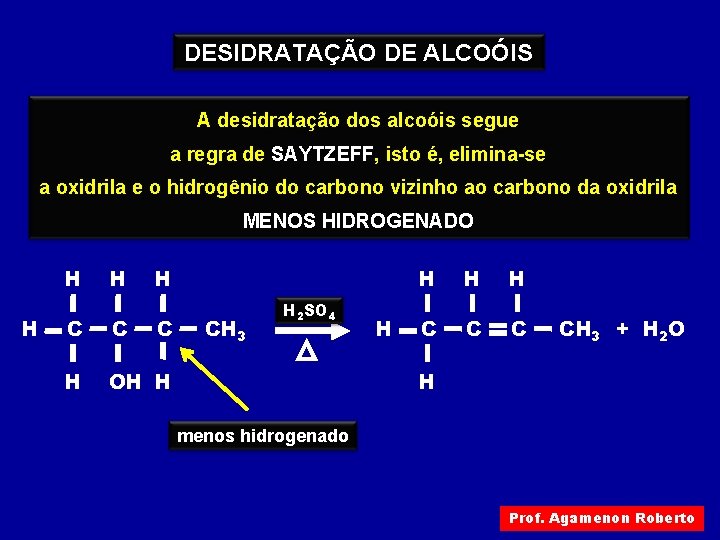
DESIDRATAÇÃO DE ALCOÓIS A desidratação dos alcoóis segue A desidratação (eliminação de água) de um álcool a regra de SAYTZEFF, isto é, elimina-se ocorre com aquecimento deste álcool a oxidrila e o hidrogênio do carbono vizinho ao carbono da oxidrila em presença de ácido sulfúrico MENOS HIDROGENADO H H C C C H OH H CH 3 H 2 SO 4 H H C CH 3 + H 2 O H menos hidrogenado Prof. Agamenon Roberto
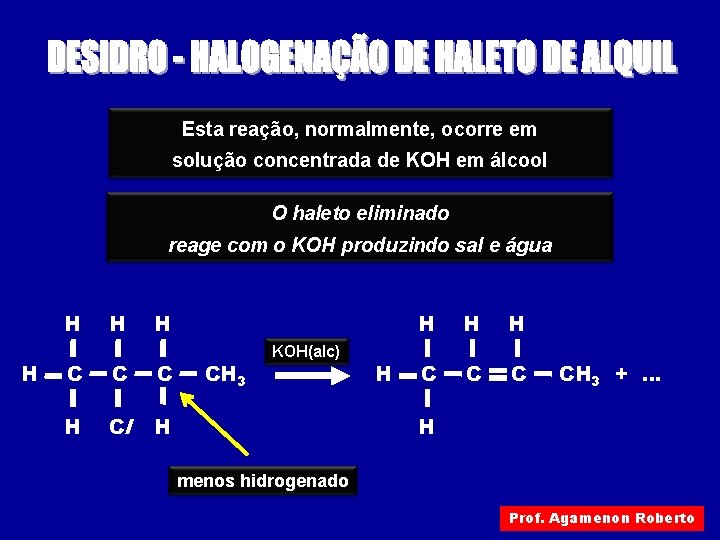
Esta reação, normalmente, ocorre em solução concentrada de KOH em álcool O haleto eliminado reage com o KOH produzindo sal e água H H C C C H Cl H CH 3 KOH(alc) H H C CH 3 +. . . H menos hidrogenado Prof. Agamenon Roberto

Ocorre na presença do ZINCO H H C C C H Br Br CH 3 Zn H H C CH 3 + Zn. Br 2 H Prof. Agamenon Roberto
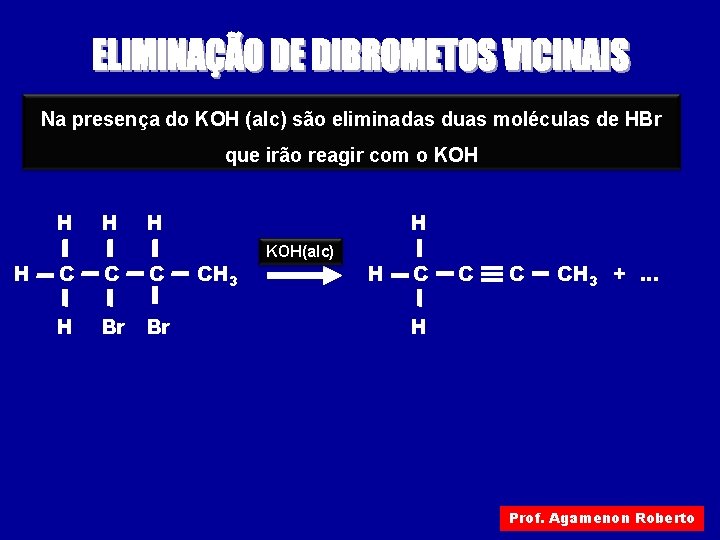
Na presença do KOH (alc) são eliminadas duas moléculas de HBr que irão reagir com o KOH H H C C C H Br Br H CH 3 KOH(alc) H C C ºC CH 3 +. . . H Prof. Agamenon Roberto

As principais reações de oxidação e redução compostos orgânicos ocorrem com os ALCOÓIS, ALDEÍDOS e ALCENOS Prof. Agamenon Roberto
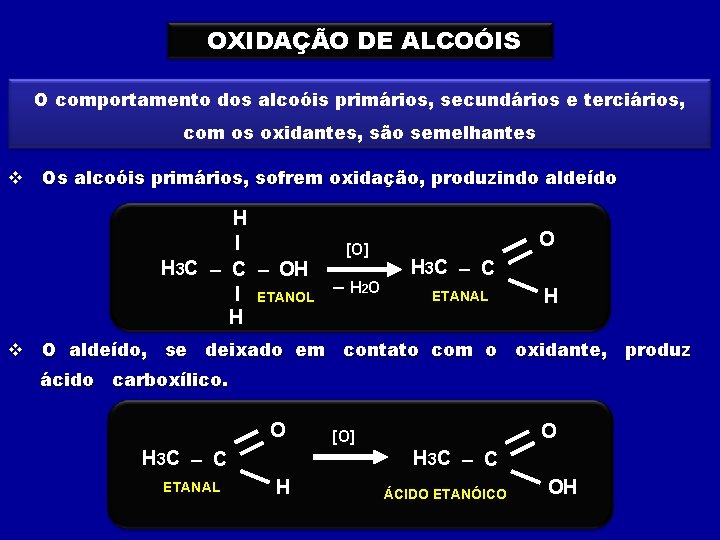
OXIDAÇÃO DE ALCOÓIS O comportamento dos alcoóis primários, secundários e terciários, com os oxidantes, são semelhantes v Os alcoóis primários, sofrem oxidação, produzindo aldeído H I [O] H 3 C – OH I ETANOL – H 2 O H 3 C – C ETANAL H v O aldeído, se deixado em contato com o oxidante, produz ácido carboxílico. O H 3 C – C ETANAL O [O] H 3 C – C H ÁCIDO ETANÓICO OH
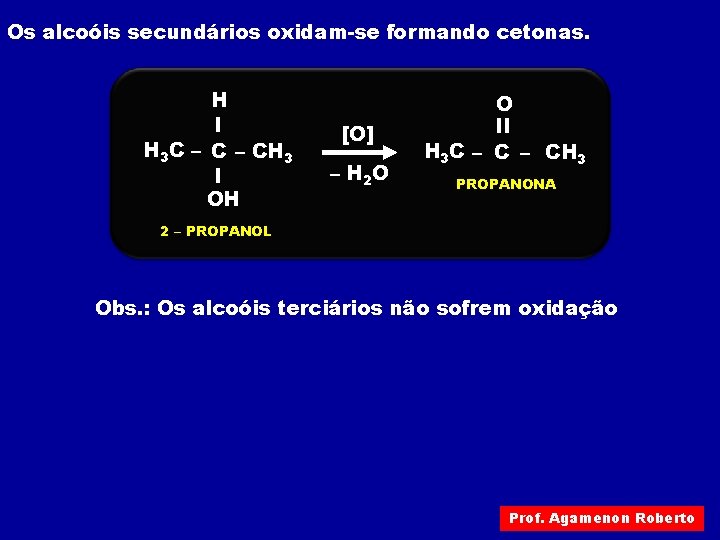
Os alcoóis secundários oxidam-se formando cetonas. H I H 3 C – CH 3 I OH [O] – H 2 O O II H 3 C – CH 3 PROPANONA 2 – PROPANOL Obs. : Os alcoóis terciários não sofrem oxidação Prof. Agamenon Roberto

01) Quando um álcool primário sofre oxidação, o produto principal é: a) ácido carboxílico. b) álcool secundário. c) éter. d) álcool terciário. e) cetona. Prof. Agamenon Roberto
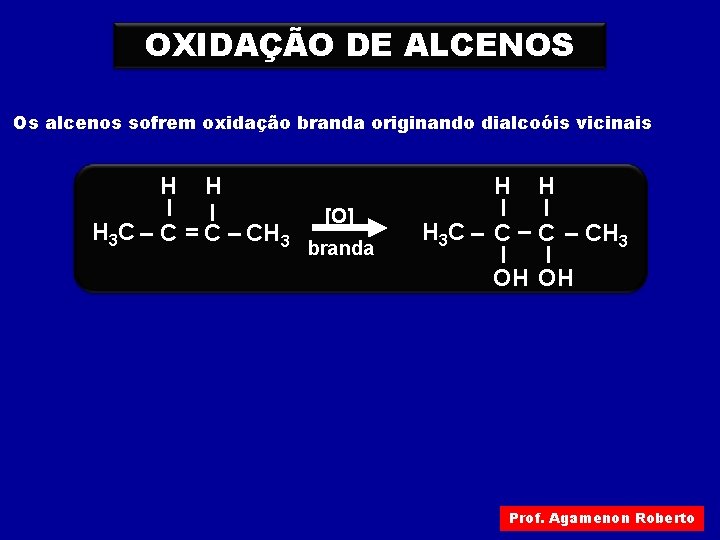
OXIDAÇÃO DE ALCENOS Os alcenos sofrem oxidação branda originando dialcoóis vicinais H H I I H 3 C – C = C – CH 3 [O] branda H H I I H 3 C – C – CH 3 I I OH OH Prof. Agamenon Roberto
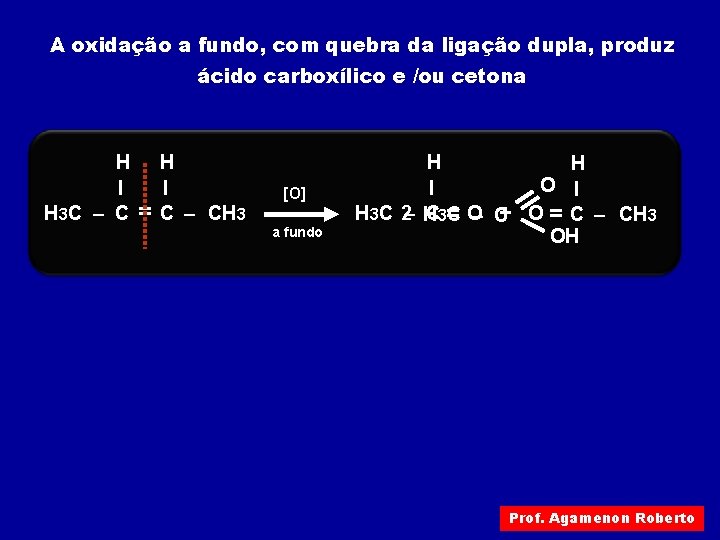
A oxidação a fundo, com quebra da ligação dupla, produz ácido carboxílico e /ou cetona H I H 3 C – C = H I C – CH 3 [O] a fundo H H O I I H 3 C 2– H + O = C – CH 3 C 3= C O– C OH Prof. Agamenon Roberto
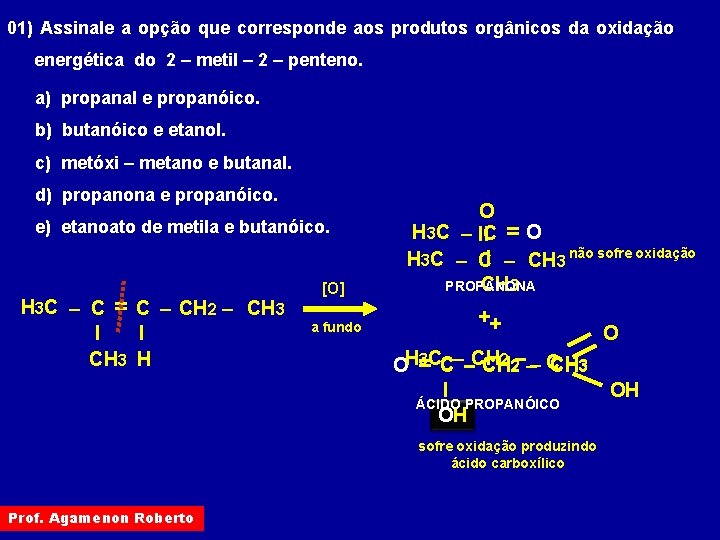
01) Assinale a opção que corresponde aos produtos orgânicos da oxidação energética do 2 – metil – 2 – penteno. a) propanal e propanóico. b) butanóico e etanol. c) metóxi – metano e butanal. d) propanona e propanóico. e) etanoato de metila e butanóico. H 3 C – C = C – CH 2 – CH 3 I I CH 3 H [O] a fundo O H 3 C – IIC = O H 3 C – CI – CH 3 não sofre oxidação CH 3 PROPANONA ++ 2 2––– C 3 CC––CH CH CH 3 OH= I ÁCIDO PROPANÓICO OH H sofre oxidação produzindo ácido carboxílico Prof. Agamenon Roberto O OH

02) Um alceno “ X “ foi oxidado energeticamente pela mistura sulfomangânica (KMn. O 4 + H 2 SO 4). Os produtos da reação foram butanona e ácido metil propanóico. Logo, o alceno X é: a) 2 – metil – 3 – hexeno. b) 3 – metil – 3 – hexeno. c) 2, 4 – dimetil – 3 – hexeno. d) 2, 5 – dimetil – 3 – hexeno. e) 3, 5 – dimetil – 3 – hexeno. 1 H 3 C 2 3 4 CH C O CH 3 H OH ÁCIDO METIL 2, 4 PROPANÓICO – dimetil – 5 6 O C CH 2 CH 3 3 – hexeno. BUTANONA Prof. Agamenon Roberto
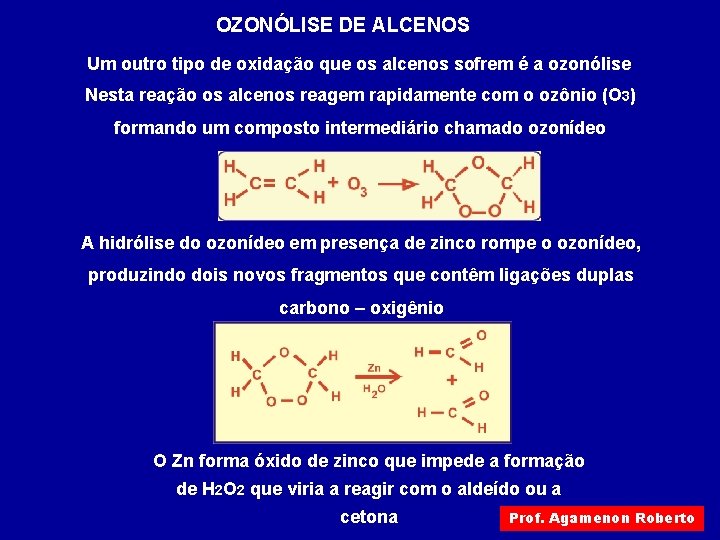
OZONÓLISE DE ALCENOS Um outro tipo de oxidação que os alcenos sofrem é a ozonólise Nesta reação os alcenos reagem rapidamente com o ozônio (O 3) formando um composto intermediário chamado ozonídeo A hidrólise do ozonídeo em presença de zinco rompe o ozonídeo, produzindo dois novos fragmentos que contêm ligações duplas carbono – oxigênio O Zn forma óxido de zinco que impede a formação de H 2 O 2 que viria a reagir com o aldeído ou a cetona Prof. Agamenon Roberto
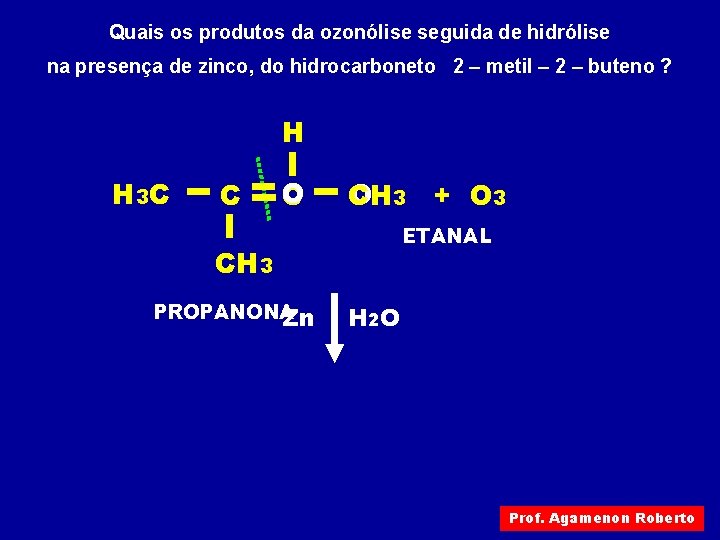
Quais os produtos da ozonólise seguida de hidrólise na presença de zinco, do hidrocarboneto 2 – metil – 2 – buteno ? H H 3 C C OH 3 + O 3 C ETANAL CH 3 PROPANONA Zn H 2 O Prof. Agamenon Roberto
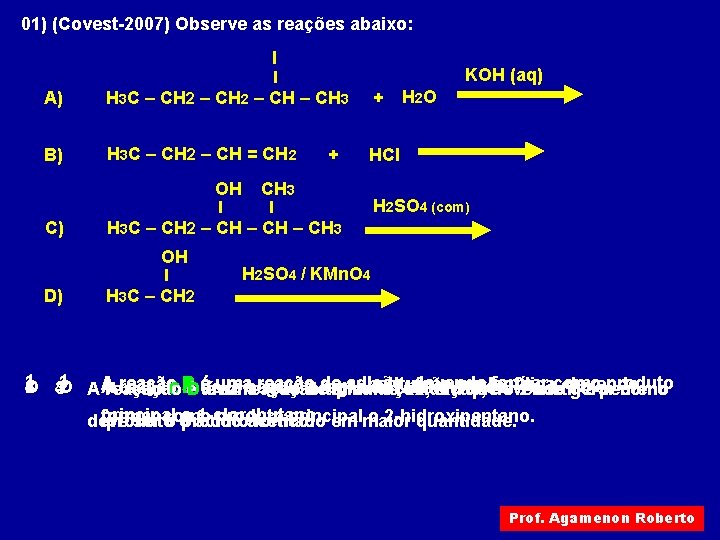
01) (Covest-2007) Observe as reações abaixo: I KOH (aq) A) H 3 C – CH 2 – CH 3 + B) H 3 C – CH 2 – CH = CH 2 HCl OH C) CH 3 H 2 SO 4 (com) H 3 C – CH 2 – CH 3 OH D) + H 2 O H 2 SO 4 / KMn. O 4 H 3 C – CH 2 1 Areação B éuma reação de adição, devendo formar como AéDdeve substituição devendo O 3 2 O AA 2 seguir aderegra de 3 4 41 Areação CB éuma reação típica eliminação, de. Markovnikov. oxidação, emnucleofílica, quedevendo o 2 -metil-2 -penteno gerarproduto como principal o 1 -clorobutano. formar produto principal o 2 -hidroxipentano. deve produto ser como oo produto ácido acético. formado em maior quantidade. Prof. Agamenon Roberto


Prof. Agamenon Roberto

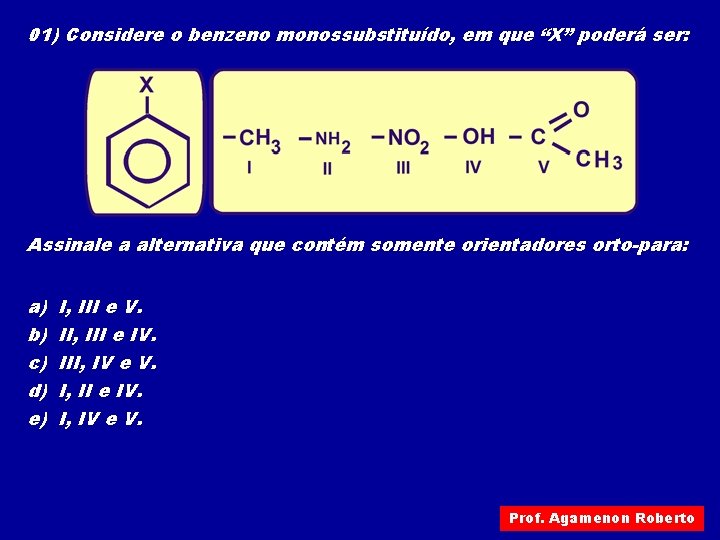
01) Considere o benzeno monossubstituído, em que “X” poderá ser: Assinale a alternativa que contém somente orientadores orto-para: a) b) c) d) e) I, III e V. II, III e IV. III, IV e V. I, II e IV. I, IV e V. Prof. Agamenon Roberto


02) (PUC – PR) A monocloração do 2 – metil pentano pode fornecer vários compostos, em proporções diferentes. Dos compostos monoclorados isômeros planos, quantos apresentarão carbono quiral ou assimétricos? a) 4. b) 5. c) 1. d) 2. e) 3. Prof. Agamenon Roberto

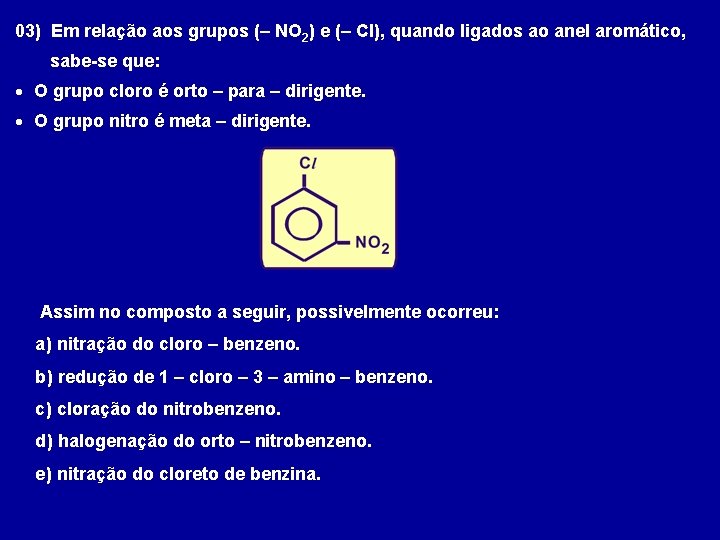
03) Em relação aos grupos (– NO 2) e (– Cl), quando ligados ao anel aromático, sabe-se que: O grupo cloro é orto – para – dirigente. O grupo nitro é meta – dirigente. Assim no composto a seguir, possivelmente ocorreu: a) nitração do cloro – benzeno. b) redução de 1 – cloro – 3 – amino – benzeno. c) cloração do nitrobenzeno. d) halogenação do orto – nitrobenzeno. e) nitração do cloreto de benzina.

04) Na reação do 2 – metil – 1 – propeno com hidreto de bromo, forma-se: a) 2 -bromo 2 -metil propano. b) 1 -bromo 2 -metil propano. c) isobutano. d) 1 -bromo 2 -metil propeno. e) 2 -buteno. Prof. Agamenon Roberto

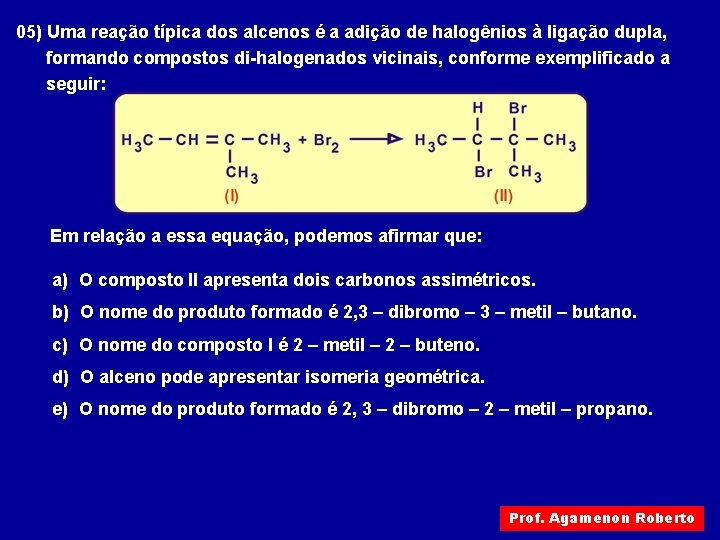
05) Uma reação típica dos alcenos é a adição de halogênios à ligação dupla, formando compostos di-halogenados vicinais, conforme exemplificado a seguir: Em relação a essa equação, podemos afirmar que: a) O composto II apresenta dois carbonos assimétricos. b) O nome do produto formado é 2, 3 – dibromo – 3 – metil – butano. c) O nome do composto I é 2 – metil – 2 – buteno. d) O alceno pode apresentar isomeria geométrica. e) O nome do produto formado é 2, 3 – dibromo – 2 – metil – propano. Prof. Agamenon Roberto

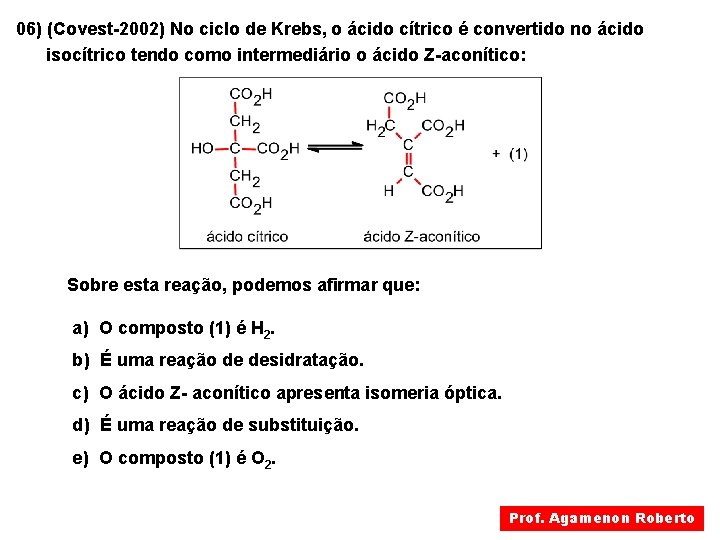
06) (Covest-2002) No ciclo de Krebs, o ácido cítrico é convertido no ácido isocítrico tendo como intermediário o ácido Z-aconítico: Sobre esta reação, podemos afirmar que: a) O composto (1) é H 2. b) É uma reação de desidratação. c) O ácido Z- aconítico apresenta isomeria óptica. d) É uma reação de substituição. e) O composto (1) é O 2. Prof. Agamenon Roberto

07) (UPE-2007 – Q 2) Analise as equações químicas a seguir: C 3 H 4 + 2 HCl A C 2 H 4 O + KMn. O 4 (meio ácido) B C 2 H 5 OH + H 2 SO 4(conc) (170ºC) C As substâncias orgânicas formadas A, B e C têm como nomenclatura IUPAC respectivamente: a) propan – 1 – ol, etanol e ácido etanóico. b) 2, 3 – diclorobutano, eteno e etanal. c) 2, 2 – dicloropropano, ácido etanóico e eteno. d) cloroetano, etano e etanol. e) clorometano, ácido etanóico e etino. Prof. Agamenon Roberto
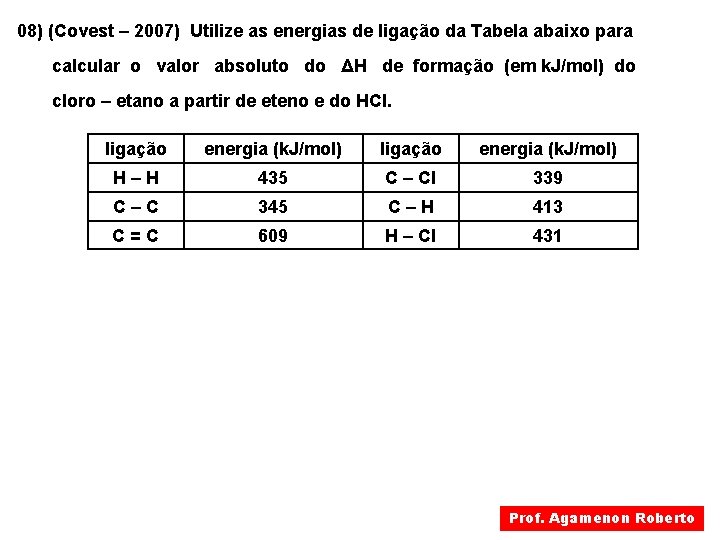
08) (Covest – 2007) Utilize as energias de ligação da Tabela abaixo para calcular o valor absoluto do ΔH de formação (em k. J/mol) do cloro – etano a partir de eteno e do HCl. ligação energia (k. J/mol) H–H 435 C – Cl 339 C–C 345 C–H 413 C=C 609 H – Cl 431 Prof. Agamenon Roberto
- Slides: 90