Principi fisici di conversione avanzata Energetica L S














- Slides: 18

Principi fisici di conversione avanzata (Energetica L. S. ) G. Mazzitelli ENEA Prima Lezione 1

Forze fondamentali • Forza gravitazionale (Moto dei corpi celesti, meccanica newtoniana) • Forza elettromagnetica (Equazioni di Maxwell) 2

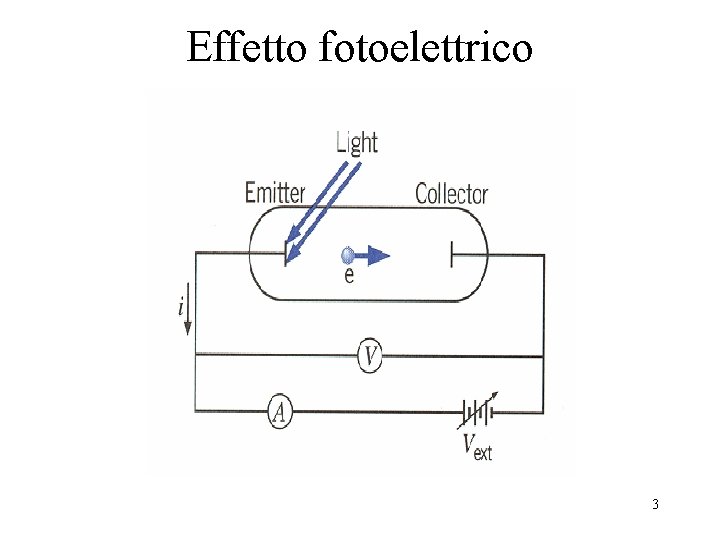
Effetto fotoelettrico 3

Effetto fotoelettrico Fisica classica Ecinetica max proporzionale alla intensità della radiazione (I) L’effetto fotoelettrico è indipendente dalla frequenza Il primo elettrone dovrebbe essere emesso per t>sec Esperimento Ecinetica max è indipendente dalla intensità della radiazione L’effetto fotoelettrico dipendente dalla frequenza Il primo elettrone è emesso istantaneamente La risposta fu proposta da Einstein il quale propose che la luce avesse una natura corpuscolare: i fotoni particelle di massa zero che viaggiano alla velocità della luce ed hanno una energia pari a E=hν h è la costante di Planck h=6. 623 x 10 -34 J. s 4

Diffrazione degli elettroni fotoni elettroni 5

Diffrazione degli elettroni La spiegazione di questo esperimento è solamente possibile assumendo che le particelle hanno una natura ondulatoria la cui lunghezza d’onda detta di De Broglie 6

Prima Lezione • • • I costituenti nucleari Le dimensione e la forma dei nuclei Le masse nucleari e le energie di legame La forza nucleare Il decadimento radioattivo Leggi di conservazione nel decadimento radioattivo Il decadimento alfa Il decadimento beta Il decadimento gamma La radioattività naturale 7

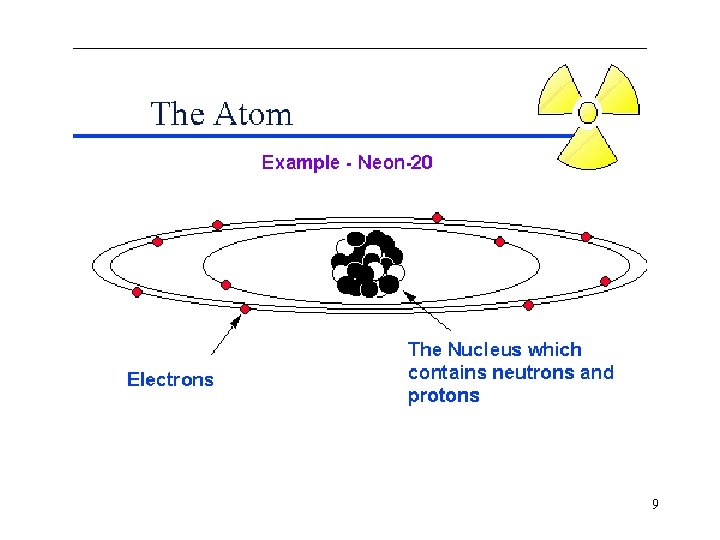
Struttura dell’atomo • Ogni atomo composto da un nucleo centrale che contiene la maggior parte della massa (99, 9%) e da una nuvola elettronica intorno al nucleo. • Il nucleo ha una carica elettrica positiva pari alla carica elettrica negativa degli elettroni per cui il nucleo è neutro. • Il nucleo è composto da due tipi di particelle: i protoni e i neutroni. Protoni e neutroni sono chiamati anche nucleoni 8

9

Protoni Neutroni Elettroni • I protoni hanno carica positiva pari alla carica elementare e=1. 6 10 -19 C e massa pari a mp=1. 673 10 -27 Kg • I neutroni sono neutri e hanno massa pari a mn =1. 675 10 -27 Kg lievemente superiore a quella dei protoni. • Gli elettroni hanno carica negativa pari alla carica elementare e=1. 6 10 -19 C e massa pari a me=9. 11 10 -31 Kg 10

L’atomo • Il numero dei protoni è uguale a quello degli elettroni e si indica con Z (numero atomico) • Il numero Z identifica l’elemento e conseguentemente determina le proprietà chimiche. • La somma del numero di protoni e neutroni si indica con A (numero di massa) 11

L’atomo • mp/me mn/me=1836. 15. Come detto la massa è quasi tutta nel nucleo. • Esistono nuclei con lo stesso Z e diverso A. Si dice che per ogni elemento vi sono diversi isotopi. • Raggio degli atomi: 0. 05 0. 2 nm; 12

L’atomo • Nella fisica nucleare è importante conoscere e specificare bene i differenti isotopi per cui un isotopo e identificato dal simbolo chimico X ( da cui si ha Z) e dal numero di massa A , il numero di neutroni sarà allora N=A-Z. AX • Attenzione il numero di massa A non identifica la massa del nucleo ma il numero di nucleoni 13

14

Alcuni esempi • L’idrogeno 1 H ha due isotopi il Deuterio (D) 2 H e il Trizio (T) 3 H • Quale l’elemento che ha un isotopo con numero di massa A=235 e che contiene nel nucleo 143 neutroni ? Z=A-N=92 ovverosia l’uranio 235 U 15

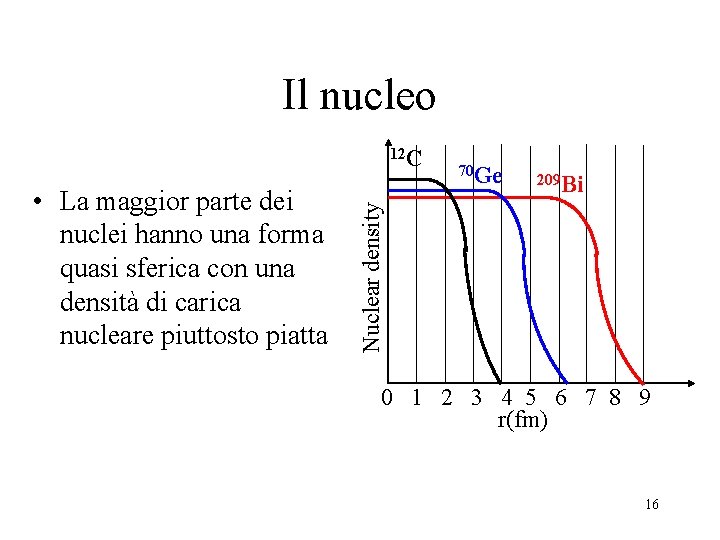
Il nucleo • La maggior parte dei nuclei hanno una forma quasi sferica con una densità di carica nucleare piuttosto piatta 70 Ge 209 Bi Nuclear density 12 C 0 1 2 3 4 5 6 7 8 9 r(fm) 16

Il nucleo Numero di protoni e neutroni = Volume del nucleo A ∞ R 3 A 4 πR 3 ≈ costante 3 R=R 0 A 1/3 R 0 è determinato sperimentalmente ed è ≈ 1. 2 X 10 -15 m Raggio dei nuclei: 1 7 fm La lunghezza 1. 0 X 10 -15 m è 1 femtometer (fm) o 1 fermi 17

Esercizio Calcoliamo la densità e la massa risultante di un nucleo che abbia un ipotetico raggio di 1 cm La massa di una sfera di raggio 1 Km della nostra materia ! 18
 Microeconomia avanzata
Microeconomia avanzata Avanzata
Avanzata Mappa concettuale democrito
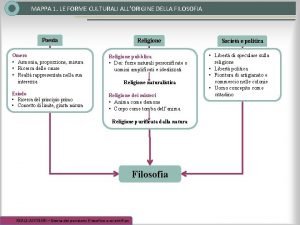
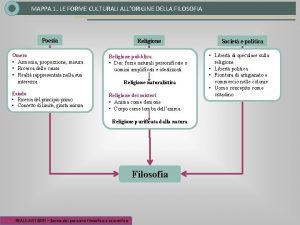
Mappa concettuale democrito Nascita della filosofia mappa concettuale
Nascita della filosofia mappa concettuale Fisici pluralisti significato
Fisici pluralisti significato Fisici pluralisti schema
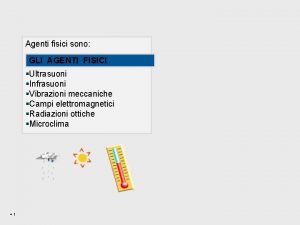
Fisici pluralisti schema I pericoli fisici sono provocati da
I pericoli fisici sono provocati da Rischi fisici microclima e illuminazione
Rischi fisici microclima e illuminazione Sistema sessagesimale angoli
Sistema sessagesimale angoli Verga rivoluzione industriale
Verga rivoluzione industriale Sample and hold spiegazione
Sample and hold spiegazione Conversione longobardi
Conversione longobardi Disturbo conversione
Disturbo conversione Ascetismo meccanismo di difesa
Ascetismo meccanismo di difesa Erudizione al bello
Erudizione al bello Equianalgesia oppioidi
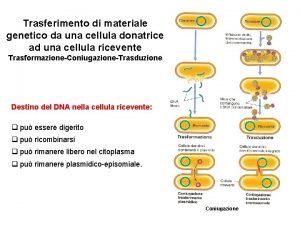
Equianalgesia oppioidi Cellula hfr
Cellula hfr Conversione gradi francesi gradi tedeschi
Conversione gradi francesi gradi tedeschi Unibo conversione voti erasmus
Unibo conversione voti erasmus