Primo principio della termodinamica Cicli termodinamici Trasmissione del













- Slides: 14

Primo principio della termodinamica Cicli termodinamici Trasmissione del calore

Lavoro fatto da un sistema termodinamico • Un gas ideale confinato in un cilindro avrà un volume V, una pressione p ed una temperatura T. • Il lavoro elementare fatto dal gas su pistone sarà: dw = p. Sdh = pd. V • La pressione p, esercitata dal gas, moltiplicata per la superficie del pistone S è la forza che determina lo spostamento dh del pistone. • In questa modalità il lavoro è definito positivo. • Qualunque aumento di volume, conseguente ad una pressione, determina un lavoro e si scrive: dw = p d. V = p dsdn. ds • In generale una trasformazione che porta il gas p dn termodinamico dallo stato a allo stato b fa un lavoro che vale:

Lavoro di un ciclo • In un piano V-p il lavoro fatto durante una trasformazione è dato dall’integrale definito fra gli stati A e B (area sottesa dalla curva). • Particolarmente importanti sono le trasformazione cicliche riportano il sistema nello stato iniziale. p • Il lavoro fatto per andare da A a C via B è B c l’area ABCC’A’A. Mentre il lavoro fatto per andare da C a A via D è dato dall’area A D CDAA’C’C. • La somma algebrica di queste due aree è V A’ C’ positiva • Se la trasformazione ciclica è percorsa in senso orario il lavoro risultante è positivo, viceversa se il ciclo è percorso in senso antiorario il lavoro è negativo

Ciclo termodinamico • Durante un ciclo termodinamico il lavoro fatto dal sistema verso l’esterno è positivo, se il ciclo è percorso in senso orario. E’ negativo nel caso opposto. P P w>0 w<0 V • Poiché sia il lavoro w che il calore Q dipendono dal tipo di trasformazione eseguita sul gas, si deduce che ne w ne Q sono variabili di stato. • Invece, la quantità (Q - w) è una variabile di stato perché non dipende dal tipo di trasformazione eseguita. V

Processo termodinamico • Togliendo un pallino per volta dalla zavorra, il gas solleverà il piattello in una successione di stati di equilibrio. Il lavoro elementare fatto dal gas sarà pari a: dw = F ds = p. A ds = p d. V • Il lavoro totale sarà: • L’area sottesa da una trasformazione in equilibrio misura il lavoro fatto dal sistema e dipende dal tipo di trasformazione. • Il lavoro è positivo quando volume aumenta ed è negativo quando il volume diminuisce

Trasformazioni semplici • Ci sono infiniti tipi di trasformazioni (una per ogni possibile linea tracciabile nel piano V - p), ma quelle p A particolarmente interessanti sono le trasformazioni: Isocora, isobara, isotermica, adiabatica. • Durante una trasformazione isocora il sistema cambia temperatura e pressione, e si rappresenta B tracciando una linea verticale. Durante questa trasformazione il gas non compie lavoro perché il volume resta invariato. w = pd. V = 0 w = 0. • Durante una trasformazione isobara la pressione p del sistema rimane costante, ma cambiano la A P 0 temperatura ed il volume. Una isobara è rappresentata da una linea orizzontale ed il lavoro è: w = P 0 (Vb-Va) Va V B Vb V

Altre Trasformazioni � P A B V

I° Principio della Termodinamica • La quantità (Q - w) dipende solo dagli stati iniziali e finali della trasformazione ed è indipendente dal tipo di trasformazione. • Questa quantità è pari alla variazione dell’energia interna DEint quindi abbiamo Q - w = DE Q = DE + w • Fornire calore ad un sistema termodinamico equivale ad aumentare l’energia interna del gas termodinamico e permettere al sistema di produrre lavoro. Ricordiamo che: • In un sistema isolato l’energia meccanica, cioè la somma dell’energia cinetica e dell’energia potenziale, è una funzione di stato. • Se A e B sono due stati successivi e se non intervengono forze esterne (leggi attriti) è possibile avere trasformazioni reversibili e quindi UA = UB. • Invece se forze esterne compiono lavoro sul sistema - w per passare dallo stato A allo stato B avremo UB - UA = - w.

Analisi del “primo principio” DEint = Q - w Processo adiabatico: • Se, durante una trasformazione, non si ha scambio di calore con l’esterno si dice che il processo è adiabatico Q=0 DEint = - w • Ovvero se il lavoro viene fatto sul sistema si ha un aumento dell’energia interna, se il lavoro è fatto dal sistema si avrà una diminuzione dell’energia interna Processo isocoro: • Se durante una trasformazione termodinamica, il volume rimane costante, avremo un lavoro nullo e il processo si dice isocoro w = 0 e la variazione dell’energia interna sarà DEint = Q • Ovvero, se si aggiunge o si sottrae calore al sistema, l’energia interna aumenterà o diminuirà.

Analisi del “primo principio” DEint = Q - w Trasformazioni cicliche: • Quando, fra scambi di Lavoro e Calore, si riporta l’energia interna di un gas al suo valore iniziale, si realizza una trasformazione ciclica. DEint = 0 e di conseguenza Q = w Espansione libera: • Se il sistema realizza una trasformazione in assenza di calore e in assenza di lavoro, allora il sistema è in espansione libera. Q = 0 w = 0 e quindi DEint = 0 Aprendo un rubinetto fra due zone termicamente isolate, una contenete gas ed una completamente vuota si realizza una espansione libera

Trasmissione del Calore • Abbiamo detto che il calore è una delle forme con cui si trasferisce l’energia da un sistema ad un altro: • Il calore determina un aumento di temperatura dal valore T 1 al T 2 quindi il corpo aumenta la sua temperatura di DT. • Sappiamo anche la temperatura di un corpo dipende dalla quantità di materia m che deve essere scaldata o raffreddata • Infine sappiamo che la quantità di calore necessario a trasferire energia dipende dal materiale che assorbe il calore. • Quindi possiamo concludere con la formula matematica Q = C DT • Dove C è la capacità termica e funziona come inerzia termica, cioè più piccolo è il valore di C più grande sarà l’aumento della temperatura, naturalmente a parità di calore disponibile. • Può essere conveniente rendere la capacità termica indipendente dalla quantità di materia, cioè definire una capacità termiva per unità di materia. Q = ncp DT

Scambi di Calore § Conduzione T 1 k Q L T 2 • Si ha conduzione perché le vibrazioni molecolari della zona più calda trasferiscono la loro energia alle molecole della zone più fredda. Sperimentalmente si osserva che: Pc = k A(T 1 – T 2)/L Conducibilità termica • Si definisce resistenza termica R = L/k [K m 2/W] Pc = A(T 1–T 2)/R • Nel caso di più strati, avremo: Pc = k 2 A(T 1 – Tx)/L 2 Pc= k 1 A(Tx – T 2)/L 1 ovvero Pc = A(T 1 –T 2)/SR T 1 k 2 k 1 T 2 Q L 2 L 1

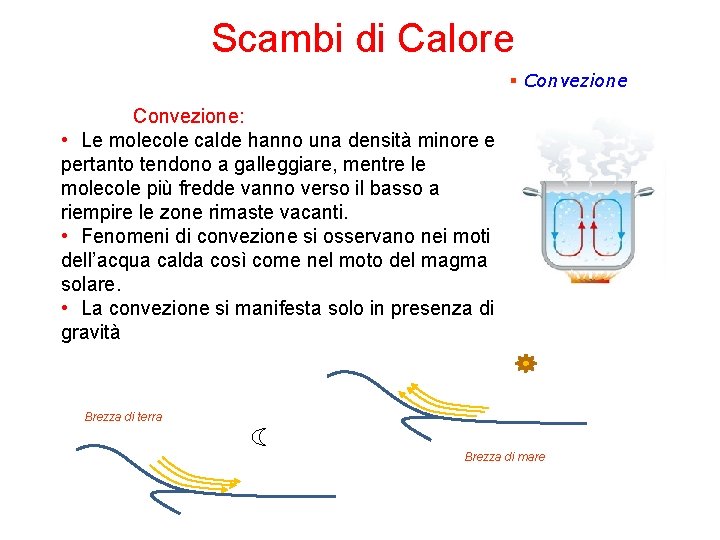
Scambi di Calore § Convezione: • Le molecole calde hanno una densità minore e pertanto tendono a galleggiare, mentre le molecole più fredde vanno verso il basso a riempire le zone rimaste vacanti. • Fenomeni di convezione si osservano nei moti dell’acqua calda così come nel moto del magma solare. • La convezione si manifesta solo in presenza di gravità Brezza di terra Brezza di mare

Scambi di Calore § Irraggiamento: • L’irraggiamento è calore trasmesso come onda elettromagnetica, quindi si trasmette anche nel vuoto. • La potenza trasmessa è Pr = s e A T 4 s - è una costante pari a 5, 67 10 -8 W/(m 2 K 4) e - è l’emittanza, sempre < 1 eccetto che per il “Corpo Nero” e = 1 • Si dice corpo nero un corpo che assorbe tutta l’energia che gli si riversa addosso. • L‘irradianza di un corpo nero ha un andamento come riportato in figura • Il massimo della curva ‘irradianza’ si sposta verso l’ultra violetto quando la temperatura del corpo nero aumenta • La potenza Pa con cui un oggetto assorbe energia dall’ambiente è Pa = s e A Tamb 4 e la potenza irraggiata è Ptot = s e A (Tamb 4 – T 4)
 Primo principio termodinamica sistemi aperti
Primo principio termodinamica sistemi aperti Primo principio della termodinamica enunciato
Primo principio della termodinamica enunciato Primo principio della termodinamica
Primo principio della termodinamica Primo principio della termodinamica
Primo principio della termodinamica I principi della termodinamica
I principi della termodinamica Potenziali termodinamici
Potenziali termodinamici 2 principio della termodinamica formula
2 principio della termodinamica formula 2 principio della termodinamica formula
2 principio della termodinamica formula V=cte
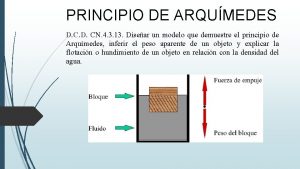
V=cte Enunciado del principio de arquímedes
Enunciado del principio de arquímedes Termodinmica
Termodinmica Macrostato
Macrostato Temperatura y equilibrio termico
Temperatura y equilibrio termico Terzo principio della termodinamica
Terzo principio della termodinamica Calore specifico formule inverse
Calore specifico formule inverse