Predmet Neorganska hemija 2 Studijski program Master akademske



![Akva kompleksi ØOpšta formula akva kompleksa Ln 3+ jona je [Ln(H 2 O)n]3+ gde Akva kompleksi ØOpšta formula akva kompleksa Ln 3+ jona je [Ln(H 2 O)n]3+ gde](https://slidetodoc.com/presentation_image_h2/4c0427bb954a7c0011853c6baab09f3b/image-4.jpg)


![Heksametilfosforamid [hmpa: (Me 2 N)3 PO] ØSa ovim ligandom lantanidi grade komplekse sledećeg stehiometrijskog Heksametilfosforamid [hmpa: (Me 2 N)3 PO] ØSa ovim ligandom lantanidi grade komplekse sledećeg stehiometrijskog](https://slidetodoc.com/presentation_image_h2/4c0427bb954a7c0011853c6baab09f3b/image-8.jpg)
![Tetrahidrofuran [thf, (CH 2)4 O] 1) [La. Cl 3(thf)4] 2) Ln. Cl 3(thf)3. 5, Tetrahidrofuran [thf, (CH 2)4 O] 1) [La. Cl 3(thf)4] 2) Ln. Cl 3(thf)3. 5,](https://slidetodoc.com/presentation_image_h2/4c0427bb954a7c0011853c6baab09f3b/image-10.jpg)





![ØPrimeri još nekih kompleksa sa N-donor atomima: 1)[MI 3 py 4] (M= Ce, Nd) ØPrimeri još nekih kompleksa sa N-donor atomima: 1)[MI 3 py 4] (M= Ce, Nd)](https://slidetodoc.com/presentation_image_h2/4c0427bb954a7c0011853c6baab09f3b/image-19.jpg)


![Alkilamidi ØNajbolje okarakterisan alkilamid je siliamid Ln[N(Si. Me 3)2]3 koji se dobija u THF Alkilamidi ØNajbolje okarakterisan alkilamid je siliamid Ln[N(Si. Me 3)2]3 koji se dobija u THF](https://slidetodoc.com/presentation_image_h2/4c0427bb954a7c0011853c6baab09f3b/image-24.jpg)
- Slides: 28

Predmet: Neorganska hemija 2 Studijski program: Master akademske studije Status predmeta: Obavezni Predmetni Profesor: Prof. dr Dragan M. Đorđević

Koordinaciona jedinjenja lantanida ØU poređenju sa d-prelaznim metalima, lantanidi grade mali broj kompleksnih jedinjenja. ØNjihovi joni su veći nego joni elemenata I prelazne serije d-metala, pa je i privlačno dejstvo metal - ligand kod njih slabije izraženo. ØKompleksne jone grade sa ligandima koji se vezuju preko kiseonika i to pre svega sa helatnim ligandima. ØSa -diketonima i dibenzoilmetanom grade komplekse tipa M(L-L)3 koji kristališu sa molekulom rastvarača ØZa ove elemente su inače karakteristični visoki koordinacioni brojevi, veći od 6 (7, 8, 9 pa i 12).

ØSa organskim kiselinama (vinskom i limunskom), amino kiselinama i EDTA grade nestabilne komplekse kao na primer: • [Eu(acac)4]- i • [La(H 2 O)4 EDTA]. acac ØNeki helati europijuma luminesciraju i primenjuju se u proizvodnji lasera i kolor katodnih [Eu(Ph. COCHCOPh)4]-. cevi, kao na primer kompleks:
![Akva kompleksi ØOpšta formula akva kompleksa Ln 3 jona je LnH 2 On3 gde Akva kompleksi ØOpšta formula akva kompleksa Ln 3+ jona je [Ln(H 2 O)n]3+ gde](https://slidetodoc.com/presentation_image_h2/4c0427bb954a7c0011853c6baab09f3b/image-4.jpg)
Akva kompleksi ØOpšta formula akva kompleksa Ln 3+ jona je [Ln(H 2 O)n]3+ gde je nkordinacioni broj koji ima vrednost 9 za lantanide od La do Eu (trostrana trigonalna prizma, slika 1) i 8 za lantanide od Dy do Lu (kvadratna antiprizma). Slika 1. Struktura nonakavalantanidnog jona [Ln(H 2 O)9]3+

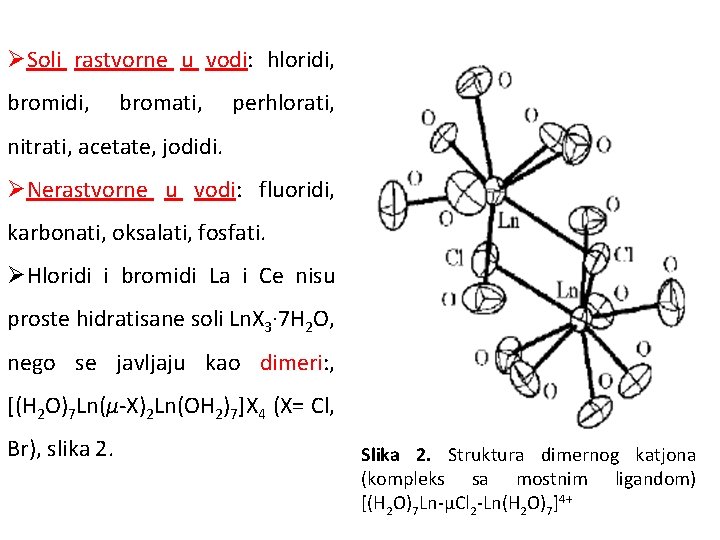
Hidratisane soli ØNastaju u reakcijama karbonata ili oksida lantanida sa kiselinama. ØSoli nonalantanoidnih jona mogu kristalisati kao: • [Ln(H 2 O)9]X 3, gde je X ≡ bromat, etilsulfat, tosilat. ØKada u sferi lantanidnog jona koordiniraju anjoni mogu se javiti različite vrste, npr: • [Ln(NO 3)3(H 2 O)5] (Ln = La, Ce), • [Ln(NO 3)3(H 2 O)4] (Ln = Pr–Yb, Y), • [(H 2 O)7 Ln-μCl 2 -Ln(H 2 O)7]4+.

ØSoli rastvorne u vodi: hloridi, bromidi, bromati, perhlorati, nitrati, acetate, jodidi. ØNerastvorne u vodi: fluoridi, karbonati, oksalati, fosfati. ØHloridi i bromidi La i Ce nisu proste hidratisane soli Ln. X 3· 7 H 2 O, nego se javljaju kao dimeri: , [(H 2 O)7 Ln(μ-X)2 Ln(OH 2)7]X 4 (X= Cl, Br), slika 2. Slika 2. Struktura dimernog katjona (kompleks sa mostnim ligandom) [(H 2 O)7 Ln-μCl 2 -Ln(H 2 O)7]4+

Kompleksi sa O-donor ligandima ØKompleksi lantanidnih soli sa neutralnim donorima generalno nastaju mešanjem rastvora liganda sa metalnim solima rastvorenim u nevodenim rastvaračima kao npr. etanol ili acetonitril ( ) ØKompleksi sa ligandima kao što su fosfin i arsin su prvi kompleksi ovog tipa koji su izučavani. Najbolje izučene serije kompleksa lantanida su sa heksametilfosforamidom.
![Heksametilfosforamid hmpa Me 2 N3 PO ØSa ovim ligandom lantanidi grade komplekse sledećeg stehiometrijskog Heksametilfosforamid [hmpa: (Me 2 N)3 PO] ØSa ovim ligandom lantanidi grade komplekse sledećeg stehiometrijskog](https://slidetodoc.com/presentation_image_h2/4c0427bb954a7c0011853c6baab09f3b/image-8.jpg)
Heksametilfosforamid [hmpa: (Me 2 N)3 PO] ØSa ovim ligandom lantanidi grade komplekse sledećeg stehiometrijskog sastava: • [Ln(hmpa)6(Cl. O 4)3] i • [Ln(hmpa)3 Cl 3]. ØPrimeri: • [Nd(hmpa)6(Cl. O 4)3] i hmpa • mer-Ln(hmpa)3 Cl 3, (Ln = Pr, Dy, Yb), mer- u etanolu/toluenu.

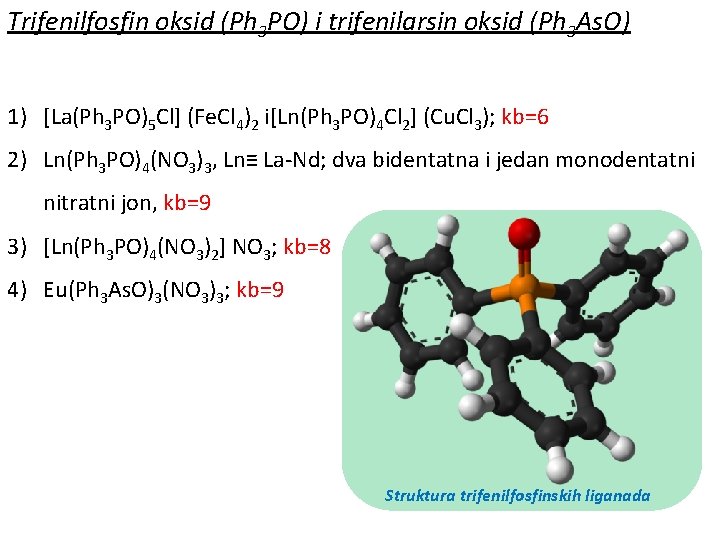
Trifenilfosfin oksid (Ph 3 PO) i trifenilarsin oksid (Ph 3 As. O) 1) [La(Ph 3 PO)5 Cl] (Fe. Cl 4)2 i[Ln(Ph 3 PO)4 Cl 2] (Cu. Cl 3); kb=6 2) Ln(Ph 3 PO)4(NO 3)3, Ln≡ La-Nd; dva bidentatna i jedan monodentatni nitratni jon, kb=9 3) [Ln(Ph 3 PO)4(NO 3)2] NO 3; kb=8 4) Eu(Ph 3 As. O)3(NO 3)3; kb=9 Struktura trifenilfosfinskih liganada
![Tetrahidrofuran thf CH 24 O 1 La Cl 3thf4 2 Ln Cl 3thf3 5 Tetrahidrofuran [thf, (CH 2)4 O] 1) [La. Cl 3(thf)4] 2) Ln. Cl 3(thf)3. 5,](https://slidetodoc.com/presentation_image_h2/4c0427bb954a7c0011853c6baab09f3b/image-10.jpg)
Tetrahidrofuran [thf, (CH 2)4 O] 1) [La. Cl 3(thf)4] 2) Ln. Cl 3(thf)3. 5, [Ln. Cl 2(thf)5]+ [Ln. Cl 4(thf)2]− (Ln ≡ Sm i Eu) thf 3) [Ln. Cl 3(thf)3] oktaedarski (Ln ≡ Yb i Lu) Dimetilsulfoksid [dmso, (CH 3)2 SO] 1) [Ln(dmso)4(NO 3)3], (Ln=La–Sm) 2) [Ln(dmso)3(NO 3)3], (Ln = Eu–Lu, Y) dmso

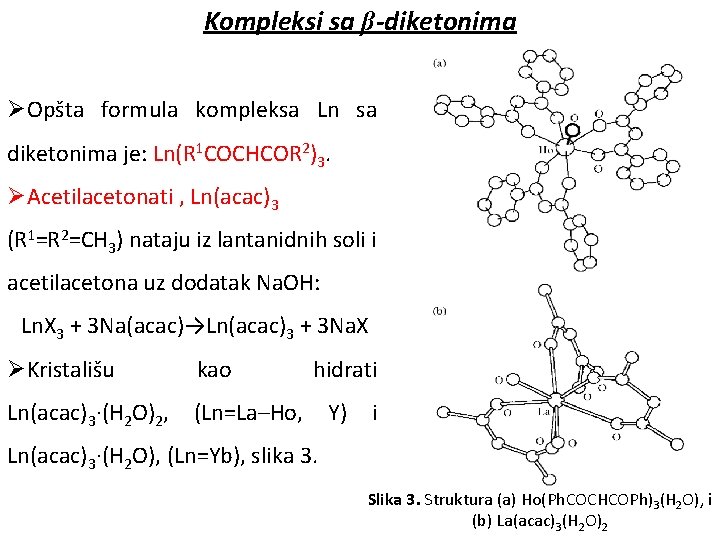
Kompleksi sa β-diketonima ØOpšta formula kompleksa Ln sa diketonima je: Ln(R 1 COCHCOR 2)3. ØAcetilacetonati , Ln(acac)3 (R 1=R 2=CH 3) nataju iz lantanidnih soli i acetilacetona uz dodatak Na. OH: Ln. X 3 + 3 Na(acac)→Ln(acac)3 + 3 Na. X ØKristališu kao Ln(acac)3·(H 2 O)2, (Ln=La–Ho, hidrati Y) i Ln(acac)3·(H 2 O), (Ln=Yb), slika 3. Struktura (a) Ho(Ph. COCHCOPh)3(H 2 O), i (b) La(acac)3(H 2 O)2

ØTeško je izvršiti dehidrataciju ovih kompleksa, čak i u vakumu, razgrađuju se na visokim temperaturama, a pri dehidrataciji na sobnoj temperaturi imaju tendenciju ka oligomerizaciji u neisparljive meterijale. ØFormiraju adukte koji se pnašaju kao Lewis-ove baze: • Ln(acac)3·(Ph 3 PO) i • Ln(acac)3·(phen), (kb=7 i 8).

Lewis-ove base kao adukti β-diketonskih kompleksa ØKako su kompleksi Ln sa diketonima Ln(R 1 COCHCOR 2)3, “koordinativno nezasićeni”, oni kompletiraju svoju koordinacionu sferu formiranjem adukata sa Lewis-ovim bazama. ØZbog paramagnetizma skoro svih Ln jona, dolazi do pomeranja u rezonaciji NMR spektara bilo kog organskog molekula koji koordinira sa Ln jonom, i to je važano zato što se takva jedinjenja koriste kao NMR reagensi. ØStruktura i stereohemija ovih adukata je dobro proučena , i 1: 1 i 1: 2 adukti su mogući, koji će se od njih javiti zavisi od sternih faktora i lieganda i kompleksa.

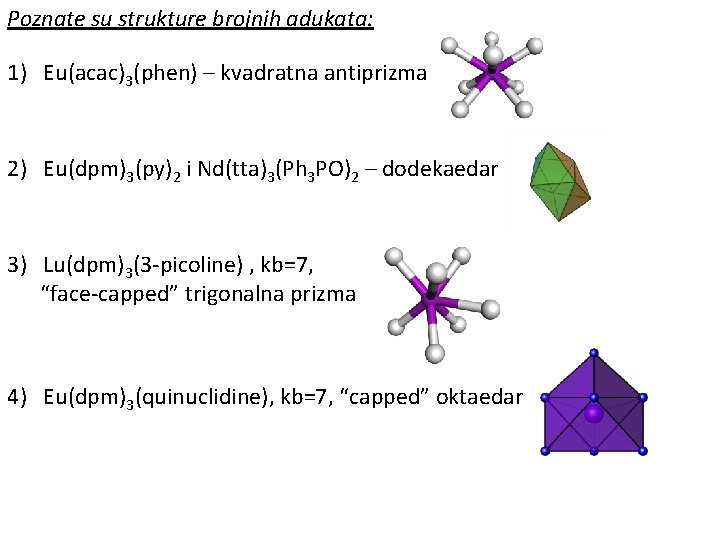
Poznate su strukture brojnih adukata: 1) Eu(acac)3(phen) – kvadratna antiprizma 2) Eu(dpm)3(py)2 i Nd(tta)3(Ph 3 PO)2 – dodekaedar 3) Lu(dpm)3(3 -picoline) , kb=7, “face-capped” trigonalna prizma 4) Eu(dpm)3(quinuclidine), kb=7, “capped” oktaedar

Nitratni kompleksi ØKaraktterišu se visokim koordinacionim brojevima. ØNitrati Mg 3 Ln 2(NO 3)12· 24 H 2 O, koji sadrže [Ln(NO 3)6]3− jone, su važni istorijski jer su korišćeni za odvajanje lantanida frakcionalnom kristalizacijom. ØKatjoni Ph 4 P+ i Me 4 N+ omogućavaju izolaciju [Ln(NO 3)5]2−.

Kompleksi sa EDTA i sličnim ligandima ØKompleksi Ln sa EDTA su značajni u postupku separacije lantanida. ØEDTA je heksadentatni ligand , kako prelazni metali grade komplekse sa EDTA gde u unutrašnjoj koordinacionoj sferi može da se nađe i H 2 O kao npr. [Fe(EDTA)(H 2 O)]−, nije isključivo da i lantnaidi mogu da grade slične komplekse sa molekulima H 2 O u unutrašnjoj koordinacionoj sferi. , primeri [Ho(EDTA)(H 2 O)3]− kb=9, i [Ho(EDTA)(H 2 O)2]− kb=8.

ØDietilentriaminpentasirćetna kiselina (H 5 DTPA) je potencijalni oktadentatni ligand i formira komplekse sa većim konstantama stabilnosti [M(DTPA)(H 2 O)]2−. ØDTPA kompleksi imaju veće kontante stabilnosti od EDTA kompleksa, pošto je veća “dentatnost” (broj atoma nekog liganda koji se može vezati za centralni atom metala) liganda koji se veže za metalni jon. ØDrugi faktor je da je promena entropija formiranja kompleksa veća, što čini ΔG (i dalje K) većim. [La(OH 2)9]3+(aq) + EDTA 4−(aq) → [La(EDTA)(OH 2)3]−(aq) + 6 H 2 O(l) [La(OH 2)9]3+(aq) + DTPA 5−(aq) → [La(DTPA)(OH 2)]2−(aq) + 8 H 2 O(l) ØTrenutno je interesantna sinteza i proučavanje kompleksa Gd koji ima primenu u dijagnostici MRI (magnetic resonance imaging).

Kompleksi sa N- donor atomima ØMada je poznato piridin i slične baze grade adukte sa β-diketonima, mali broj kompleksa sa monodentatnim N-donor atomima postoji. Izbor medijuma (rastvarača) pri sintezi ovih kompleksa je veoma bitan. ØAminski kompleksi [Yb(NH 3)8][Cu(S 4)2]NH 3, [Yb(NH 3)8][Ag(S 4)2]· 2 NH 3, i [La(NH 3)9][Cu(S 4)2] su sintetizovani u amonijaku. ØDirektna reakcija halida lantanoida sa piridinom daje piridinske komplekse lantanoida: [YCl 3 py 4] i [Ln. Cl 3 py 4]· 0. 5 py (Ln = La, Er). Svi su oni pentagonalne bipiramide, sa dva Cl-atoma koja zauzimaju aksijalne položaje.
![ØPrimeri još nekih kompleksa sa Ndonor atomima 1MI 3 py 4 M Ce Nd ØPrimeri još nekih kompleksa sa N-donor atomima: 1)[MI 3 py 4] (M= Ce, Nd)](https://slidetodoc.com/presentation_image_h2/4c0427bb954a7c0011853c6baab09f3b/image-19.jpg)
ØPrimeri još nekih kompleksa sa N-donor atomima: 1)[MI 3 py 4] (M= Ce, Nd) 2)Eu. Cl 3 py 4 3)[Sm(meim)8]I 3 – kvadratna antiprizma meim 4)N-metilimidazol kompleksi [YX 2(N-meim)5]+ X− (X = Cl, Br) ØU slučaju tiocijanatnih kompleksa postoji različitost u vrsti i strukturi: 1)(Bu 4 N)3[M(NCS)6] (M = Y, Pr–Yb) – oktaedarska koordinacija 2)(Et 4 N)4 [M(NCS)7]. benzene (M = La, Pr) “capped” trigonalna prizma 3)(Me 4 N)4 [M(NCS)7]benzene (M = Dy, Et, Tb) – pentagonalna bipiramida

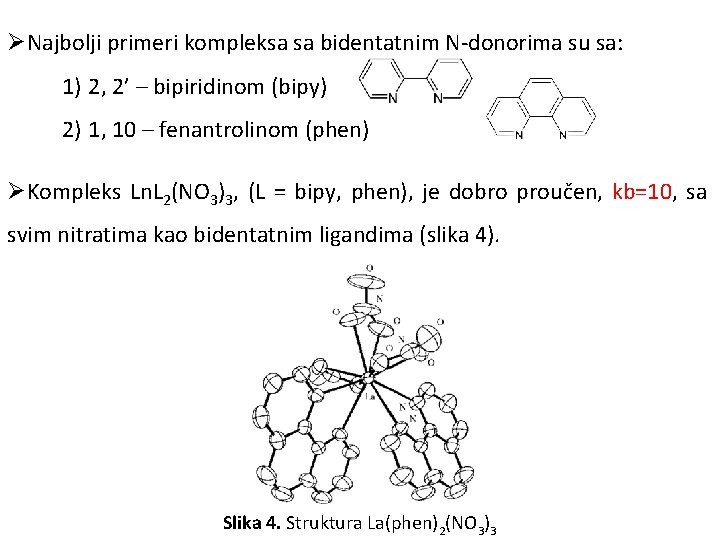
ØNajbolji primeri kompleksa sa bidentatnim N-donorima su sa: 1) 2, 2’ – bipiridinom (bipy) 2) 1, 10 – fenantrolinom (phen) ØKompleks Ln. L 2(NO 3)3, (L = bipy, phen), je dobro proučen, kb=10, sa svim nitratima kao bidentatnim ligandima (slika 4). Slika 4. Struktura La(phen)2(NO 3)3

ØTridentatni ligandi sa N-donor atomima su efikasni u odvajanju lantanida od aktinida u postupku frakcione ekstrakcije, primer 2, 2’ : 6’, 2’’ – terpiridil (terpy). ØOpšta formula Ln kompleksa sa ovim ligandom je [Ln(terpy)3] (Cl. O 4)3, sa kb=9, slika 5. Slika 5. Struktura [Eu(terpy)3]3+

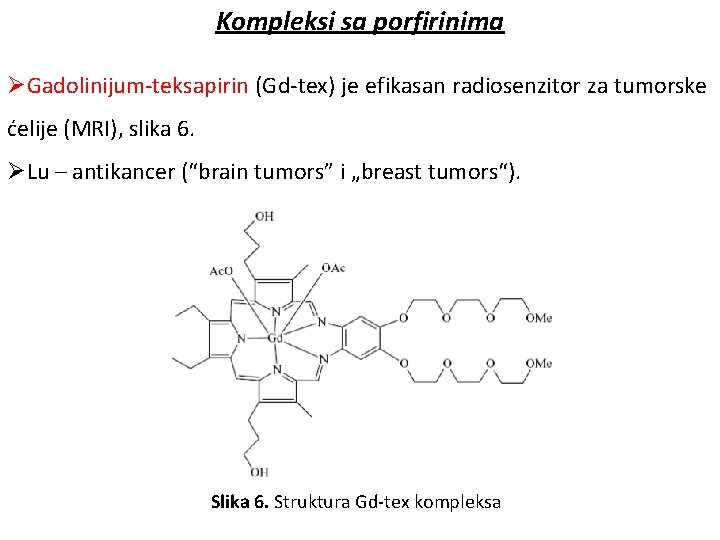
Kompleksi sa porfirinima ØGadolinijum-teksapirin (Gd-tex) je efikasan radiosenzitor za tumorske ćelije (MRI), slika 6. ØLu – antikancer (“brain tumors” i „breast tumors“). Slika 6. Struktura Gd-tex kompleksa

Halidni kompleksi ØHloridni i fluoridni kompleksi su dosta izučeni. Fluoridni kompleksi ALn. F 4, A 2 Ln. F 5 i A 3 Ln. F 6 (A = alkalni metal); imaju strukture sa kb= 9. ØCs 2 Li. Ln. Cl 6 važan u hemiji lantanida jer su na njemu proučavane optičke i magnetne osobine Ln 3+ jona. Kompleksi sa S-donor atomima ØKao meki donor atom S se ne očekuje mnogo u kompleksima lantanida. Većina kompleksa je izolovana u nepolarnim rastvaračima. ØPrimeri kompleksa sa S-donor atomima: 1) sa ditiokarbamatima Ln(S 2 CNR 2)3 2) ditiofosfatima Ln(S 2 PR 2)3
![Alkilamidi ØNajbolje okarakterisan alkilamid je siliamid LnNSi Me 323 koji se dobija u THF Alkilamidi ØNajbolje okarakterisan alkilamid je siliamid Ln[N(Si. Me 3)2]3 koji se dobija u THF](https://slidetodoc.com/presentation_image_h2/4c0427bb954a7c0011853c6baab09f3b/image-24.jpg)
Alkilamidi ØNajbolje okarakterisan alkilamid je siliamid Ln[N(Si. Me 3)2]3 koji se dobija u THF kao rastvaraču: Ln. Cl 3 + 3 Li. N(Si. Me 3)2 → 3 Li. Cl + Ln[N(Si. Me 3)2]3 Slika 7. Struktura Ln[N(Si. Me 3)2]3

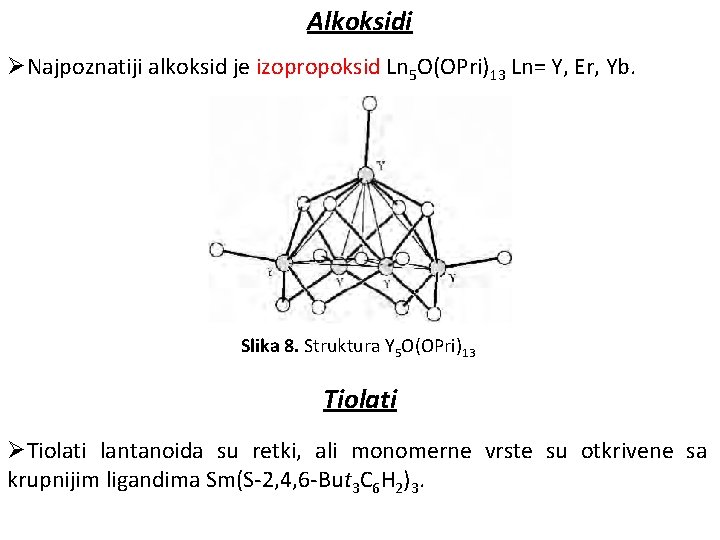
Alkoksidi ØNajpoznatiji alkoksid je izopropoksid Ln 5 O(OPri)13 Ln= Y, Er, Yb. Slika 8. Struktura Y 5 O(OPri)13 Tiolati ØTiolati lantanoida su retki, ali monomerne vrste su otkrivene sa krupnijim ligandima Sm(S-2, 4, 6 -But 3 C 6 H 2)3.

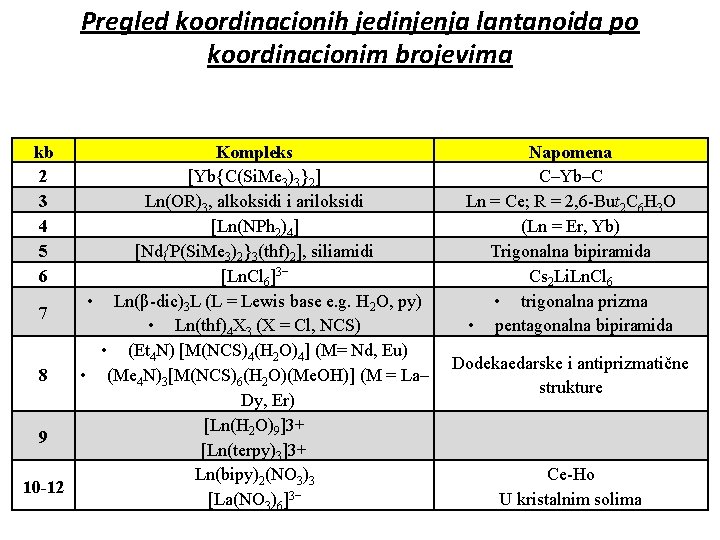
Pregled koordinacionih jedinjenja lantanoida po koordinacionim brojevima kb 2 3 4 5 6 Kompleks [Yb{C(Si. Me 3)3}2] Ln(OR)3, alkoksidi i ariloksidi [Ln(NPh 2)4] [Nd{P(Si. Me 3)2}3(thf)2], siliamidi [Ln. Cl 6]3− • Ln(β-dic)3 L (L = Lewis base e. g. H 2 O, py) 7 • Ln(thf)4 X 3 (X = Cl, NCS) • (Et 4 N) [M(NCS)4(H 2 O)4] (M= Nd, Eu) • (Me 4 N)3[M(NCS)6(H 2 O)(Me. OH)] (M = La– 8 Dy, Er) [Ln(H 2 O)9]3+ 9 [Ln(terpy)3]3+ Ln(bipy)2(NO 3)3 10 -12 [La(NO 3)6]3− Napomena C–Yb–C Ln = Ce; R = 2, 6 -But 2 C 6 H 3 O (Ln = Er, Yb) Trigonalna bipiramida Cs 2 Li. Ln. Cl 6 • trigonalna prizma • pentagonalna bipiramida Dodekaedarske i antiprizmatične strukture Ce-Ho U kristalnim solima

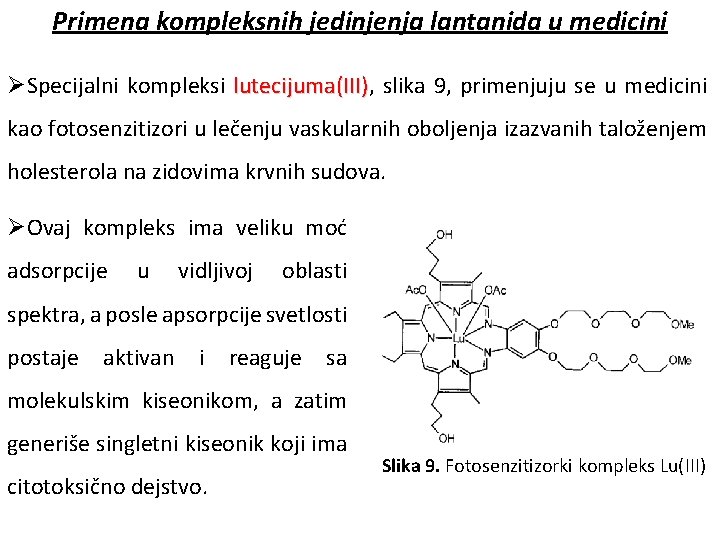
Primena kompleksnih jedinjenja lantanida u medicini ØSpecijalni kompleksi lutecijuma(III), lutecijuma(III) slika 9, primenjuju se u medicini kao fotosenzitizori u lečenju vaskularnih oboljenja izazvanih taloženjem holesterola na zidovima krvnih sudova. ØOvaj kompleks ima veliku moć adsorpcije u vidljivoj oblasti spektra, a posle apsorpcije svetlosti postaje aktivan i reaguje sa molekulskim kiseonikom, a zatim generiše singletni kiseonik koji ima citotoksično dejstvo. Slika 9. Fotosenzitizorki kompleks Lu(III)

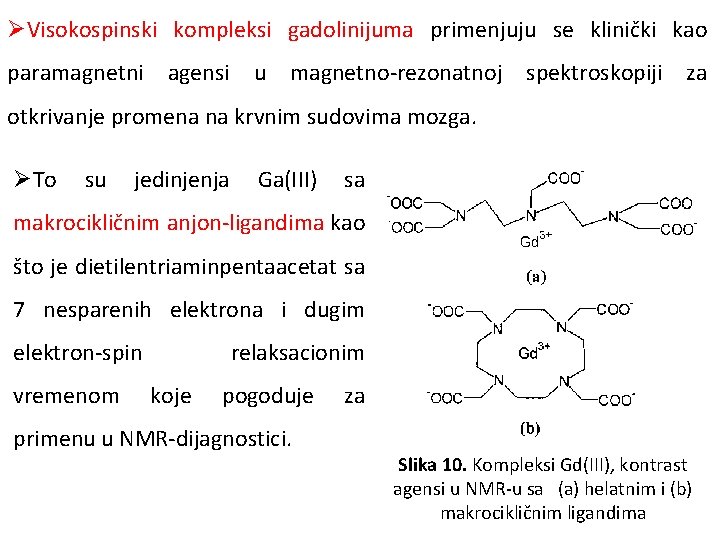
ØVisokospinski kompleksi gadolinijuma primenjuju se klinički kao paramagnetni agensi u magnetno-rezonatnoj spektroskopiji za otkrivanje promena na krvnim sudovima mozga. ØTo su jedinjenja Ga(III) sa makrocikličnim anjon-ligandima kao što je dietilentriaminpentaacetat sa 7 nesparenih elektrona i dugim elektron-spin vremenom relaksacionim koje pogoduje primenu u NMR-dijagnostici. za Slika 10. Kompleksi Gd(III), kontrast agensi u NMR-u sa (a) helatnim i (b) makrocikličnim ligandima