PRCTICA 4 PREPARACIN DISOLUCIONES DE CONCENTRACIN DETERMINADA Universidad







- Slides: 8

PRÁCTICA 4. PREPARACIÓN DISOLUCIONES DE CONCENTRACIÓN DETERMINADA. Universidad Veracruzana IQ 201 Química Inorgánica Profesora: María de Lourdes Nieto Peña Equipo 4: PEÑA CAUDER DENISE SANCHEZ GOMEZ JAHAZIEL DEL PRADO PEREZ YAHANA CISNEROS JIMENES ALEJANDRO HDZ MARTINEZ KEVIN

OBJETIVO • Preparar disoluciones de concentración definidas que sean utilizadas en prácticas posteriores. Fundamento q En las soluciones, el componente que se encuentra en mayor proporción por lo general es llamado disolvente, y el que se encuentra en menor proporción se reconoce como soluto. La mezcla que se constituye con disolventes y solutos es precisamente la solución o disolución. Cuando un soluto se mezcla con un disolvente y “aparentemente” parece desaparecer, se dice que se disuelve y que es muy soluble si es posible disolver una cantidad relativamente grande, y poco soluble si la cantidad que se disuelve es relativamente pequeña. La solubilidad es la capacidad que tienen los solutos de disolverse en solventes.

• El grado de solubilidad se aprecia por la cantidad de soluto que se disuelve en cierta cantidad de disolvente. Las unidades más comunes para expresar la concentración de una solución son como las que se muestran en el cuadro siguiente.

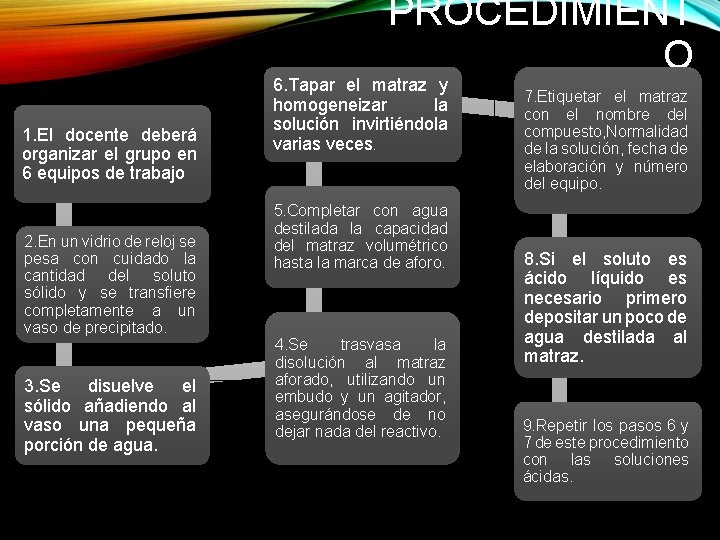
PROCEDIMIENT O 1. El docente deberá organizar el grupo en 6 equipos de trabajo 2. En un vidrio de reloj se pesa con cuidado la cantidad del soluto sólido y se transfiere completamente a un vaso de precipitado. 3. Se disuelve el sólido añadiendo al vaso una pequeña porción de agua. 6. Tapar el matraz y homogeneizar la solución invirtiéndola varias veces. 5. Completar con agua destilada la capacidad del matraz volumétrico hasta la marca de aforo. 4. Se trasvasa la disolución al matraz aforado, utilizando un embudo y un agitador, asegurándose de no dejar nada del reactivo. 7. Etiquetar el matraz con el nombre del compuesto, Normalidad de la solución, fecha de elaboración y número del equipo. 8. Si el soluto es ácido líquido es necesario primero depositar un poco de agua destilada al matraz. 9. Repetir los pasos 6 y 7 de este procedimiento con las soluciones ácidas.

CÁLCULOS Y RESULTADOS Sustancia Concentración % peso % volumen P. P. M Molaridad Sulfato de sodio 1. 5 % ------ 1, 500 0. 105 Na. OH (gr) 2% ------- 2, 00 0. 5 HCl (gr) ------- 1% 1, 000 0. 32 Ácido nítrico ------- 0. 5% 500 0. 11 MANEJO DE RESIDUOS Entregar los frascos con las soluciones preparadas al docente responsable.

Molaridad Na 2 SO 4 1 g/(142 g/mol*0. 1 L) = 0. 07 M Na. OH 0. 5 g/(40 g/mol*0. 1 L) = 0. 125 M HCl 1. 5 g/(36. 5 g/mol*0. 1 L) = 0. 41 M HNO 3 2 g/(63 g/mol*0. 1 L) = 0. 32 M Normalidad Na 2 SO 4 2. 5 g/(71 g/eq*0. 1 L) = 0. 352 N Na. OH 1. 3 g/(40 g/eq *0. 1 L) = 0. 325 N HCl 0. 8 g/(36. 5 g/eq*0. 1 L) = 0. 219 N HNO 3 1. 7 g/(63 g/eq*0. 1 L) = 0. 269 N Molalidad Na 2 SO 4 Vsoluto = m/D = 1. 7 g/2. 66 g/ml = 0. 639 ml Vsolvente = 100 ml – 0. 639 ml = 99. 361 g Psolvente = 0. 99361 kg 1. 7 g/(142 g/mol*0. 9931 kg) = 0. 012 m Na. OH Vsoluto = m/D = 0. 8 g/2. 13 g/ml = 0. 375 ml Vsolvente = 100 ml – 0. 375 ml = 99. 625 ml Kg solvente = 0. 99635 kg 0. 8 g/(40 g/mol*0. 99625 kg) = 0. 02 m HCl m = VD = (1. 3 ml)(1. 2 g/mol) = 1. 56 g; Kg solvente = 100 ml – 1. 3 ml = 98. 7 ml = 0. 987 kg ; molalidad = 1. 56 g/(36. 5 g/mol* 0. 987 kg) = 0. 04 m HNO 3 m = VD = (2. 5 ml)(1. 51 g/ml) = 3. 775 g; Kg solvente = 100 ml – 2. 5 ml = 97. 5 ml = 0. 975 kg; molalidad = 3. 775 g/(63 g/mol*0. 975 kg) = 0. 058 m

SUSTANC IA % en peso % en volumen partes por millón molaridad normalidad molalidad Na 2 SO 4 2 0. 5640 0. 07 0. 352 0. 012 Na. OH 1 0. 9630 0. 125 0. 325 0. 02 HCl 0. 56 1 10000 0. 41 0. 219 0. 04 HNO 3 2. 265 0. 5 5000 0. 32 0. 269 0. 058

OBSERVACIONES La solución de sulfato de sodio e hidróxido de sodio las depositamos en pequeños frascos de vidrio etiquetados respectivamente, mientras que las soluciones de HCl y HNO 3 las depositamos en matraces de 1000 ml. Etiquetados utilizados por todo el grupo. El Na. OH utilizado es sólido y son como perlas acuosas blanquecinas, el sulfato de sodio es sólido y es un polvo blanco que con el tiempo se endura, el ácido clorhídrico y el ácido nítrico son reactivos líquidos que deben manejarse con mucho cuidado por el riesgo que presentan para la salud.















