Ppravn kurs pro posluchae 1 ronku FCh T












- Slides: 14

Přípravný kurs pro posluchače 1. ročníku FCh. T Upce Studijní materiály Obecná a anorganická chemie I 1. Přednášky: Klikorka J. , Hájek B. , Votinský J. : Obecná a anorganická chemie, SNTL, Praha 1985, 1989, www. ulozto. cz. 2. Semináře: Handlíř K. , Nádvorník M. , Vlček M. : Výpočty a cvičení z obecné a anorganické chemie I. Skriptum UPa, Pardubice 2008. 3. Přípravný kurs: https: //fcht. upce. cz/fcht/koanch/dokumenty-ke-stazeni. html. Laboratorní cvičení z Obecné a anorganická chemie I 1. Laboratorní cvičení: Handlíř K. , Mošner P. , Nádvorník M. , Vlček M. : Laboratorní cvičení z obecné chemie. Skriptum UPa, 4. vydání, Pardubice 2008. 2. Informace také na nástěnce u posluchačské laboratoře.

Názvosloví anorganických sloučenin Prvky • Je třeba znát české názvy prvků, včetně f-prvků. • Latinské (mezinárodní) názvy následujících prvků se výrazně odlišují od českých: H, C, N, O, Na, Mg, Al, Si, P, S, K, Ca, Fe, Ni, Cu, Ag, Sn, Sb, Au, Hg, Pb. • Izotopy nemají samostatné názvy, výjimky: deuterium (2 H, D) a tritium (3 H, T). • Skupinové názvy prvků (alkalické kovy, chalkogeny, vzácné plyny atd. ). • Pravopis (tellur, beryllium, bismut, thallium, yttrium, thorium, ytterbium ap. ). • Časté záměny a chyby nastávají u prvků jejichž značka začíná stejným písmenem. B Ba Be Bi Br Bk Ca Cd Cf Cm Cs Cr Pt Pu Pa Pd Po Pm Ra Rb Rh Rn Ru Re Ta Tb Tc Th Tl Tm Si Sc Se Sr Sn Sm Ni Nb V W Fe Fr Periodická soustava prvků dle IUPAC. Osobní webové stránky Ladislava Nádherného na VŠCHT Praha [online]

Názvosloví anorganických sloučenin Sloučeniny • České názvy sloučenin jsou obvykle tvořeny dvěma slovy • Pro sestavení správného názvu je třeba určit oxidační čísla iontů v kationtové i aniontové části sloučeniny Podstatné jméno (elektronegativnější část) (anion) Rb 2 O Ag. Br (NH 4)2 SO 4 Mg. Cr 3 O 10 KCN oxid bromid síran trichroman kyanid Přídavné jméno (elektropozitivnější část) (kation) rubidný stříbrný amonný hořečnatý draselný

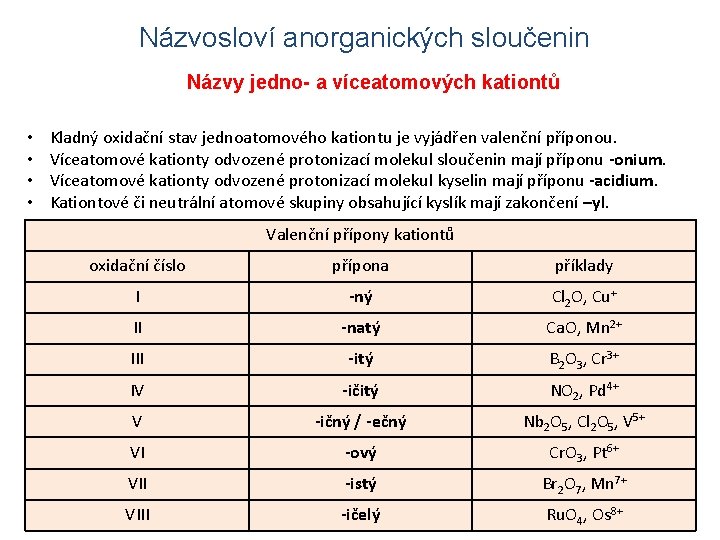
Názvosloví anorganických sloučenin Názvy jedno- a víceatomových kationtů • • Kladný oxidační stav jednoatomového kationtu je vyjádřen valenční příponou. Víceatomové kationty odvozené protonizací molekul sloučenin mají příponu -onium. Víceatomové kationty odvozené protonizací molekul kyselin mají příponu -acidium. Kationtové či neutrální atomové skupiny obsahující kyslík mají zakončení –yl. Valenční přípony kationtů NH 4+ oxidační číslo H 3 S+ I PH 4+ H 3 Se+ II H 2 NOIII 3+ H 4 PO 4+ IV NO+ V NO 2+VI SO 2+ SO 22+ Sb. H 4+ přípona + H F 2 -ný H 3 O+příklady Cl 2 O, Cu+ -natý Ca. O, Mn 2+ -itý B 2 O 3, Cr 3+ -ičitý NO 2, Pd 4+ -ičný / -ečný UO 22+ -ový VO 2+ 2+, Cl O , V 5+ Nb 2 O Cr. O 2 5 25 CO Cr. O 3, Pt 6+ VII -istý Br 2 O 7, Mn 7+ VIII -ičelý Ru. O 4, Os 8+

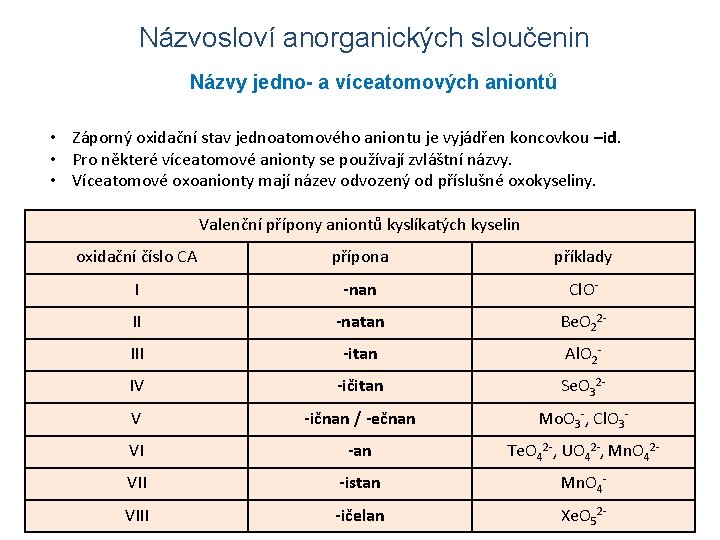
Názvosloví anorganických sloučenin Názvy jedno- a víceatomových aniontů • Záporný oxidační stav jednoatomového aniontu je vyjádřen koncovkou –id. • Pro některé víceatomové anionty se používají zvláštní názvy. • Víceatomové oxoanionty mají název odvozený od příslušné oxokyseliny. Valenční přípony aniontů kyslíkatých kyselin oxidační číslo CA OHI II IV V VI O 22 O 2 O 3 HO 2 S 22 C 4 C 22 - 3 Npřípona NH-nan 2 2 NH-natan N 3 CN--itan OCN -ičitan SCN-ičnan /--ečnan Se. CN -an příklady C(CN)3 P 3 Cl. OSi 4 Be. O 223 B Al. O 2 HSI 3 Se. O 32 DMo. O 3 -, Cl. O 32 Sn Te. O 42 -, UO 42 -, Mn. O 42 - VII -istan Mn. O 4 - VIII -ičelan Xe. O 52 -

Názvosloví anorganických sloučenin Sloučeniny prvků s vodíkem • Silně elektropozitivní prvky tvoří s vodíkem hydridy (Na. H, Li. H, Mg. H 2 aj. ). • Halogeny tvoří s vodíkem halogenovodíky (HF, HCl, HBr, HI) • Ostatní binární sloučeniny s vodíkem mají název odvozený od latinského názvu prvku s příponou –an. • V některých případech se používají triviální názvy (CH 4, C 2 H 2, NH 3, N 2 H 4, H 2 O). BH 3 Al. H 3 Ga. H 3 In. H 3 Tl. H 3 CH 4 Si. H 4 Ge. H 4 Sn. H 4 Pb. H 4 NH 3 PH 3 As. H 3 Sb. H 3 Bi. H 3 H 2 O H 2 S H 2 Se H 2 Te H 2 Po B 2 H 6 Si 2 H 6 P 2 H 4 H 2 Sx

Názvosloví anorganických sloučenin Kyseliny a jejich deriváty Binární a pseudobinární kyseliny s příponou –ová k názvu odpovídající kyseliny U jednosytných oxokyselin se číslovka mono vynechává. U vícesytných se uvádí počet kyselých vodíků. Existují triviální názvy kyselin (např. H 2 S 2 O 4, H 2 S 2 O 6). Peroxokyseliny vznikají formální záměnou oxidového můstku peroxidovým, tj. –O– → –O–O–. • V thiokyselinách je oxidový můstek nahrazen sulfidovým, tj. –O– → –S–. • V halogenokyselinách je skupina –OH nahrazena halogenidem –X. • • • HF HMn. O 4 H 4 Si. O 4 HNO 4 H 3 As. OS 2 HSO 3 F HCN HIO H 2 Si. O 2 H 2 CO 5 H 2 S 2 O 3 HBF 4 HN 3 HBO 2 H 6 Te. O 6 H 2 SO 5 H 2 CS 3 HPF 6 HOCN HAs. O 3 H 3 PO 4 H 2 S 2 O 8 HSCN HSb. F 6

Názvosloví anorganických sloučenin Normální (jednoduché) soli a) Násobné číslovky se uvádí u kombinace, kde je kyselina jedno- nebo trojsytná a vzniká sůl s trojmocným kationtem, např. Al. PO 4 vs Al(PO 3)3. b) Násobné číslovky se uvádí u kombinace, kde je kyselina dvoj- nebo čtyřsytná a vzniká sůl se čtyřmocným kationtem, např. Ce. Si. O 4 vs Ce(Si. O 3)2. c) V ostatních případech se uvádí počet kationtů s odpovídající valenční koncovkou, např. Na 3 Tc. O 5, K 2 U 2 O 7. Cr. BO 3 Tl(As. O 2)3 Zn 5(IO 6)2 Tl 3 PO 3 Y(BO 2)3 Sc 2 Si 2 O 7 Ga. As. O 3 Li 2 Cr 3 O 10

Názvosloví anorganických sloučenin Ostatní soli • U hydrogensolí se uvádí počet kyselých vodíků v aniontu a předpona hydrogen-. • Hydráty solí se udávají vždy jako genitiv (Sn. Cl 2∙ 2 H 2 O, Ca. SO 4∙ ½ H 2 O). • Oxid- a hydroxid-soli: počet O 2 - nebo OH- uvést číslovkou, názvy aniontů jsou odděleny pomlčkou, pořadí abecedně i ve vzorci. Např. Bi. Cl(O), Cu 2 Cl(OH)3. • Názvy podvojných solí se tvoří podobně, názvy aniontů odděleny pomlčkou v abecedním pořadí (centrálního atomu). Např. Ca. Cl(Cl. O), Cu 3(CO 3)2 F 2. • V případě více kationtů je pořadí určeno rostoucím oxidačním číslem (je-li shodné, pak dle abecedy). Víceatomové kationty jako poslední. (KCa. F 3, Na. NH 4 HPO 4∙ 4 H 2 O, NH 4 Cr(SO 4)2∙ 12 H 2 O)

Názvosloví anorganických sloučenin Nevazebné sloučeniny, karbonyly kovů • Jsou to sloučeniny, ve kterých jsou prvky formálně v oxidačním stavu 0. Např. Mn 2 As, Sr. B 6, Fe(CO)5, Co 2(CO)8, Fe 3 C, Cu 5 Si • Naproti tomu jsou následující sloučeniny pojmenované jako klasické soli: Mn 3 As 2, BN, Fe 2 C, Mg 2 C 3. Arsenid dimanganu Hexaborid stroncia Pentakarbonyl železa Oktakarbonyl dikobaltu Karbid triželeza Silicid pentamědi Arsenid manganatý Nitrid boritý Karbid železnatý Trikarbid (allenid) hořečnatý

Názvosloví anorganických sloučenin Příklady k procvičení Pojmenujte: 1) Ba. O 2 2) La 2 Te 3 3) Ga. P 4) H 6 Te. O 6 5) Ce(Si. O 3)2 6) Th(Cl. O 4)(OH)3 7) Cd. H 3 IO 6 8) Sc 2 Mo 7 O 24 9) H 2 PO 310) PH 4 Cl. O 4 11) NO+ 12) Ag 2 C 2 13) Be. Mn. O 4 14) HI 3 O 8 15) Rb. NH 2 1) Peroxid barnatý 2) Tellurid lanthanitý 3) Fosfid gallitý 4) Kyselina hexahydrogentellurová 5) Bis(křemičitan) ceričitý 6) Chloristan-trihydroxid thoričitý 7) Trihydrogenjodistan kademnatý 8) Heptamolybdenan diskanditý 9) Dihydrogenfosforitan(1 -) 10) Chloristan fosfonia 11) Nitrosylový kation 12) Acetylid stříbrný 13) Manganan beryllnatý 14) Kyselina trijodičná 15) Amid rubidný

Názvosloví anorganických sloučenin Příklady k procvičení Pojmenujte: 1) KMg. PO 4 2) Mn 6 N 5 3) Cl. F 3 O 4) H 2 O 2 5) Na 2 S 2 O 4 6) Cr(OH)3 7) Sm. I 2 8) UCl 4 9) Cu. HAs. O 4 10) H 2 F+ 11) V 5 O 14312) Na 6 Cl. F(SO 4)2 13) (CN)2 14) O 2 F 2 15) Eu 2(SO 4)3 ∙ 9 H 2 O 1) Foforečnan draselno-hořečnatý 2) Pentanitrid hexamanganu 3) Trifluorid-oxid chlorečný 4) Peroxid vodíku 5) Dithioničitan sodný 6) Hydroxid chromitý 7) Jodid samarnatý 8) Chlorid uraničitý 9) Hydrogenarseničnan měďnatý 10) Kation fluoronia 11) Pentavanadičnan(3 -) 12) Chlorid-fluorid-bis(síran) hexasodný 13) Dikyan 14) Difluorid dikyslíku 15) Nonahydrát síranu europitého

Názvosloví anorganických sloučenin Příklady k procvičení Uveďte vzorce: 1) Hydroxid thallný 2) Ruthenan hořečnatý 3) Hexahydrát dusičnanu uranylu 4) Hyperoxid cesný 5) Azidovodík 6) Kyselina osmičelá 7) Karbid wolframu 8) Tris(fosforečnan) ytterbitý 9) Dihydrogendirheničnan(2 -) 10) Trichlorid-oxid fosforečný 11) Digerman 12) Peroxodisíran amonný 13) Pentahydrát thiosíranu sodného 14) Kyselina chlorosírová 15) Oxid manganistý 1) Tl. OH 2) Mg. Ru. O 4 3) UO 2(NO 3)2 ∙ 6 H 2 O 4) Cs. O 2 5) HN 3 6) H 2 Os. O 5 7) WC 8) Y(PO 3)3 9) H 2 Re 2 O 5210) PCl 3 O (POCl 3) 11) Ge 2 H 6 12) (NH 4)2 S 2 O 8 13) Na 2 S 2 O 3 ∙ 5 H 2 O 14) HSO 3 Cl 15) Mn 2 O 7

Názvosloví anorganických sloučenin Příklady k procvičení Uveďte vzorce: 1) Kyselina tetrathionová 2) Imid strontnatý 3) Xenoničelan(4 -) 4) Acetylid zlatný 5) Bromičnan rubidný 6) Chlorid rtuťný 7) Dichlorid-oxid zirkoničitý 8) Bis(seleničitan) manganičitý 9) Stannid hořečnatý 10) Hydroxonium 11) Oxid-diperoxid chromový 12) Disulfid železnatý 13) Trihydrogenjodistan rtuťnatý 14) Triboritan(3 -) 15) Selenokyanatan amonný 1) H 2 S 4 O 6 2) Sr. NH 3) Xe. O 544) Au 2 C 2 5) Rb. Br. O 3 6) Hg 2 Cl 2 7) Zr. Cl 2 O 8) Mn(Se. O 3)2 9) Mg 2 Sn 10) H 3 O+ 11) Cr. O 5 12) Fe. S 2 13) Hg. H 3 IO 6 14) B 3 O 6315) NH 4 Se. CN



























