Potenciometria Elektroanalitika fogalma Potenciometria fogalma mrcella felptse mr







- Slides: 10

Potenciometria Elektroanalitika fogalma, Potenciometria fogalma, mérőcella felépítése, mérő- és összehasonlító elektródok, Közvetlen és közvetett potenciometria

Elektroanalitika fogalma Az elektroanalitikai eljárások közé azok az analitikai módszerek tartoznak, ahol egy elektrokémiai cellában lévő minta meghatározását végezzük feszültség és/vagy áram mérésén keresztül. Attól függően, hogy az elektrokémia folyamat során melyik paramétert szabályozzuk, illetve mérjük, számos módszert különíthetünk el. Az elektroanalitika négy legfontosabb, leggyakrabban alkalmazott ága: ➔ ➔ potenciometria (elektródpotenciál különbség mérése) konduktometria coulombmetria (a cellán átfolyó áram mérése az idő függvényében) voltammetria (a cella potenciálját szabályozva mérjük az áramot). Az elektrokémia vizsgálatokhoz a mérőcellában lévő mintába merülő elektródokat használunk. A mérések típusától függően 2 -4 elektródot alkalmazunk. Funkciójuk alapján elkülönítünk: a) munka- vagy indikátorelektródot, b) vonatkozási- vagy referenciaelektródot c) segédelektródot

Potenciometria fogalma A potenciometria az elektródpotenciálok mérésén alapuló elektroanalitikai eljárás, amelynél a mérendő ion, komponens meghatározására a vizsgálandó oldatban elhelyezett indikátorelektródon kialakuló potenciáljelet (elektródpotenciált) használjuk. Egy indikátor-, és az állandó potenciálú vonatkozási (összehasonlító) elektródot tartalmazó elektrokémiai cella (galváncella) feszültségét mérjük, úgy, hogy a mérés során jelentős áram nem halad át a cellán.

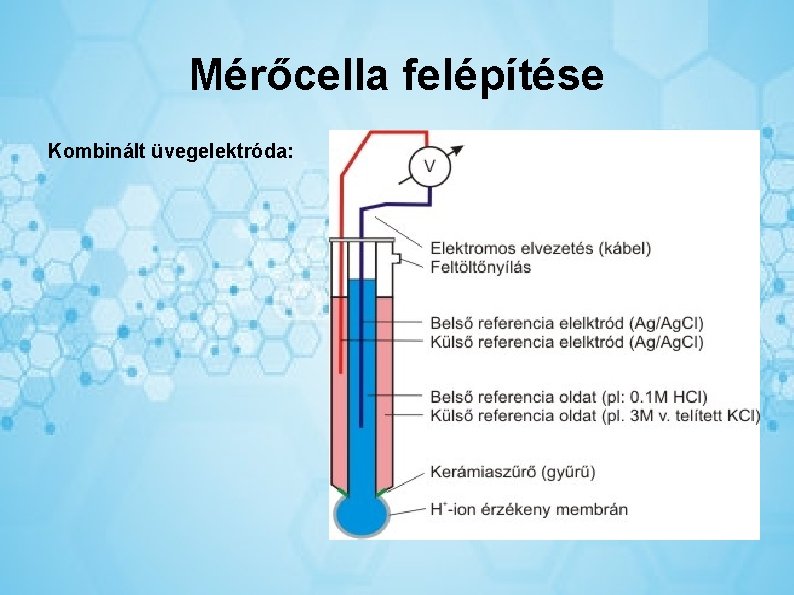
Mérőcella felépítése Kombinált üvegelektróda:

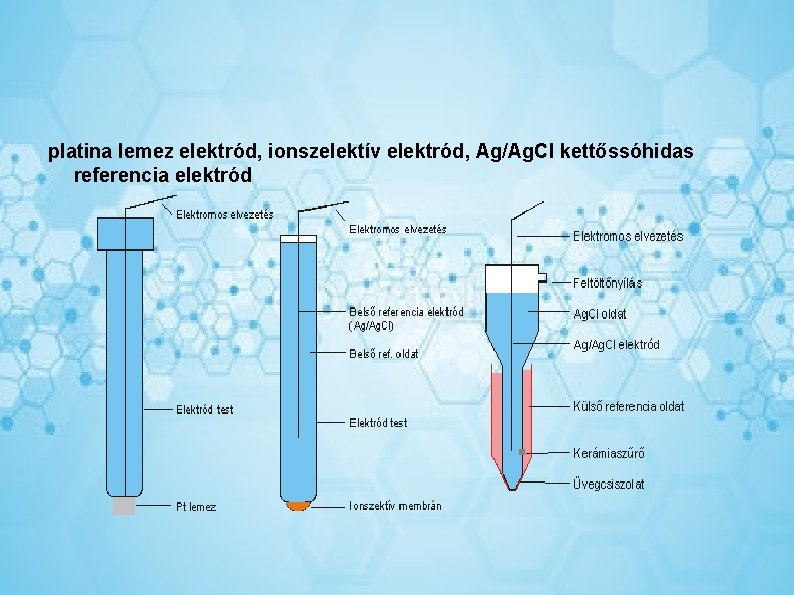
platina lemez elektród, ionszelektív elektród, Ag/Ag. Cl kettőssóhidas referencia elektród

Ionszelektív elektródok Az ionszelektív alapelektródoknak mind a konstrukció, mind a működési elv szerint számos fajtáját különböztetjük meg. Számos típus potenciálja nem követi a Nernst-egyenletet sem, azonban mindig igaz, hogy az elektródaktív ion koncentrációjának megváltozása eltolja az elektród potenciálját, ami a gyakorlati alkalmazáshoz elegendő. Az ionszelektív elektródok leggyakoribb típusa a membránelektród. Ezen elektródok felépítése hasonló az üvegelektródéhoz azzal a különbséggel, hogy itt a membrán egy szervetlen csapadékból préselt lapos pasztilla (lemez) vagy vezetővé tett műanyag membrán, amelybe alkalmas szerves vegyület (pl. enzim) van beágyazva. Ehhez a „membránhoz” legtöbbször közvetlenül csatlakozik a potenciál kivezető fémérintkező, ritkábban megtalálható itt is a belső referencia elektród. Az elektródtest többnyire egy műanyag cső, alján a membránnal

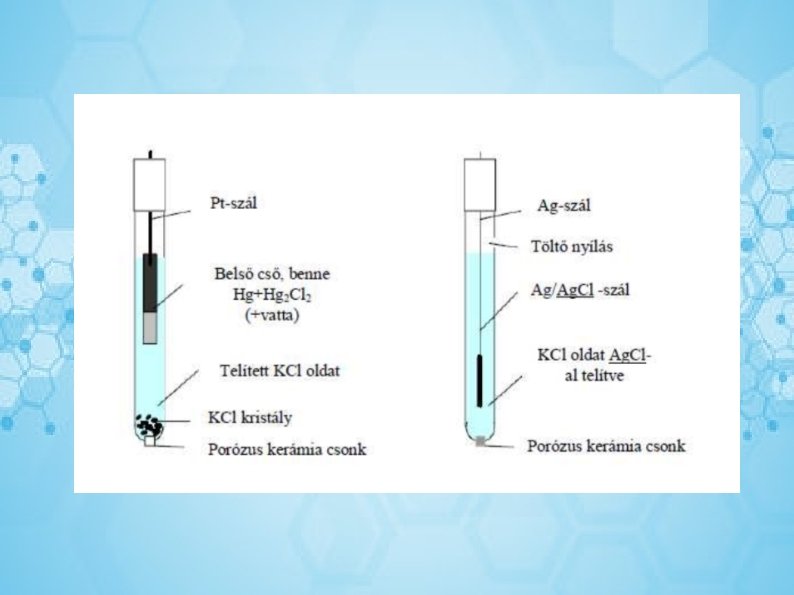
Mérő- és összehasonlító elektródok A pontos mérésekhez szükséges, hogy a referencia (viszonyító)elektródok potenciálja a mérés során közel állandó legyen, ugyanis ekkor a mért elektródpotenciál-különbség csak az indikátor elektródon kialakuló potenciálból származik, vagyis az elektródaktív anyag koncentrációjával (aktivitásával) arányos. A referencia elektródok többnyire másodfajú elektródok, a gyakorlatban Ag/Ag. Cl vagy Hg/Hg 2 Cl 2 elektródokat használunk. A másodfajú elektródok egy fémből, a fém rosszul oldódó sójából, valamint a só anionjának nagy koncentrációjú oldatából állnak. Indikátor elektródként elsőfajú fémelektródokat vagy 1 -1 ionra (v. molekulára) szelektív elektródokat használunk, melyek lehetnek ionszelektív-, gáz-, redoxi-, enzimelektródok.


Közvetlen és közvetett potenciometria Közvetlen Direkt potenciometria: Az elektromotoros erő méréséből az elektródpotenciálon keresztül az aktivitásra illetve a koncentrációra következtetünk. A meghatározás hibája általában néhány %-os nagyságrendű. Leggyakoribb alkalmazása: p. H-mérés. Közvetett Indirekt potenciometria = potenciometriás titrálás: az elektródpotenciál változását követjük titrálás közben, a potenciometriás mérés a végpont megállapítására szolgál. A megbízhatóság elérheti a klasszikus elemzésekre jellemző értéket.

Potenciometriás titrálás esetén a mérés ekvivalencia pontjának meghatározása a mérési adatok grafikus kiértékelésével történik. Az ábrán egy erős sav-erős bázis titrálási görbe látható. A mérőoldat fogyásának függvényében ábrázoljuk az oldat p. H-jának változását. A p. H az ekvivalencia pont eléréséig gyakorlatilag nem változik, de a titrálás végpontjának közelében ugrásszerű változás következik be, már egy csepp mérőoldat hatására is. Ha az oldathoz még tovább adunk mérőoldatot a p. H változása újra jelentéktelen. Az ekvivalenciapont helye szerkesztéssel könnyen meghatározható. A görbék egyenes szakaszaihoz húzott érintők metszéspontjának távolsága az ún. potenciállépcső (h). A h/2 -vel jelölt féllépcsőpotenciálban húzott x-tengellyel párhuzamos egyenes elmetszi a görbét. A metszéspontot az x-tengelyre levetítve megkapjuk az ekvivalenciaponthoz tartozó fogyást. E térfogat és a mérőoldat koncentrációjának, valamint a lejátszódó folyamat reakcióegyenletének ismeretében a titrált oldat koncentrációja kiszámolható.