Potenciometra Qumica Analtica Instrumental Comisin A Curso 2016






















![Error alcalino (p. Hmedido < p. Hreal) Cuando la [H+] es muy baja (p. Error alcalino (p. Hmedido < p. Hreal) Cuando la [H+] es muy baja (p.](https://slidetodoc.com/presentation_image_h/7df25602a9648cc417aaf33ea8664900/image-42.jpg)
- Slides: 42

Potenciometría Química Analítica Instrumental Comisión A Curso 2016

Potenciometría Electrodos y sensores v Métodos directos v Titulaciones potenciométricas v

Aplicaciones comunes • Análisis de iones de procesos industriales batch o continuos • Determinación de monitoreo continuo de la calidad de aire y gases contaminantes • Determinación de electrolitos en fluidos fisiológicos para análisis clínicos • Desarrollo de biosensores basados en enzimas inmovilizadas y electrodos • Determinación de iones constituyentes en muestras de agricultura, medio ambiente y farmacia • Determinación de p. H • Determinación del punto final en titulaciones de ácidos, bases y redox

Muestras: Estado, cantidad y preparación Se pueden analizar fácilmente la mayoría de las muestras líquidas y gaseosas. Las muestras sólidas se pueden analizar si es posible prepararlas en forma de solución Los límites de detección son de aproximadamente 10 -5 a 10 -6 M para electrodos convencionales. Para sensores de gas, los límites de detección varían entre 0, 01 y 5 ppm. Se requiere poca preparación para muestras líquidas y gaseosas. Los sólidos orgánicos que no se disuelven fácilmente (tales como alimentos, vegetales y productos farmacéuticos) se deben calcinar primero, y luego extraer los iones empleando un solvente adecuado.

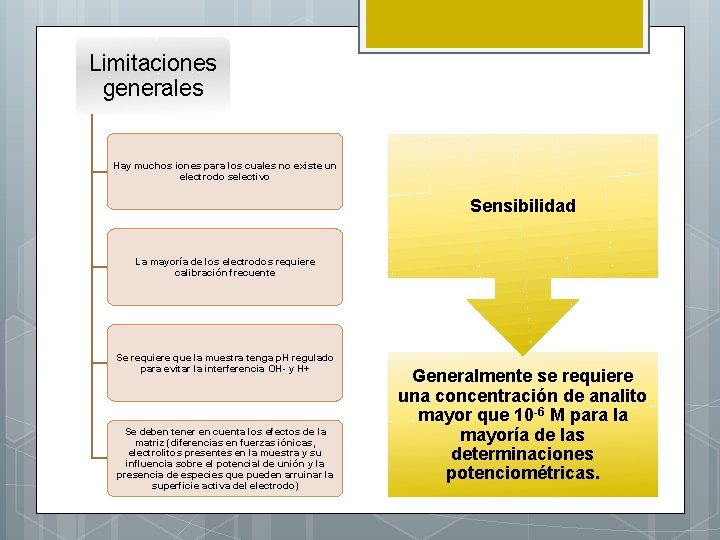
Limitaciones generales Hay muchos iones para los cuales no existe un electrodo selectivo Sensibilidad La mayoría de los electrodos requiere calibración frecuente Se requiere que la muestra tenga p. H regulado para evitar la interferencia OH- y H+ Se deben tener en cuenta los efectos de la matriz (diferencias en fuerzas iónicas, electrolitos presentes en la muestra y su influencia sobre el potencial de unión y la presencia de especies que pueden arruinar la superficie activa del electrodo) Generalmente se requiere una concentración de analito mayor que 10 -6 M para la mayoría de las determinaciones potenciométricas.

Métodos potenciométricos Se basan en las medidas del potencial de celdas electroquímicas en ausencia de corrientes apreciables. Comprenden dos tipos fundamentales: Medida directa del potencial de electrodo Medida del cambio de la FEM causado por la adición de un titulante

Medidas potenciométricas directas Se pueden utilizar para realizar análisis químicos de aquellas especies para las cuales existe un electrodo indicador. Está limitada a la medida de potenciales de equilibrio de sistemas rápidos, a los que puede aplicarse la ecuación de Nernst:

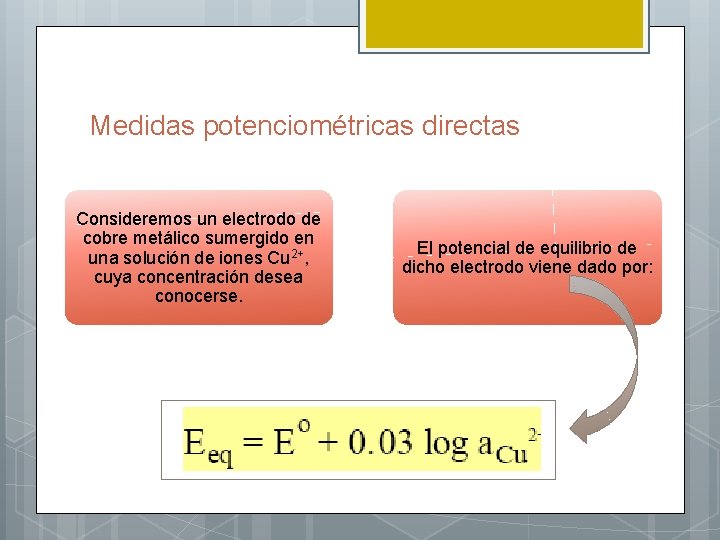
Medidas potenciométricas directas Consideremos un electrodo de cobre metálico sumergido en una solución de iones Cu 2+, cuya concentración desea conocerse. El potencial de equilibrio de dicho electrodo viene dado por:

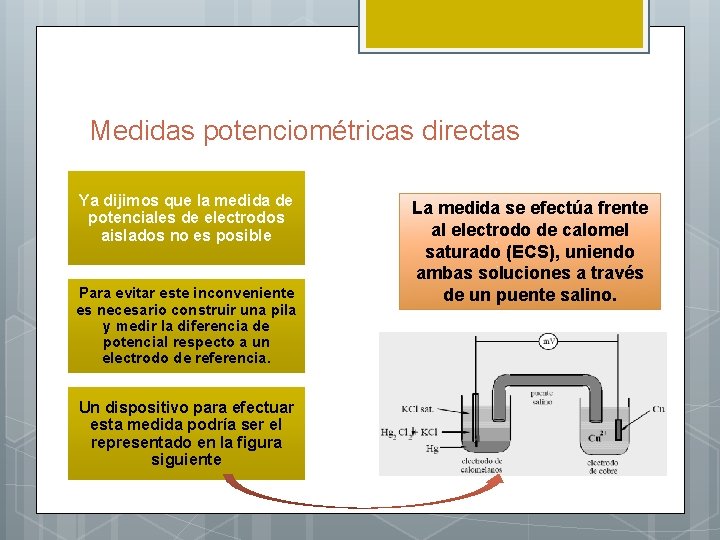
Medidas potenciométricas directas Ya dijimos que la medida de potenciales de electrodos aislados no es posible Para evitar este inconveniente es necesario construir una pila y medir la diferencia de potencial respecto a un electrodo de referencia. Un dispositivo para efectuar esta medida podría ser el representado en la figura siguiente La medida se efectúa frente al electrodo de calomel saturado (ECS), uniendo ambas soluciones a través de un puente salino.

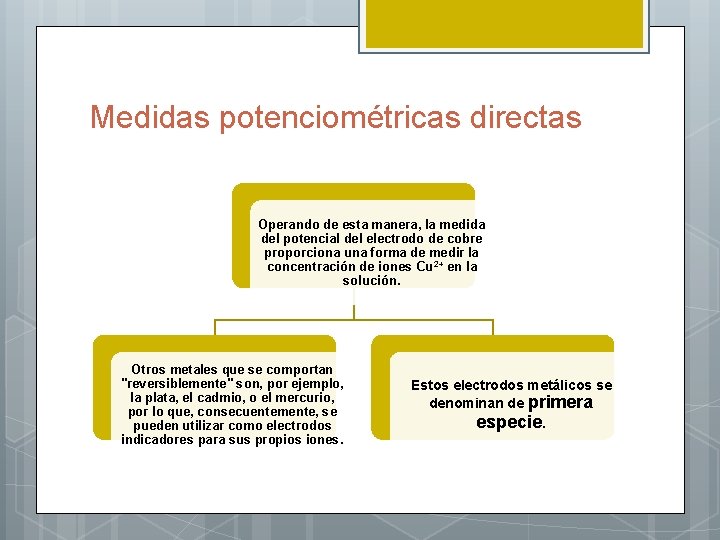
Medidas potenciométricas directas Operando de esta manera, la medida del potencial del electrodo de cobre proporciona una forma de medir la concentración de iones Cu 2+ en la solución. Otros metales que se comportan "reversiblemente" son, por ejemplo, la plata, el cadmio, o el mercurio, por lo que, consecuentemente, se pueden utilizar como electrodos indicadores para sus propios iones. Estos electrodos metálicos se denominan de primera especie.

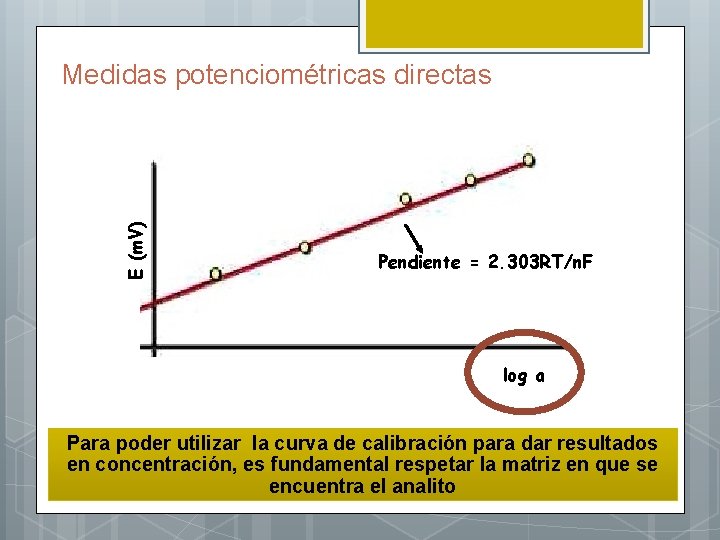
Medidas potenciométricas directas La concentración del analito se obtiene por interpolación a partir de una curva de calibración E vs. log c La curva de calibración se Se elimina el O 2 construye con por burbujeo con patrones de N 2 concentración entre 10 -1 y 10 -9 M

E (m. V) Medidas potenciométricas directas Pendiente = 2. 303 RT/n. F log a Para poder utilizar la curva de calibración para dar resultados en concentración, es fundamental respetar la matriz en que se encuentra el analito

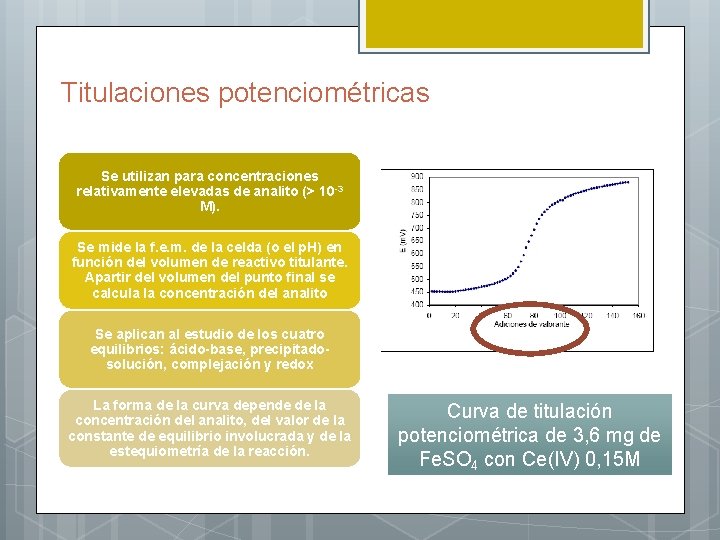
Titulaciones potenciométricas Se utilizan para concentraciones relativamente elevadas de analito (> 10 -3 M). Se mide la f. e. m. de la celda (o el p. H) en función del volumen de reactivo titulante. Apartir del volumen del punto final se calcula la concentración del analito Se aplican al estudio de los cuatro equilibrios: ácido-base, precipitadosolución, complejación y redox La forma de la curva depende de la concentración del analito, del valor de la constante de equilibrio involucrada y de la estequiometría de la reacción. Curva de titulación potenciométrica de 3, 6 mg de Fe. SO 4 con Ce(IV) 0, 15 M

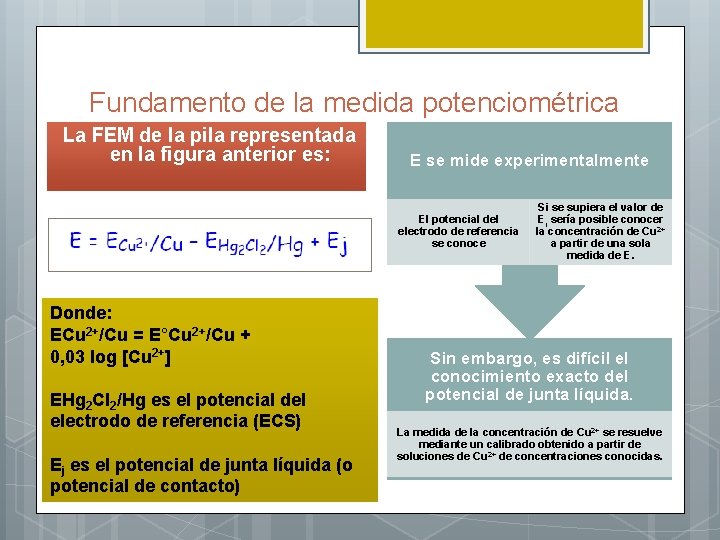
Fundamento de la medida potenciométrica La FEM de la pila representada en la figura anterior es: E se mide experimentalmente El potencial del electrodo de referencia se conoce Donde: ECu 2+/Cu = E°Cu 2+/Cu + 0, 03 log [Cu 2+] EHg 2 Cl 2/Hg es el potencial del electrodo de referencia (ECS) Ej es el potencial de junta líquida (o potencial de contacto) Si se supiera el valor de Ej sería posible conocer la concentración de Cu 2+ a partir de una sola medida de E. Sin embargo, es difícil el conocimiento exacto del potencial de junta líquida. La medida de la concentración de Cu 2+ se resuelve mediante un calibrado obtenido a partir de soluciones de Cu 2+ de concentraciones conocidas.

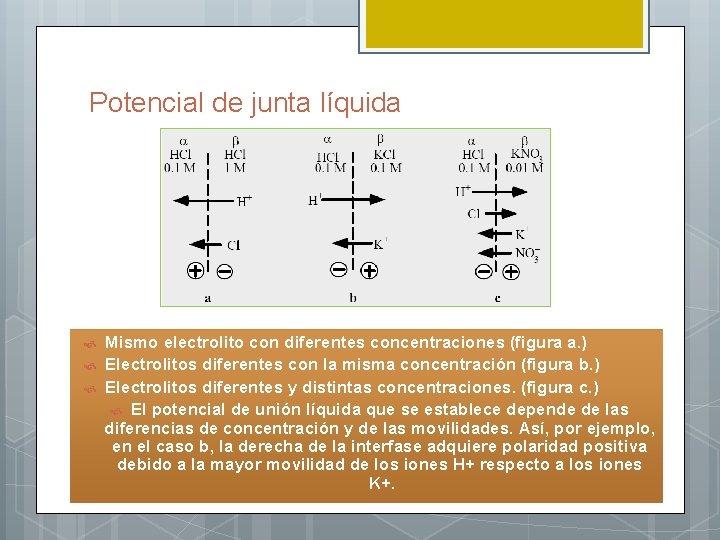
El potencial de junta líquida (Ej) l Pequeña diferencia de potencial que se establece en la interfase entre el puente salino y cada semicelda l Impone una limitación fundamental a la exactitud de las medidas potenciométricas l Sea la celda: l Más iones pasarán del compartimiento donde la concentración es mayor hacia aquel donde es menor (c 2 > c 1)

Potencial de junta líquida Como consecuencia del gradiente de concentración, los iones K + de la solución contenida en el electrodo difunden hacia el puente salino. Asimismo, los iones Cl – difunden en la misma dirección, mientras que los iones NO 3– lo hacen en dirección contraria. Cuando se tienen dos electrólitos distintos (en concentración o en naturaleza), en la interfase de ambos, se establece una diferencia de potencial, como consecuencia de la diferente difusión de sus iones. El movimiento de los iones Cl – y NO 3– hacia la derecha e izquierda respectivamente es casi de la misma magnitud, mientras que pasan mayor número de iones K + de derecha a izquierda que al contrario. Por ello, el lado izquierdo de la interfase se cargaría negativamente y el lado derecho positivamente, estableciéndose una diferencia de potencial, denominado de junta líquida o también potencial de difusión.

Potencial de junta líquida Mismo electrolito con diferentes concentraciones (figura a. ) Electrolitos diferentes con la misma concentración (figura b. ) Electrolitos diferentes y distintas concentraciones. (figura c. ) El potencial de unión líquida que se establece depende de las diferencias de concentración y de las movilidades. Así, por ejemplo, en el caso b, la derecha de la interfase adquiere polaridad positiva debido a la mayor movilidad de los iones H+ respecto a los iones K+.

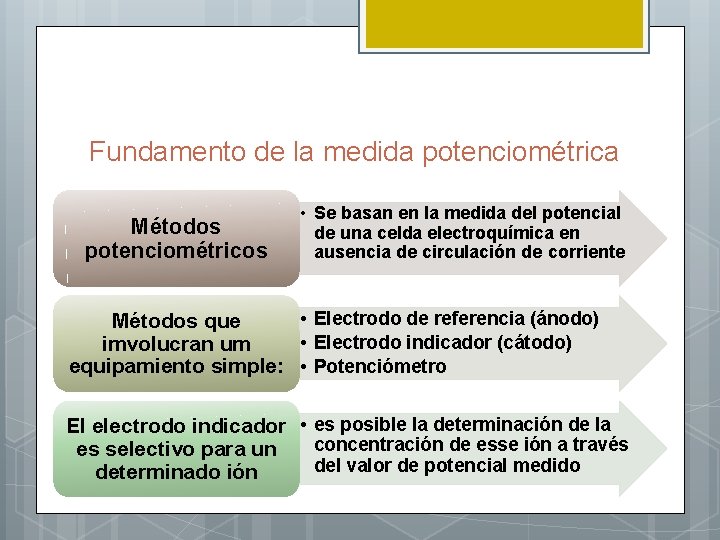
Fundamento de la medida potenciométrica Métodos potenciométricos • Se basan en la medida del potencial de una celda electroquímica en ausencia de circulación de corriente • Electrodo de referencia (ánodo) Métodos que • Electrodo indicador (cátodo) imvolucran um equipamiento simple: • Potenciómetro El electrodo indicador • es posible la determinación de la concentración de esse ión a través es selectivo para un del valor de potencial medido determinado ión

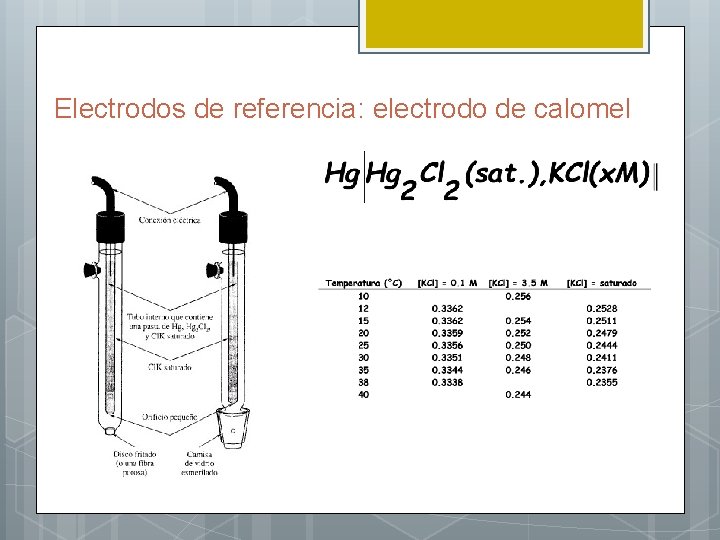
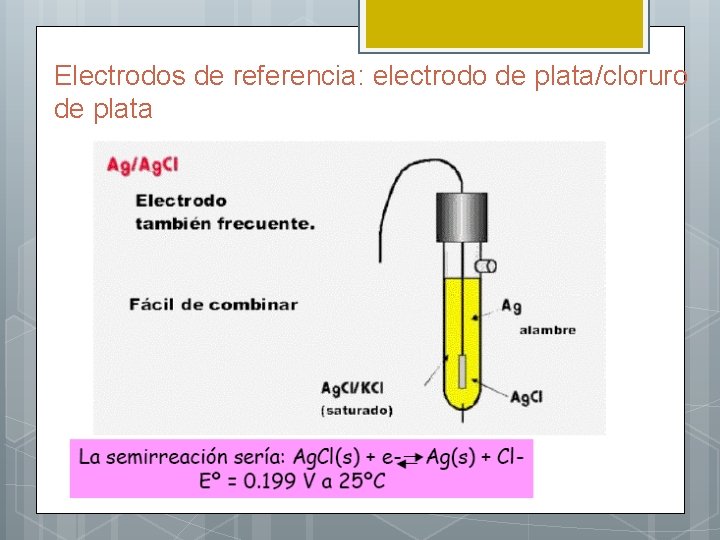
Electrodos para potenciometría: electrodos de referencia l Deben tener un potencial conocido y constante l Requisitos: (1) reversibilidad (2) reproducibilidad (3) estabilidad l Los más usuales: calomel y plata/cloruro de plata

Electrodos de referencia: electrodo de calomel Calomel = cloruro mercurioso (Kps = 3. 5 x 10 -18) E°Hg 2+2/Hg°=+0. 80 V Lo más común es utilizar una soluión saturada de KCl debido a la facilidad de preparación. Desventajas: – Coeficiente de temperatura elevado – Tiempo de estabilización prolongado luego de un cambio de temperatura, por el tiempo que lleva reestablecer el equilibrio

Electrodos de referencia: electrodo de calomel

Electrodos de referencia: electrodo de plata/cloruro de plata

Ejemplo 2. Calcular el potencial de reducción del Ag. Cl, a partir de su Kps

Electrodos indicadores Responder de manera rápida y reproducible a los cambios de actividad del analito Pueden ser metálicos, de membrana y sensores de estado sólido Transistores de efecto de campo selectivos (ion-selective field-effect transistors - ISFETs) “Electrodos” para gases Biosensores

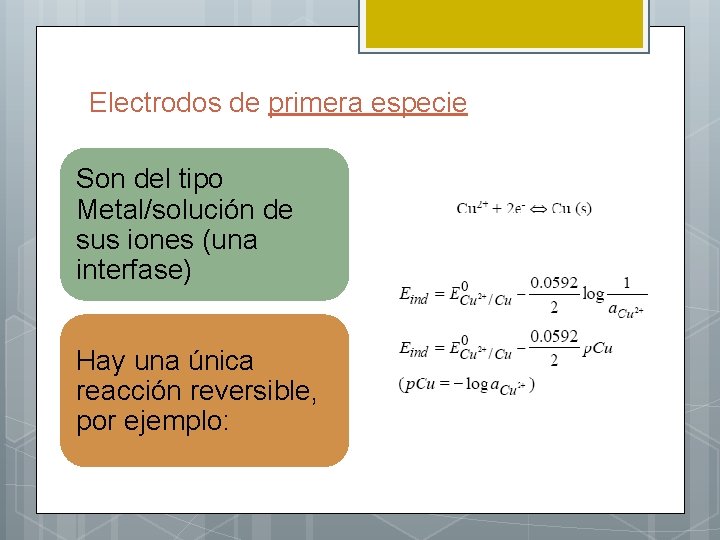
Electrodos de primera especie Son del tipo Metal/solución de sus iones (una interfase) Hay una única reacción reversible, por ejemplo:

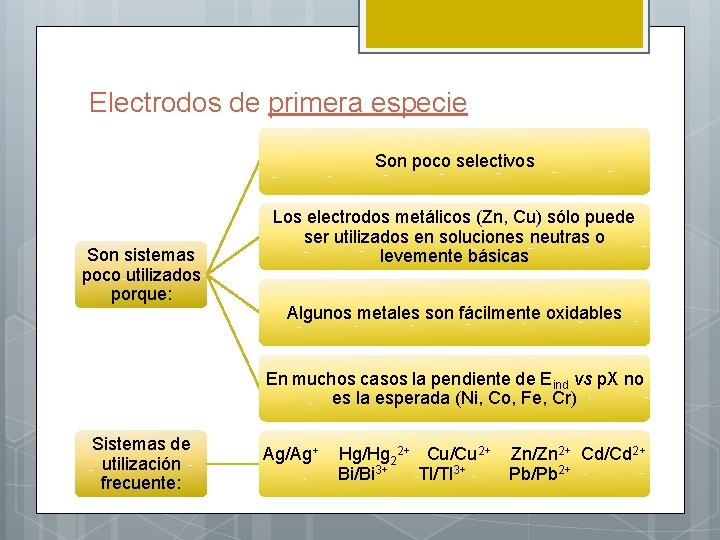
Electrodos de primera especie Son poco selectivos Son sistemas poco utilizados porque: Los electrodos metálicos (Zn, Cu) sólo puede ser utilizados en soluciones neutras o levemente básicas Algunos metales son fácilmente oxidables En muchos casos la pendiente de Eind vs p. X no es la esperada (Ni, Co, Fe, Cr) Sistemas de utilización frecuente: Ag/Ag+ Hg/Hg 22+ Cu/Cu 2+ Zn/Zn 2+ Cd/Cd 2+ Bi/Bi 3+ Tl/Tl 3+ Pb/Pb 2+

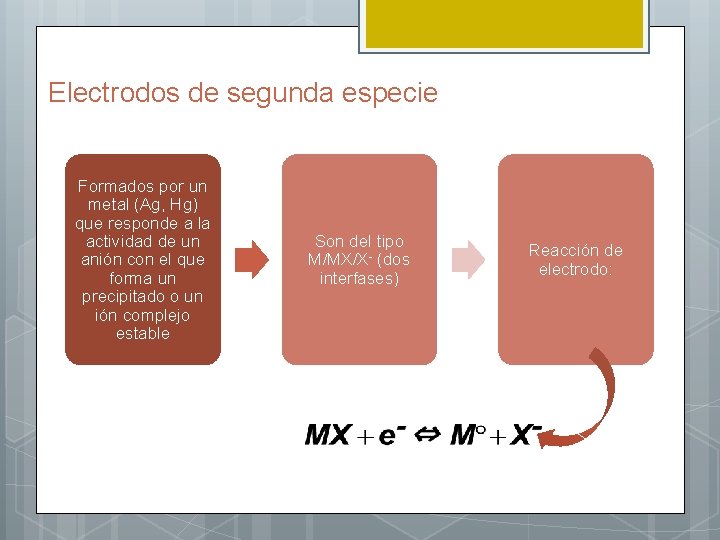
Electrodos de segunda especie Formados por un metal (Ag, Hg) que responde a la actividad de un anión con el que forma un precipitado o un ión complejo estable Son del tipo M/MX/X- (dos interfases) Reacción de electrodo:

Electrodos de segunda especie Ejemplo:

Electrodos de tercera especie o redox Electrodos metálicos inertes (Au, Pt, Pd) sirven como electrodos indicadores em sistemas de oxidación-reducción Ejemplo: Problemas: A veces el proceso de transferencia electrónica no es reversible y los electrodos no responden de manera previsible

Electrodos de membrana • Tienen una delgada membrana que separa la muestra problema y el interior del electrodo • Responden selectivamente a una especie presente en la solución • La parte interna tiene una solución del ión de interés a actividad constante • La parte externa está en contacto con la solución desconocida • La diferencia de potencial depende de la diferencia entre las actividades del ión a cada lado de la membrana

Electrodos de membrana

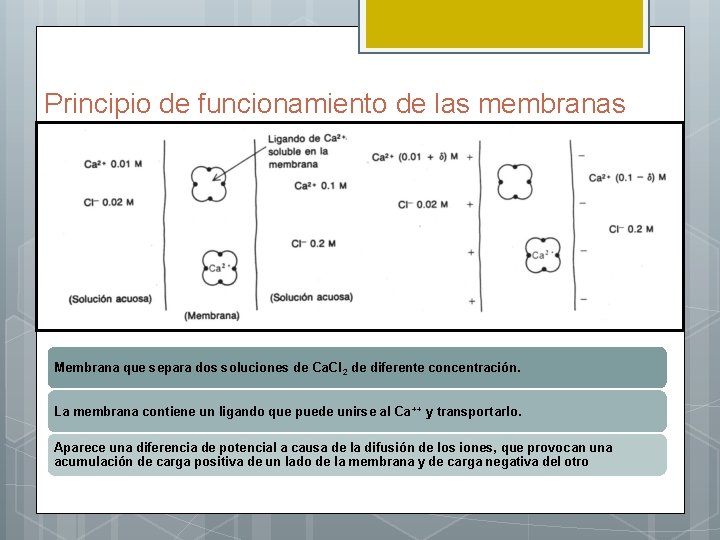
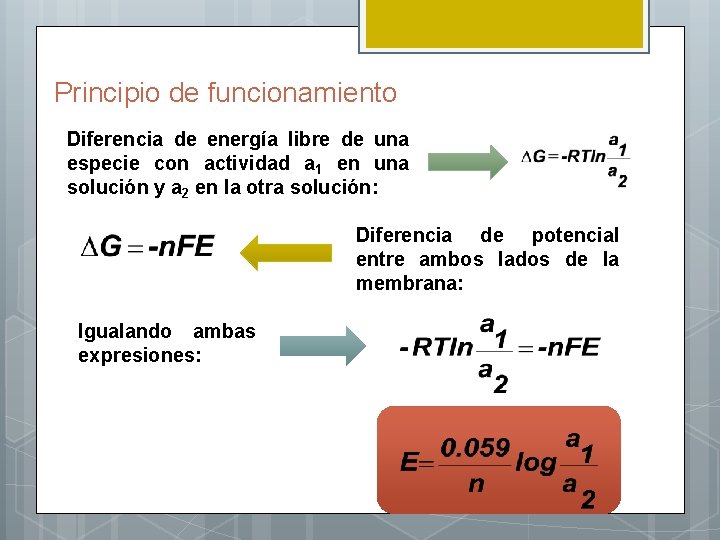
Principio de funcionamiento de las membranas Membrana que separa dos soluciones de Ca. Cl 2 de diferente concentración. La membrana contiene un ligando que puede unirse al Ca ++ y transportarlo. Aparece una diferencia de potencial a causa de la difusión de los iones, que provocan una acumulación de carga positiva de un lado de la membrana y de carga negativa del otro

Principio de funcionamiento Diferencia de energía libre de una especie con actividad a 1 en una solución y a 2 en la otra solución: Diferencia de potencial entre ambos lados de la membrana: Igualando ambas expresiones:

Selectividad “Ningún electrodo de membrana responde a un solo tipo de ión” Si un electrodo que responde a un ión X, puede responder a un ión Y, se define el coeficiente de selectividad (KXY) como: l Se espera que KXY << 1 l La respuesta de un electrodo de membrana para un ión X en presencia de una interferencia Y, sigue la ecuación de NICOLSKY:

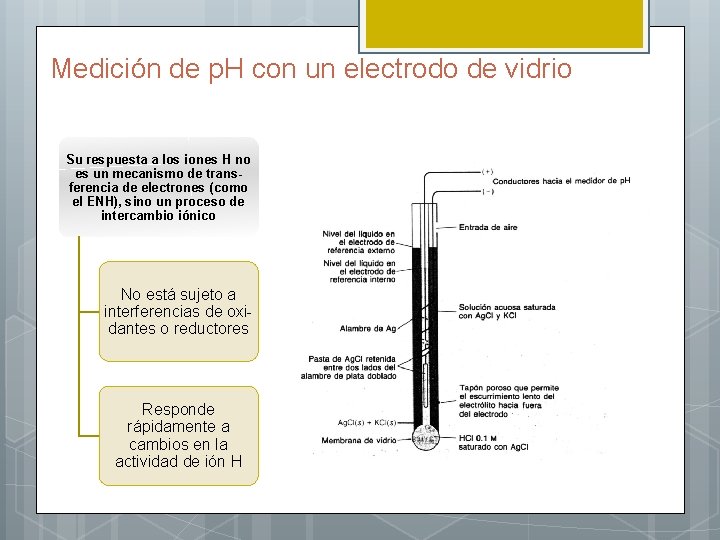
Medición de p. H con un electrodo de vidrio Su respuesta a los iones H no es un mecanismo de transferencia de electrones (como el ENH), sino un proceso de intercambio iónico No está sujeto a interferencias de oxidantes o reductores Responde rápidamente a cambios en la actividad de ión H

Medición de p. H con un electrodo de vidrio Donde: EAg. Cl/Ag y EECS son los potenciales de los dos electrodos de referencia, Ej es el potencial de junta líquida y Ea es el potencial de asimetría La actividad del H+ en la solución interna (a 2) es fija y constante.

Medición de p. H con un electrodo de vidrio K debe ser determinada por calibración con una solución de p. H perfectamente conocido (standard) Para la muestra problema (x) De donde:

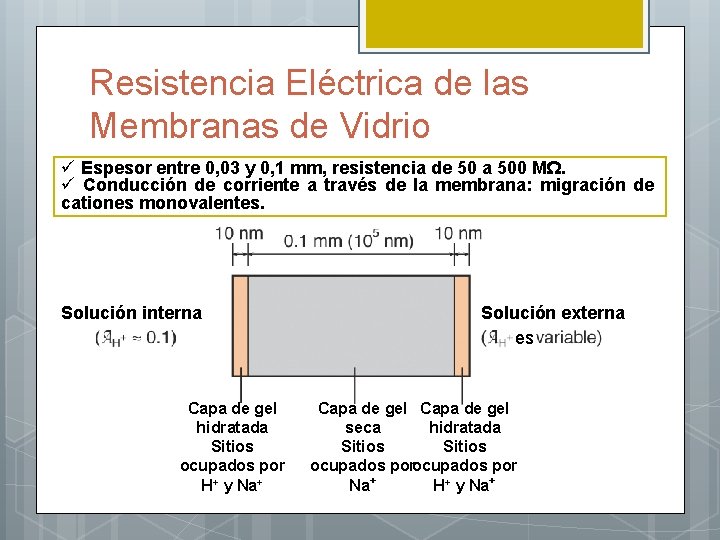
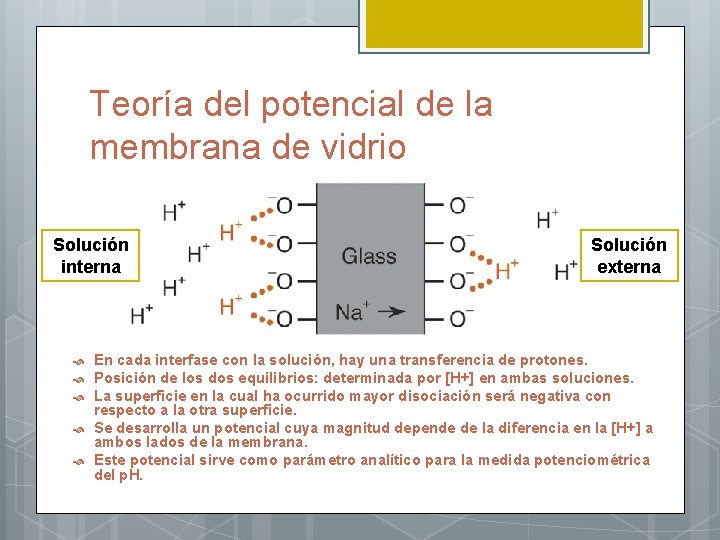
Teoría del potencial de la membrana de vidrio Cada Si está enlazado a tres O en el plano y a otro por encima o por debajo del plano, constituyendo una red tridimensional de grupos Si. O 4 -4. En los intersticios de esta estructura hay cationes de compensación. Cationes monovalentes (Na+, Li+) se pueden mover en la red y son los responsables de la conducción eléctrica en el interior de la membrana. La superficie de una membrana de vidrio debe estar hidratada antes de funcionar como electrodo de p. H. La hidratación de una membrana de vidrio sensible al p. H consiste en una reacción de intercambio iónico entre los cationes monovalentes de la red:

Resistencia Eléctrica de las Membranas de Vidrio ü Espesor entre 0, 03 y 0, 1 mm, resistencia de 50 a 500 MΩ. ü Conducción de corriente a través de la membrana: migración de cationes monovalentes. Solución interna Capa de gel hidratada Sitios ocupados por H+ y Na+ Solución externa es Capa de gel seca hidratada Sitios ocupados por Na+ H+ y Na+

Teoría del potencial de la membrana de vidrio Solución interna Solución externa En cada interfase con la solución, hay una transferencia de protones. Posición de los dos equilibrios: determinada por [H+] en ambas soluciones. La superficie en la cual ha ocurrido mayor disociación será negativa con respecto a la otra superficie. Se desarrolla un potencial cuya magnitud depende de la diferencia en la [H+] a ambos lados de la membrana. Este potencial sirve como parámetro analítico para la medida potenciométrica del p. H.

Errores en la medición de p. H • El conocimiento del p. H de una solución no puede ser mejor que el de buffer utilizados en la calibración del electrodo (± 0. 01 unidad de p. H) • Incertidumbre en el potencial de junta líquida • Error alcalino • Error ácido • Tiempo de equilibración • Deshidratación de la membrana
![Error alcalino p Hmedido p Hreal Cuando la H es muy baja p Error alcalino (p. Hmedido < p. Hreal) Cuando la [H+] es muy baja (p.](https://slidetodoc.com/presentation_image_h/7df25602a9648cc417aaf33ea8664900/image-42.jpg)
Error alcalino (p. Hmedido < p. Hreal) Cuando la [H+] es muy baja (p. H ≥ 9), algunas membranas de vidrio responden también a la concentración de iones de metales alcalinos. El error alcalino puede explicarse satisfactoriamente suponiendo un equilibrio de intercambio entre los iones de hidrógeno de la superficie del vidrio y los cationes de la solución.
 Atmica
Atmica Comisin
Comisin Las comisiones regionales de moralización
Las comisiones regionales de moralización Analtica
Analtica Analtica
Analtica Analtica
Analtica Geometria
Geometria Analtica
Analtica Analtica
Analtica Analtica
Analtica Qumica
Qumica H6se nomenclatura
H6se nomenclatura Qumica
Qumica Cintica
Cintica Qumica
Qumica Qumica
Qumica Orbitais
Orbitais Qumica
Qumica Qumica
Qumica Ionização
Ionização Qumica
Qumica Qumica
Qumica Setas curvas
Setas curvas Truta
Truta Cinetica molecular
Cinetica molecular Reaccion de condensacion
Reaccion de condensacion Qumica
Qumica Qumica
Qumica Enlace dativo
Enlace dativo Polissacarídeos
Polissacarídeos Qumica
Qumica Caracteristicas dos seres vivos composição quimica
Caracteristicas dos seres vivos composição quimica Clivagem oxidativa de alcenos
Clivagem oxidativa de alcenos Os atomos sao formados por protons neutrons e eletrons
Os atomos sao formados por protons neutrons e eletrons Qumica
Qumica Hidrocarbonetos
Hidrocarbonetos Propiedades intensivas
Propiedades intensivas Qumica
Qumica Enantiomeros
Enantiomeros Qumica
Qumica Qumica
Qumica Cintica
Cintica Variação de entalpia
Variação de entalpia