Potaov chemie 5 pednka vod 1 pednka Molekula
















- Slides: 23

Počítačová chemie (5. přednáška) • Úvod (1. přednáška) • Molekula – Struktura molekuly (2. , 3. a 4. přednáška) – Geometrie molekuly (5. přednáška) – Vhled do praxe (6. přednáška) • Molekulové modelování – Molekulová mechanika (7. a 8. přednáška) – Kvantová mechanika (9. a 10. přednáška) – Molekulová dynamika (11. přednáška) – Vhled do praxe (12. přednáška)

Geometrie molekuly • Základní chemické pojmy • Souřadnice atomů: – Kartézské – Interní • Porovnávání geometrií

Základní chemické pojmy Rozměry objektů v chemii: • Elektron: – hmotnost: 9, 12. 10 -31 kg – poloměr: 10 -15 m • Proton: – hmotnost: 1, 67. 10 -27 kg – poloměr: 10 -13 m

Základní chemické pojmy • Atomy a molekuly: – Rozměr se udává v nm (nm = 10 -9 m) nebo angströmech (Å = 10 -10 m). – Hmotnost se uvádí ve formě relativní atomové hmotnosti (AR). AR je rovna podílu hmotnosti atomu a hmotnosti atomové hmotnostní jednotky u: u = 1, 66057. 10 -27 kg (1/12 hmotnosti 1 atomu nuklidu uhlíku C 612)

Základní chemické pojmy • Atomy - příklad: Uhlík: Poloměr: 0, 77 Å; relativní atomová hmotnost: 12, 011 • Molekula: – Rozměry: jednotky - stovky Å (u makromolekul i podstatně více) – Hmotnost: Součet hmotností atomů : -)

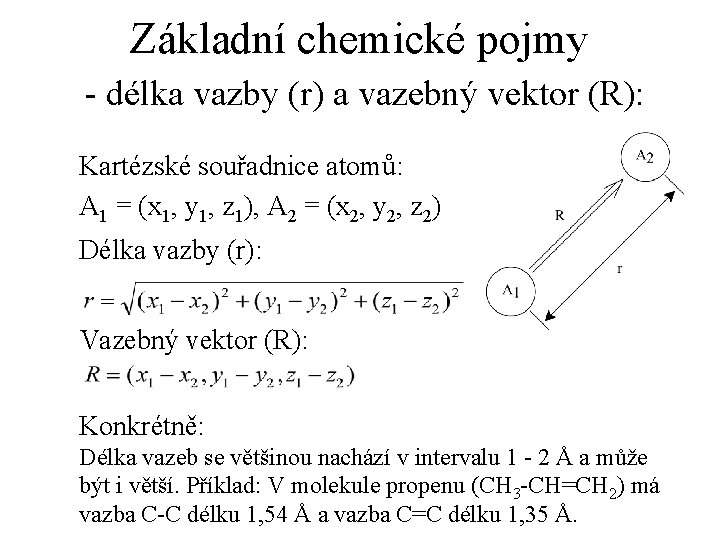
Základní chemické pojmy - délka vazby (r) a vazebný vektor (R): Kartézské souřadnice atomů: A 1 = (x 1, y 1, z 1), A 2 = (x 2, y 2, z 2) Délka vazby (r): Vazebný vektor (R): Konkrétně: Délka vazeb se většinou nachází v intervalu 1 - 2 Å a může být i větší. Příklad: V molekule propenu (CH 3 -CH=CH 2) má vazba C-C délku 1, 54 Å a vazba C=C délku 1, 35 Å.

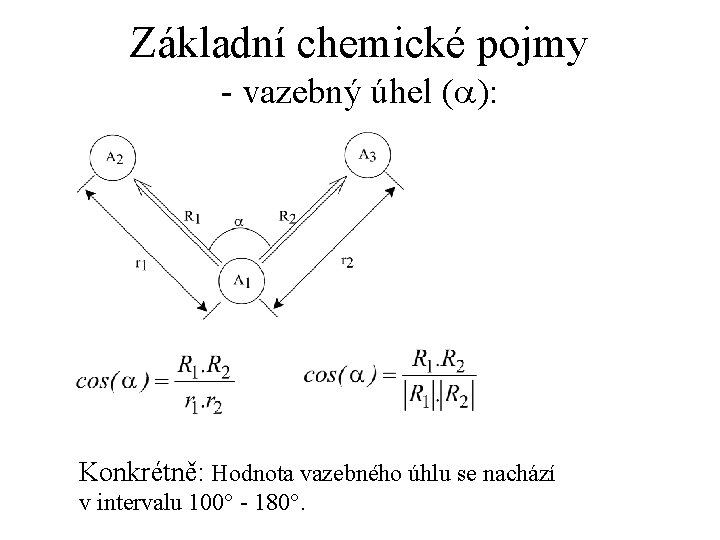
Základní chemické pojmy - vazebný úhel (a): Konkrétně: Hodnota vazebného úhlu se nachází v intervalu 100° - 180°.

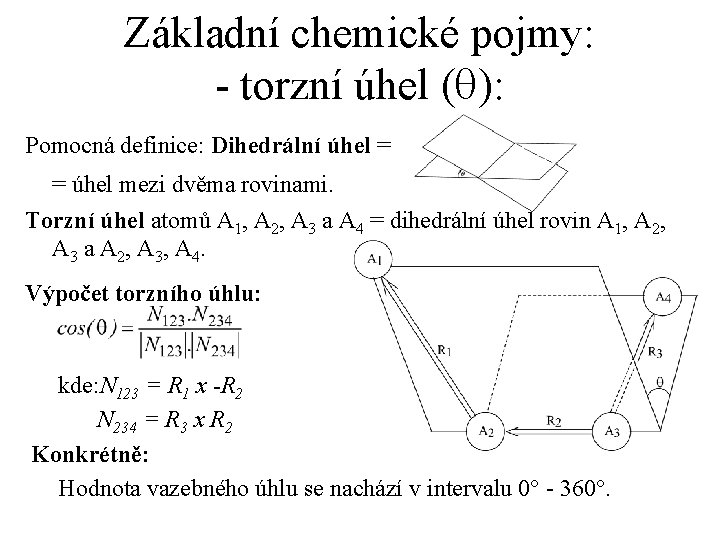
Základní chemické pojmy: - torzní úhel (q): Pomocná definice: Dihedrální úhel = = úhel mezi dvěma rovinami. Torzní úhel atomů A 1, A 2, A 3 a A 4 = dihedrální úhel rovin A 1, A 2, A 3 a A 2, A 3, A 4. Výpočet torzního úhlu: kde: N 123 = R 1 x -R 2 N 234 = R 3 x R 2 Konkrétně: Hodnota vazebného úhlu se nachází v intervalu 0° - 360°.

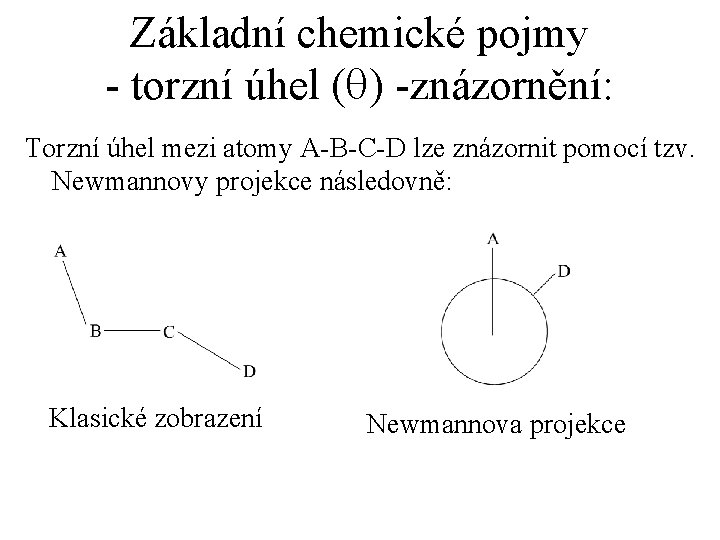
Základní chemické pojmy - torzní úhel (q) -znázornění: Torzní úhel mezi atomy A-B-C-D lze znázornit pomocí tzv. Newmannovy projekce následovně: Klasické zobrazení Newmannova projekce

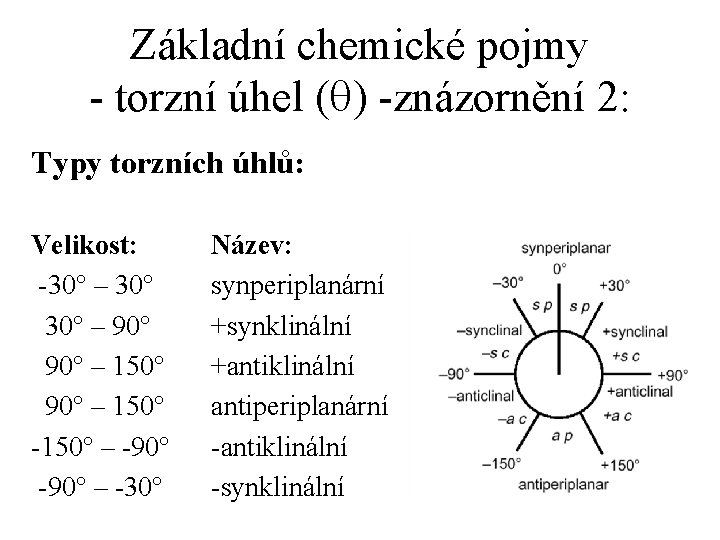
Základní chemické pojmy - torzní úhel (q) -znázornění 2: Typy torzních úhlů: Velikost: -30° – 90° – 150° -150° – -90° – -30° Název: synperiplanární +synklinální +antiklinální antiperiplanární -antiklinální -synklinální

Kartézské souřadnice atomů • Poloha každého atomu popsána x-ovu, y-ovou a z-ovu souřadnicí v kartézské soustavě souřadnic. • Pro molekulu s N atomy je nutno znát 3 N - 6 souřadnic. Poloha a orientace molekuly vzhledem ke vztažné soustavě totiž může být libovolná.

Kartézské souřadnice atomů příklad: Molekula methanu: Souřadnice: C H H H 0. 000* 1. 100 0. 000* -0. 367 -1. 037 -0. 367 0. 519 H -0. 367 0. 519 0. 000* 0. 898 -0. 898 * Tyto souřadnice mohou být zvoleny libovolně, ale stále se bude jednat o tutéž molekulu (pouze bude posunuta v prostoru).

Interní souřadnice atomů • Je vyjádřena Z-maticí. • Poloha atomu D je popsána: – vzdáleností mezi atomy C a D – vazebným úhlem mezi atomy B, C a D – dihedrálním úhlem mezi atomy A, B, C a D • Vyjímka: – Pro 1. atom v z-matici nejsou uvedeny žádné informace. – Pro 2. atom v z-matici jsou uvedeny jen informace o vazbě. – Pro 3. atom v z-matici jsou uvedeny jen informace o vazbě a vazebném úhlu.

Interní souřadnice atomů molekuly Ethan: strukturní vzorec Z matice: geometrický vzorec Newmannova projekce

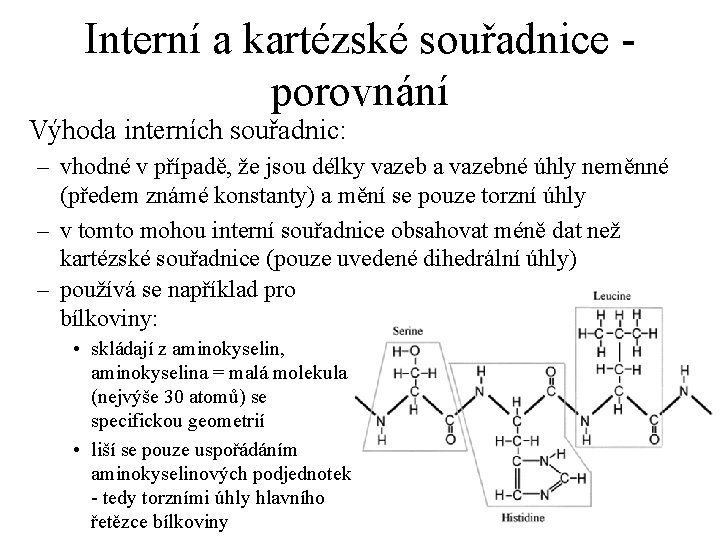
Interní a kartézské souřadnice porovnání Výhoda interních souřadnic: – vhodné v případě, že jsou délky vazeb a vazebné úhly neměnné (předem známé konstanty) a mění se pouze torzní úhly – v tomto mohou interní souřadnice obsahovat méně dat než kartézské souřadnice (pouze uvedené dihedrální úhly) – používá se například pro bílkoviny: • skládají z aminokyselin, aminokyselina = malá molekula (nejvýše 30 atomů) se specifickou geometrií • liší se pouze uspořádáním aminokyselinových podjednotek - tedy torzními úhly hlavního řetězce bílkoviny

Interní a kartézské souřadnice porovnání II Nevýhoda interních souřadnic: – Některé základní výpočty jsou mnohem obtížnejší • Vzdálenost mezi dvěma body • Určení nejbližších atomů (bodů) vzhledem k určitému atomu – Porovnávání nezávislých objektů – Mnohem více nelineárních vztahů mezi souřadnicemi => obtížná případně nemožná optimalizace výpočtů

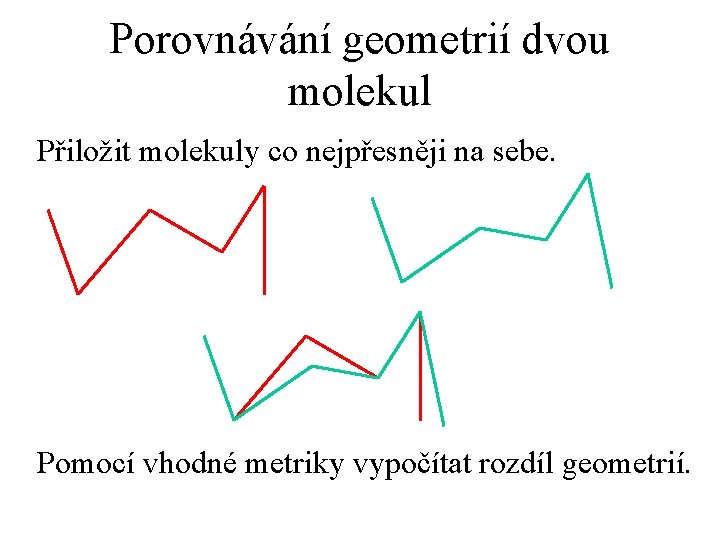
Porovnávání geometrií dvou molekul Přiložit molekuly co nejpřesněji na sebe. Pomocí vhodné metriky vypočítat rozdíl geometrií.

Porovnání geometrií dvou molekul II • Podmínka: Atomy daných molekul jsou indexovány (seřazeny) tak, že odpovídající atomy* mají stejné indexy. * Atom x z molekuly X odpovídá atomu y z molekuly Y, pokud lze atom x zobrazit na atom y pomocí zobrazení izomorfismu. Je zřejmé, že pro všechny atomy musí být použit stejný izomorfismus.

Porovnání geometrií dvou molekul III Porovnávací kritérium: RMSD (root mean square deviation). Jednotky: Å Kde: d(xi, yi) N w vzdálenost odpovídajících atomů xi a yi počet atomů ohodnocení jednotlivých atomů Nejčastěji používaná ohodnocení: 1 - stejné pro všechny atomy AR - atomová relativní hmotnost atomu

Porovnání geometrií dvou molekul IV Problém porovnávání geometrií: Máme 2 uspořádané množiny bodů v R 3: X: (x 1, …, x. N) a Y: (y 1, …, y. N), kde xi odpovídá yi. Hledáme transformaci T = r + t v R 3, kde r je rotace a t je translace tak, že: RMSD(X, T(Y)) ® min

Porovnání geometrií dvou molekul V Vyhledání translace Výpočet těžišť obou molekul podle vztahu: Analogicky TY. Translace molekuly Y: Posunutí TY do TX.

Porovnání geometrií dvou molekul VI Vyhledání rotace Vytvořeno mnoho metod, nejpoužívanější: • Mc. Lachlan (1972): Iterativní metoda, která rotuje molekulu Y o malý úhel (b) v každém kroku a hledá minimální RMSD. Složitost: O(p 3), kde p je počet pootočení (p = 360°/b) • Kabsch a Diamond (1976): Převádí problém nalezení rotace na problém nalezení vlastních vektorů matice 3 x 3 (matice tenzorů definované metriky). Složitost: lineární.

Literatura 1) Leach A. R. : Molecular modelling. Longman (1996) 2) Jensen F. : Computational chemistry. Wiley (1999) 3) Wampler J. E. : Different Concepts of Molecular Structure. The University of Georgia (1999): http: //bmbiris. bmb. uga. edu/wampler/ 8200/structure
 Diagnostika potaov hp
Diagnostika potaov hp Diagnostika potaov toshiba
Diagnostika potaov toshiba Vod marketing
Vod marketing Zakupljeni vod
Zakupljeni vod Vod
Vod Tulipan vod
Tulipan vod Iptv replay
Iptv replay Rw + vo c inverter transient response vod inverte...
Rw + vo c inverter transient response vod inverte... Ztv vod
Ztv vod Iptv vod italia
Iptv vod italia Nadzemni vodovi
Nadzemni vodovi Ztv vod
Ztv vod Znakovlje
Znakovlje Vod marketing
Vod marketing Ammnia
Ammnia Raspodela molekula po brzinama
Raspodela molekula po brzinama Polimeri prezentacija
Polimeri prezentacija Molekula
Molekula Struktura molekula vode
Struktura molekula vode Molekula
Molekula Mhc molekula
Mhc molekula Molekula vodíku
Molekula vodíku Dipolni molekuli
Dipolni molekuli Ukupna energija
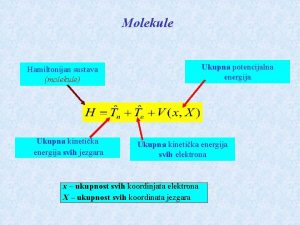
Ukupna energija