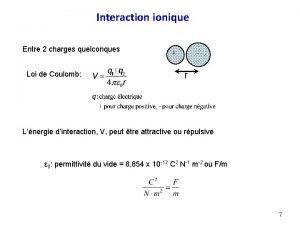
Polymrisation ionique IUPAC Polymrisation anionique Croissance des chanes











![Distribution des masses molaires IUPAC Amorçage instantané : Distribution de Poisson 15 [AMn] (%) Distribution des masses molaires IUPAC Amorçage instantané : Distribution de Poisson 15 [AMn] (%)](https://slidetodoc.com/presentation_image/018819ca75df25fe6bbfd10f0c186e73/image-24.jpg)
















![Équilibre polymérisation - dépolymérisation IUPAC Cinétique À l'équilibre : Ln [ M ]0 - Équilibre polymérisation - dépolymérisation IUPAC Cinétique À l'équilibre : Ln [ M ]0 -](https://slidetodoc.com/presentation_image/018819ca75df25fe6bbfd10f0c186e73/image-53.jpg)




- Slides: 60

Polymérisation ionique IUPAC Polymérisation anionique Croissance des chaînes Mécanismes de polymérisation Cinétique de polymérisation Polymérisation vivante Distribution des masses molaires Fonctionnalisation des macromolécules copolymères à blocs Polymérisation cationique Mécanismes de polymérisation Réactions de transfert Équilibre polymérisation - dépolymérisation Polymérisation cationique vivante Chimie Macromoléculaire/ Polymérisation ionique 1

Polymérisation anionique IUPAC Principe général de la croissance des chaînes Polymérisabilité Polymérisation du styrène Polymérisation de l'oxyde d'éthylène Distribution des masses molaires Désactivation fonctionnelle Copolymères à blocs Chimie Macromoléculaire/ Polymérisation ionique 2

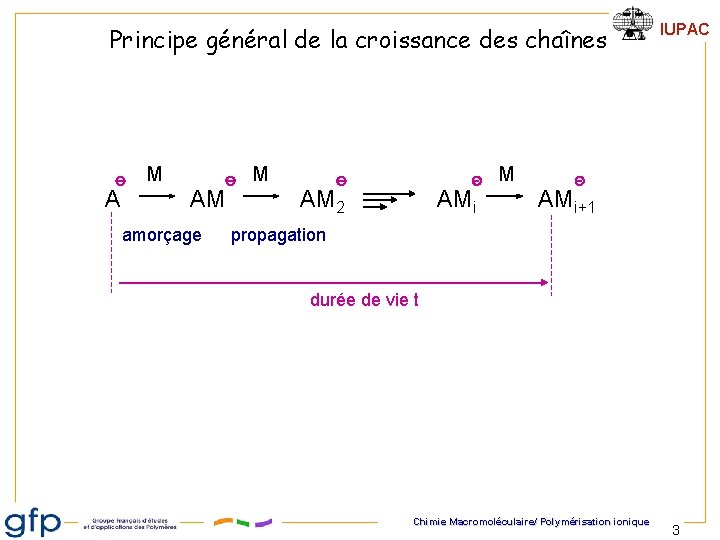
Principe général de la croissance des chaînes A M AM amorçage M IUPAC M AM 2 AMi+1 propagation durée de vie t Chimie Macromoléculaire/ Polymérisation ionique 3

Polymérisabilité des monomères IUPAC Monomères vinyliques : styrène, méthacrylate de méthyle … Substituant mésomère ou inducteur attracteur : diminue la densité électronique de la liaison p R R Hétérocycles oxygénés : oxyde d'éthylène, oxyde de propylène, ε-caprolactone Chimie Macromoléculaire/ Polymérisation ionique 4

Conditions de polymérisation IUPAC Les polymérisations sont réalisées en solution • Solvants dipolaires, aprotiques (THF, cyclohexane, DMSO. . ) Pas de groupes réactifs avec les anions • Le milieu réactionnel doit être anhydre • Polymérisation sous atmosphère inerte (azote, argon) Chimie Macromoléculaire/ Polymérisation ionique 5

Polymérisation anionique du styrène IUPAC Amorçage par le butyl lithium Chimie Macromoléculaire/ Polymérisation ionique 6

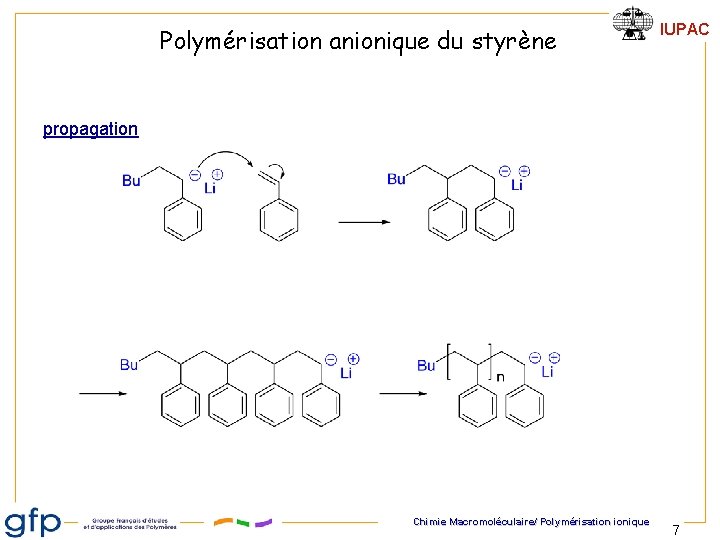
Polymérisation anionique du styrène IUPAC propagation Chimie Macromoléculaire/ Polymérisation ionique 7

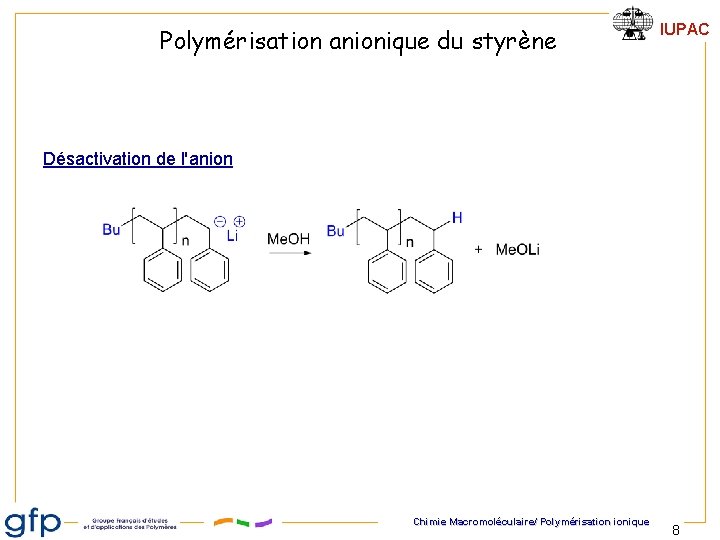
Polymérisation anionique du styrène IUPAC Désactivation de l'anion Chimie Macromoléculaire/ Polymérisation ionique 8

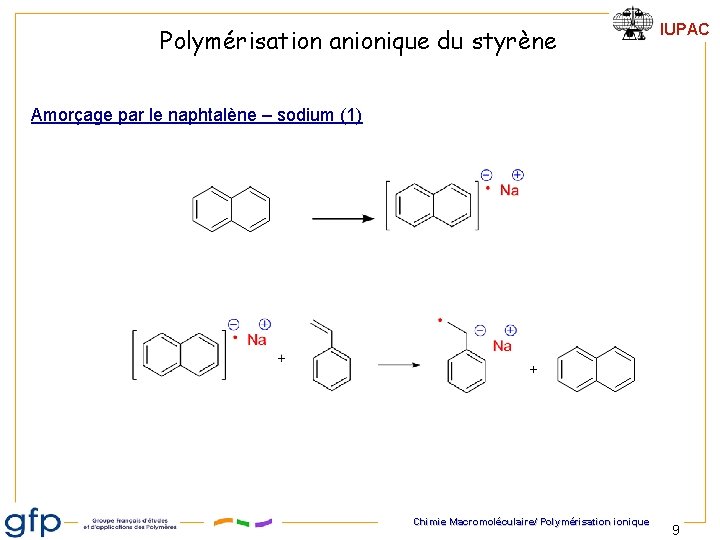
Polymérisation anionique du styrène IUPAC Amorçage par le naphtalène – sodium (1) + Chimie Macromoléculaire/ Polymérisation ionique 9

Polymérisation anionique du styrène IUPAC Amorçage par le naphtalène – sodium (2) Propagation aux deux extrémités de la chaîne en croissance : 2 Chimie Macromoléculaire/ Polymérisation ionique 10

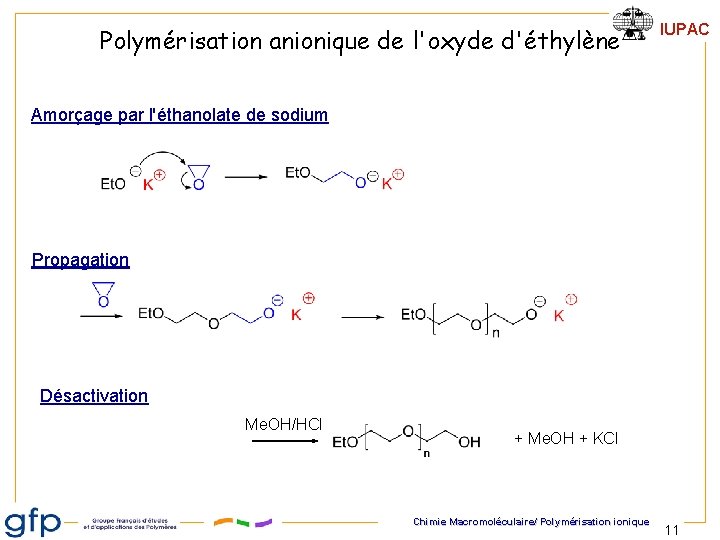
Polymérisation anionique de l'oxyde d'éthylène IUPAC Amorçage par l'éthanolate de sodium Propagation Désactivation Me. OH/HCl + Me. OH + KCl Chimie Macromoléculaire/ Polymérisation ionique 11

Polymérisation anionique de l'e-caprolactone IUPAC e-caprolactone Poly(ε-caprolactone) (PCL) Chimie Macromoléculaire/ Polymérisation ionique 12

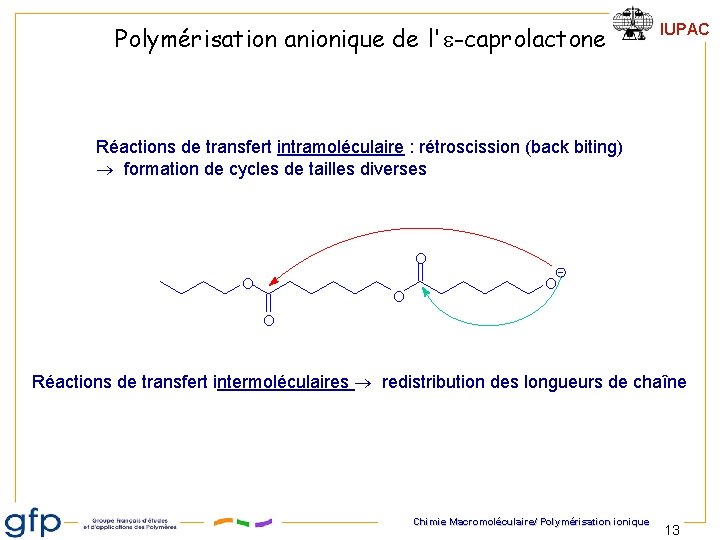
Polymérisation anionique de l'e-caprolactone IUPAC Réactions de transfert intramoléculaire : rétroscission (back biting) formation de cycles de tailles diverses O O O Réactions de transfert intermoléculaires redistribution des longueurs de chaîne Chimie Macromoléculaire/ Polymérisation ionique 13

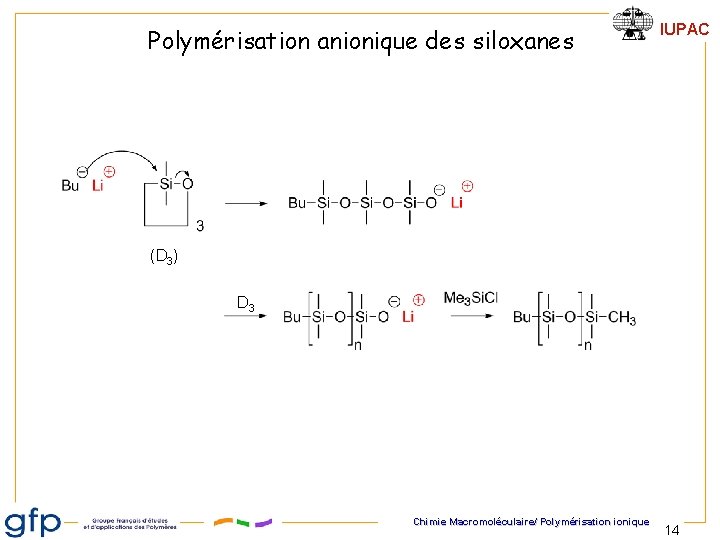
Polymérisation anionique des siloxanes IUPAC (D 3) D 3 Chimie Macromoléculaire/ Polymérisation ionique 14

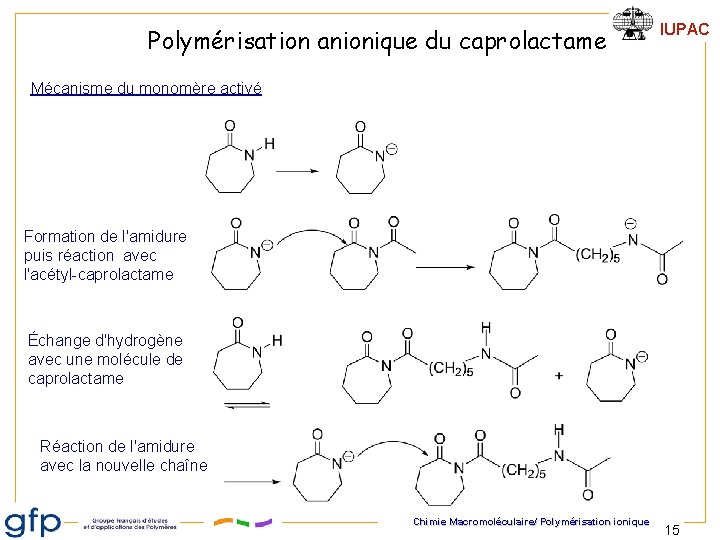
Polymérisation anionique du caprolactame IUPAC Mécanisme du monomère activé Formation de l'amidure puis réaction avec l'acétyl-caprolactame Échange d'hydrogène avec une molécule de caprolactame Réaction de l'amidure avec la nouvelle chaîne Chimie Macromoléculaire/ Polymérisation ionique 15

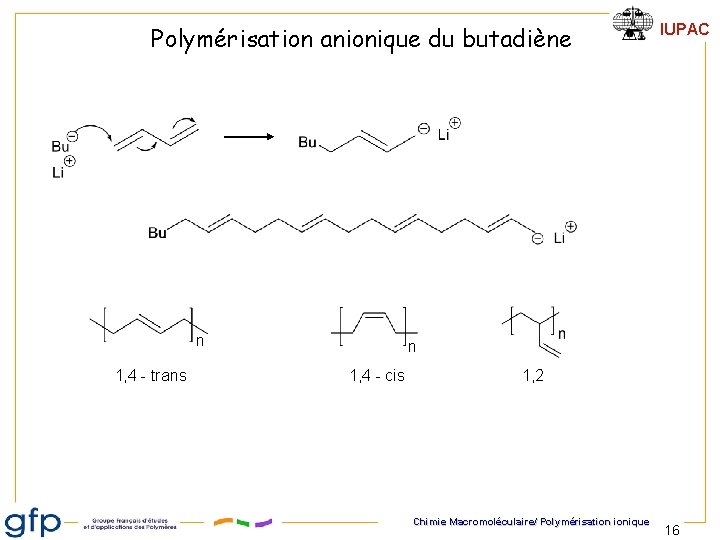
Polymérisation anionique du butadiène n 1, 4 - trans IUPAC n 1, 4 - cis 1, 2 Chimie Macromoléculaire/ Polymérisation ionique 16

Cinétique de polymérisation anionique IUPAC La valeur de kp devient rapidement indépendante de la valeur de j Chimie Macromoléculaire/ Polymérisation ionique 17

Cinétique de polymérisation anionique Amorçage Propagation A + M AM j + M Amorçage "instantané" : ka >> kp ka kp IUPAC AM 1 AMj+1 - d[M] = kp[M]å [Mi-] dt i [M(t)] = [M(0)]. exp(-Kt) avec K = kp[M-] = kp[A] Chimie Macromoléculaire/ Polymérisation ionique 18

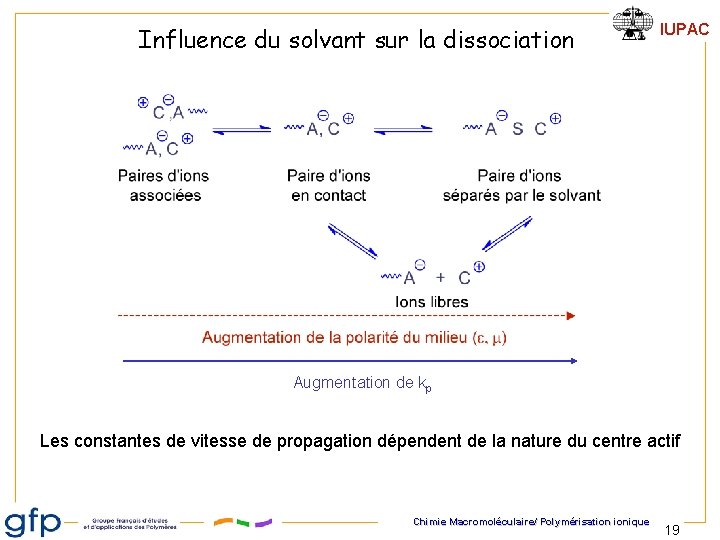
Influence du solvant sur la dissociation IUPAC Augmentation de kp Les constantes de vitesse de propagation dépendent de la nature du centre actif Chimie Macromoléculaire/ Polymérisation ionique 19

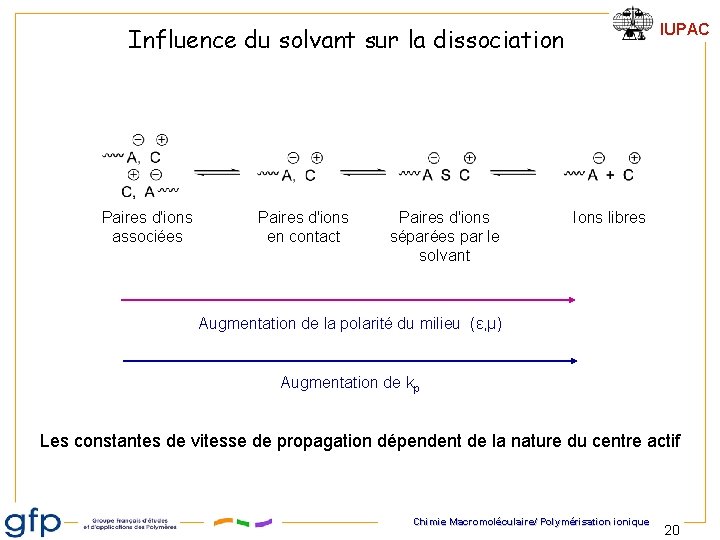
IUPAC Influence du solvant sur la dissociation Paires d'ions associées Paires d'ions en contact Paires d'ions séparées par le solvant Ions libres Augmentation de la polarité du milieu (ε, μ) Augmentation de kp Les constantes de vitesse de propagation dépendent de la nature du centre actif Chimie Macromoléculaire/ Polymérisation ionique 20

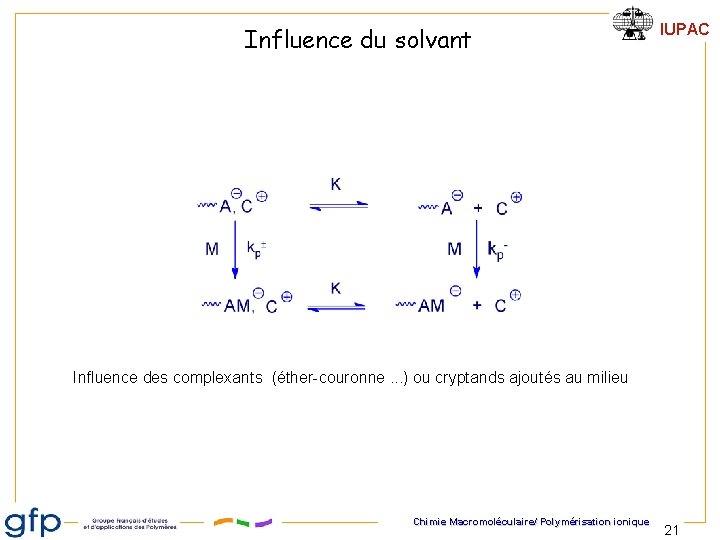
Influence du solvant IUPAC Influence des complexants (éther-couronne. . . ) ou cryptands ajoutés au milieu Chimie Macromoléculaire/ Polymérisation ionique 21

Distribution des masses molaires IUPAC Hypothèse : amorçage instantané ka > kp Le nombre de chaînes en croissance est égal au nombre de molécules d'amorceur Chimie Macromoléculaire/ Polymérisation ionique 22

Distribution des masses molaires IUPAC Degré de polymérisation moyen en nombre Hyp : Amorçage instantané Xn Conversion Chimie Macromoléculaire/ Polymérisation ionique 23
![Distribution des masses molaires IUPAC Amorçage instantané Distribution de Poisson 15 AMn Distribution des masses molaires IUPAC Amorçage instantané : Distribution de Poisson 15 [AMn] (%)](https://slidetodoc.com/presentation_image/018819ca75df25fe6bbfd10f0c186e73/image-24.jpg)
Distribution des masses molaires IUPAC Amorçage instantané : Distribution de Poisson 15 [AMn] (%) 12 9 6 3 longueur n 0 0 5 10 15 20 25 Chimie Macromoléculaire/ Polymérisation ionique 24

Désactivation fonctionnelle IUPAC Stratégie : profiter de la pérennité du centre actif terminal porté par chacune des chaînes fonctionnalisation terminale copolymères à blocs copolymères en étoile Chimie Macromoléculaire/ Polymérisation ionique 25

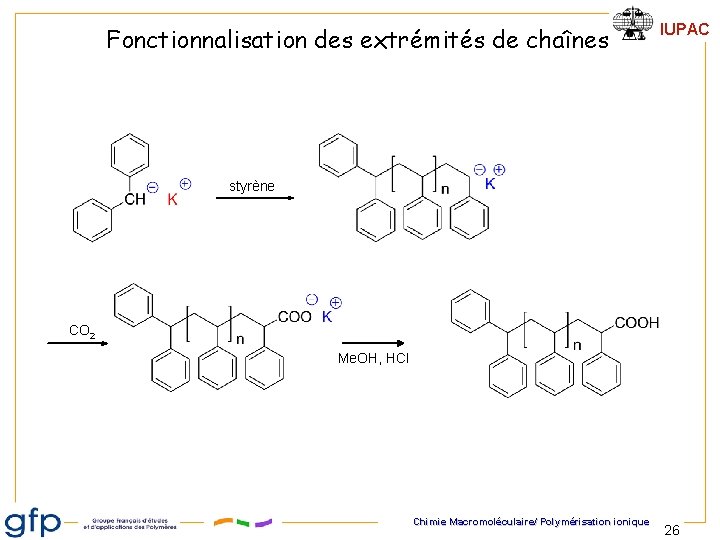
Fonctionnalisation des extrémités de chaînes IUPAC styrène CO 2 Me. OH, HCl Chimie Macromoléculaire/ Polymérisation ionique 26

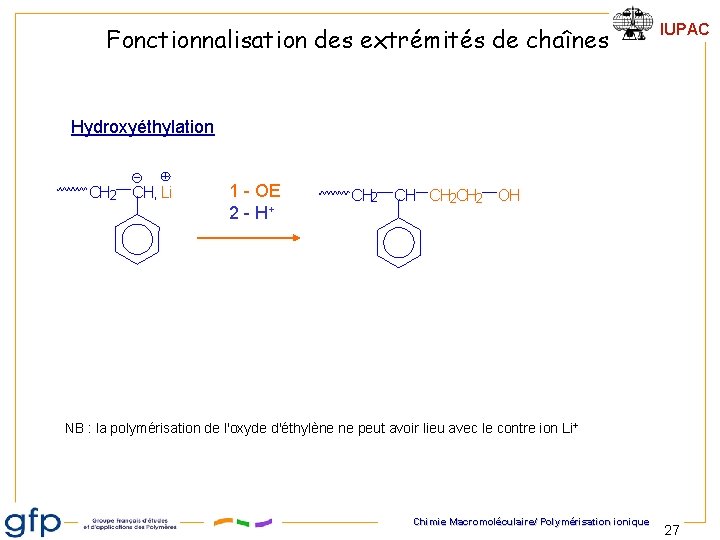
Fonctionnalisation des extrémités de chaînes IUPAC Hydroxyéthylation CH 2 CH, Li 1 - OE 2 - H+ CH 2 CH 2 OH NB : la polymérisation de l'oxyde d'éthylène ne peut avoir lieu avec le contre ion Li+ Chimie Macromoléculaire/ Polymérisation ionique 27

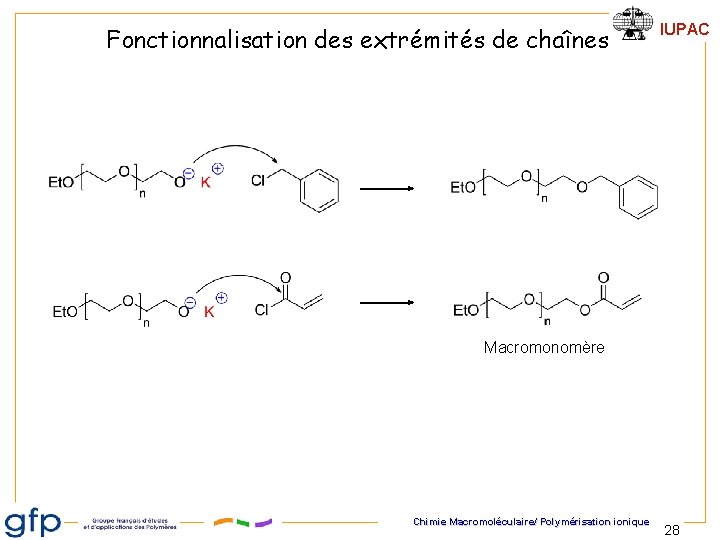
Fonctionnalisation des extrémités de chaînes IUPAC Macromonomère Chimie Macromoléculaire/ Polymérisation ionique 28

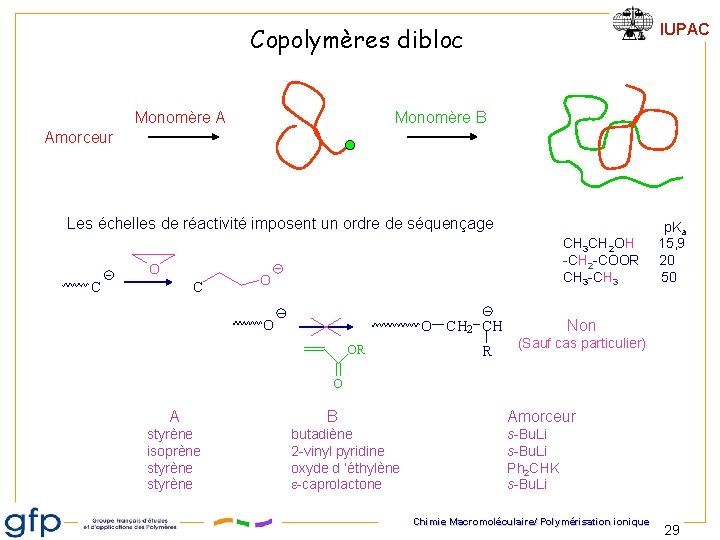
IUPAC Copolymères dibloc Monomère A Monomère B Amorceur Les échelles de réactivité imposent un ordre de séquençage O C C p. Ka CH 3 CH 2 OH 15, 9 -CH 2 -COOR 20 CH 3 -CH 3 50 O O O CH 2 CH OR R Non (Sauf cas particulier) O A B Amorceur styrène isoprène styrène butadiène 2 -vinyl pyridine oxyde d ’éthylène e-caprolactone s-Bu. Li Ph 2 CHK s-Bu. Li Chimie Macromoléculaire/ Polymérisation ionique 29

IUPAC Copolymères tribloc Agent de couplage Copolymère tribloc Amorceur bifonctionnel (naphtalène sodium …) Chimie Macromoléculaire/ Polymérisation ionique 30

IUPAC Chimie Macromoléculaire/ Polymérisation ionique 31

Polymérisation cationique IUPAC Polymérisabilité Amorceurs : acide de Brönstedt, acide de Lewis Polymérisation des dérivés vinyliques : styrène, isobutène Polymérisation des hétérocycles Chimie Macromoléculaire/ Polymérisation ionique 32

Polymérisabilité des monomères Y 1 Styrène Alpha-méthylstyrène Isobutène Ethers vinyliques Substituant mésomère ou inducteur donneur IUPAC Y 2 H CH 3 CH 3 H-O-R stabilisent le carbocation augmentent la nucléophilie de la double liaison Chimie Macromoléculaire/ Polymérisation ionique 33

Polymérisation cationique IUPAC Hétérocycles Oxiranes, THF, dioxolane oxazolines D 4 Chimie Macromoléculaire/ Polymérisation ionique 34

Polymérisation cationique IUPAC Les polymérisations sont réalisées en solution • Solvants halogénés polaires (CH 2 Cl 2, CHCl 3, C 2 H 5 Cl. . . ) • A très basse température (T < – 50 °C) • Le milieu réactionnel doit être anhydre • Polymérisation sous atmosphère inerte (azote, argon) Chimie Macromoléculaire/ Polymérisation ionique 35

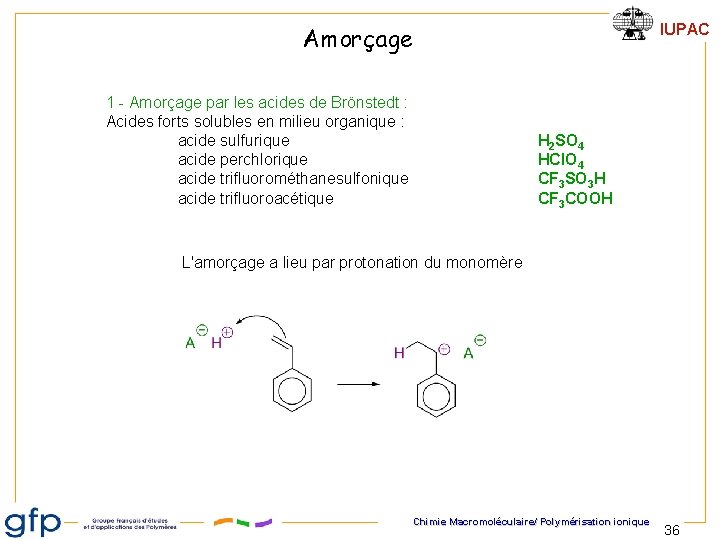
IUPAC Amorçage 1 - Amorçage par les acides de Brönstedt : Acides forts solubles en milieu organique : acide sulfurique acide perchlorique acide trifluorométhanesulfonique acide trifluoroacétique H 2 SO 4 HCl. O 4 CF 3 SO 3 H CF 3 COOH L'amorçage a lieu par protonation du monomère Chimie Macromoléculaire/ Polymérisation ionique 36

Amorçage IUPAC 2 - Amorçage par les acides de Lewis : BF 3 BCl 3 Al. Cl 3 Ti. Cl 4 Sn. Cl 4 comportent une lacune électronique sur le métal (accepteur de doublet électronique). Amorçage direct Equilibre d'auto-ionisation de l'acide de Lewis et amorçage par la forme cationique Al. Cl 2+ 2 Al. Cl 3 Al. Cl 2+ Al. Cl 4– En fait, processus rare. On utilise souvent un cocatalyseur. Amorçage par un cocatalyseur générateur de protons, puis amorçage par protonation du monomère H 2 O + Ti Cl 4 H + Ti Cl 4 OH - HCl + Ti Cl 4 H + Ti Cl 5 - Chimie Macromoléculaire/ Polymérisation ionique 37

Amorçage IUPAC Amorçage par un cocatalyseur générateur de carbocations Equilibre d'ionisation : Amorçage : Chimie Macromoléculaire/ Polymérisation ionique 38

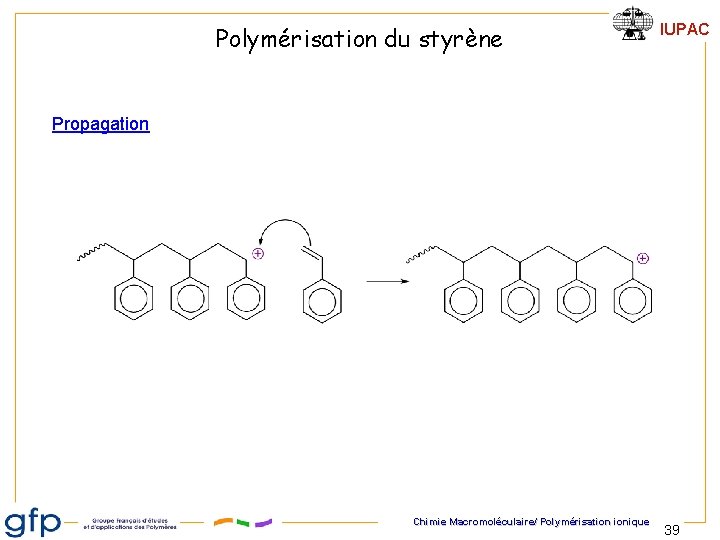
Polymérisation du styrène IUPAC Propagation Chimie Macromoléculaire/ Polymérisation ionique 39

IUPAC Polymérisation du styrène Réactions de transfert réamorçage Chimie Macromoléculaire/ Polymérisation ionique 40

IUPAC Polymérisation du styrène Réactions de transfert intramoléculaire Alkylation de Friedel-Crafts de noyaux aromatiques appartenant au polymère (réaction intra ou intermoléculaire). Favorisée à "haute température". Une double liaison terminale peut être reprotonée pour donner ensuite cette réaction de transfert. A long terme, les chaînes se terminent ainsi CH 2 CH CH 2 H + – CH A CH 2 CH CH 2 + H + A – CH Chimie Macromoléculaire/ Polymérisation ionique 41

Polymérisation de l'isobutène IUPAC Amorçage Propagation Chimie Macromoléculaire/ Polymérisation ionique 42

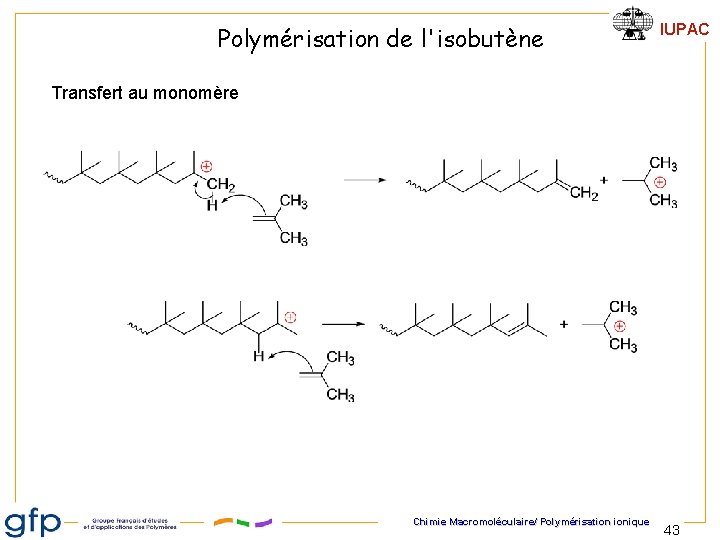
Polymérisation de l'isobutène IUPAC Transfert au monomère Chimie Macromoléculaire/ Polymérisation ionique 43

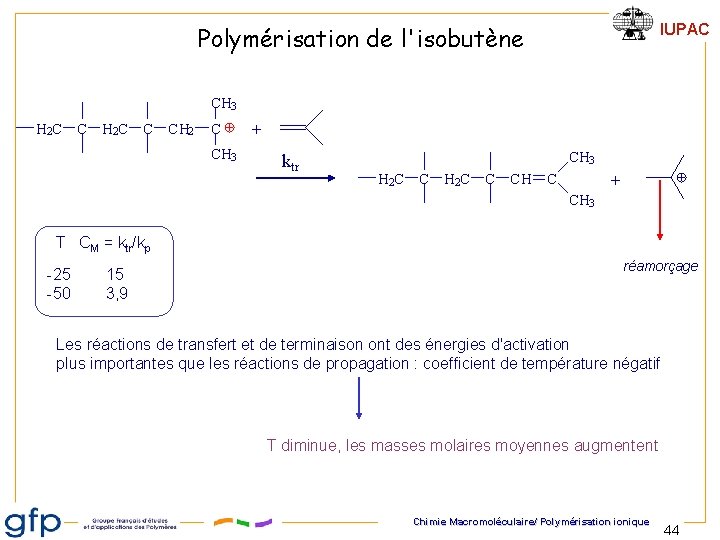
IUPAC Polymérisation de l'isobutène CH 3 H 2 C C CH 2 C CH 3 + ktr CH 3 H 2 C C CH C + CH 3 T CM = ktr/kp -25 15 -50 3, 9 réamorçage Les réactions de transfert et de terminaison ont des énergies d'activation plus importantes que les réactions de propagation : coefficient de température négatif T diminue, les masses molaires moyennes augmentent Chimie Macromoléculaire/ Polymérisation ionique 44

Stabilité des carbocations IUPAC - Stabilité des carbocations : CIII > CI - Transposition vers un carbocation plus stable CH CH CH 3 C CH 2 CH 3 L'unité de répétition est parfois différente de la structure de base du monomère exemple : 4 -méthyl-1 -pentène, b-pinène. Chimie Macromoléculaire/ Polymérisation ionique 45

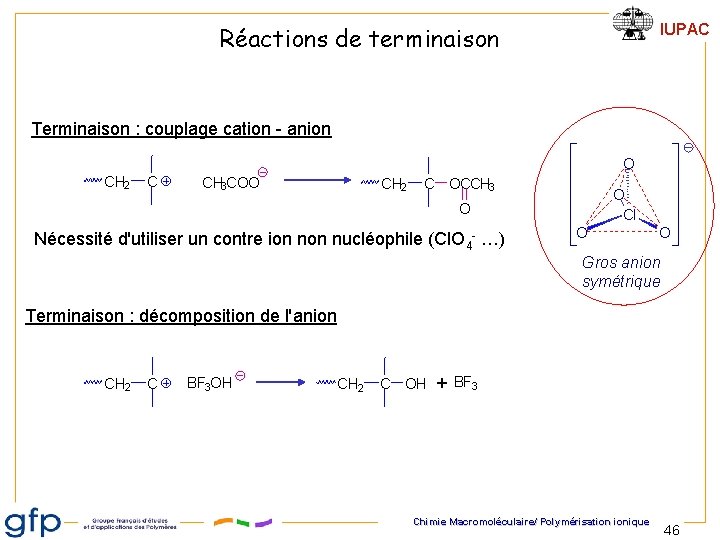
Réactions de terminaison IUPAC Terminaison : couplage cation - anion O CH 2 C CH 3 COO CH 2 C OCCH 3 O Cl O Nécessité d'utiliser un contre ion nucléophile (Cl. O 4 - …) O O Gros anion symétrique Terminaison : décomposition de l'anion CH 2 C BF 3 OH CH 2 C OH + BF 3 Chimie Macromoléculaire/ Polymérisation ionique 46

Application industrielle : le caoutchouc butyle IUPAC Copolymère d'isobutène et d'isoprène CH CH 2 C CH 3 CH 2 x CH C CH 3 CH CH CH 2 C CH 3 T < – 90 °C; solvant halogéné Al. Cl 3 (+ traces d'eau) Polymérisation quasi instantanée Précipitation du polymère vitreux 2 3 y 3 Unités isolées d'isoprène Addition 1, 4 (60 % trans ; 40 % cis) Ó Doubles liaisons : vulcanisation, halogénation Ó Applications industrielles : élastomère imperméable aux gaz Chambres à air, Revêtement intérieur des pneus sans chambre Chimie Macromoléculaire/ Polymérisation ionique 47

Polymérisation des éthers cycliques IUPAC La polymérisation par ouverture de cycle des éthers cycliques se fait principalement par voie cationique, sauf pour les oxiranes. Les éthers cycliques à 5 ou 6 chaînons sont stables. L'amorçage apporte en fait la polarisation et donc l'affaiblissement de la liaison C - O qui permet la polymérisation ultérieure. Les oxiranes polymérisent par voie anionique et cationique car la tension de cycle est suffisante pour permettre l'ouverture de cycle directe par un amorceur anionique Chimie Macromoléculaire/ Polymérisation ionique 48

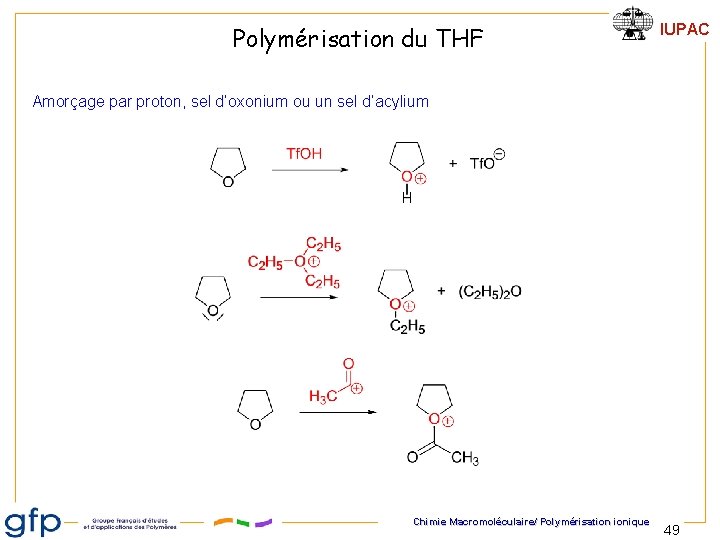
Polymérisation du THF IUPAC Amorçage par proton, sel d’oxonium ou un sel d’acylium Chimie Macromoléculaire/ Polymérisation ionique 49

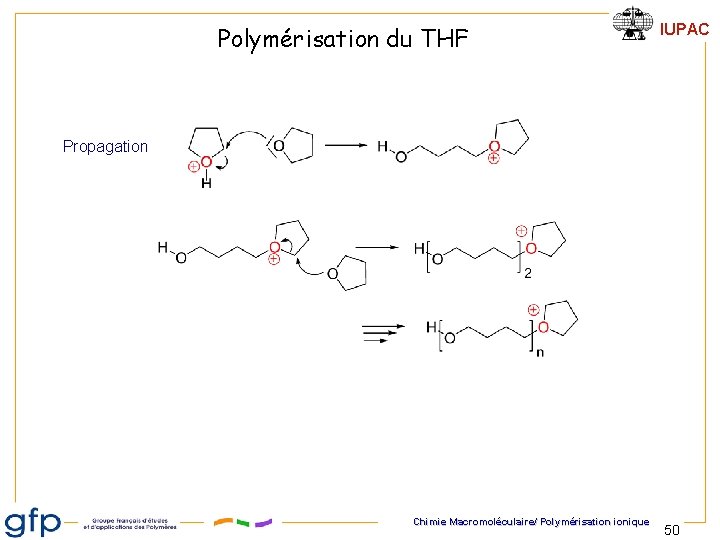
Polymérisation du THF IUPAC Propagation Chimie Macromoléculaire/ Polymérisation ionique 50

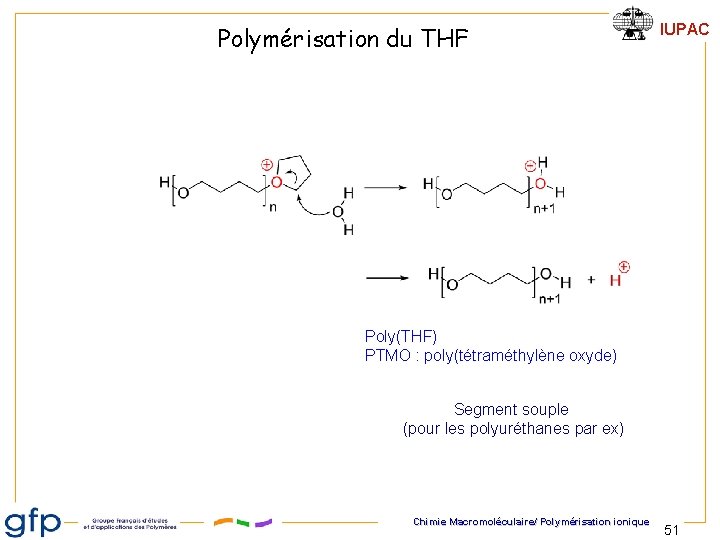
Polymérisation du THF IUPAC Poly(THF) PTMO : poly(tétraméthylène oxyde) Segment souple (pour les polyuréthanes par ex) Chimie Macromoléculaire/ Polymérisation ionique 51

Équilibre polymérisation - dépolymérisation Chimie Macromoléculaire/ Polymérisation ionique IUPAC 52
![Équilibre polymérisation dépolymérisation IUPAC Cinétique À léquilibre Ln M 0 Équilibre polymérisation - dépolymérisation IUPAC Cinétique À l'équilibre : Ln [ M ]0 -](https://slidetodoc.com/presentation_image/018819ca75df25fe6bbfd10f0c186e73/image-53.jpg)
Équilibre polymérisation - dépolymérisation IUPAC Cinétique À l'équilibre : Ln [ M ]0 - [ M ]e = k p[ A ] t [ M ]e Chimie Macromoléculaire/ Polymérisation ionique 53

Équilibre polymérisation - dépolymérisation IUPAC Thermodynamique Température plafond Tc THF : Tc = 84°C Chimie Macromoléculaire/ Polymérisation ionique 54

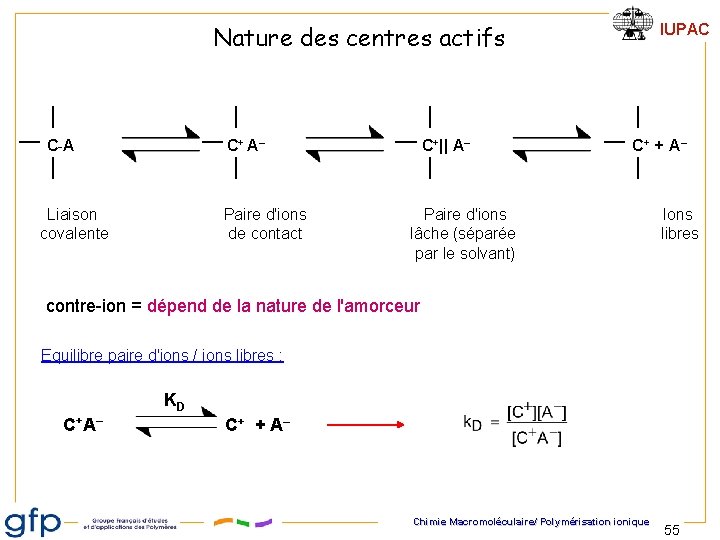
Nature des centres actifs C-A C+ A– Liaison covalente Paire d'ions de contact C+|| A– IUPAC C+ + A – Paire d'ions lâche (séparée par le solvant) Ions libres contre-ion = dépend de la nature de l'amorceur Equilibre paire d'ions / ions libres : KD C+ A– C+ + A– Chimie Macromoléculaire/ Polymérisation ionique 55

Équilibre paire d'ions / ions libres : IUPAC polarité du solvant KD C+ A– C+ + A – kp kp +/– + La concentration de carbocations à un instant t n'est pas connue avec précision propagation kp+ > kp+/– Chimie Macromoléculaire/ Polymérisation ionique 56

Polymérisation cationique vivante de l'isobutène IUPAC Amorçage Propagation Hex / Me. Cl 60/40 vol/vol; T = – 80 °C Travail en présence de DTBP pour piéger l’eau résiduelle et éviter l’amorçage parasite Contrôle de Mn; I faible Copolymères à Chimie Macromoléculaire/ blocs Polymérisation ionique 57

Polymérisation cationique vivante de l'isobutène IUPAC TMPCl / Ti. Cl 4 / Me. Cyclohexane: Me. Cl 60 v: 40 v / – 80 °C Droite théorique Mw/Mn < 1. 1 Amorceur. TMPCl : 2, 2, 4 -triméthyl-4 -chloro pentane [TMPCl] = constante. From R. Faust Chimie Macromoléculaire/ Polymérisation ionique 58

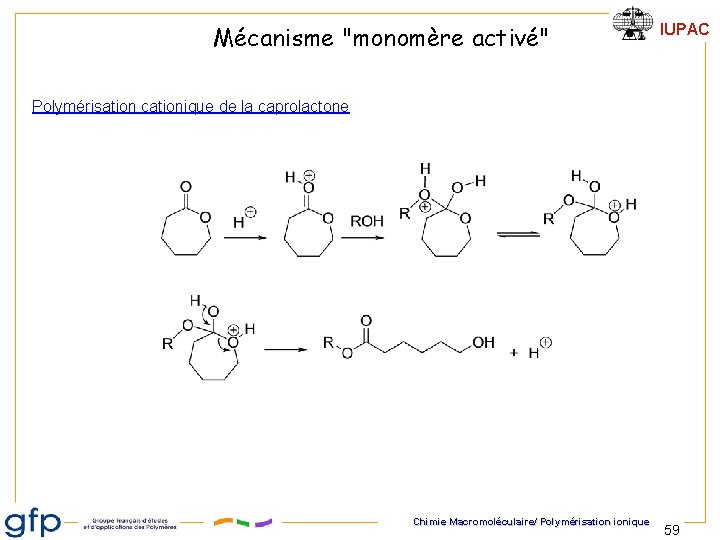
Mécanisme "monomère activé" IUPAC Polymérisation cationique de la caprolactone Chimie Macromoléculaire/ Polymérisation ionique 59

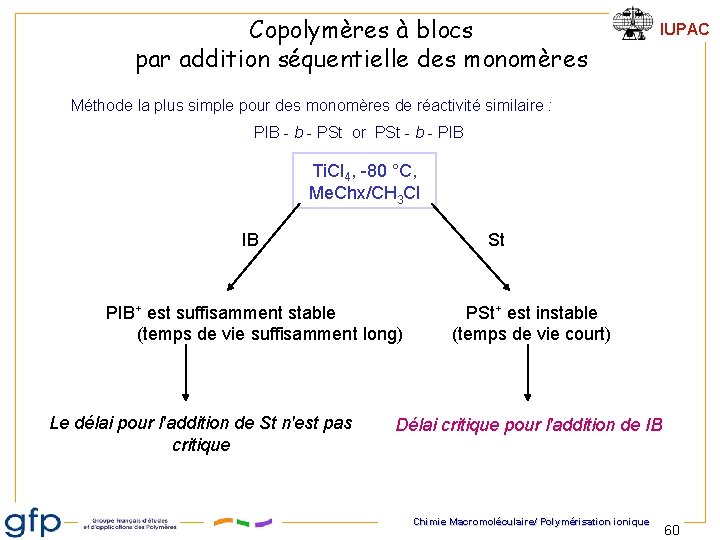
Copolymères à blocs par addition séquentielle des monomères IUPAC Méthode la plus simple pour des monomères de réactivité similaire : PIB - b - PSt or PSt - b - PIB Ti. Cl 4, -80 °C, Me. Chx/CH 3 Cl IB St PIB+ est suffisamment stable (temps de vie suffisamment long) Le délai pour l'addition de St n'est pas critique PSt+ est instable (temps de vie court) Délai critique pour l'addition de IB Chimie Macromoléculaire/ Polymérisation ionique 60
 Alcalose metabolique
Alcalose metabolique Trou anionique
Trou anionique Conductivité molaire ionique k+
Conductivité molaire ionique k+ Style dorique
Style dorique Po3nh
Po3nh Suppresseur chromatographie ionique
Suppresseur chromatographie ionique Solide ionique
Solide ionique Temple grec rond
Temple grec rond Solide ionique
Solide ionique Cristal ionique definition
Cristal ionique definition Des des des
Des des des Croissance douglas
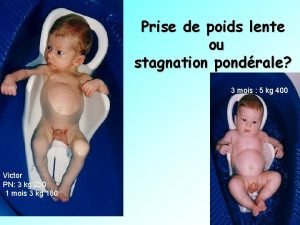
Croissance douglas Retard staturo pondéral
Retard staturo pondéral Contribution à la croissance
Contribution à la croissance Croissance somatique
Croissance somatique Les sources de la croissance
Les sources de la croissance Betli
Betli Le triangle de croissance sijori
Le triangle de croissance sijori Croissance intensive
Croissance intensive Contribution à la croissance
Contribution à la croissance Fecondation interne
Fecondation interne Chorus ii croissance maximale
Chorus ii croissance maximale La croissance intensive
La croissance intensive Facteurs de croissance hématopoïétiques
Facteurs de croissance hématopoïétiques Functional groups table class 10
Functional groups table class 10 Iupac kuralı
Iupac kuralı Nomenclatura iupac
Nomenclatura iupac Isobutil
Isobutil Name
Name Na pcl6 iupac name
Na pcl6 iupac name Test for alkanal
Test for alkanal Nitrilo grupo funcional
Nitrilo grupo funcional Anidridos nomenclatura
Anidridos nomenclatura Cumulated diene examples
Cumulated diene examples Benennung organischer verbindungen übungen
Benennung organischer verbindungen übungen Kbr nomenclatura tradicional
Kbr nomenclatura tradicional Iupac stands for
Iupac stands for What is the iupac name of ch3ch2ch2ch2ch2i?
What is the iupac name of ch3ch2ch2ch2ch2i? Nombre iupac de la cetona que se utiliza como quitaesmalte
Nombre iupac de la cetona que se utiliza como quitaesmalte Ejemplo de cadena ramificada
Ejemplo de cadena ramificada Karboksilat benzena
Karboksilat benzena Iupac name search by image
Iupac name search by image Blm gold book
Blm gold book Propiedades quimicas de las cetonas
Propiedades quimicas de las cetonas ıupac sistemi
ıupac sistemi Beta oxidation
Beta oxidation Hidrocarburos aromaticos
Hidrocarburos aromaticos Na pcl6 iupac name
Na pcl6 iupac name Clonazepam iupac name
Clonazepam iupac name Iupac name for cycloalkane
Iupac name for cycloalkane Carboxylic acid + amine
Carboxylic acid + amine Iupac name
Iupac name 3-hydroxycyclopentanecarbaldehyde
3-hydroxycyclopentanecarbaldehyde Ch3
Ch3 Heptan butan pentan
Heptan butan pentan Unsaturated hydrocarbon
Unsaturated hydrocarbon Polimerlere örnek
Polimerlere örnek Nomenclatura
Nomenclatura Sodium oxidanide
Sodium oxidanide Caoutchoutique
Caoutchoutique How to name carboxylic acid
How to name carboxylic acid