PODSTAWY CHEMII ANALITYCZNEJ Analiza miareczkowa wprowadzenie do Alkacymetrii








- Slides: 18

PODSTAWY CHEMII ANALITYCZNEJ Analiza miareczkowa + wprowadzenie do Alkacymetrii

Analiza miareczkowa – terminy: • • Titrant Mianowanie roztworu Krzywa miareczkowania Skok krzywej Punkt równoważnikowy (PR) Punkt końcowy (PK) Detekcja PK ….

ANALIZA MIARECZKOWA Miareczkowanie wolumetryczne (rzadzej wagowe lub kulometryczne) TITRANT Roztwór mianowany Substancja reagująca z analitem: - selektywnie - ilościowo (stechiometrycznie) - szybko - z dużym „skokiem” krzywej miareczkowania - z łatwym do stwierdzenia punktem końcowym P. K. - z P. K. bliskim P. R. (punktowi równoważnikowemu) ROZTWÓR ANALITU

ANALIZA MIARECZKOWA - Metoda szybka (+) - Konieczny roztwór mianowany (-) - Błąd względny 0, 1 – 0, 2% - Błąd detekcji (P. K. P. R. ) - Błąd kropli (0, 03 ml) - Błąd odczytu (paralaksa) - Błąd naczyń (współmierność)

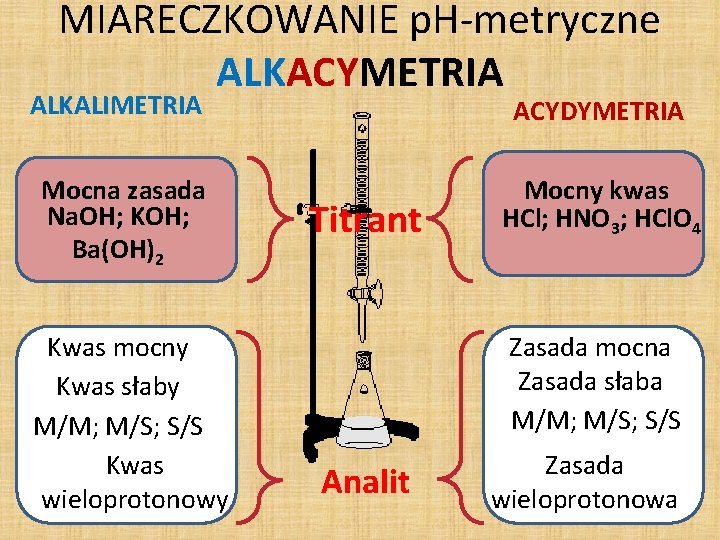
MIARECZKOWANIE p. H-metryczne ALKACYMETRIA ALKALIMETRIA ACYDYMETRIA Mocna zasada Na. OH; KOH; Ba(OH)2 Mocny kwas HCl; HNO 3; HCl. O 4 Kwas mocny Kwas słaby M/M; M/S; S/S Kwas wieloprotonowy Titrant Zasada mocna Zasada słaba M/M; M/S; S/S Analit Zasada wieloprotonowa

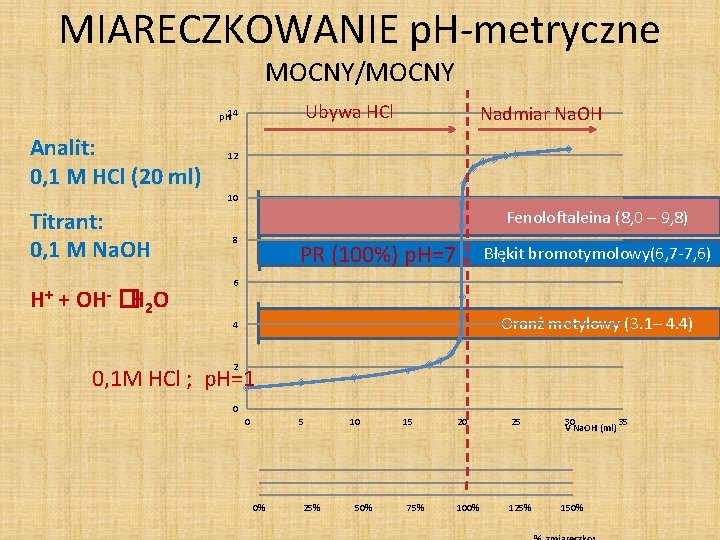
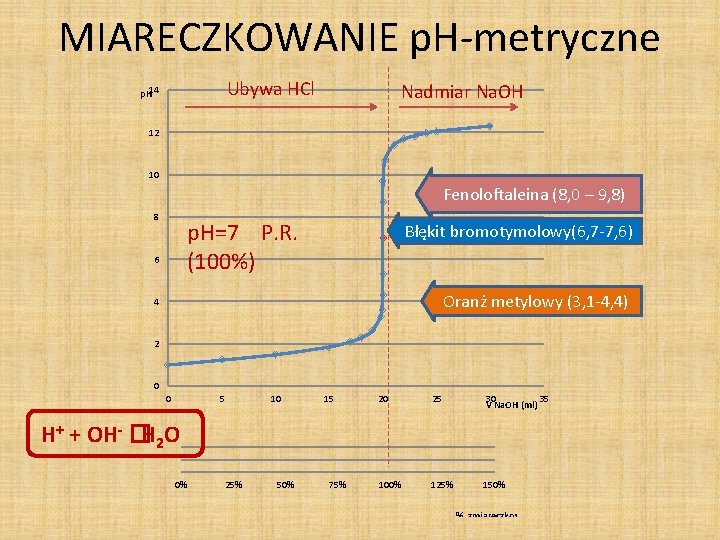
MIARECZKOWANIE p. H-metryczne MOCNY/MOCNY Ubywa HCl p. H 14 Analit: 0, 1 M HCl (20 ml) Nadmiar Na. OH 12 10 Titrant: 0, 1 M Na. OH H+ + OH- �H 2 O Fenoloftaleina (8, 0 – 9, 8) 8 PR (100%) p. H=7 Błękit bromotymolowy(6, 7 -7, 6) 6 Oranż metylowy (3. 1– 4. 4) 4 2 0, 1 M HCl ; p. H=1 0 0 5 0% 25% 10 50% 15 75% 20 25 100% 125% 30 35 V Na. OH (ml) 150%

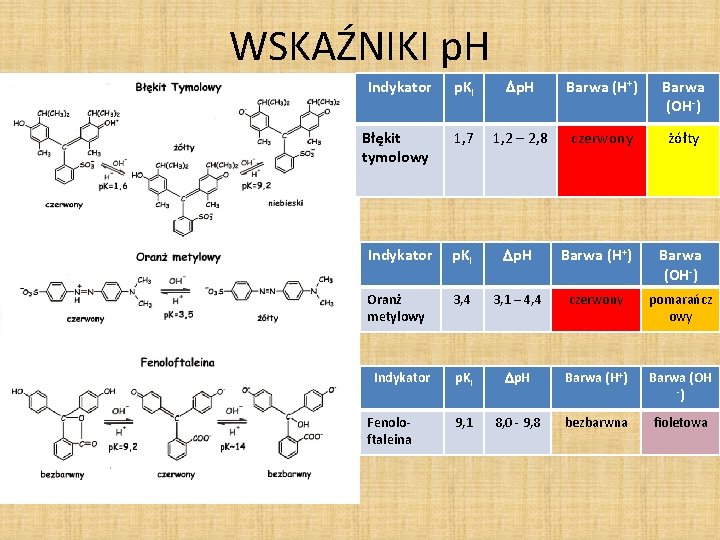
WSKAŹNIKI p. H Indykator p. KI p. H Barwa (H+) Barwa (OH-) Błękit tymolowy 1, 7 1, 2 – 2, 8 czerwony żółty Indykator p. KI p. H Barwa (H+) Barwa (OH-) Oranż metylowy 3, 4 3, 1 – 4, 4 czerwony pomarańcz owy p. KI p. H Barwa (H+) Barwa (OH -) 9, 1 8, 0 - 9, 8 bezbarwna fioletowa Indykator Fenoloftaleina

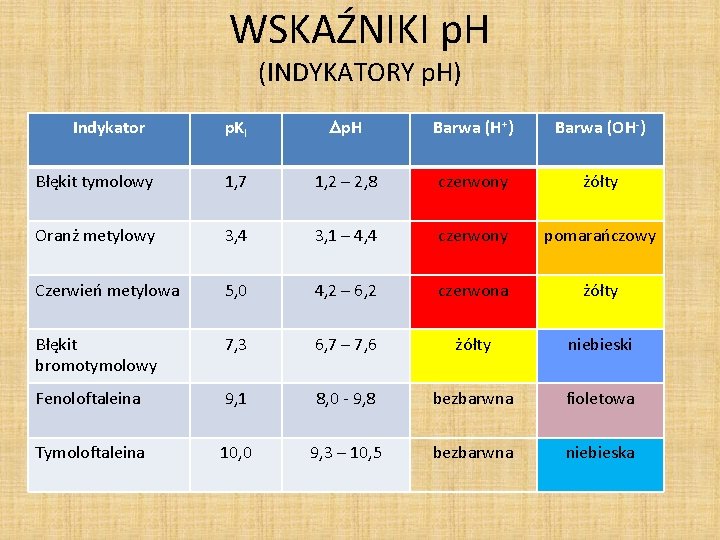
WSKAŹNIKI p. H (INDYKATORY p. H) p. KI p. H Barwa (H+) Barwa (OH-) Błękit tymolowy 1, 7 1, 2 – 2, 8 czerwony żółty Oranż metylowy 3, 4 3, 1 – 4, 4 czerwony pomarańczowy Czerwień metylowa 5, 0 4, 2 – 6, 2 czerwona żółty Błękit bromotymolowy 7, 3 6, 7 – 7, 6 żółty niebieski Fenoloftaleina 9, 1 8, 0 - 9, 8 bezbarwna fioletowa Tymoloftaleina 10, 0 9, 3 – 10, 5 bezbarwna niebieska Indykator

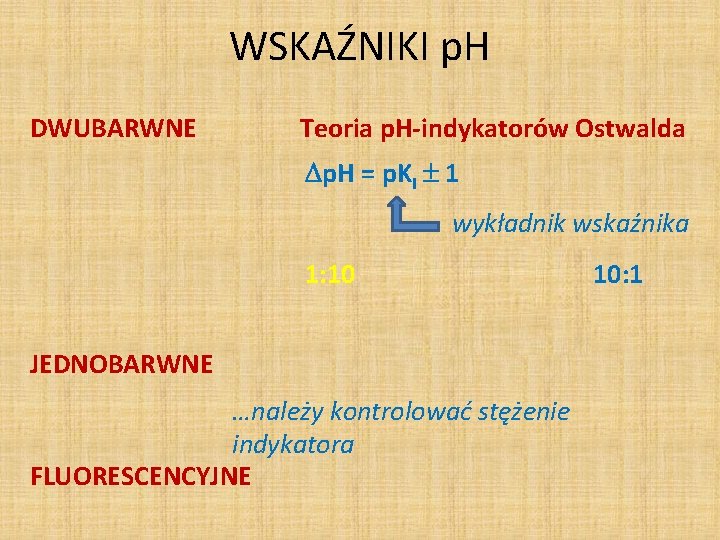
WSKAŹNIKI p. H DWUBARWNE Teoria p. H-indykatorów Ostwalda p. H = p. KI 1 wykładnik wskaźnika 1: 10 1: 1 10: 1 barwa przejściowa JEDNOBARWNE …należy kontrolować stężenie indykatora FLUORESCENCYJNE

WSKAŹNIKI p. H PROBLEMY Efekt stężenia Efekt solny Subtelne zmiany Subiektywność ROZWIĄZANIA Bufor porównawczy (świadek) (p. H i moc jonowa jak w P. R. ) „Poprawa” barw oranż metylowy czerwony - pomarańczowy oranż metylowy + błękit metylowy fioletowy - zielony Elektrody p. H-metryczne

MIARECZKOWANIE p. H-metryczne Ubywa HCl p. H 14 Nadmiar Na. OH 12 10 Fenoloftaleina (8, 0 – 9, 8) 8 p. H=7 P. R. (100%) 6 Błękit bromotymolowy(6, 7 -7, 6) Oranż metylowy (3, 1 -4, 4) 4 2 0 0 5 10 15 20 25 30 35 V Na. OH (ml) 100% 125% 150% H+ + OH- �H 2 O 0% 25% 50% 75% % zmiareczkowania

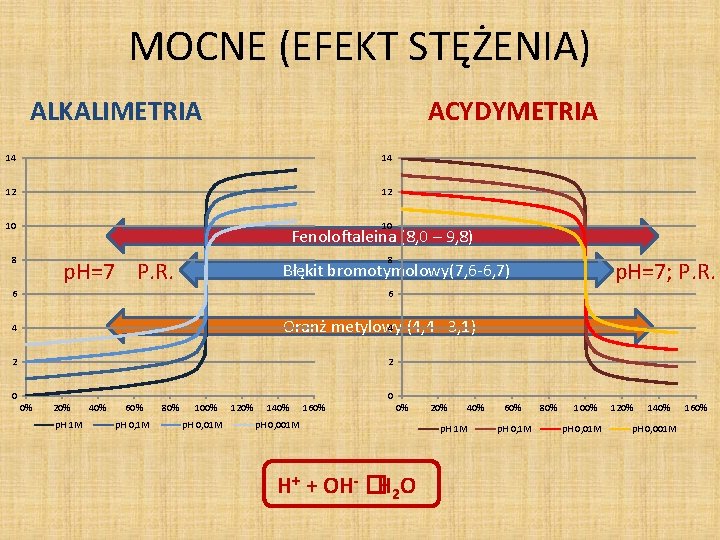
MOCNE (EFEKT STĘŻENIA) ALKALIMETRIA ACYDYMETRIA 14 14 12 12 10 10 Fenoloftaleina (8, 0 – 9, 8) 8 8 p. H=7 P. R. p. H=7; P. R. Błękit bromotymolowy(7, 6 -6, 7) 6 6 4 (4, 4– 3, 1) Oranż metylowy 4 2 2 0 0 0% 20% p. H 1 M 40% 60% p. H 0, 1 M 80% 100% p. H 0, 01 M 120% 140% 160% 0% p. H 0, 001 M H+ + OH- �H 2 O 20% 40% p. H 1 M 60% p. H 0, 1 M 80% 100% p. H 0, 01 M 120% 140% p. H 0, 001 M 160%

MIARECZKOWANIE SŁABYCH KWASÓW ALKALIMETRIA P. R. 14 Nadmiar Na. OH Ubywa HA Przybywa A- 12 Analit: 0, 1 M CH 3 COOH (p. Ka=4, 8 ) 10 8 BUFOR 6 90 50 10 99 P. R. F (8, 0 -9, 8) p. H =7 BB (6, 7 -7, 6) OM (3, 1 -4, 4) p. H =p. Ka 4 2 CH 3 COOH + OH- �CH 3 COO- + H 2 O HCl 0 0% 20% 40% 60% Titrant: 0, 1 M Na. OH 80% 100% P. R. 120% 140% 160%

MIARECZKOWANIE SŁABYCH ZASAD Ubywa NH 3 Przybywa NH 4+ 14 ACYDYMETRIA P. R. Nadmiar HCl Analit: 0, 1 M NH 3 (p. Ka=9, 2 ) Na. OH 12 10 50 10 90 BUFOR 8 F (8, 0 -9, 8) 99 Titrant: 0, 1 M HCl BB (7, 6 -6, 7) p. H =7 P. R. p. H =p. Ka 6 4 OM (4, 4 -3, 1) 2 NH 3 + H+ �NH 4+ 0 0% 20% 40% 60% 80% 100% P. R. 120% 140% 160%

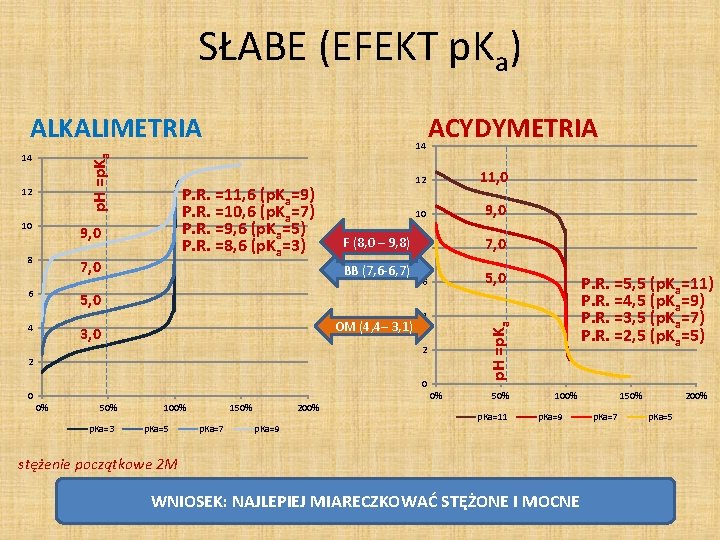
SŁABE (EFEKT p. Ka) p. H =p. Ka 14 12 10 P. R. =11, 6 (p. Ka=9) P. R. =10, 6 (p. Ka=7) P. R. =9, 6 (p. Ka=5) P. R. =8, 6 (p. Ka=3) 9, 0 8 7, 0 6 14 F (8, 0 – 9, 8) BB (7, 6 -6, 7) 5, 0 4 OM (4, 4– 3, 1) 3, 0 ACYDYMETRIA 12 11, 0 10 9, 0 8 7, 0 6 5, 0 4 2 2 0 0 0% 50% p. Ka=3 100% p. Ka=5 150% p. Ka=7 200% p. Ka=9 P. R. =5, 5 (p. Ka=11) P. R. =4, 5 (p. Ka=9) P. R. =3, 5 (p. Ka=7) P. R. =2, 5 (p. Ka=5) p. H =p. Ka ALKALIMETRIA 0% 50% p. Ka=11 100% p. Ka=9 stężenie początkowe 2 M WNIOSEK: NAJLEPIEJ MIARECZKOWAĆ STĘŻONE I MOCNE 150% p. Ka=7 200% p. Ka=5

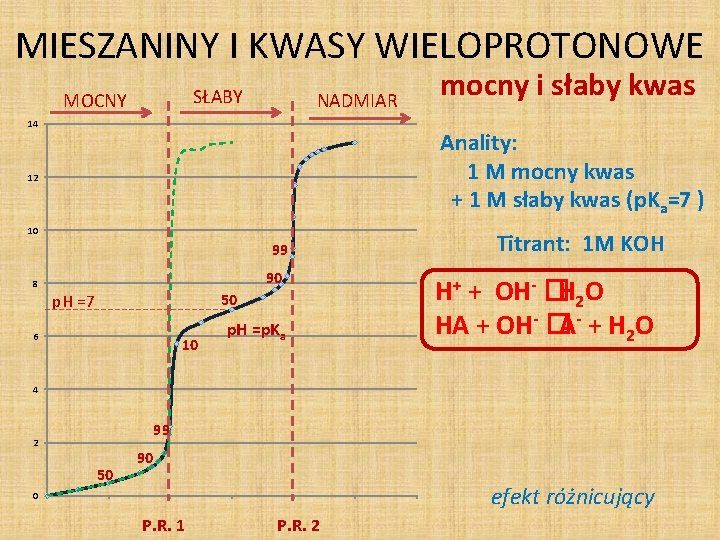
MIESZANINY I KWASY WIELOPROTONOWE SŁABY MOCNY NADMIAR 14 mocny i słaby kwas Anality: 1 M mocny kwas + 1 M słaby kwas (p. Ka=7 ) 12 10 99 90 8 p. H =7 50 6 10 p. H =p. Ka Titrant: 1 M KOH H+ + OH- �H 2 O HA + OH- �A- + H 2 O 4 99 2 50 90 efekt różnicujący 0 P. R. 1 P. R. 2

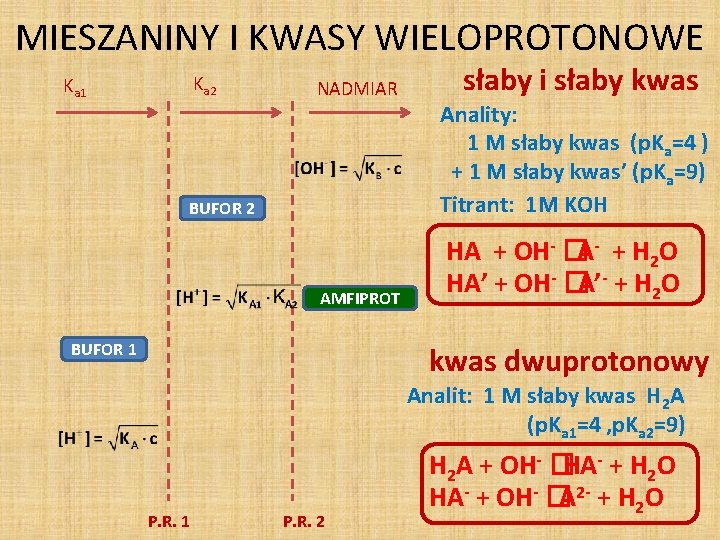
MIESZANINY I KWASY WIELOPROTONOWE Ka 2 Ka 1 NADMIAR BUFOR 2 AMFIPROT BUFOR 1 słaby i słaby kwas Anality: 1 M słaby kwas (p. Ka=4 ) + 1 M słaby kwas’ (p. Ka=9) Titrant: 1 M KOH HA + OH- �A- + H 2 O HA’ + OH- �A’- + H 2 O kwas dwuprotonowy Analit: 1 M słaby kwas H 2 A (p. Ka 1=4 , p. Ka 2=9) P. R. 1 P. R. 2 H 2 A + OH- �HA- + H 2 O HA- + OH- �A 2 - + H 2 O

Punkty charakterystyczne krzywej + … ile skoków i gdzie? ? • glicyna • węglany …. • • • H 2 SO 4 H 2 C 2 O 4 H 3 PO 4 H 3 BO 3 …. . (1) (2) (0) 18
 Kolory w chemii nieorganicznej
Kolory w chemii nieorganicznej Jądrowe
Jądrowe Adrianna stawarz
Adrianna stawarz Substancje podstawowe w alkacymetrii
Substancje podstawowe w alkacymetrii Wprowadzenie do systemów baz danych
Wprowadzenie do systemów baz danych Ogólne wprowadzenie do mszału rzymskiego
Ogólne wprowadzenie do mszału rzymskiego Romantyzm nazwa
Romantyzm nazwa Wprowadzenie do prezentacji
Wprowadzenie do prezentacji Metoda dobrego startu bogdanowicz
Metoda dobrego startu bogdanowicz Gimp wprowadzenie
Gimp wprowadzenie Wprowadzenie do informatyki
Wprowadzenie do informatyki Vhdl podstawy
Vhdl podstawy Płomień kinetyczny
Płomień kinetyczny Zasada prac przygotowanych belka
Zasada prac przygotowanych belka Teoretyczne podstawy informatyki
Teoretyczne podstawy informatyki Płomień kinetyczny
Płomień kinetyczny Podstawy kryptografii
Podstawy kryptografii Monitorowanie realizacji podstawy programowej
Monitorowanie realizacji podstawy programowej Podstawy akustyki
Podstawy akustyki


































