Podstawowe typy reakcji organicznych Kwasy i zasady Lewisa












- Slides: 16

Podstawowe typy reakcji organicznych Kwasy i zasady Lewisa v Ø Ø Ø v Ø Ø Reakcje organiczne: reakcje rodnikowe – homolityczne, reakcje jonowe – heterolityczne, reakcje substytucji, reakcje addycji, reakcje eliminacji, Kwasy i zasady Lewisa: kwasy Lewisa, zasady Lewisa

Reakcje organiczne v Reakcje organiczne są z reguły reakcjami dwucząsteczkowymi zachodzącymi w wyniku efektywnego zderzenia dwóch drobin, zderzenia mogą zachodzić między: Ø dwiema elektrycznie obojętnymi cząsteczkami, Ø dwoma jonami, dwoma rodnikami, Ø obojętnej cząsteczki z jonem lub rodnikiem, Ø obojętne cząsteczki są z reguły trwałymi dipolami, których moment dipolowy może być zwiększony w momencie samego zderzenia. v Przegrupowanie wewnątrzcząsteczkowe – reakcje organiczne polegające na zmianie struktury lub przestrzennego rozmieszczenia atomów cząsteczki – izomeryzacja, tautomeryzacja.

Reakcje rodnikowe – homolityczne ● ●● ●● ●● v Pary elektronowe tworzące wiązanie kowalencyjne ulega rozerwaniu, w efekcie przy każdym z powstających fragmentów zostaje niesparowany(e) elektron(y): ● + B● Ø A ●●●● B ● A ●● ●● ● uv ●● Cl Cl ●● ü Cl + Cl ●● ●● ●● R ●● ●● ü H 2 C CH 2 H 2 C ● ● CH 2 R ● ● ü HC ● ● CH HC ●● ●● CH Ø rodnik (wolny rodnik) – atom lub grupa atomów zawierająca niesparowany(e) elektron(y) (dwurodnik – birodnik posiada 2 niesparowane elektrony), Ø rodniki organiczne są nietrwałe i bardzo aktywne, Ø produkty przejściowe w reakcjach – substytucji rodnikowej, addycji rodnikowej, polimeryzacji rodnikowej ● ● ● ●●

Reakcje jonowe – heterolityczne ●● v W przemianach jonowych w trakcie rozerwania wiązania atomowego para elektronowa zostaje przy jednym z powstających fragmentów, który staje się anionem, drugi fragment staje się kationem: ɵ � Ø A ●●B A + B Ø w reakcjach jonowych przemiany chemiczne są uwarunkowane siłami oddziaływania elektrostatycznego między biegunami trwałych lub tworzącymi się nietrwałymi dipolami (dipole wzbudzone, indukcyjne, chwilowe), Ø reakcje heterolityczne mogą przebiegać wg. mechanizmu elektrofilowego lub mechanizmu nukleofilowego.

Reakcje jonowe – heterolityczne v Procesy elektrofilowe: Ø czynnikiem atakującym są układy zawierające luki elektronowe (kwasy Lewisa - w elektronowej teorii kwasów i zasad), Ø czynniki elektrofilowe – drobiny wykazujące powinowactwo do elektronów lub ujemnych biegunów spolaryzowanych cząsteczek Ø czynnikami elektrofilowymi (kwasami Lewisa) są kationy oraz spolaryzowane cząsteczki stanowiące dipole elektryczne włączające się do reakcji biegunem dodatnim (H+, Li+, Mg 2+, Cl+, Br+, NO 2+, SO 3 H+, R 3 C+, COR+, RN 2+, Al. Cl 3, BF 3, Ti. Cl 4, Fe. Cl 3, Zn. Cl 2)

Reakcje jonowe – heterolityczne v Procesy nukleofilowe: Ø czynnikiem atakującym są układy zawierające wolne pary elektronowe (zasady Lewisa - w elektronowej teorii kwasów i zasad), Ø czynniki nukleofilowe – drobiny wykazujące powinowactwo do jąder atomowych lub dodatnich biegunów spolaryzowanych cząsteczek, Ø czynnikami nukleofilowymi (zasadami Lewisa) są aniony, obojętne cząsteczki zawierające wolne (niewiążące) pary elektronowe, spolaryzowane cząsteczki stanowiące dipole elektryczne, włączające się do reakcji biegunami ujemnymi (F-, Cl-, Br-, OH-, CN-, NH 3, H 2 O, aminy 1 o, 2 o, 3 o - R-NH 2, R 2 NH, R 3 N)

Reakcje substytucji - podstawiania ● ● v Reakcja polega na tym, że atom lub grupa funkcyjna w cząsteczce zostaje podstawiona (zastąpiona) przez inny atom lub inną grupą funkcyjną. Ø substytucja rodnikowa SR: ü R + A ●● B A – R + B ●● ü A ● ● B + R 1 R 2 A – R 1 + B – R 2 Ø substytucja elektrofilowa SE (Z�– czynnik eletrofilowy): � ü Z + A ● ● B A – Z + B� ü A ●● B + Z ●● Y A–Z+B–Y ɵ Ø substytucja nukleofilowa SN ( Y - czynnik nukleofilowy): ɵ ●● ü A B + Y B – Y + Aɵ ü A ●● B + Y ●● Z B – Y + A – Z

Reakcje addycji – przyłączenia ● v Reakcje addycji są charakterystyczne do związków zawierających w cząsteczkach wiązania wielokrotne (wiązanie/a π) Ø addycja rodnikowa AR (R - rodnik): ●● ü R + A _B R–A–B ●● ●● ü A _ B + R 1 R 2 R 1 – A – B – R 2 � Ø addycja elektrofilowa AE (Z – czynnik eletrofilowy): � � ●● _ Z B A ü + Z–Z–B ●● ü A _ B + Z ●● Y Z – A – B – Y ɵ Ø addycja nukleofilowa AN ( Y - czynnik nukleofilowy): ɵ ɵ ●● _ ü A B + Y A–B–Y ü A ●_● B + Y ● ● Z Z – A – B – Y ● ●

Reakcje eliminacji – odszczepienia ●● v Reakcje eliminacji polega na oderwaniu od cząsteczki substratu dwóch podstawników: Ø β – eliminacja: podstawniki odszczepiają się od sąsiadujących z sobą atomów cząsteczki, eliminacja prowadzi do powstania wiązania wielokrotnego: ●● ●● Z A – B Y A = B + ZY ü Ø α – eliminacja: podstawniki odszczepiają się od tego samego atomu cząsteczki substratu: ●● Z A ● ● Y A + ZY ü Ø eliminacja dwóch podstawników na atomach niesąsiadujących z sobą w cząsteczce substratu, powstają produkty cykliczne: ●● ü Z A – B – C ● ● Y A| – | B + ZY C

Kwasy i zasady Lewisa v Elektronowa teoria kwasów i zasad: Ø kwas Lewisa - substancja (cząsteczka, jon), która jest akceptorem pary elektronowej, Ø zasada Lewisa - substancja (cząsteczka, jon), która jest donorem pary elektronowej, Ø oddana para elektronowa zostaje uwspólniona między kwasem i zasadą w wiązaniu atomowym, wolny orbital obsadzony orbital ●● Ø B + zasada Lewisa A kwas Lewisa B–A

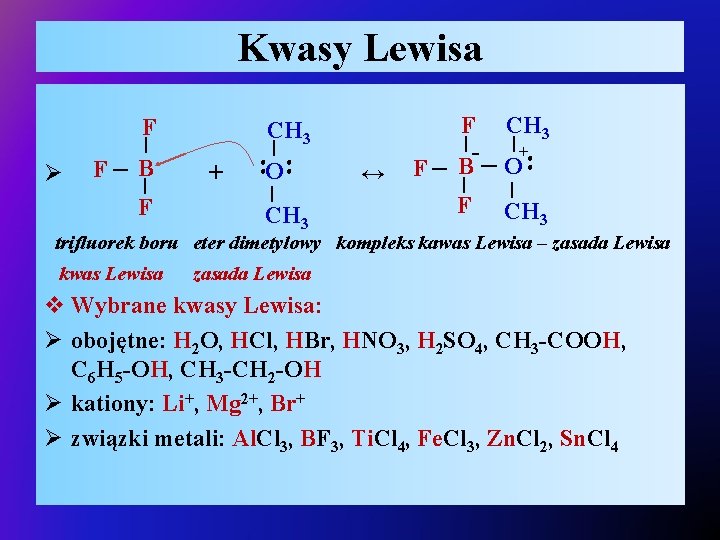
Kwasy Lewisa v Kwas Lewisa – drobina zdolna do przyjęcia pary elektronowej oznacza, że musi posiadać pusty, nieobsadzony niskoenergetyczny orbital lub silnie spolaryzowane wiązanie chemiczne z atomem wodoru, które łatwo uwolni proton wodorowy (H+ posiada wolny orbital 1 s): Ø kwasami Lewisa są również kationy metali – Li+, Mg 2+, są akceptorami pary elektronowej, gdy tworzą wiązanie z zasadą Ø fluorowce pierwiastków grupy 13 BF 3, Al. Cl 3, ponieważ mają niezapełnione orbitale walencyjne i mogą być akceptorami par elektronowych z zasad Lewisa, Ø związki metali: Ti. Cl 4, Fe. Cl 3, Zn. Cl 2, Sn. Cl 4

Kwasy Lewisa zasada Lewisa Cl chlorek gliny kwas Lewisa Cl | ●● Ø Cl – Al – Cl + N – CH 3 | CH 3 trimetyloamina zasada Lewisa + Cl - kation oksoniowy (hydroniowy) CH 3 | + O – H ↔ H –O – H | | H H ↔ | Cl – Al - | kwas Lewisa + ●● Ø H – Cl ●● δ- ●● δ+ | Cl CH 3 | + N – CH 3 | CH 3 kompleks kwas Lewisa – zasada Lewisa

Kwasy Lewisa CH 3 | F + O | CH 3 ↔ ●● | ●● F– B ●● Ø | F CH 3 | - |+ F– B O | F | CH 3 trifluorek boru eter dimetylowy kompleks kawas Lewisa – zasada Lewisa kwas Lewisa zasada Lewisa v Wybrane kwasy Lewisa: Ø obojętne: H 2 O, HCl, HBr, HNO 3, H 2 SO 4, CH 3 -COOH, C 6 H 5 -OH, CH 3 -CH 2 -OH Ø kationy: Li+, Mg 2+, Br+ Ø związki metali: Al. Cl 3, BF 3, Ti. Cl 4, Fe. Cl 3, Zn. Cl 2, Sn. Cl 4

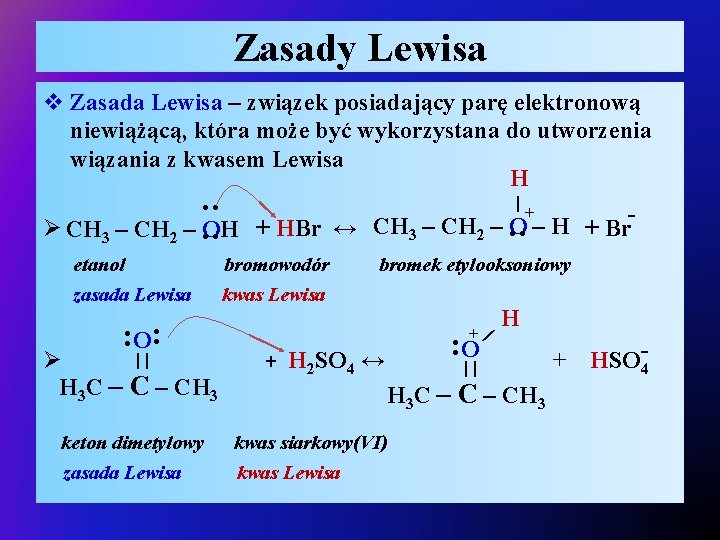
Zasady Lewisa v Zasada Lewisa – związek posiadający parę elektronową niewiążącą, która może być wykorzystana do utworzenia wiązania z kwasem Lewisa H | ●● + CH – O – H Ø CH 3 – CH 2 – OH + HBr ↔ + Br ●● ●● 3 2 || Ø H 3 C – CH 3 keton dimetylowy zasada Lewisa bromek etylooksoniowy + | ●● ●● O bromowodór kwas Lewisa H O ●● etanol zasada Lewisa + H 2 SO 4 ↔ || H 3 C – CH 3 kwas siarkowy(VI) kwas Lewisa + HSO 4 -

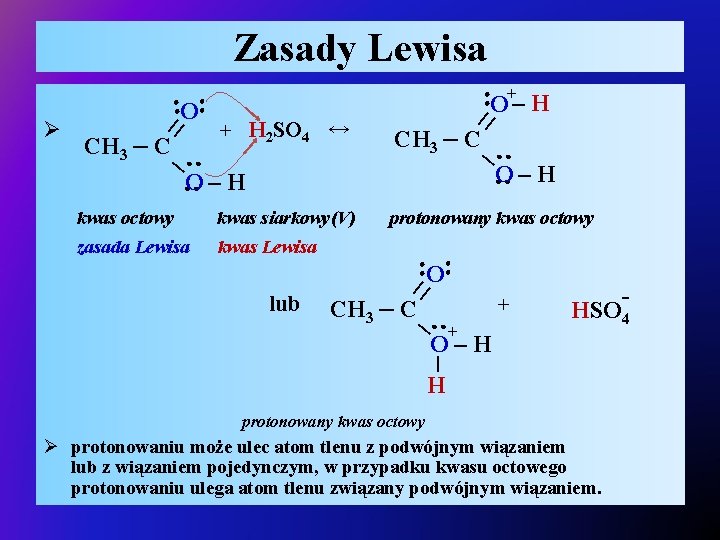
Zasady Lewisa Ø + H 2 SO 4 ↔ | ●● | CH 3 – C ●● ●● ●● ||O + ||O – H CH 3 – C ●● O● – H ● O–H ●● kwas octowy kwas siarkowy(V) zasada Lewisa kwas Lewisa protonowany kwas octowy ●● ●● ||O lub ●● | CH 3 – C + + - HSO 4 O–H | H protonowany kwas octowy Ø protonowaniu może ulec atom tlenu z podwójnym wiązaniem lub z wiązaniem pojedynczym, w przypadku kwasu octowego protonowaniu ulega atom tlenu związany podwójnym wiązaniem.

Zasady Lewisa v Przykładowe zasady Lewisa: Ø CH 3 -CH 2 -OH – alkohol, H 3 C-O-CH 3 – eter, CH 3 -CHO – aldehyd, H 3 C-CO-CH 3 – keton, CH 3 -COCl – chlorek kwasowy, CH 3 -COOH – kwas karboksylowy CH 3 -CO-O-CH 3 - ester, CH 3 -CONH 2 - amid, CH 3 -S-CH 3 – sulfid, aminy 1 o, 2 o i 3 o R – NH 2, (R)2 – NH, (R)3 – N, v Niektóre związki mogą oddziaływać zarówno jak kwasy, jak i zasady (np. H 2 O, kwasy karboksylowe, alkohole) – są kwasami gdy są dawcami protonów wodorowych a zasadami gdy atom tlenu w ich cząsteczkach przyłącza proton wodorowy. v Kwasy karboksylowe, estry i amidy mają dwa atomy z wolnymi parami elektronowymi i mogą reagować na obu centrach aktywnych.