Pillole di chimica Legge Charles Giovanni Casavecchia 1





- Slides: 9

Pillole di chimica: Legge Charles Giovanni Casavecchia

1 Un modello per i gas La teoria cinetica e il gas perfetto Secondo la teoria cinetica dei gas a) le particelle del gas sono in costante, rapido e disordinato movimento tra un urto e l’altro, si muovono lungo traiettorie rettilinee b) urtando contro le pareti del recipiente le particelle rimbalzano e cambiano direzione ed esercitano una forza sulla parete La pressione è la forza che le molecole del gas esercitano sull’area unitaria di una superficie Capitolo 7 Le leggi dei gas 2

1 Un modello per i gas c) l’energia cinetica delle particelle è associata al movimento degli atomi e delle molecole ed è direttamente proporzionale alla temperatura del gas d) gli urti delle particelle contro le pareti del recipiente sono elastici – l’energia prima e dopo l’urto è la stessa e) il volume delle particelle è trascurabile rispetto al volume totale del gas – questo spiega la comprimibilità dei gas Un gas che si comporta come previsto dalla teoria cinetica è detto gas ideale (o perfetto) Quando il gas si trova a temperature molto basse o a pressioni molto alte, il modello non è più valido Capitolo 7 Le leggi dei gas 3

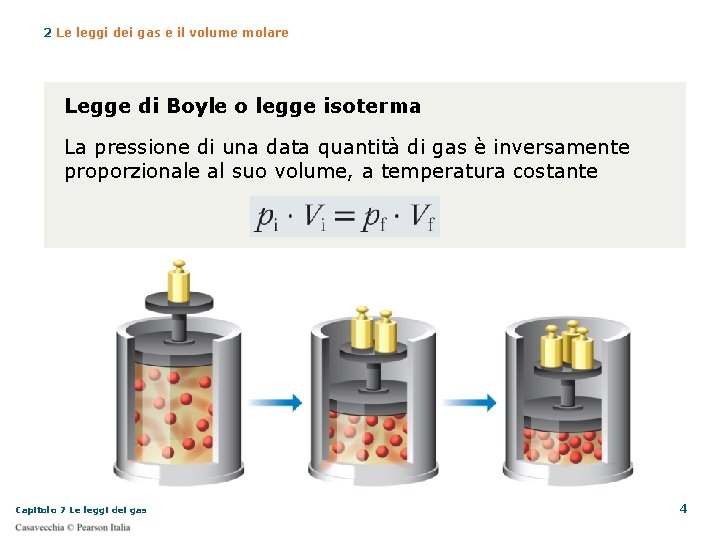
2 Le leggi dei gas e il volume molare Legge di Boyle o legge isoterma La pressione di una data quantità di gas è inversamente proporzionale al suo volume, a temperatura costante Capitolo 7 Le leggi dei gas 4

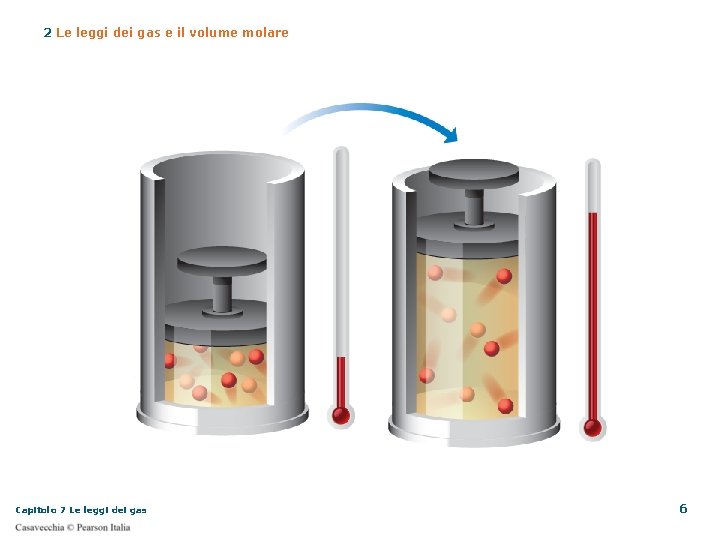
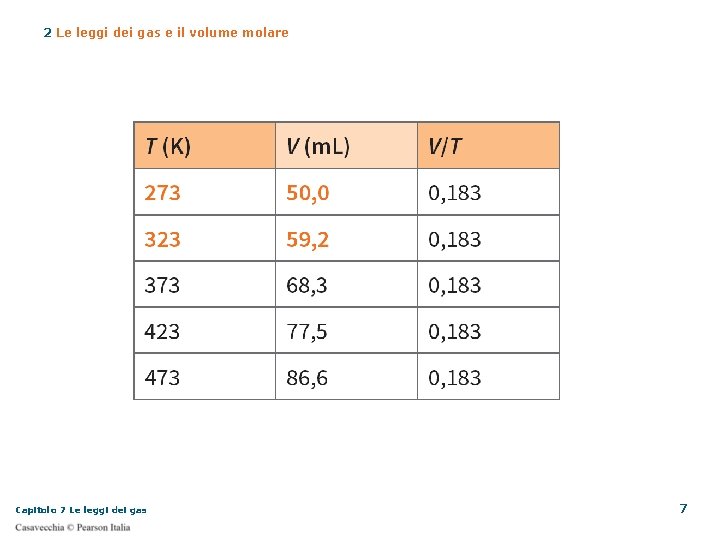
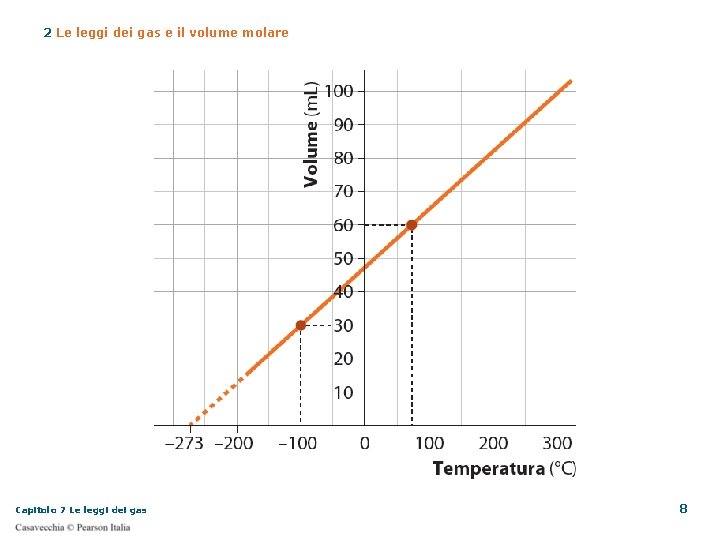
2 Le leggi dei gas e il volume molare Legge di Charles Come per Boyle, l’analisi dei dati portò Charles a queste conclusioni all’aumentare della temperatura, il volume aumenta le due grandezze sono direttamente proporzionali il rapporto tra il volume e la temperatura è costante Capitolo 7 Le leggi dei gas 5

2 Le leggi dei gas e il volume molare Capitolo 7 Le leggi dei gas 6

2 Le leggi dei gas e il volume molare Capitolo 7 Le leggi dei gas 7

2 Le leggi dei gas e il volume molare Capitolo 7 Le leggi dei gas 8

2 Le leggi dei gas e il volume molare Legge di Charles o legge isobara Il volume di una data massa di gas è direttamente proporzionale alla sua temperatura assoluta, a pressione costante Fai attenzione! Quando applichi questa legge la temperatura deve essere espressa in kelvin (K) Usando i gradi Celsius (°C) Capitolo 7 Le leggi dei gas 9