Piccioni Sara e Fidanza Davide Solidi Ionici Covalenti













- Slides: 15

Piccioni Sara e Fidanza Davide; Solidi; Ionici; Covalenti; Molecolari; Metallici.

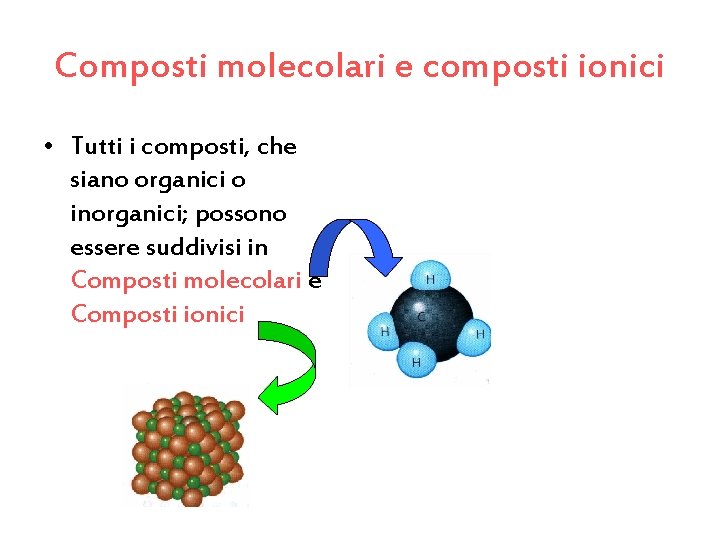
Composti molecolari e composti ionici • Tutti i composti, che siano organici o inorganici; possono essere suddivisi in Composti molecolari e Composti ionici

Composti molecolari; Legami covalenti • I composti molecolari sono formati da gruppi di molecole cioè atomi uniti da legami covalenti. Questo tipo di legame è responsabile della formazione delle molecole; in tale legame gli elettroni sono Condivisi dai due nuclei positivi. • Spiegazione della figura • Rappresentazione della formazione del legame covalente

Composti ionici Nei composti ionici invece non è possibile individuare una vera e propria molecola Ad esempio nel cloruro di litio un sale che è formato da ioni di litio positivi e da ioni di cloruro negativi. Ciascun ione Li + è circondato da ioni Cl - e ogni ione Cl – è circondato da ioni Li+.

• Per i composti ionici è più corretto chiamare l’unità base (Formula unitaria) invece che (Molecola) • Per riconoscere se un composto è ionico o molecolare ? • La maggior parte dei composti ionici è formata da metalli e non metalli , per esempio ( Na. Cl ; Mg. O ; Al 2 O 3) • Invece gran parte dei composti molecolari derivano dalla combinazione fra due o più elementi non metallici come per esempio (CO 2; H 2 O; NH 3; CHCL 3).

Legame ionico • Il legame ionico avviene tra due ioni di carica opposta che si attraggono formando cosi il legame ionico. Questo tipo di legame si ha quando la differenza di elettronegatività fra i due elementi che intendono legarsi è superiore a 1. 9 facendo avvenire un trasferimento da un atomo all’altro. Per capire come il bilancio energetico possa essere favorevole ; bisogna prendere in considerazione almeno i tre contributi più importanti : l’energia spesa

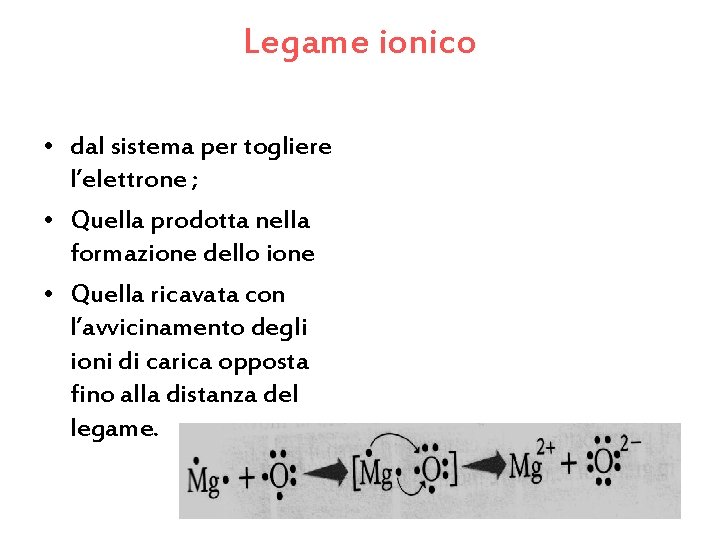
Legame ionico • dal sistema per togliere l’elettrone ; • Quella prodotta nella formazione dello ione • Quella ricavata con l’avvicinamento degli ioni di carica opposta fino alla distanza del legame.

• Spiegazione della figura precedente: • Il magnesio ( un metallo ) cede due elettroni all’ossigeno (un non metallo) e si formano i due ioni Mg 2+ e. O 2 - stabilendo cosi un legame ionico.

La valenza ionica • La valenza ionica di un elemento rappresenta il numero di elettroni perduti o acquistati dall’atomo di tale elemento. • Per tanto se l’elemento perde elettroni si trasforma in uno ione positivo ad esempio(Na+; Mg 2+; Al 3+) • Se l’elemento acquista elettroni, si ottengono ioni negativi ; ad esempio(Cl-; O 2 -)

I composti ionici si dissociano • Come abbiamo visto per formare il composto Na. Cl ogni atomo di cloro riceve un elettrone dagli atomi di sodio; grazie alla sua carica negativa attirando intorno a se sei ioni sodio, che si pongono a stretto contatto con ogni ione di cloro e viceversa. Il numero sei, che indica gli ioni che circondano ogni ione di carica opposta, non è una regola fissa.

Il legame metallico • Il legame metallico è dovuto all'attrazione fra gli ioni metallici positivi e gli elettroni mobili che li circondano.

La classificazione dei solidi • I solidi possono essere cristallini o amorfi. • Nei solidi cristallini gli atomi, le molecole o gli ioni che li costituiscono sono disposti ordinatamente. • Nei solidi amorfi come il burro, la gomma e il vetro fra le particelle microscopiche prevale il disordine. • I cristalli hanno una disposizione interna regolare di atomi, molecole o ioni; essi possono essere ionici reticolari molecolari e non molecolari.

Cristalli ionici • Elementi metallici e non metallici che abbiano differenza elettronegatività molto elevata • Fra ioni poliato 0 mici i cui atomi raggiungono configurazioni elettroniche stabili (NO 3 -, NH 4+) • Essi hanno un alto punto di fusione perché allo stato solido non conducono elettricità, le loro soluzioni acquose conducono discretamente l'elettricità, allo stato fuso conducono l'elettricità. • Il legame ionico si forma tra:

Solidi reticolari • Nei solidi reticolari una rete tridimensionale di legami covalenti unisce gli atomi in un enorme molecola. Gli elettroni di legame sono localizzati lungo la linea di congiunzione. I solidi covalenti sono molto duri e molti di loro sono anche considerati pietre preziose.

Cristalli metallici • I metalli hanno una struttura cristallina, mascherata dal loro aspetto lucente. • I metalli sono costituiti dai ioni ( che occupano i punti del reticolo) immersi tra gli elettroni più esterni. • Essi sono buoni conduttori di calore ed elettricità. Tale proprietà consente di riconoscerli in laboratorio.