PHYSICS CHEMISTRY FSICA Y QUMICA 3 ESO Colegio








- Slides: 13

PHYSICS & CHEMISTRY FÍSICA Y QUÍMICA 3º ESO Colegio Ntra. Sra. del Buen Consejo (Agustinas) 12/03/2021 Juan Antonio Romano Largo

UNIT 6: CHEMICAL COMPOUNDS. TEMA 6: COMPUESTOS QUÍMICOS. Stability and octect rule. Estabilidad y Regla del octeto. Ionic bond. Enlace iónico. Covalent bond. Enlace covalente. Metallic bond. Enlace metálico. Molecular mass and mass percent composition. Masa molecular y composición centesimal. Concept of mole and Avogadro’s number. Concepto de mol y nº de Avogadro. Acids and bases. Ácidos y bases. 12/03/2021 Juan Antonio Romano Largo

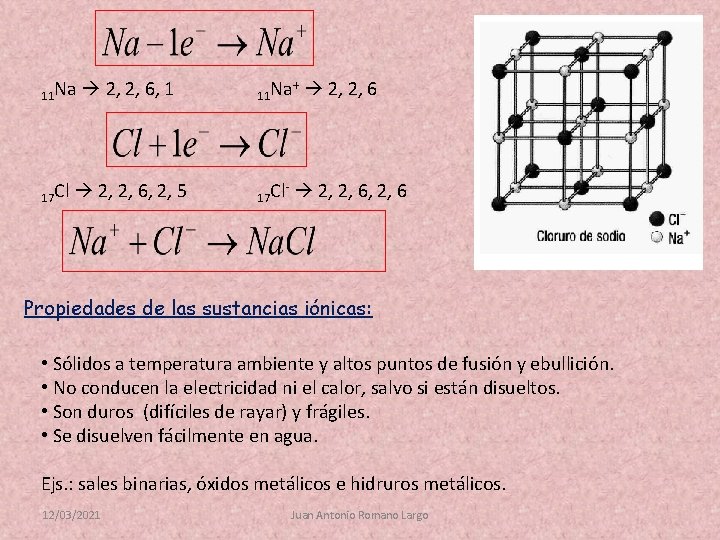
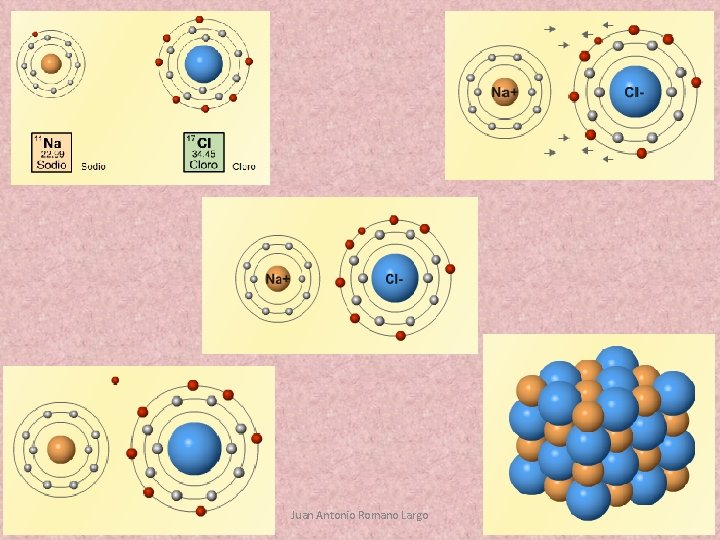
Stability and octect rule. Estabilidad y regla del octeto. Se llama enlace químico a la unión estable de dos o más átomos, iones o moléculas para conseguir tener menos energía que por separado. Regla del octeto Cuando se produce un enlace químico, los átomos intentan ganar, perder o compartir electrones para conseguir tener 8 en su última capa. Ionic bond. Enlace iónico. Se produce entre un metal y un no metal. El metal pierde con facilidad uno o varios electrones, convirtiéndose en un catión. El no metal acepta uno o varios electrones fácilmente y se convierte en un anión. Como son de distinta carga, los iones se atraen formando una red cristalina tridimensional. 12/03/2021 Juan Antonio Romano Largo

11 Na 17 Cl 2, 2, 6, 1 11 Na + 2, 2, 6, 2, 5 17 Cl 2, 2, 6 - 2, 2, 6 Propiedades de las sustancias iónicas: • Sólidos a temperatura ambiente y altos puntos de fusión y ebullición. • No conducen la electricidad ni el calor, salvo si están disueltos. • Son duros (difíciles de rayar) y frágiles. • Se disuelven fácilmente en agua. Ejs. : sales binarias, óxidos metálicos e hidruros metálicos. 12/03/2021 Juan Antonio Romano Largo

12/03/2021 Juan Antonio Romano Largo

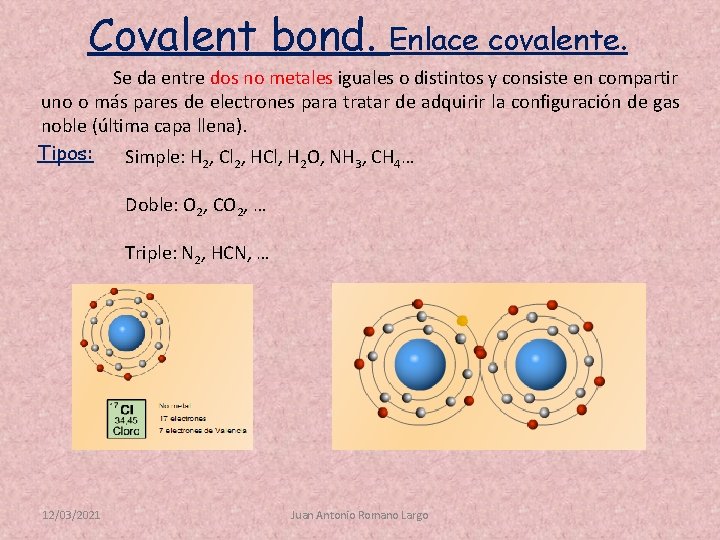
Covalent bond. Enlace covalente. Se da entre dos no metales iguales o distintos y consiste en compartir uno o más pares de electrones para tratar de adquirir la configuración de gas noble (última capa llena). Tipos: Simple: H 2, Cl 2, HCl, H 2 O, NH 3, CH 4… Doble: O 2, CO 2, … Triple: N 2, HCN, … 12/03/2021 Juan Antonio Romano Largo

Propiedades de las sustancias covalentes moleculares: • Gases a temperatura ambiente, aunque hay algunos líquidos. • Puntos de fusión y ebullición bajos. • No conducen la electricidad ni el calor. • No son solubles en agua, aunque si en acetona o gasolina. Ejs. : hidruros no metálicos, elementos no metálicos. Una molécula especial: el agua • Su punto de fusión es de 0 ºC y el de ebullición 100 ºC, por lo que a temperatura ambiente es líquido. • Presenta una dilatación anómala al enfriarse entre 4 y 0 ºC. Por eso la densidad del hielo es menor que la del agua líquida. • Estas propiedades se deben a que la molécula es polar puesto que el oxígeno atrae con mayor fuerza a los electrones compartidos que el hidrógeno. • En estado sólido adopta formas hexagonales (cristales de hielo), en estado líquido las moléculas se unen por puentes de hidrógeno y en estado gas las moléculas están sueltas. 12/03/2021 Juan Antonio Romano Largo

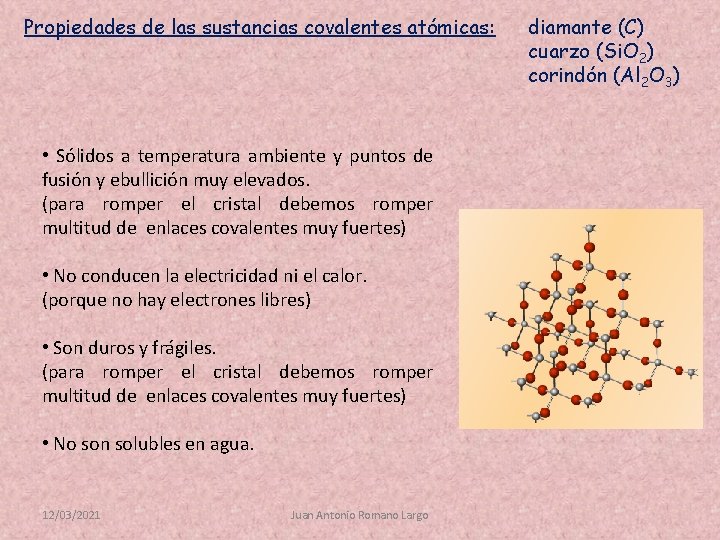
Propiedades de las sustancias covalentes atómicas: • Sólidos a temperatura ambiente y puntos de fusión y ebullición muy elevados. (para romper el cristal debemos romper multitud de enlaces covalentes muy fuertes) • No conducen la electricidad ni el calor. (porque no hay electrones libres) • Son duros y frágiles. (para romper el cristal debemos romper multitud de enlaces covalentes muy fuertes) • No son solubles en agua. 12/03/2021 Juan Antonio Romano Largo diamante (C) cuarzo (Si. O 2) corindón (Al 2 O 3)

Metallic bond. Enlace metálico. Se da entre átomos metálicos del mismo tipo, que pierden con facilidad uno o más electrones. Los cationes forman una red cristalina que se mantiene unida gracias a una nube de electrones. Propiedades de las sustancias metálicas: • Sólidos a temperatura ambiente (salvo el Hg) y puntos de fusión muy variados. • Conducen bien la electricidad y el calor. • Son blandos, tenaces, dúctiles y maleables. • Tienen brillo metálico. 12/03/2021 Juan Antonio Romano Largo

Molecular mass. Masa molecular. • Masa molecular: es la masa de una molécula medida en u. m. a. , o lo que es lo mismo, g/mol. EJ: Mm(H 2 SO 4) = 2· 1 + 32 + 4· 16 = 98 u. Mass percent composition. Composición centesimal. • Composición centesimal: es el porcentaje de cada elemento que aparece en un compuesto. 12/03/2021 Juan Antonio Romano Largo

Mole concept. Concepto de mol. • Mol: es la cantidad de sustancia cuya masa en gramos coincide con la masa molecular. EJ: 1 mol de H 2 SO 4 = 98 g Avogadro’s number. Nº de Avogadro. • Nº de Avogadro: es el nº de partículas (átomos, moléculas, iones…) que hay en 1 mol. 12/03/2021 Juan Antonio Romano Largo

12/03/2021 Juan Antonio Romano Largo

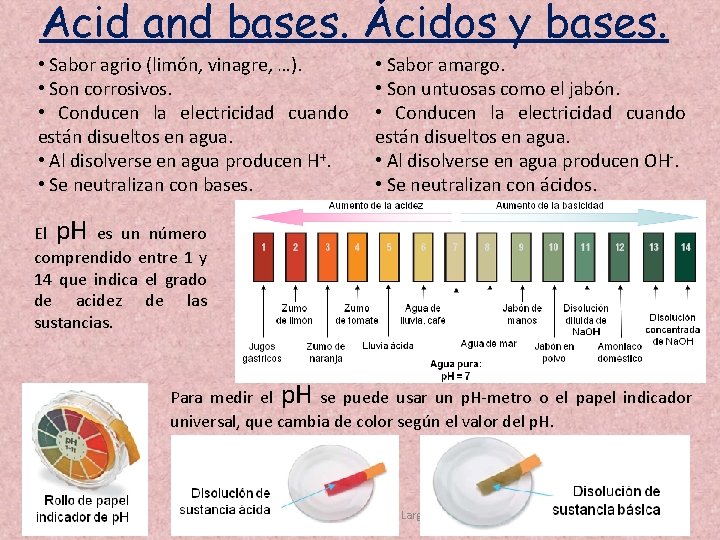
Acid and bases. Ácidos y bases. • Sabor agrio (limón, vinagre, …). • Son corrosivos. • Conducen la electricidad cuando están disueltos en agua. • Al disolverse en agua producen H+. • Se neutralizan con bases. • Sabor amargo. • Son untuosas como el jabón. • Conducen la electricidad cuando están disueltos en agua. • Al disolverse en agua producen OH-. • Se neutralizan con ácidos. El p. H es un número comprendido entre 1 y 14 que indica el grado de acidez de las sustancias. Para medir el p. H se puede usar un p. H-metro o el papel indicador universal, que cambia de color según el valor del p. H. 12/03/2021 Juan Antonio Romano Largo