Physical Chemistry 1 8 Konsep ENTROPI Dr M















- Slides: 17

Physical Chemistry 1 8 Konsep ENTROPI Dr. M. Masykuri, M. Si. Chemistry Education Study Program Teacher Training and Education Faculty Sebelas Maret University (UNS) Website: http: //masykuri. staff. fkip. uns. ac. id, Teacher Training andemail: Education Faculty 11/13/2016 mmasykuri@yahoo. com Sebelas Maret University 1 M. Masykuri_Physical Chemistry 1 Feb 2012 Solo, Peb 2012

Kelemahan Hukum I Umumnya perubahan di alam disertai dengan perubahan energi. Dua aspek penting dalam proses perubahan energi : a) Arah pemindahan energi b) Pengubahan energi dari satu bentuk ke bentuk yang lain Kelemahan Hukum Termodinamika I: - Hanya menyatakan kekekalan energi /konversi energi - Tidak memberikan informasi arah jalannya proses; Perubahan-perubahan di alam terjadi dengan arah tertentu Hukum pertama tidak mempersoalkan arah perubahan ini Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

Konsep Entropi Apa yang menentukan arah perubahan spontan? • Sistem alami cenderung kearah tidak teratur, random, distribusi partikel kurang teratur • Beberapa sistem cenderung lebih tidak teratur (es meleleh) secara spontan Es yang meleleh pada suhu ruangan merupakan contoh dari naiknya entropi dijelaskan pada tahun 1862 oleh Rudolf Clausius sebagai kenaikan disgregasi (ketidakteraturan) molekul air pada es Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

Konsep Entropi Apa yang menentukan arah perubahan spontan? • Dengan meninjau sistem dan lingkungan terlihat: “semua proses yang berlangsung dalam arah spontan akan meningkatkan entropi total alam semesta (sistem dan lingkungan)”. Ini yang disebut dengan hukum kedua termodinamika • Hukum ini tidak memberikan batasan perubahan entropi sistem atau lingkungan, tetapi untuk perubahan spontan entropi total sistem dan lingkungan harus positif Suniv = Ssis + Ssurr > 0 Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

Konsep Entropi • Kata entropi pertama kali dicetuskan oleh Rudolf Clausius pada tahun 1865, berasal dari bahasa Yunani εντροπία [entropía], (en: masuk) dan (tropē: mengubah, mengonversi) Rudolf Clausius (1822 -1888) Fisikawan & Matematikawan Jerman, penemu Hk Termodinamika II Teacher Training and Education Faculty Sebelas Maret University Entropi ini di definisikan sebagai: keacakan, ketidak teraturan, kekacauan ataupun ketidak efisisienan proses Pada termodinamika klasik, konsep entropi menyatakan bahwa entropi dari sistem yang terisolasi selalu bertambah atau tetap konstan. Entropi juga menunjukkan bahwa energi panas selalu mengalir secara spontan dari daerah yang suhunya lebih tinggi ke daerah yang suhunya lebih rendah. M. Masykuri_Physical Chemistry 1 Feb 2012

Entropi sebagai fungsi keadaan Entropi ini di definisikan sebagai: Untuk perubahan terbatas: Satuan entropy: JK-1 Satuan entropi molar : JK-1 mol-1 Entropi sebagai fungsi keadaan: d. U= n. Cvd. T dqrev = d. U + Pd. V Untuk gas ideal berlaku: P = n. RT/V d. S = d. U/T + Pd. V/T maka: d. S = n. Cv d. T/T + n. R d. V/V karena: d(n. R/V)/d. T = 0, dan d(n. Cv/T)/d. T Teacher Training and Education Faculty Sebelas Maret University ? ? M. Masykuri_Physical Chemistry 1 Feb 2012

Memperkirakan Nilai So Relatif Sistem • Berdasarkan pengamatan level molekuler kita bisa memperkirakan entropi zat akibat pengaruh 1. 2. 3. 4. 5. Perubahan temperatur Keadaan fisik dan perubahan fasa Pelarutan solid atau liquid Pelarutan gas Ukuran atom atau kompleksitas molekul Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

1. Perubahan Temperatur • So meningkat seiring dengan kenaikan temperatur T(K) 273 295 298 So 31, 0 32, 9 33, 1 • Kenaikan temperatur menunjukkan kenaikan energi kinetik rata-rata partikel Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

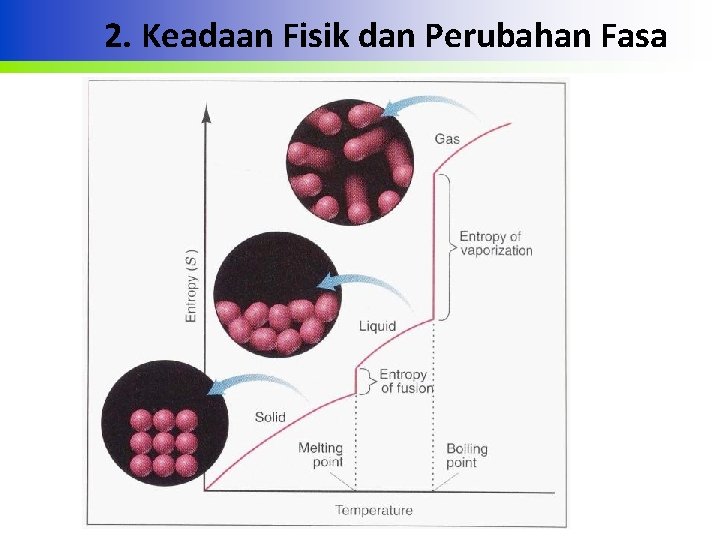
2. Keadaan Fisik dan Perubahan Fasa • Ketika fasa yang lebih teratur berubah ke yang kurang teratur, perubahan entropi positif • Untuk zat tertentu So meningkat manakala perubahan zat dari solid ke liquid ke gas Na H 2 O C (grafit) • So (s / l) 51, 4(s) 69, 9 (l) 5, 7(s) • So (g) 153, 6 188, 7 158, 0 Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

2. Keadaan Fisik dan Perubahan Fasa Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

3. Pelarutan solid atau liquid • Entropi solid atau liquid terlarut biasanya lebih besar dari solut murni, tetapi jenis solut dan solven dan bagaimana proses pelarutannya mempengaruhi entropi overall Na. Cl Al. Cl 3 CH 3 OH • So s/l 72. 1(s) 167(s) 127(l) • Soaq 115, 1 -148 132 Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

4. Pelarutan Gas • Gas begitu tidak teratur dan akan menjadi lebih teratur saat dilarutkan dalam liquid atau solid • Entropi larutan gas dalam liquid atau solid selalu lebih kecil dibanding gas murni • Saat O 2 (Sog = 205, 0 J/mol K) dilarutkan dalam air, entropi turun drastis (Soaq = 110, 9 J/mol K) Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

5. Ukuran Atom atau Kompleksitas molekul Perbedaan entropi zat dengan fasa sama tergantung pada ukuran atom dan komplesitas molekul Li Na K Rb Cs Jari 2 152 186 227 248 265 M molar 6. 941 22. 99 39. 10 85. 47 132. 9 So(s) 29. 1 51. 4 64. 7 69. 5 85. 2 Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

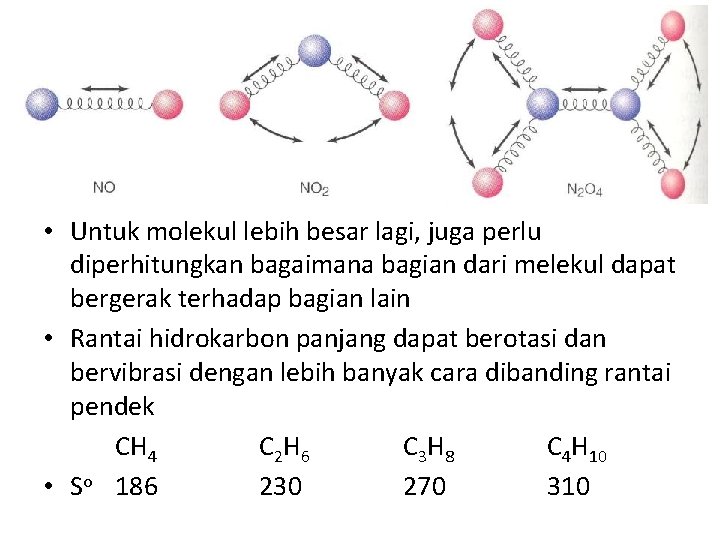
5. Ukuran Atom atau Kompleksitas molekul • Untuk senyawa, entropi meningkat seiring dengan kompleksitas kimia yaitu dengan semakin banyaknya jumlah atom dalam molekul • Hal ini berlaku untuk senyawa ionik dan kovalen NO NO 2 N 2 O 4 • So(g) 211 240 304 • Kecenderungan ini didasarkan atas variasi gerakan yang dapat dilakukan molekul Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

• Untuk molekul lebih besar lagi, juga perlu diperhitungkan bagaimana bagian dari melekul dapat bergerak terhadap bagian lain • Rantai hidrokarbon panjang dapat berotasi dan bervibrasi dengan lebih banyak cara dibanding rantai pendek CH 4 C 2 H 6 C 3 H 8 C 4 H 10 • So 186 230 270 310 Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

Latihan Mana entropi yang lebih tinggi • 1 mol SO 2(g) atau 1 mol SO 3(g) • 1 mol CO 2(s) atau 1 mol CO 2(g) • 3 mol gas oksigen (O 2) atau 2 mol gas ozon (O 3) • 1 mol KBr(s) atau 1 mol KBr(aq) • Air laut pada pertengahan musim dingin 2 o. C atau pada pertengahan musim panas 23 o. C • 1 mol CF 4(g) atau 1 mol CCl 4(g) Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012

Teacher Training and Education Faculty Sebelas Maret University M. Masykuri_Physical Chemistry 1 Feb 2012