PEXIVAS Echanges plasmatiques et corticodes dans les vascularites

























- Slides: 30

PEXIVAS Echanges plasmatiques et corticoïdes dans les vascularites associées aux ANCA : une étude internationale, randomisée, contrôlée Promoteur Cambridge University Hospitals NHS Foundation Trust Organisme délégué en France Assistance Publique – Hôpitaux de Paris (AP-HP) Monitoring URC/CIC Cochin-Necker Hôpitaux Universitaires Paris Centre Cochin Broca Necker Site Tarnier - Paris CP : Séverine Aït el Ghaz-Poignant ARC : Leyya Mansoor-Diallo Investigateur coordonnateur Dr Xavier Puéchal Hôpital Cochin Pôle de Médecine Interne 27, rue du Faubourg Saint-Jacques 75 014 Paris Responsable scientifique Pr Loïc Guillevin Hôpital Cochin Pôle de Médecine Interne 27, rue du Faubourg Saint-Jacques 75 014 Paris

Rationnel : PEXIVAS q Chez des malades ayant une créatininémie à l’inclusion > 500 micromoles/l, les échanges plasmatiques améliorent significativement la survie rénale (à court terme), mais pas leur survie globale (MEPEX) q La dose efficace des corticoïdes est peu étudiée q L’évolution défavorable des vascularites sévères est souvent liée à l’inefficacité et/ou aux complications des traitements corticoïdes et immunosuppresseurs

1. Inconnues : PEXIVAS n Les EP sont-ils utiles en traitement d’induction, en plus des CS et IS, chez les patients atteints de vascularite associée aux ANCA (GPA et MPA) : n q en cas d’insuffisance rénale modérée ? q en cas d’hémorragie alvéolaire ? Faut-il nécessairement une forte dose de corticothérapie ? pexivas_version du 11/03/2014

2. Hypothèses: PEXIVAS n Dans une population de patients GPA ou MPA sévères Les EP améliorent la survie et diminuent le risque d’évolution vers l’insuffisance rénale terminale Une dose réduite de corticoïdes n’aggrave pas le risque d’insuffisance rénale terminale ou de décès et réduit les effets secondaires pexivas_version du 11/03/2014

3. Objectifs et Critères de jugement Objectif Principal n Démontrer l’efficacité des EP en adjonction aux CS et aux IS n Démontrer la non-infériorité d’une dose réduite de CS à diminuer le nombre de décès et d’évolution vers l’insuffisance rénale terminale. Critère de Jugement Principal n Critère composite comprenant toutes les causes de mortalité et/ou insuffisance rénale terminale pexivas_version du 11/03/2014

4. Objectifs secondaires et Critères de jugement Objectifs Secondaires Comparer les effets des corticoïdes dans les différents groupes (+/- EP et/ou dose standard CS/dose réduite CS) Critères de Jugement Secondaires n n n Rémission prolongée Toute cause de mortalité Insuffisance rénale terminale n n Effets indésirables graves Infections sérieuses Echelle de qualité de vie SF-36 Euro. Qo. L EQ 5 D Index Score pexivas_version du 11/03/2014

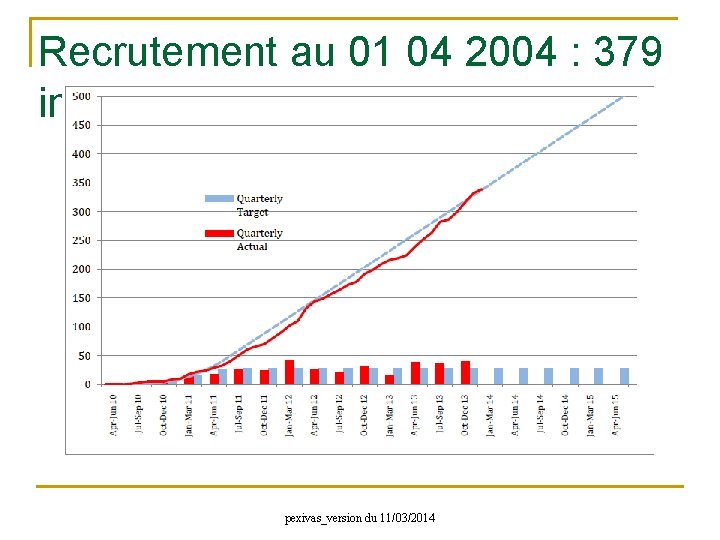
5. Méthodologie n Etude de phase III, prospective, internationale, multicentrique, comparative, contrôlée, randomisée, en ouvert, réalisée en groupes parallèles, dans les vascularites sévères associées aux ANCA. n Nombre de patients : 500 au total dont 60 en France 1ère inclusion: 08/06/2010 Nombre de patients inclus: 379 au 01/04/2014 n Durée de l’étude : 7 ans - inclusion : 5 ans - suivi par patient : 2 à 7 ans (selon la date d’inclusion) n Centres participants : 78 centres actifs dans le monde ; 18 pays En France 17 mois d’inclusion 2 à 3 ans de suivi/patient Juin 2010 1ère inclusion Avril 2014 Début en France Mai 2015 Fin des inclusions pexivas_version du 11/03/2014 Mai 2017 Fin de l’étude

Recrutement au 01 04 2004 : 379 inclus pexivas_version du 11/03/2014

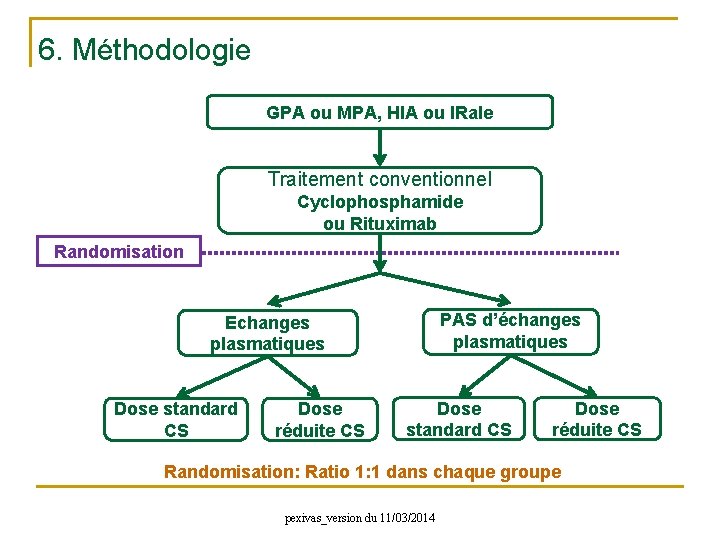
6. Méthodologie GPA ou MPA, HIA ou IRale Traitement conventionnel Cyclophosphamide ou Rituximab Randomisation PAS d’échanges plasmatiques Echanges plasmatiques Dose standard CS Dose réduite CS Randomisation: Ratio 1: 1 dans chaque groupe pexivas_version du 11/03/2014

7. Critères d’inclusion 1. Diagnostic ou rechute - d’une granulomatose avec polyangéite (de Wegener) - ou d’une polyangéite microscopique 2. Avec présence d’ANCA anti-PR 3 ou anti-MPO en ELISA (au moins une fois au cours de l’évolution de la vascularite) 3. Et avec une vascularite sévère définie par au moins : v une atteinte rénale, v et/ou une hémorragie alvéolaire liée à la vascularite pexivas_version du 11/03/2014

7. Critères d’inclusion 1. Diagnostic ou rechute - d’une granulomatose avec polyangéite (de Wegener) - ou d’une polyangéite microscopique 2. Avec présence d’ANCA anti-PR 3 ou anti-MPO en ELISA (au moins une fois au cours de l’évolution de la vascularite) 3. Et avec une vascularite sévère définie par au moins : v une atteinte rénale définie par : Ø Ø une biopsie rénale (retrouvant une glomérulonéphrite nécrosante) ou des anomalies du sédiment urinaire (hématurie et protéinurie) et un débit de filtration glomérulaire < 50 ml/min/1, 73 m² pexivas_version du 11/03/2014

8. Critères d’inclusion une hémorragie alvéolaire liée à la vascularite définie par : Ø un aspect compatible (infiltrats pulmonaires diffus) sur la radiographie ou le scanner thoraciques Ø et l’absence d’autre cause d’infiltrats pulmonaires (par exemple un œdème aigu pulmonaire ou une infection pulmonaire) Ø et au moins un des critères suivants : § mise en évidence d’une hémorragie alvéolaire à la fibroscopie bronchique ou un lavage broncho-alvéolaire hémorragique § présence d’hémoptysies § anémie inexpliquée (< 10 g/dl) ou constatation d’une baisse du taux d’hémoglobine (> 1 g/dl) § augmentation de la capacité de diffusion du Dioxyde de Carbone 4. Signature du consentement éclairé par le patient ou son représentant légal. v pexivas_version du 11/03/2014

9. Critères de non inclusion 1. Diagnostic d’une vascularite autre qu’une granulomatose avec polyangéite ou qu’une polyangéite microscopique 2. Présence d’anticorps anti-membrane basale glomérulaire ou dépôts glomérulaires linéaires d’immunoglobulines sur la biopsie rénale 3. Dialyse > 21 jours immédiatement avant la randomisation ou transplantation rénale antérieure 4. Age < 18 ans pexivas_version du 11/03/2014

10. Critères de non inclusion 5. Femme enceinte 6. Traitement antérieur par > 1 dose de Cyclophosphamide en IV et/ou >14 jours de Cyclophosphamide oral et/ou >14 jours de Prednisone/Prednisolone (> 30 mg/j) et/ou >1 dose de Rituximab dans les 28 jours immédiatement avant la randomisation 7. Présence d’une comorbidité ou d’une contre-indication à l’utilisation du Cyclophosphamide/Rituximab, des corticoïdes ou des EP ou qui requiert absolument l’utilisation des EP 8. EP effectués au cours des 3 mois précédant la randomisation. pexivas_version du 11/03/2014

11. Procédures de Randomisation Connexion au e-CRF sur le site internet : https: //www. trials. bham. ac. uk/PEXIVAS n Attention: L’identifiant et le mot de passe sont personnels et confidentiels. Conditions d’obtention : • Signature du formulaire de délégation de fonctions • CV daté et signé • Certificat de Bonnes Pratiques Cliniques pexivas_version du 11/03/2014

12. Procédures de Randomisation 1) Inclusion nouveau patient pexivas_version du 11/03/2014

13. Fin d’étude (Mai 2017) Les patients sortiront de l’étude, après 2 à 3 ans de suivi, selon la date d’inclusion v v Modalités de sorties d’étude prématurée q Critères retenus pour interrompre les EP: - abord veineux difficile, - intolérance aux produits de substitution, - infection évolutive, sepsis, - mauvaise tolérance hémodynamique des échanges plasmatiques, collapsus. q Décision de l’investigateur q Retrait du consentement q Patient perdu de vue Devenir de ces patients, Q et prélèvements ? pexivas_version du 11/03/2014

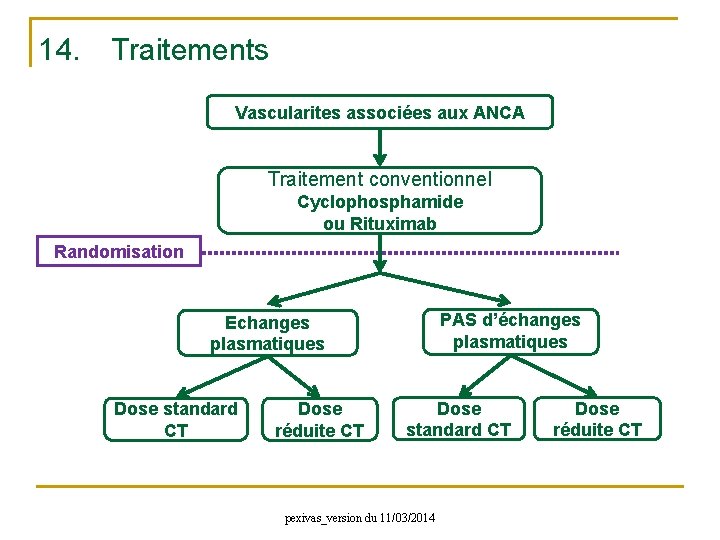
14. Traitements Vascularites associées aux ANCA Traitement conventionnel Cyclophosphamide ou Rituximab Randomisation PAS d’échanges plasmatiques Echanges plasmatiques Dose standard CT Dose réduite CT Dose standard CT pexivas_version du 11/03/2014 Dose réduite CT

1. Traitements Immunosuppresseurs (IS) Induction de la rémission q Cyclophosphamide (CYC) Pendant au moins 13 sem et au plus 26 sem Per Os (2 mg/kg/jr) ou En IV (15 mg/kg/dose) Modifications de la posologie: Leucopénie, selon l’âge et la fonction rénale Adjonction MESNA selon pratiques locales Patients ↔ Groupe + EP: ü Pas de EP dans les 24 h suivant une injection de CYC ü Si EP et CYC oral ou IV le même jour: EP puis CYC ü Si CYC oral attendre au moins 12 h par rapport à la dernière prise CYC pour effectuer EP pexivas_version du 11/03/2014

1. Traitements Immunosuppresseurs Induction de la rémission q Rituximab (RTX) En IV : 4 bolus, de 375 mg/m 2 , à une semaine d’intervalle 1 er bolus au cours des 14 ers jours à partir de l’inclusion Ensuite 1 bolus tous les 7 jours Dernier bolus à J 42 maximum par rapport au 1 er bolus Prophylaxie selon le RCP du produit Patients ↔ Groupe + EP: ü Pas de EP dans les 48 h suivant une injection de RTX Traitements fournis par l’hôpital ↔ prise en charge habituelle de la pathologie pexivas_version du 11/03/2014

2. Traitements Immunosuppresseurs Maintien de la rémission q Azathioprine (AZA) Per Os (2 mg/kg/jr) Patients ↔ CYC en traitement d’induction et en rémission Immédiatement après la dernière prise de CYC per os ou 7 jours après le dernier bolus de CYC Intolérances AZA: maintien AZA à une dose plus faible ou Traitement de substitution: Méthotrexate ou Mycophenolate Mofetil Modifications de la posologie: diminution à 1, 5 mg/kg/jr pour les patients > 60 ans et 1 mg/kg/jr pour les patients > 75 ans Surveillance Hémogramme et Bilan hépatique pexivas_version du 11/03/2014

3. Echanges plasmatiques (EP) q Randomisation: 50 % des patients ↔ EP en adjonction aux CS et IS q 7 EP de 60 ml/kg → dans les 14 jours suivant la randomisation (Calendrier flexible) q EP par centrifugation ou filtration selon les pratiques locales Aphérèse par double filtration : NON autorisée q EP par Voie veineuse ou centrale q Solution de substitution: Albumine sérique humaine (3 ou 5 %) +/- colloïdes volume minimum de la solution de substitution = 3000 ml q Anti-coagulation : par héparinisation ou citrate selon les pratiques locales Les patients avec saignement actif ↔ du plasma supplémentaire pour remplacer les facteurs de coagulation conformément aux usages locaux q Fréquence des EP peut être diminuée en cas de complications selon appréciation du médecin pexivas_version du 11/03/2014

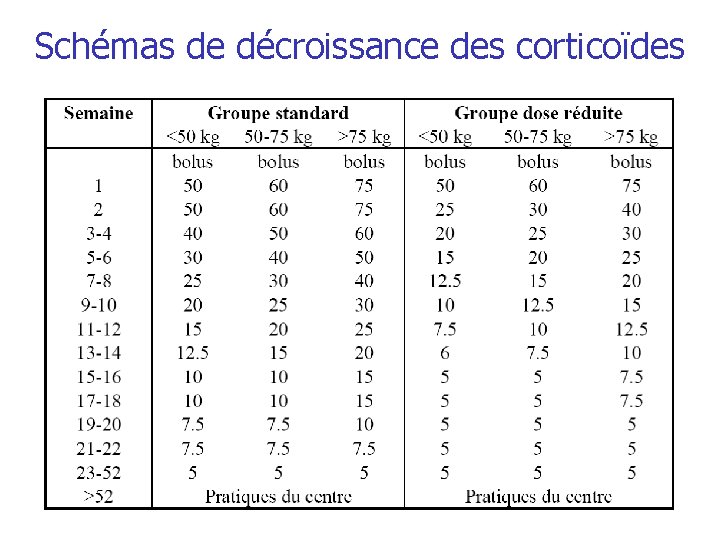
4. Corticostéroïdes q Introduction CS per os Randomisation - 50 % des patients ↔ “dose standard CS” - 50 % des patients ↔ dose réduite de CS (± 50 % de la dose standard au cours des 6 premiers mois) Si contre-indication: poursuite en IV Prednisone ou Prednisolone Dosage en fonction du poids du patient avec 3 catégories de poids Possiblité d’alterner les doses 1 j/2 si la différence < 5 mg CT non fournis ↔ prise en charge habituelle de la pathologie pexivas_version du 11/03/2014

5. Prélèvements Visite 1: INCLUSION ADN ARN SERUM PLASMA VISITES DE SUIVI Visite 2: Semaine 2 Visite 3: Semaine 12 SERUM PLASMA Visite 4: Semaine 52 ARN SERUM PLASMA Documents pour la biothèque disponibles dans le classeur patient « Inclusion/Prélèvements » pexivas_version du 11/03/2014

6. Kits de Prélèvements n Pour chaque patient : ü 1 tube PAXgene ↔ DNAthèque (visite d’inclusion) ü 3 tubes PAXgene ↔ RNAthèque (visite d’inclusion, V 3 -S 12 et V 4 -S 52) ü 24 cryotubes (de 2 ml) ↔ Plasmathèque et Sérothèque (visite d’inclusion, V 2 -S 2, V 3 -S 12 et V 4 -S 52, 3 aliquots par visite) ü ÉTIQUETTES ü Boîtes de stockage pexivas_version du 11/03/2014

7. Conservation des échantillons ADN et ARN SERUM et PLASMA Tubes PAXgene à -80 C Aliquots à -80°C Conservation dans le centre L’envoi des prélèvements se fera de façon différée (1 fois par an selon le nombre d’inclusion) Centralisation des prélèvements au Centre de Référence des Maladies Rares Hôpital Cochin - Pavillon St Jacques 27, rue du Faubourg St Jacques 75 014 Paris pexivas_version du 11/03/2014

8. Procédures d’enregistrement et notification des EIG 1/ Compléter le formulaire EIG dans l’e-CRF A déclarer dans 2/ Faxer au +441223586796 les 24 h Ou envoyer par mail par l’investigateur alina. casian@addenbrookes. nhs. uk bjovanovska@nhs. net 3/ Faxer au CP DRCD ou à l’URC pexivas_version du 11/03/2014 au 01 58 41 11 83

PEXIVAS : ouverture des centres en France Modalités : - Réception CV et Certificat de Bonnes Pratiques Cliniques (GCP) pour l’Investigateur principal et tous ses collaborateurs ↔ accès à l’e-CRF - Signature de la convention hospitalière avec surcoût Pour obtenir le GCP : http: //phrp. nihtraining. com/users/login. php Programmation possible des mises en place : HOPITAL COCHIN HOPITAL HAUT L'EVEQUE HOPITAL CHU GRENOBLE HOPITAL CHU ANGERS CHU NANCY HOPITAL Ste BLANDINE HOPITAL CHG HEGP HOPITAL BICHAT HOPITAL CHU DUPUYTREN PARIS PESSAC GRENOBLE ANGERS NANCY METZ VALENCIENNES PARIS LIMOGES Médecine Interne Néphrologie Médecine Interne Médecine interne Médecine Interne Néphrologie Dr PUECHAL Pr VIALLARD Dr CARRON Dr LAVIGNE Pr KAMINSKY Dr MAURIER Pr VANHILLE Dr KARRAS Pr DAUGAS Pr ESSIG

BACK UP pexivas_version du 11/03/2014

Schémas de décroissance des corticoïdes