PERSAMAAN REAKSI KIMIA RUMUS KIMIA Rumus yang menyatakan



















- Slides: 23

PERSAMAAN REAKSI KIMIA

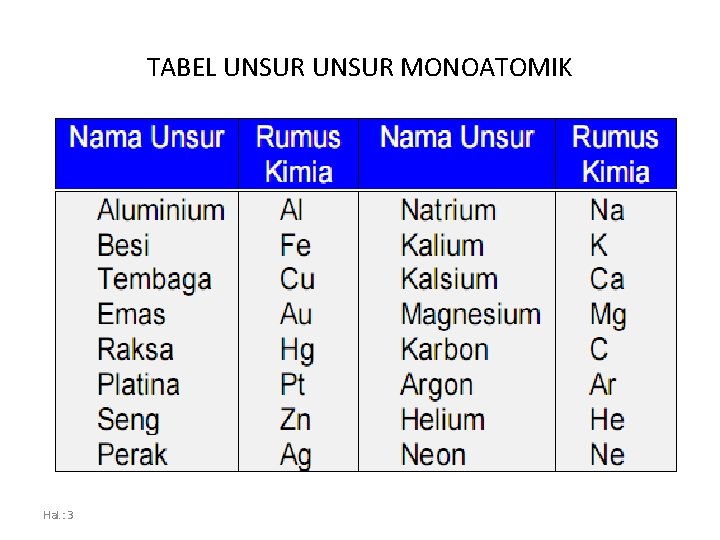
RUMUS KIMIA • Rumus yang menyatakan jenis dan jumlah atom dengan komposisi tertentu untuk setiap molekul • Rumus kimia Unsur Terdiri dari satu atom (monoatomik) sama dengan lambang atom unsur tersebut Hal. : 2

TABEL UNSUR MONOATOMIK Hal. : 3

RUMUS MOLEKUL • Adalah rumus yang menyatakan jenis dan jumlah atom yang membentuk molekul senyawa tersebut • Rumus Molekul unsur adalah rumus yang menyatakan gabungan atom-atom yang sama yang membentuk molekul Hal. : 4 Isi dengan Judul Halaman Terkait

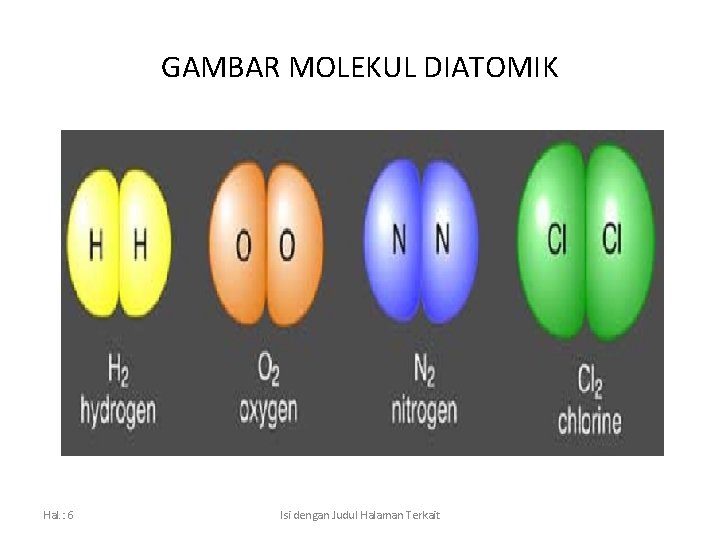
MOLEKUL DIATOMIK yaitu molekul yang terbentuk dari dua atom yang sama Hal. : 5 Isi dengan Judul Halaman Terkait

GAMBAR MOLEKUL DIATOMIK Hal. : 6 Isi dengan Judul Halaman Terkait

MOLEKUL POLIATOMIK Yaitu tiga atom yang sama atau lebih bergabung membentuk sebuah molekul Hal. : 7 Isi dengan Judul Halaman Terkait

RUMUS MOLEKUL SENYAWA • Menyatakan rumus senyawa yang tersusun atas dua atom atau lebih yang berbeda yang membentuk molekul Hal. : 8 Isi dengan Judul Halaman Terkait

RUMUS EMPIRIS • Menyatakan perbandingan paling sederhana dari jumlah atom penyusun suatu molekul Hal. : 9 Isi dengan Judul Halaman Terkait

PERSAMAAN REAKSI adalah persamaan yang menggambarkan terjadinya suatu reaksi kimia, meliputi lambang dan rumus, serta tanda panah yang menunjukkan terjadinya reaksi. Contoh : Salah satu senyawa penyusun gas elpiji adalah etana, C 2 H 6. Pada saat dibakar, gas ini bereaksi dengan oksigen (O 2) menghasilkan gas CO 2 dan uap air (H 2 O). Reaksi pembakaran tersebut dapat dituliskan sebagai berikut 2 C 2 H 6 (g)+ 7 O 2 (g) → 4 CO 2 (g) + 6 H 2 O (g)

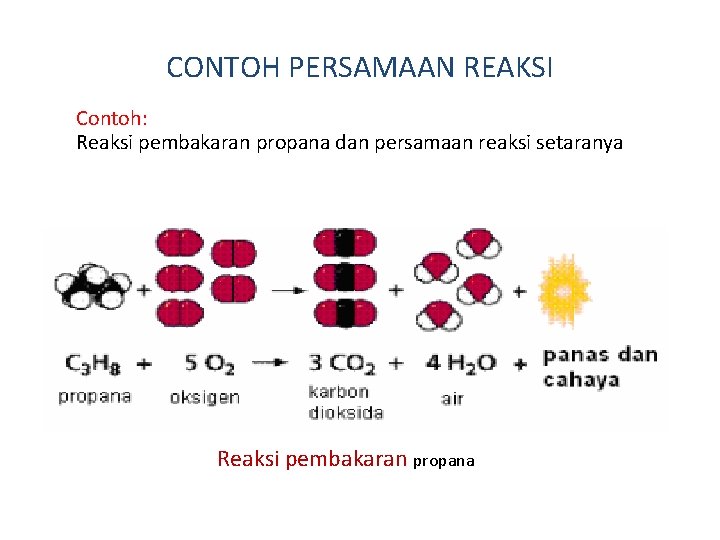
CONTOH PERSAMAAN REAKSI Contoh: Reaksi pembakaran propana dan persamaan reaksi setaranya Reaksi pembakaran propana

CONTOH PERSAMAAN REAKSI Contoh : Reaksi logam natrium dengan air Dapat ditulis persamaan reaksinya sebagai berikut: 2 Na + 2 H 2 O → 2 Na. OH + H 2

PENULISAN PERSAMAAN REAKSI PEREAKSI HASIL REAKSI • Zat-zat yang bereaksi • Di sebelah kiri tanda panah • Zat-zat hasil reaksi • Di sebelah kanan tanda panah Secara umum, persamaan reaksi dapat dituliskan sebagai berikut: p. A + q. B → r. C + s. D Keterangan : A dan B sebagai pereaksi C dan D sebagai hasil reaksi p = koefisien reaksi zat A r = q = koefisien reaksi zat B s = koefisien reaksi zat D

MENYETARAKAN PERSAMAAN REAKSI Dasar : Hukum Kekekalan Massa “Jumlah massa sebelum reaksi sama dengan jumlah massa sesudah reaksi” Dengan demikian, diperoleh ketentuan bahwa jumlah atom pereaksi sama dengan jumlah atom hasil reaksi.

MENYETARAKAN PERSAMAAN REAKSI Contoh Soal : Setarakan persamaan reaksi Fe Penyelesaian : Fe + O 2 → Fe. O 3 atom 2 atom + O 2 → Fe. O ----- belum setara Cara penyetaraannya : Jumlah atom Fe di kiri dan di kanan sudah sama, yaitu 1. Jumlah atom O di kiri = 2, sedangkan di kanan = 1 sehingga koefisien O 2 disebelah kiri dikalikan 1/2, menjadi Fe + 1/2 O 2 menjadi → Fe. O. Agar koefisien tidak berbentuk pecahan, persamaan tersebut dikalikan 2, 2 Fe + O 2 → 2 Fe. O

CONTOH MENYELESAIKAN PERSAMAAN REAKSI Contoh soal Setarakan persamaan reaksi berikut ini! Cl 2 + KOH → KCl + KCl. O 2 + H 2 O Penyelesaian Dimisalkan masing-masing koefisien ditandai dengan huruf a, b, c, d, dan e a Cl 2 + b KOH → c KCl + d KCl. O 2 + e H 2 O Setiap atom disamakan jumlahnya antara ruas kiri dan ruas kanan. Ruas kiri = ruas kanan Jumlah atom Cl 2 a = c + d persamaan 1 K b =c+d persamaan 2 O b = 2 d + e persamaan 3 H b = 2 e persamaan 4

MENYETARAKAN PERSAMAAN REAKSI dimisalkan a =1 sehingga Dari persamaan 1 & 2 2 = c + d Dari persamaan 4 Dari pesamaan 3 Dari persamaan 2 b = c + d, berarti b = 2 e 2 = 2 e, berarti e= 1 b = 2 d + e 2 = 2 d + 1 2 - 1= 2 d, berarti d = ½ b=c+d 2 = c + ½ , berarti c =1 ½ Jadi, a = 1, b = 2, c= 1 ½ , d= ½ , dan e= 1 Agar tidak berbentuk pecahan, koefisien-koefisien tersebut dikalikan 2 menjadi a= 2, b= 4, c= 3, d=1, dan e=2. Jadi, persamaan reaksi lengkapnya 2 Cl 2 + 4 KOH → 3 KCl + KCl. O 2 + 2 H 2 O

CONTOH PENYETARAAN REAKSI CARA LANGSUNG (SEDERHANA) Setarakan persamaan reaksi : Al + O 2 Al 2 O 3 Penyelesaian a. Jumlah atom Al dikiri = 1, sedangkan di kanan = 2, sehingga koefisien Al di sebelah kiri dikalikan 2, menjadi 2 Al + O 2 Al 2 O 3 b. Jumlah atom O di kiri = 2, sedangkan di kanan =3 sehingga koefisien di sebelah kiri dikalikan 3/2, menjadi 2 Al + 3/2 O 2 Al 2 O 3 c. Agar tidak berbentuk pecahan, persamaan reaksi dikalikan 2 sehingga reaksi lengkapnya menjadi 4 Al + 3 O 2 2 Al 2 O 3 Hal. : 18 Isi dengan Judul Halaman Terkait

MENGGUNAKAN CARA PERSAMAAN Setarakan persamaan reaksi berikut ini! Cl 2 + KOH KCl + KCl. O 2 + H 2 O Penyelesaian • Dimisalkan masing-masing koefisien ditandai dengan huruf a, b, c, d, dan e a. Cl 2 + b. KOH c. KCl + d. KCl. O 2 + e. H 2 O • Setiap atom disamakan jumlahnya antara ruas kiri dan ruas kanan Ruas kiri = ruas kanan Hal. : 19 Isi dengan Judul Halaman Terkait

Jumlah atom Cl : 2 a=c+d Pers 1 K : b = c+d Pers 2 O : b = 2 d+e Pers 3 H : b = 2 e Pers 4 Dimisalkan a =1 sehingga : Dari persamaan 1 dan 2 : b = 2 Dari persamaan 4 : e =1 Dari persamaan 3 : d = 1/2 Dari persamaan 2 : c = 3/2 Hal. : 20 Isi dengan Judul Halaman Terkait

Agar tidak berbentuk pecahan maka koefisien dikalikan 2, maka : 2 Cl 2 + 4 KOH 3 KCl + KCl. O 2 + 2 H 2 O Hal. : 21 Isi dengan Judul Halaman Terkait

PERSAMAAN KIMIA KARBON BEREAKSI DENGAN OKSIGEN MEMBENTUK KARBONDIOKSIDA + O 2 CO 2 [ C HASIL REAKSI PEREAKSI 1 MOLEKUL O 2 1 ATOM C 1 MOLEKUL CO 2 HIDROGEN BEREAKSI DENGAN OKSIGEN MEMBENTUK AIR H 2 2 H 2 + + + O 2 O 2 H 2 O 2 (SALAH)

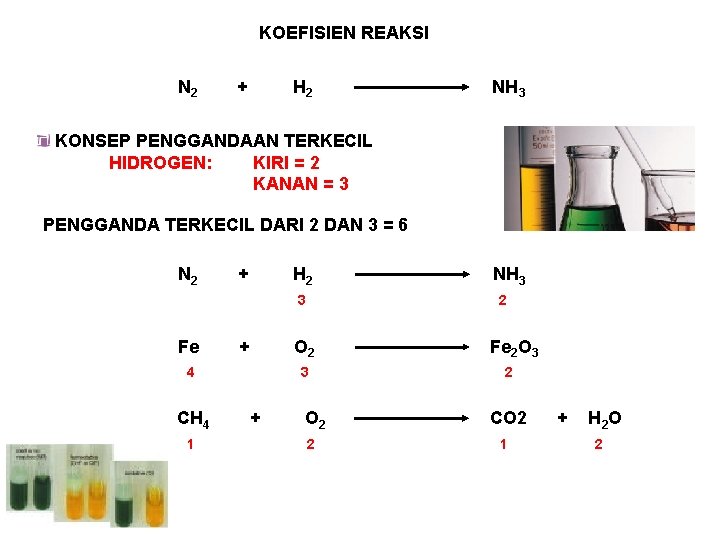
KOEFISIEN REAKSI N 2 + H 2 NH 3 KONSEP PENGGANDAAN TERKECIL HIDROGEN: KIRI = 2 KANAN = 3 PENGGANDA TERKECIL DARI 2 DAN 3 = 6 N 2 + H 2 3 Fe + CH 4 1 2 O 2 4 3 + NH 3 O 2 2 Fe 2 O 3 2 CO 2 1 + H 2 O 2