Peridusos rendszer Mengyelejev 1869 Peridusos rendszer Peridusos rendszer











- Slides: 20

Periódusos rendszer (Mengyelejev, 1869)

Periódusos rendszer

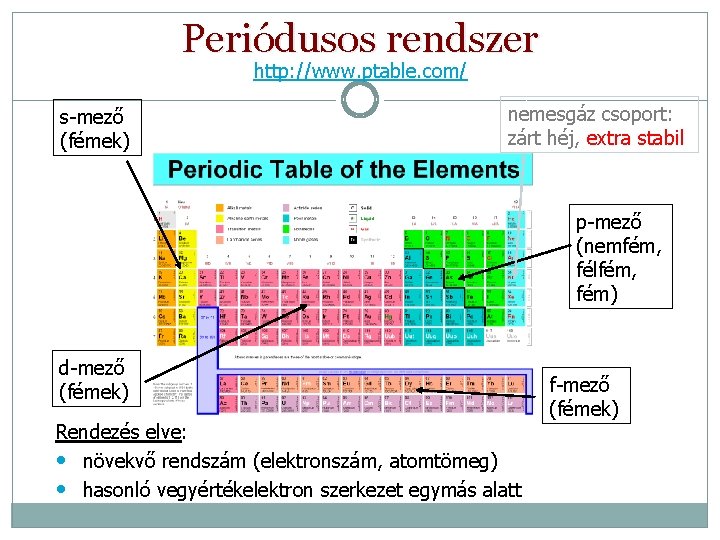
Periódusos rendszer http: //www. ptable. com/ s-mező (fémek) nemesgáz csoport: zárt héj, extra stabil p-mező (nemfém, félfém, fém) d-mező (fémek) Rendezés elve: • növekvő rendszám (elektronszám, atomtömeg) • hasonló vegyértékelektron szerkezet egymás alatt f-mező (fémek)

Egyéb periódusos rendszerek

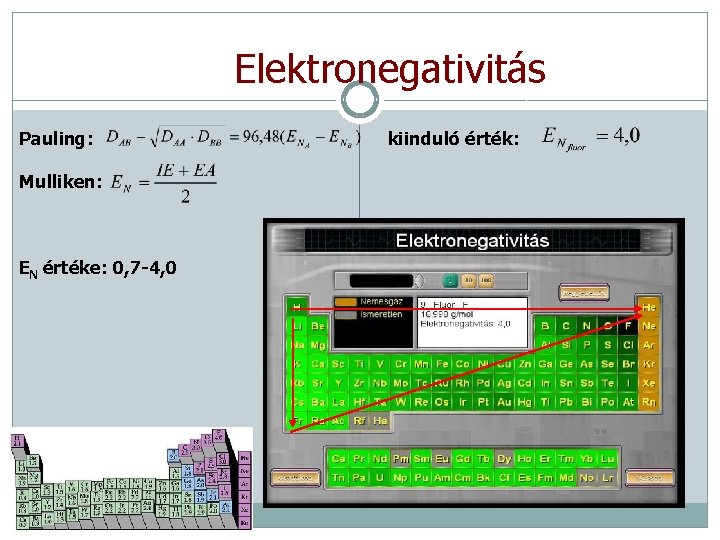
Kémiai kötések Az atomok kémiai kötésekkel kapcsolódnak egymáshoz molekulákat vagy nagyobb rendszereket alkotva: • Elsőrendű kötések (általában atomok között) • Ionos kötés • Kovalens kötés (koordinatív kötés) • Fémes kötés • Másodrendű kötések (általában molekulák között) • Hidrogénkötés • Dipólus-dipólus kölcsönhatás • Diszperziós kölcsönhatás Elektronegativitás: az atom elektronvonzó képessége. Két atom kölcsönhatásakor a nagyobb elektronegativitású képes bizonyos fokig elszívni a másik egyes vegyértékelektronjait. • Kis elektronegativitás: s-, d-, f-mező fémei (ENCs=0. 7) • Nagy elektronegativitás: p-mező nemfémes elemei (ENF=4) • Változás: csoportban felfelé, sorban jobbra nő. Nemesgáz elektronszerkezetre való törekvés = stabilitás!

Elektronegativitás Pauling: Mulliken: EN értéke: 0, 7 -4, 0 kiinduló érték:

Ionos kötés negatív és egy pozitív töltésű ionok közötti elektrosztatikus (Coulomb-féle) vonzóerő. Anion: semleges atomból elektron felvétellel (nemfémes elemek: F-, Cl-, O 2 -) Kation: semleges atomból elektron leadással (fémek: Na+, Ca 2+, Al 3+, stb. ) Összetett ionok: NH+4 , SO 42 -, CO 32 -, stb. Vegyületképzés: Al 2 O 3 semleges! (Első) Ionizációs energia (Ei): energia, mely ahhoz szükséges, hogy a semleges atom külső héjáról egy elektront leszakítsunk és a végtelenbe távolítsuk. Elektronaffinitás (Ea): energia, mely felszabadul (vagy szükséges ahhoz), ha a semleges atomból egyszeres negatív töltésű anion képződik. K+ F- Kötéstávolság: elektrosztatikus vonzás és taszító (mag-mag, e--e-) erők egyensúlya határozza meg

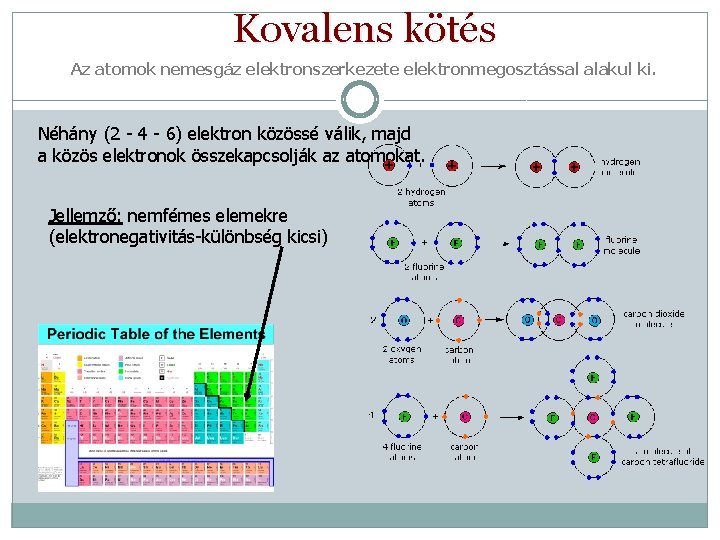
Kovalens kötés Az atomok nemesgáz elektronszerkezete elektronmegosztással alakul ki. Néhány (2 - 4 - 6) elektron közössé válik, majd a közös elektronok összekapcsolják az atomokat. Jellemző: nemfémes elemekre (elektronegativitás-különbség kicsi)

Kovalens kötés Molekulapálya: ahol az elektron két vagy több atommag erőterében 90%-os valószínűséggel tartózkodik. A molekulapálya a kötésben résztvevő elektronok eredeti atompályáiból, azok kombinálódásával alakul ki. Emiatt tükrözi bizonyos fokig az atompályák tulajdonságait. Ahány atompálya kombinálódik ugyanannyi molekulapálya jön létre! Kötő molekulapálya alacsonyabb energiájú mint az atompályák, elektronok számára kedvezőbb. Ez a kémiai kötés hajtóereje! E * lazító molekulapálya atompályák kötő molekulapálya

Kovalens kötés (s (egyszeres) kötés) Kialakulhat: • s – s elektronok között • s – p elektronok között • px – px elektronok között Jellemző: az elektronsűrűség maximuma a két atomot összekötő egyenes (kötéstengely) mentén van. Egyszeres kötés = egyvegyértékű atom az egyik partner: F • hidrogén vegyületei (HBr, H 2 O, NH 3, CH 4) E • halogének vegyületei (F 2, Cl 2, SCl 2, PF 3, CCl 4) http: //dl. clackamas. edu/ch 106 -02/sigma. htm F 2 F

Kovalens kötés (p kötés) Kialakulhat: • py – py elektronok között • pz – pz elektronok között Jellemző: a két atomot összekötő egyenes (kötéstengely) mentén nincs elektron, az elektronsűrűség az egyenes alatt és felett épül ki (két érintkezési pont, de csak egy kötés!). A gyengébb p-p átlapolás miatt a p kötések sérülékenyebbek, mint a s kötés. A többszörös kötésekben az egyik általában s kötés, csak a második illetve harmadik p. p kötés = két- vagy háromvegyértékű atomok között • kettős kötés (O 2, CO 2, SO 3, H 2 C=CH 2) N • hármas kötés (N 2, HCCH, HCN) p atompályák a második p merőleges az első síkjára http: //dl. clackamas. edu/ch 106 -02/sigma. htm p pályák s pálya N 2 N E

Kovalens kötés egyéb fontosabb jellemzői: • Nemkötő (magános) elektronpár: kötésben részt nem vevő vegyértékelektronok N N a N vegyértékhéja: 2 s 2 2 p 3 pl: N 2 • Kötéshossz: a kötést létesítő atomok magjai közti távolság • Kötésszög: a kapcsolódó atomok magjai által bezárt szög • Kötési energia: kötés felszakításához szükséges energia • Kötésrend = (kötőelektronok – lazító +pályán levő elektronok)/2 H 2 : 1 E lazító H 2: 0. 5 E H 2: 0. 5 Pl. E atompályák kötő Miért nincs kovalens kötésű He 2 molekula? (2 e- kötő, 2 e- lazító pályán lenne)

Kovalens kötés Koordinatív (datív) kötés: A kötő elektronpárt az egyik atom adja (volt nemkötő elektronpárja) Pl. C O , H 3 N : BH 3 C (2 s 2 2 p 2) p atompályák O (2 s 2 2 p 4) Molekulák között is: H 3 B + NH 3 H 3 B NH 3 p pályák s pálya Vegyérték: egy adott molekulában az adott atomhoz tartozó kötő elektronpárok száma. HCl (1; 1), H 2 O (1; 2), NH 3 (3; 1), CH 4 (4; 1), H 2 S (1; 2), SO 2 (4; 2), SO 3 (6, 2) (a) (b) S vegyértékhéja: 3 s 2 3 p 4 3 d 0 kis energia befektetéssel átalakulhat: (a) 3 s 2 3 p 3 3 d 1 illetve (b) 3 s 1 3 p 3 3 d 2 -vé

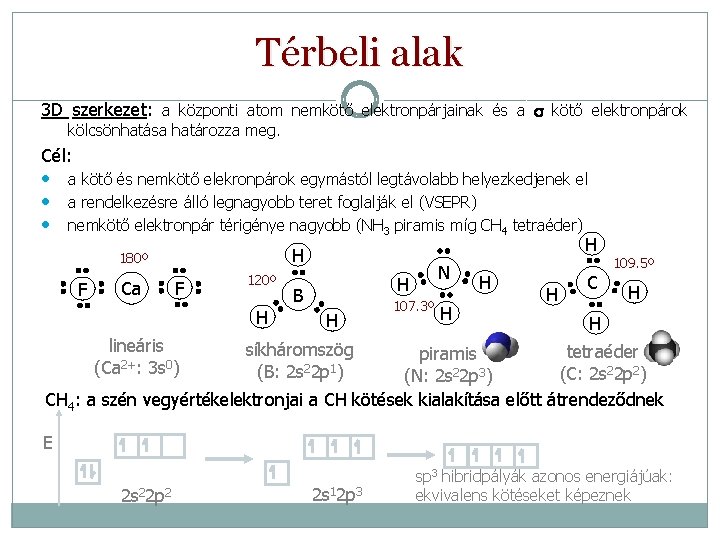
Térbeli alak 3 D szerkezet: a központi atom nemkötő elektronpárjainak és a s kötő elektronpárok kölcsönhatása határozza meg. Cél: • a kötő és nemkötő elekronpárok egymástól legtávolabb helyezkedjenek el • a rendelkezésre álló legnagyobb teret foglalják el (VSEPR) • nemkötő elektronpár térigénye nagyobb (NH 3 piramis míg CH 4 tetraéder) F Ca H H 180º F 120º H lineáris (Ca 2+: 3 s 0) N H B H 107. 3º H H H C 109. 5º H H síkháromszög (B: 2 s 22 p 1) tetraéder piramis (C: 2 s 22 p 2) (N: 2 s 22 p 3) CH 4: a szén vegyértékelektronjai a CH kötések kialakítása előtt átrendeződnek E 2 s 22 p 2 2 s 12 p 3 sp 3 hibridpályák azonos energiájúak: ekvivalens kötéseket képeznek

Polaritás Kötések polaritása: Az eltérő elektronegativitású atomok poláris kötéseket létesítenek. A nagyobb elektronegativitású atom jobban vonzza maga felé a kötő elektronpárt: a kötés elektronfelhője torzul. Megbomlik a töltésegyensúly, a nagyobb elektronegativitású atom parciálisan negatív, míg a másik parciálisan pozitív töltésű lesz. Pl. HCl, CO, H 2 O. Apoláris kötés van azonos atomok kapcsolódása esetén. Pl. H 2, O 2, N 2, F 2. Molekulák polaritása: Apoláris kötés esetén a molekula is apoláris. Poláros kötéssel kapcsolódó kétatomos molekulák polárisak. Poláris kötéssel kapcsolódó többatomos molekulák polaritása szimmetriától: d+ ddd. O C O O d+ H 105º H d+ szén-dioxid: apoláris pozitív és negatív súlypont egybeesik víz: erős dipólus függ a

Fémes kötés A fémek kis elektronegativitásuk miatt könnyen leadják vegyérték elektronjaikat. Szilárd és olvadt halmazállapotban pozitív töltésű fématomtörzsek és delokalizált (helyhez nem kötött) elektronrendszer jön létre. A szilárd halmazállapotban kialakuló szerkezet a fémrács: + + + + + Alapja a fémes tulajdonságok: • elektromos vezetés • jó hővezetés • megmunkálhatóság (ugyanolyan környezet mint megmunkálás előtt) + + + + +

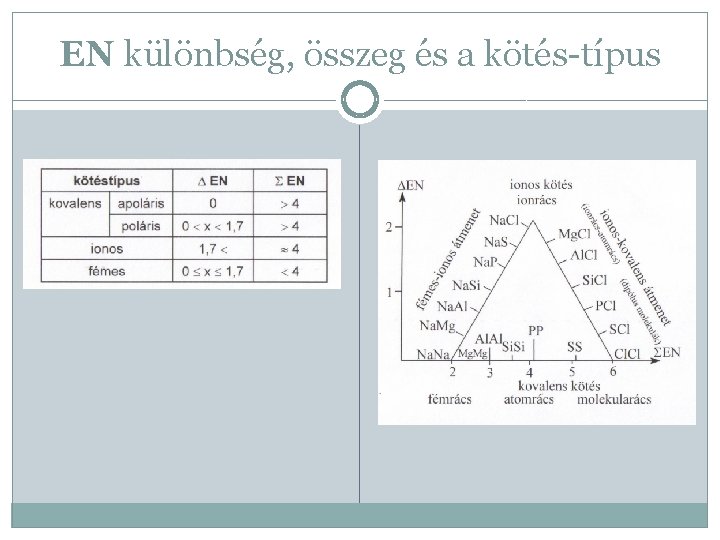
EN különbség, összeg és a kötés-típus

Másodrendű kötések (általában molekulák között) Elsőrendű kötések kötési energiája: 80 -850 k. J/mol Másodrendű kötések (általában molekulák között) • • Hidrogénkötés Dipólus-dipólus kölcsönhatás Diszperziós kölcsönhatás Indukciós hatás 8 -40 k. J/mol 1. 0 Å 0. 8 -12 k. J/mol O d+ H d+ 1. 9 Å O d+ H d+ Hidrogénkötés: O-H/N-H/Halogén-H kötések nagy polaritása miatt nagyon kicsi a H-atom körül az elektronsűrűség. Emiatt a közelben levő másik elektronegatívabb atom vonzza az elektronhiányos Hatomot. Vegyes ionos - kovalens jellegű a kölcsönhatás. Annál erősebb, minél elektronegatívabbak a nem-H-atomok.

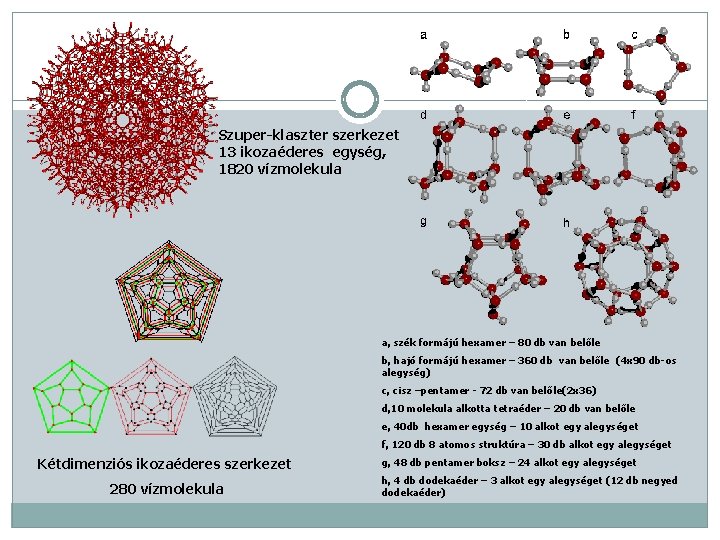
Szuper-klaszter szerkezet 13 ikozaéderes egység, 1820 vízmolekula a, szék formájú hexamer – 80 db van belőle b, hajó formájú hexamer – 360 db van belőle (4 x 90 db-os alegység) c, cisz –pentamer - 72 db van belőle(2 x 36) d, 10 molekula alkotta tetraéder – 20 db van belőle e, 40 db hexamer egység – 10 alkot egy alegységet f, 120 db 8 atomos struktúra – 30 db alkot egy alegységet Kétdimenziós ikozaéderes szerkezet 280 vízmolekula g, 48 db pentamer boksz – 24 alkot egy alegységet h, 4 db dodekaéder – 3 alkot egy alegységet (12 db negyed dodekaéder)

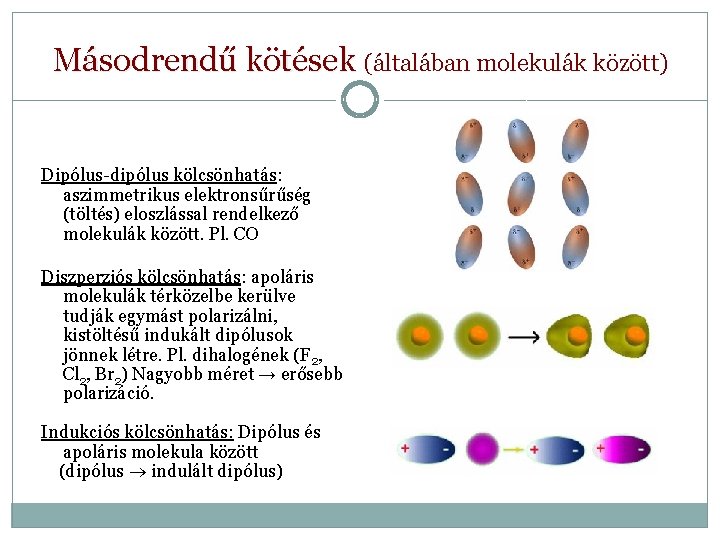
Másodrendű kötések (általában molekulák között) Dipólus-dipólus kölcsönhatás: aszimmetrikus elektronsűrűség (töltés) eloszlással rendelkező molekulák között. Pl. CO Diszperziós kölcsönhatás: apoláris molekulák térközelbe kerülve tudják egymást polarizálni, kistöltésű indukált dipólusok jönnek létre. Pl. dihalogének (F 2, Cl 2, Br 2) Nagyobb méret → erősebb polarizáció. Indukciós kölcsönhatás: Dipólus és apoláris molekula között (dipólus indulált dipólus)